菜豆黃花葉病毒RPA-LFD技術快速檢測方法的建立與應用
朱宇翔 秦嘉超 季英華 陳新 陳學好 崔曉艷

摘要:根據菜豆黃花葉病毒(bean yellow mosaic virus,簡稱BYMV)外殼蛋白基因序列的保守區設計特異性引物和探針,建立蠶豆中BYMV的重組酶聚合酶擴增(recombinase polymerase amplification,簡稱RPA)檢測方法。同時,將該方法與側向流動試紙條(LFD)檢測方法相結合,建立RPA-LFD快速檢測方法,并進行特異性和靈敏度驗證。結果表明,該方法可在 37~42 ℃等溫條件下進行,30 min即可完成檢測。靈敏度試驗表明,采用 RPA-LFD方法檢測BYMV的靈敏性是PCR方法的 100 倍。在特異性試驗方面,與同屬于馬鈴薯Y病毒屬親緣關系較近的大豆花葉病毒(soybean mosaic virus,簡稱SMV)、菜豆普通花葉病毒(bean common mosaic virus,簡稱BCMV)和蕪菁花葉病毒(turnip mosaic virus,簡稱TuMV)無交叉反應。因此,本研究建立的菜豆黃花葉病毒RPA-LFD技術檢測快速、靈敏且高效,有望成為我國菜豆黃花葉病毒田間診斷與防控的實用性技術手段。
關鍵詞:菜豆黃花葉病毒;重組酶聚合酶擴增;側向流動試紙條;病毒檢測
中圖分類號:S436.43 文獻標志碼:A
文章編號:1002-1302(2023)14-0070-06
菜豆黃花葉病毒(bean yellow mosaic virus,簡稱BYMV)是馬鈴薯Y病毒屬的成員,屬于正義單鏈RNA病毒,全長9.5 kb,基因組編碼一條多聚蛋白,該多聚蛋白裂解成11個編碼蛋白:P1、HC-Pro、P3、P3N-PIPO、6K1、CI、6K2、NIa、NIb、VPg和CP[1-2]。研究人員常用外殼蛋白(CP)作為株系劃分的一個標準,它作為重要的結構蛋白,主要參與病毒的運動和介體傳播[3-9]。BYMV首次在1925年被報道,隨后在世界各個國家廣泛傳播[10]。寄主范圍特別廣泛,主要侵染豌豆和蠶豆[11-12]。通常以種子帶毒和蚜蟲非持久性傳播為主,也可通過汁液摩擦接種的方式傳毒。蠶豆受病的葉片一般會表現出系統花葉、斑駁等癥狀,嚴重時會造成植株畸形,嚴重影響作物的產量及品質[13]。目前菜豆黃花葉病毒已經成為世界范圍內的流行性植物病毒,造成豆科植物以及其他多種田間作物的大面積減產。關于菜豆黃花葉病毒的防治方法以選育優良的抗病品種為主,田間管理時應注意蚜蟲的防治并結合合理的藥劑防治,防止病毒病相互傳染,加重病情。因此,快速且高效的檢測方法對防控菜豆黃花葉病毒至關重要。
目前已報道的菜豆黃花葉病毒的檢測方法主要有酶聯免疫吸附(ELISA)法[14],包括直接抗原包被ELISA和雙抗體夾心ELISA[15]。然而,該方法檢測靈敏度低,且需要高質量的抗體[16];聚合酶鏈式反應(PCR)及RT-PCR法包括RT-PCR[17]、一步實時定量RT-PCR[16]、免疫捕捉RT-PCR[18]。該方法具有較高的靈敏度和特異性,被廣泛使用,但PCR對菜豆黃花葉病毒的檢測需要提取RNA、反轉錄、擴增、瓊脂糖凝膠電泳及成像檢查擴增子等[19]。步驟繁瑣、耗時長、需要大型昂貴儀器,不適合野外現場的快速檢測[20]。
重組酶聚合酶擴增(RPA)作為一種新型的等溫分析法,能夠對植物病原體內的DNA或RNA進行高度特異和有效的檢測。RPA已經廣泛應用于細菌、真菌和病毒的分子檢測。Ghosh等基于柑橘黃龍病病原菌(Candidatus Liberiabacter asiaticus)保守的16S RNA基因設計特異性引物對和探針,結合側向流動試紙條建立了RPA檢測體系[21];Lei等利用便攜式實時熒光檢測儀完成了對甘藍型油菜莖基潰瘍病(Lep tosphaeria maculans)的快速檢測[22];Zhang等首次應用 RPA 檢測李痘病毒 (plum pox virus,簡稱PPV)后,RPA逐漸應用在植物病毒的檢測上[23],比如番茄黃化曲葉病毒(tomato yellow leaf curl virus,簡稱簡稱TYLCV)[24]、菜豆莢斑駁病毒 (bean pod mottle virus,簡稱BPMV)[25]、櫻桃病毒(cherry virus A,簡稱CVA)[26]、紫云英矮縮病毒(milk vetch dwarf virus,簡稱MVDV)[27]、黃瓜花葉病毒(cucumber mosaic virus,簡稱CMV)[28],顯示了其可應用于檢測菜豆黃花葉病毒的潛力。RPA利用鏈置換聚合酶、重組酶和單鏈DNA結合蛋白(SSB)進行DNA變性[29],通過包括凝膠電泳、基于探針的熒光監測或簡單的非儀器“夾心分析”,如側向流動試紙條等方法進行檢測,該方法無需大型昂貴儀器進行擴增、電泳等繁瑣步驟,恒溫的條件下,短時間內即可觀察結果。該方法簡單、快速、高效,非技術人員也可直接操作,對現場菜豆黃花葉病毒病株快速檢測具有良好的應用潛力。
在本研究中,建立了基于RPA-LFD檢測BYMV的方法,開發引物和探針,不僅測試了對BYMV的特異性,而且可對RPA-LFD和PCR靈敏度進行比較。同時,RPA-LFD檢測技術可以快速且有效地檢測出田間病樣中的BYMV。
1 材料與方法
1.1 材料
2020年,從江蘇和云南不同地區收集9份表現出花葉癥狀的蠶豆病樣。所有樣本均PCR檢測和序列測定后儲存在江蘇省農業科學院經濟作物研究所實驗室-80 ℃冰箱。大豆花葉病毒(SMV)、菜豆普通花葉病毒(BCMV)和蕪菁花葉病毒(TuMV)樣本均儲存在筆者所在課題組實驗室。本試驗于2022年3—4月于江蘇省農業科學院經濟作物研究所完成。
1.2 RNA提取,cDNA合成
使用天根生化科技(北京)有限公司的植物總RNA提取試劑盒提取蠶豆葉片的總RNA,采用NanoDrop 2000C微體積紫外可見分光光度計測定RNA提取物的純度和濃度。使用北京擎科生物科技有限公司的Glodenstar RT6cDNA合成試劑盒,利用 1 μg 總RNA以20 μL體積合成第1鏈cDNA。cDNA-20 ℃保存備用。
1.3 RPA-LFD檢測BYMV
本研究中RPA的引物設計是按照制造商的引物設計說明(英國劍橋TwistDx)靶向部分菜豆黃花葉病毒CP基因(來自不同NCBI參考序列菌株CP的比對)。RPA使用來自TwistAmpnfo工具包的材料和方案(英國劍橋TwistDx)進行。RPA反應含有1 μL BYMV感染的蠶豆植株cDNA、29.5 μL Rehydration Buffer、2.1 μL 10 mmol/L正向引物(BYMV-RPA-F:5′-TTATTTGGACTTGATGGCAATGTTGGAACAGAC-3′) 和2.1 μL 10 mmol/L反向引物(BYMV-RPA-R:[5′BIOTIN]ACATAGTATTAAGTAATGTAACGCCAAATTATA-3′)、0.6 μL 10 mmol/L 探針(BYMV--probe:[5′FAM]GCAGGAGATGTCAATCGTGATATGCACACCAT[THF]CTTGGTGTTCGTATTT[3′BLOCK])、12.2 μL ddH2O和2.5 μL 280 mmol/L醋酸鎂的50 μL反應體積, 37 ℃ 擴增20 min。對于側向流動分析,參考試劑盒操作(德國Milenia Genline HybriDetect試紙),將5 μL RPA擴增產物與100 μL分析緩沖液(HybriDetect分析緩沖液)在新反應管中混合。然后將側向流動試紙條(LFD)浸入混合物中,并在室溫下培養5 min。在控制區有1條可見線的條帶被視為陰性,在控制區和測試區都有2條可見線的條帶被視為陽性。
1.4 PCR檢測BYMV
PCR反應使用10 μL 2×Taq Master Mix ll (with Dye)[天根生化科技(北京)有限公司],0.5 μmol/L 正向引物 [BYMV-CP-F:5′-CCAACATTC(T)CGCCAA(G)ATAATGT-3′]和反向引物 (BYMV-CP-R:5′-TAGAGAGAATGATACACATACTG-3′),1 μL cDNA和8 μL ddH2O。所有樣品在95 ℃下預變性5 min,然后進行35個循環(95 ℃? 30 s,58 ℃ 30 s和72 ℃ 30 s),最后72 ℃延伸 10 min。獲得的PCR產物在1.5%瓊脂糖凝膠上分離。溴化乙錠染色,Bio-Rad分子成像儀凝膠DOCXR系統(Bio-Rad,Hercules,CA,美國)觀察圖像。
2 結果與分析
2.1 RPA-LFD檢測BYMV方法的建立
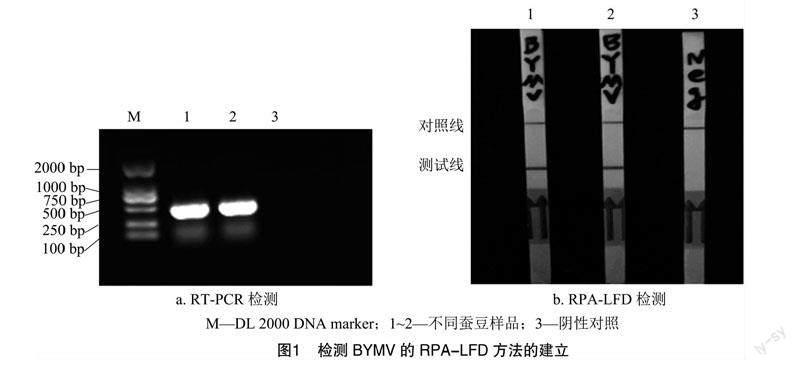
以2份感染菜豆黃花葉病毒的蠶豆樣品的cDNA作為模板分別進行PCR和RPA-LFD的擴增,用健康蠶豆植株的cDNA作為陰性對照。PCR擴增之后,通過瓊脂糖凝膠電泳檢測出400 bp的目標條帶,RPA-LFD試驗使用特異性引物和探針成功地在感染植株中檢測到菜豆黃花葉病毒(圖1),陰性對照無條帶,表明RPA-LFD可用于菜豆黃花葉病毒的快速檢測。
2.2 RPA-LFD與PCR的靈敏度比較
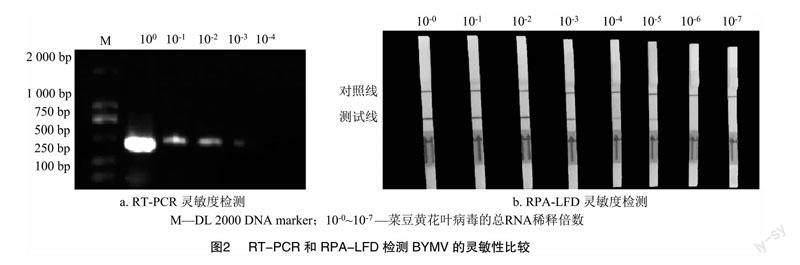
為評估RPA-LFD的靈敏度,以菜豆黃花葉病毒檢測為陽性的蠶豆葉片總RNA為模板,以 10 倍濃度梯度進行稀釋,反轉錄之后得到cDNA進行 RPA-LFD 和PCR檢測的靈敏度比較。結果表明,RPA-LFD可以檢測到總RNA稀釋到10-5的樣品,而PCR僅能檢測到總RNA稀釋到10-3的樣品(圖2)。因此,本研究建立RPA-LFD的檢測方法比PCR靈敏100倍。
2.3 RPA-LFD特異性分析
BYMV屬于馬鈴薯Y病毒屬,分別以該屬侵染豆科作物的其他病毒(SMV、BCMV、TuMV)陽性樣品的cDNA和BYMV陽性樣品的cDNA為模板進行RPA[CM(19*2/3]擴增,同時以PCR進行驗證,對所建立的RPA-LFD 的方法特異性進行分析。結果顯示,該引物和探針只能從含菜豆黃花葉病毒的cDNA中擴增出條帶,大豆花葉病毒、蕪菁花葉病毒和菜豆普通花葉病毒的樣品均未檢測出條帶(圖3)。因此,所建立的RPA-LFD檢測技術具有良好的特異性,可以有效地檢測菜豆黃花葉病毒。
2.4 RPA-LFD田間樣品的檢測
2020年從江蘇和云南不同地區采集了9份疑似菜豆黃花葉病毒感染的蠶豆樣品葉片。通過RPA-LFD的方法檢測BYMV,同時用PCR進一步驗證。結果表明,9份樣品中有6個陽性植株,RPA-LFD 檢測結果與PCR結果一致(圖4)。因此,所建立的菜豆黃花葉病毒的RPA-LFD檢測技術可以快速且有效地檢測出田間病樣中的BYMV(表1)。
3 討論
1985年濮祖芹等利用血清學的方法曾在江蘇菜豆中檢測到菜豆黃花葉病毒[30],之后在浙江[31]、云南[32]等地均有報道。 筆者所在實驗室在2019—2021這3年間,從江蘇、安徽、云南、廣西、重慶、四川等地收集了200多份蠶豆疑似病樣,經PCR檢測出的病毒,菜豆黃花葉病毒的占比接近30%,說明該病毒已經對全國各地蠶豆的生產造成了嚴重威脅。病毒病的準確檢測和診斷是有效防控作物病害的重要步驟,所以建立一套快捷、高效的檢測方法對有效地防止病害的流行起到至關重要的作用。
本研究建立的RPA-LFD檢測蠶豆植株中菜豆黃花葉病毒的方法操作簡單,反應迅速而且具有較高的特異性。RPA-LFD可在37~42 ℃的常溫條件下進行擴增,因為引物的退火和延伸是由酶介導的,不是靠溫度驅動,從而不需要昂貴的熱循環儀,僅需在恒溫的水浴鍋中即可完成,甚至有學者通過RPA可常溫擴增的特點設計出了僅用人體體溫就能完成DNA擴增的檢測方法[33]。在田間樣品檢測到的陽性病樣均經PCR檢測得以驗證,RPA-LFD最短可在20 min內完成擴增,通過側向流動試紙條5 min即可讀出結果,相比于PCR擴增一般需要90 min左右,而且如果操作不當,電泳條帶易不清晰或彌散,本研究建立側向流動試紙條的檢測方法耗時短,操作更簡易,結果直觀且易于辨識,非常適合用于野外病樣的快速診斷;同時,RPA-LFD檢測的靈敏度也是其優勢之一,本研究中RPA-LFD檢測菜豆黃花葉病毒的靈敏度是PCR的100倍;本試驗開發的引物和探針對菜豆黃花葉病毒具有特異性,而對其他3種馬鈴薯Y病毒屬的病毒無交叉反應。
2006年RPA技術首次被報道,因其檢測快速、靈敏且高效等優點,近年來在植物病毒檢測領域被廣泛使用。RPA-LFD技術可直接以粗提物為模板,操作簡便,避免了樣品制備的繁瑣過程,減少時間成本,可以直接在田間完成檢測[34]。不過,RPA技術還存在一些不足之處可供完善,比如其檢測成本較高于PCR,缺乏專門的引物和探針設計軟件,而且在檢測過程中容易受其他因素的影響,尤其是氣溶膠污染而產生假陽性,所以檢測應在無污染且通風良好的環境中進行。隨著RPA技術的不斷完善,該技術有望成為我國菜豆黃花葉病毒田間診斷與防控的實用性技術手段。相比于傳統的分子檢測技術,RPA技術在植物快速診斷領域具有更為廣泛的應用前景。
參考文獻:
[1]Chen J,Chen J,Adams M J.A universal PCR primer to detect members of the Potyviridae and its use to examine the taxonomic status of several members of the family[J]. Archives of Virology,2001,146(4):757-766.
[2]Chung B Y W,Miller W A,Atkins J F,et al. An overlapping essential gene in the Potyviridae[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(15):5897-5902.
[3]Wada Y,Iwai H,Ogawa Y,et al. Comparison of Pathogenicity and Nucleotide sequences of 3′-terminal regions of bean yellow mosaic virus isolates from Gladiolus[J]. Journal of General Plant Pathology,2000,66(4):345-352.
[4]Wylie S J,Coutts B A,Jones M G K,et al. Phylogenetic analysis of bean yellow mosaic virus isolates from four continents:relationship between the seven groups found and their hosts and origins[J]. Plant Disease,2008,92(12):1596-1603.
[5]Kumar Y,Hallan V,Zaidi A A.Identification and Characterization of bean yellow mosaic virus Infecting Freesia[J]. Journal of Plant Biochemistry and Biotechnology,2009,18(2):253-255.
[6]Parrella G,Lanave C. Identification of a new pathotype of bean yellow mosaic virus (BYMV) infecting blue passion flower and some evolutionary characteristics of BYMV[J]. Archives of Virology,2009,154(10):1689-1694.
[7]Wylie S J,Luo H,Li H,et al. Multiple polyadenylated RNA viruses detected in pooled cultivated and wild plant samples[J]. Archives Of Virology,2012,157(2):271-284.
[8]Sharma P,Sahu A K,Verma R K,et al. Current status of potyvirus in India[J]. Archives of Phytopathology and Plant Protection,2014,47(8):906-918.
[9]Zakubanskiy A V,Mitrofanova I V,Chirkov S N.Molecular characterization of viruses infecting canna in Russia[J]. European Journal of Plant Pathology,2017,149(4):923-931.
[10]Murashige T,Skoog F.A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15(3):473-497.
[11]Bos L.The identification of three new viruses isolated from Wisteria and Pisum in The Netherlands,and the problem of variation within the potato virus Y group[J]. Netherlands Journal of Plant Pathology,1970,76(1):8-46.
[12]夏明忠. 蠶豆病害研究簡介[J]. 園藝與種苗,1990(3):45-46.
[13]涂麗琴,吳淑華,干射香,等. 江蘇省蠶豆上菜豆黃花葉病毒的分子鑒定[J]. 江蘇農業學報,2019,35(4):804-810.
[14]Prabowo D B,Hadiastono T,Himawan T,et al. Detection disease of sugarcane streak mosaic virus (SCSMV) via serological test on sugarcane (Saccharum officinarum L.),weed and insect vector[J]. International Journal of Science and Research,2014,3(1):88-92.
[15]Hema M,Savithri H S,Sreenivasulu P. Antibody and nucleic acid probe-based techniques for detection of sugarcane streak mosaic virus causing mosaic disease of sugarcane in India[J]. Current Science,2001,81(8):1105-1108.
[16]Fu W L,Sun S R,Fu H Y,et al. A one-step real-time RT-PCR assay for the detection and quantitation of sugarcane streak mosaic virus[J]. BioMed Research International,2015,2015:569131.
[17]Chandran V,Gajjeraman P. A simple precipitation approach for isolation and enrichment of sugarcane streak mosaic virus[J]. Sugar Tech,2013,15(4):417-419.
[18]Hema M,Kirthi N,Sreenivasulu P,et al. Development of recombinant coat protein antibody based IC-RT-PCR for detection and discrimination of sugarcane streak mosaic virus isolates from Southern India[J]. Archives of Virology,2003,148(6):1185-1193.
[19]Vincelli P,Tisserat N. Nucleic acid-based pathogen detection in applied plant pathology[J]. Plant Disease,2008,92(5):660-669.
[20]Babu B,Washburn B K,Miller S H,et al. A rapid assay for detection of rose rosette virus using reverse transcription-recombinase polymerase amplification using multiple gene targets[J]. Journal of Virological Methods,2017,240:78-84.
[21]Ghosh D K,Kokane S B,Kokane A D,et al. Development of a recombinase polymerase based isothermal amplification combined with lateral flow assay (HLB-RPA-LFA) for rapid detection of Candidatus Liberibacter asiaticus[J]. PLoS One,2018,13(12):e0208530.
[22]Lei R,Kong J,Qiu Y H,et al. Rapid detection of the pathogenic fungi causing blackleg of Brassica napus using a portable real-time fluorescence detector[J]. Food Chemistry,2019,288:57-67.
[23]Zhang S L,Ravelonandro M,Russell P,et al. Rapid diagnostic detection of plum pox virus in Prunus plants by isothermal AmplifyRP? using reverse transcription-recombinase polymerase amplification[J]. Journal of Virological Methods,2014,207:114-120.
[24]Wang T M,Yang J T.Visual DNA diagnosis of tomato yellow leaf curl virus with integrated recombinase polymerase amplification and a gold-nanoparticle probe[J]. Scientific Reports,2019,9(1):1-8.
[25]張永江,魏 霜,袁俊杰,等. 一步法逆轉錄重組酶聚合酶常溫擴增(RT-RPA) 技術檢測菜豆莢斑駁病毒[J]. 江蘇農業科學,2018,46(21):96-98.
[26]陳 玲,段續偉,張開春,等. 基于重組酶聚合酶擴增 (RPA) 技術的櫻桃病毒 A(CVA) 的檢測方法[J]. 園藝學報,2020,47(2):390-398.
[27]Cao Y H,Yan D K,Wu X Y,et al. Rapid and visual detection of milk vetch dwarf virus using recombinase polymerase amplification combined with lateral flow strips[J]. Virology Journal,2020,17(1):102.
[28]Srivastava N,Kapoor R,Kumar R,et al. Rapid diagnosis of cucumber mosaic virus in banana plants using a fluorescence-based real-time isothermal reverse transcription-recombinase polymerase amplification assay[J]. Journal of Virological Methods,2019,270:52-58.
[29]Piepenburg O,Williams C H,Stemple D L,et al. DNA detection using recombination proteins[J]. PLoS Biology,2006,4(7):e204.
[30]濮祖芹,周益軍. 從菜豆上分離的菜豆黃花葉病毒鑒定[J]. 南京農業大學學報,1985,8(2):130.
[31]鄭 滔,陳 炯,陳劍平. 杭州郊區菜豆花葉病病原的分子鑒定[J]. 浙江農業學報,2002,14(3):178-181.
[32]Qi P,Wang X M,He Q Y,et al. Sequence analysis of the coat protein gene of bean yellow mosaic virus isolates from faba bean in Yunnan,China and Syria[J]. Acta Phytopathologica Sinica,2007,37(4):368-376.
[33]Crannell Z A,Rohrman B,Richards-Kortum R.Equipment-free incubation of recombinase polymerase amplification reactions using body heat[J]. PLoS One,2014,9(11):e112146.
[34]Kappagantu M,Villamor D E V,Bullock J M,et al. A rapid isothermal assay for the detection of Hop stunt viroid in hop plants (Humulus lupulus)and its application in disease surveys[J]. Journal of Virological ?Methods,2017,245:81-85.
收稿日期:2022-10-08
基金項目:國家食用豆產業技術體系建設專項(編號:CARS-08-G15);江蘇現代農業(特糧特經)產業技術體系集成創新中心項目(編號:JATS[2019]399)。
作者簡介:朱宇翔(1996—),男,江蘇南通人,碩士研究生,從事豆類作物病毒病的研究。E-mail:1017980413@qq.com。
通信作者:崔曉艷,博士,研究員,從事大豆花葉病毒及豆類作物抗病遺傳育種研究,E-mail:cxy@jaas.ac.cn;陳學好,博士,教授,從事黃瓜品質性狀和抗逆性狀研究,E-mail:xhchen@yzu.edu.cn。

