簡談獸藥GLP/GCP 質量管理標準體系的建立與運行
鐘薇馨
(揚州大學獸醫學院,江蘇 揚州 225009)
為提高獸藥非臨床/臨床研究質量,保證獸藥的安全性,確保獸藥研究評價的真實性、完整性和可靠性,2015 年12 月9 日,農業農村部根據《獸藥管理條例》規定,公布農業農村部公告第2336 號《獸藥非臨床研究質量管理規范》與農業農村部公告第2337 號《獸藥臨床試驗質量管理規范》。而后的農業農村部公告第2464 號規定自2018 年1 月1 日起,未經農業農村部監督檢查或監督檢查不合格的獸藥安全性評價單位,其完成的研究、試驗數據資料不得用于獸藥注冊申請,至此獸藥非臨床/臨床研究管理規范正式實施。
1 獸藥GLP 與GCP
1.1 獸藥GLP
獸藥GLP(Good laboratory practice,GLP),即獸藥非臨床研究質量管理規范。實施目的是為規范和提高獸藥非臨床研究質量,以確保獸藥安全評價工作的真實性、完整性和可靠性,保證獸藥的質量安全,是對獸藥非臨床安全性評價機構的組織管理體系、人員、實驗設施設備、試驗項目運行與管理等方面的要求,對獸藥非臨床研究全過程進行規范化管理的技術性標準。截至2023 年6 月,根據中國獸藥信息網的公告信息,共計8 個機構單位通過獸藥GLP 監督檢查,其中高校4 所、科研院所1 所、企業3 家。具體通過監督檢查的數據見表1。
1.2 獸藥GCP
獸藥GCP(Good Clinical Practice,GCP),即獸藥臨床試驗質量管理規范。實施目的是是對臨床試驗中方案設計、組織實施、檢查監督、記錄、分析總結和報告等全過程的規范化要求,以保證試驗數據的真實性、完整性和準確性。通常申報獸藥GCP 監督檢查的項目分為化藥與中獸藥、生藥兩大類,由不同的靶動物與試驗項目組合而成,具體靶動物分為豬、牛、羊、禽類、寵物等,試驗項目包括安全性試驗、生物等效性試驗等。截至2023 年5 月,根據中國獸藥信息網的公告信息,共計66 個機構單位通過獸藥GCP 監督檢查,其中化藥、中獸藥類共計通過20 所,包括高校5 所、科研院所4 所、企業11 家;生藥類共計通過50 所,包括高校2 所、科研院所3 所、企業45 家。具體通過監督檢查的數據見表2。
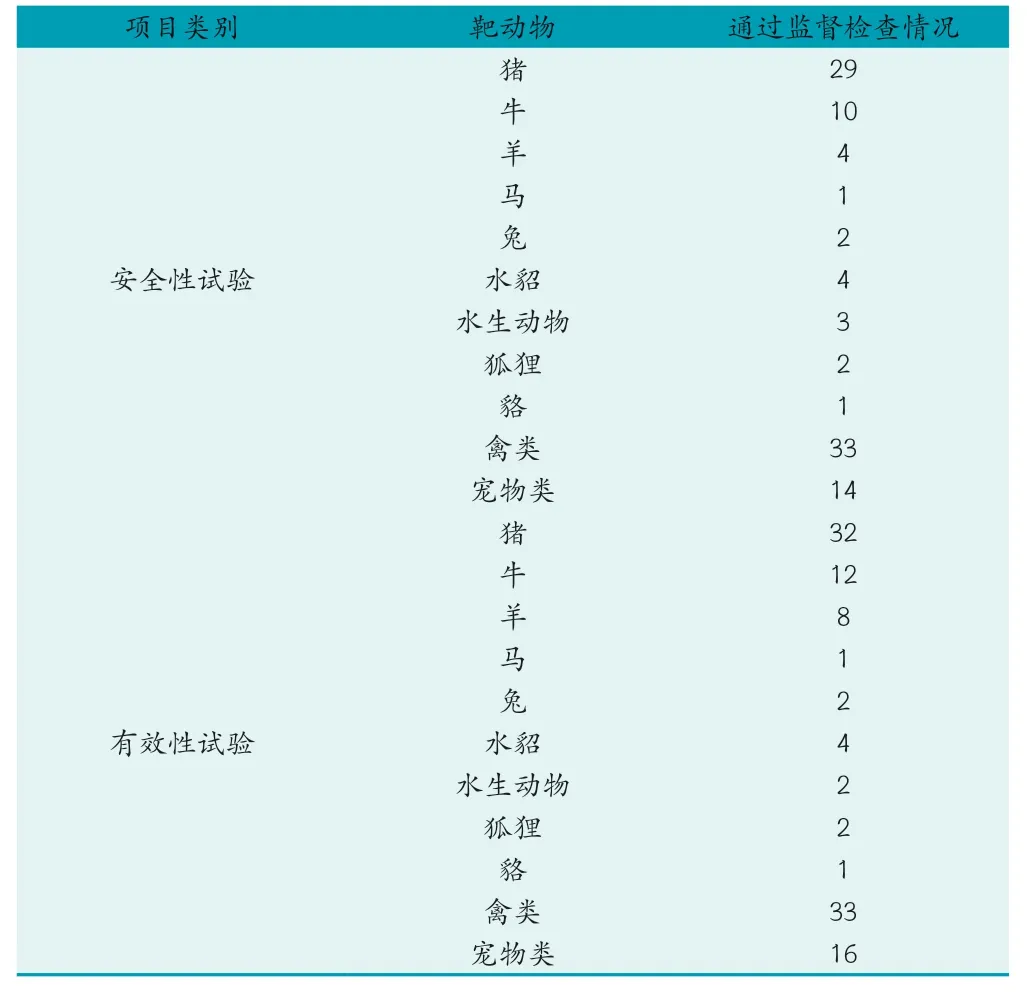
表2 生藥GCP 監督檢查項目及通過情況表
2 組織機構的建立
按照農業農村部第2464 號公告規定,獸藥非臨床/臨床試驗機構應具有獨立的法人資格或經法定代表人授權,不同法人單位不可聯合作為獸藥非臨床/臨床試驗機構,設置合理的組織機構,即成立實驗動物福利倫理委員會、生物安全委員會、質量保證部門、綜合管理辦公室、項目管理部門、檢測實驗室等,配備與非臨床/臨床試驗相適應的管理人員與技術人員,各部門職能明確、運行有序。獸藥安全評價機構組織機構示例圖見圖1。
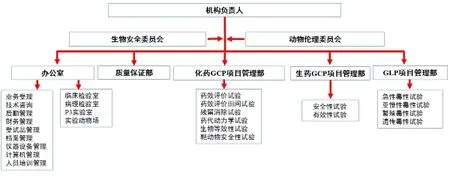
圖1 獸藥安全評價機構組織機構圖
在組織機構設立之初,應充分考慮農業農村部公告第2336 號、第2337 號、第2464 號中對于機構、人員的相關具體規范要求。包括機構應通過CMA 或CNAS 認可,另需設置有獨立的質量保證部門、專用檔案室(文件柜需帶鎖)、樣品接收室、設盲與揭盲室等。另關于人員方面,要求機構中的管理人員、技術人員均需經過GLP/GCP 培訓,熟悉管理規范相關內容,同時經過專業知識培訓,需進行考核上崗,對于所承擔工作相關的標準操作規程能熟練掌握并嚴格執行。同時對相關部門負責人提出具體要求,均要求具備獸醫學、藥學、生物學等相關專業背景,具備相關非臨床/臨床研究經驗,要求具有高級職稱或根據不同崗位要求不同年限的相關工作經驗。
3 質量管理體系的建立
3.1 建立質量管理體系的重要性
質量管理在新獸藥安全研究評價中至關重要,質量管理體系文件是一套具有指導性、綱領性的針對本機構研究活動進行質量保障的管理原則與規定的具體文字文件,其闡述在新獸藥研究評價過程中所必須遵循的規定,力求對新獸藥研究評價活動的所有質量環節達到有效控制。
機構通過質量管理體系,對機構內試驗相關的人員、環境、儀器設備、檢測等具體環節作出科學、系統、細化的要求,進行有效控制,提升研究評價活動結果的真實性、準確性和可靠性。機構質量管理體系是否完善,直接影響研究評價活動所出具的報告質量高低。
3.2 質量管理體系的策劃與設計
結合機構的研究評價活動的特點,首先組織機構內部的培訓教育、統一認識,再組織工作小組,擬定、落實工作計劃,制定適宜本機構的質量方針與質量目標,完成編寫質量管理體系文件等。
3.2.1 培訓教育、統一認識
質量管理體系建立和完善,首先應對管理層人員進行培訓,主要培訓內容為介紹質量管理與質量保證的相關知識,說明建立質量管理體系的重要性;再次對技術骨干及與建立質量管理體系相關的工作人員,組織對農業農村部公告第2336 號、第2337 號中獸藥GLP/GCP 相關監督檢查標準中各條款有關內容進行深入學習。
3.2.2 組織落實、擬定計劃
在了解質量管理體系的基本內容后,成立一個工作小組,由機構負責人擔任組長,質量保證部負責人擔任副組長,各項目部負責人與主要技術人員作為組員的班子。組長、副組長對機構管理體系進行總體規劃,制定質量方針與質量目標,同時根據各部門質量管理體系要素的不同進行工作分解,如采購、設備管理、檢測工作、動物實驗等環節。各工作小組成員根據分工的不同,分別制定各自的工作計劃,明確階段性工作目標與任務及相關責任人。
3.2.3 制定質量方針與目標
質量方針是對機構內人員質量行為的準則和質量工作方向,通常與總方針相協調,需包含機構的質量目標,結合機構特點進行制定,應通俗易懂便于堅持執行。
3.2.4 確定活動過程和要素
新獸藥研究評價工作是一系列的研究活動,包括動物實驗與檢測活動等,工作小組成員應根據獸藥GLP/GCP 相關監督檢查標準要求,結合獸藥安全評價試驗中的具體情況,對實驗設施與管理、儀器設備和實驗材料、標準操作規程、研究工作的實施、資料檔案等方面進行分析,確保研究工作中各個要素、過程達到質量要求。
3.2.5 編寫質量管理體系文件
質量管理體系文件通常包含質量手冊、程序文件、作業指導書(標準操作規程)、記錄與其他文件。質量手冊是闡述機構質量方針與目標的綱領性文件,為第一層次文件。程序文件是對質量管理、技術活動過程進行控制的依據,是質量手冊的支持文件,為第二層次文件。作業指導書(標準操作規程)是具體各項技術活動的具體標準操作規程,包括管理類、技術類與儀器設備類,為第四層次文件。記錄與其他文件中記錄文件是指各項獸藥安全評價項目運行的記錄與機構運行期間產生的管理類表格記錄,其他文件指來自外部的文件(包括上級機構或客戶),如標準、測試方法等。
根據獸藥GLP/GCP 相關監督檢查標準,其中作業指導書需包含以下標準操作規程:制定有與實驗工作相適應;SOP 的制定、修改、銷毀和管理;質量保證相關;受試獸藥的管理(接收、登記、標識、保存、分發、返還);受試獸藥的使用(取樣分析、處理、配制、領用);實驗室管理和環境調控(動物實驗設施與功能實驗室);實驗設施/設備的使用、維護、保養、校正和管理;計算機系統操作和管理;實驗動物運輸與接收;臨床試驗動物篩選與入選;臨床試驗動物隔離觀察;實驗動物檢疫;實驗動物分組與識別;實驗動物飼養管理;實驗動物的技術操作及觀察記錄;動物尸檢及組織病理學檢查(包括瀕死或已死亡動物);各種實驗樣品采集、各種指標的檢查和測定等操作技術和統計處理;質量控制用樣本的制備與分析;樣品預處理;樣品特定編碼;樣本接收、保存和安全處置;分析測試方法學考察;病例報告表記錄;數據和分析結果的打印和保存;測試圖譜打印和保存;測試結果和藥代參數分析結果打印和保存;制定抽查及整改;工作人員管理(年度培訓與考核、健康檔案);廢棄物處理(包括醫療廢棄物與動物尸體等);資料檔案(包括電子文檔)管理;盲底保存;不良事件及嚴重不良事件處理;嚴重不良事件報告;其他工作。
4 管理體系試運行
制定的質量管理體系只有通過試運行,才能在實際中發現并改正問題,以發揮管理體系文件對質量活動控制的目的。在試運行過程中,首先必須在機構內宣貫體系文件,保證全體人員了解、掌握機構的管理制度。其次,在各部門內對試運行期間出現的問題及改進建議進行收集,運行一段時間后,召開機構內主要人員會議,討論試運行期間暴露問題及整改措施,對質量管理體系文件中的不適之處,及時落實責任人進行修訂。
5 持續改進
5.1 內部審核
機構內部審核稱為第一方審核,由質量保證部的相關內審員負責對機構質量管理體系進行的審核,是自我約束、自我完善的活動。機構的內審員需經過相關培訓與考核獲得內審資格及內審員證書。內審小組通過現場檢查、與受審人員面談、查看文件和記錄等方式對機構進行全面檢查,找出不符合項,并及時整改以達到完善、優化機構質量管理體系的目的。
5.2 管理評審
管理評審就是機構負責人為評價管理體系運行情況以及質量方針和目標的貫徹落實及實現情況組織進行的綜合評價活動,具體體現為年度總結等方式,在總結當前年度活動的同時,對下一年度的目標提出新的要求,以期機構持續發展。
5.3 糾正與改進措施
糾正是“為消除已發現的不合格所采取的措施”,糾正措施是“針對不合格原因采取措施”。機構通過建立不符合工作控制程序, 對不符合工作進行控制,消除已存在的不符合項,保證管理體系有效運行。應及時對存在的問題進行討論分析具體原因,對該類問題有針對性地制定糾正措施,并對糾正措施的效果實施跟蹤驗證。
6 結語
總而言之,建立符合機構實際的質量管理體系在機構日常運行中非常重要,通過質量手冊、程序文件、作業指導書、記錄及其他文件等多層體系文件具體規定,以資源控制、過程要求、持續改進三個方面形成機構質量管理體系,是各個環節工作高效、持續、穩定運行的關鍵,同時才能保證研究評價工作的可靠、有效性,實現公平公正。

