雜化納米材料光熱治療腫瘤的研究進展
黃小秀 李虎 楊松

摘 要:光熱治療(photothermal therapy,PTT)具有高效快速、侵入性小、無創等優點。通常在光熱治療中采用單一的納米材料作為光熱劑,然而使用單一納米材料通常會面臨生物相溶性差、穩定性差、毒性大、靶向性能差、缺少成像性等問題。本文主要綜述了最近幾年開發的雜化納米材料,通過多種光熱材料的摻雜、包覆、表面修飾等方法開發了碳基雜化、無機雜化、有機-無機雜化等具有優良光熱性能的光熱材料,解決了使用單一光熱材料面臨的問題。此外,通過融合光熱材料、靶向材料、成像材料、化療材料和放射性材料等達到聯合協同治療的效果。雜化材料促進高效治療癌癥技術的發展,為光熱協同治療提供材料支持。這些方法為進一步開發新型雜化光熱材料提供了思路,有望基于當前報道的各類具有光熱潛力的材料,開發出高光熱效率、高安全性的雜化光熱材料,使光熱雜化納米材料在腫瘤的治療臨床應用具有廣闊的前景。
關鍵詞:光熱治療;光熱材料;靶向特異性;生物相容性;癌細胞
中圖分類號:TB383.1;R730.5
文獻標志碼:A
癌癥一直是威脅人類生命健康的主要疾病之一。目前,癌癥的治療方法主要依賴手術、化療、放療等傳統技術[1]。但這些原始的治療方案往往會對正常人體組織產生不可避免的損害,而且具有療效低、靶向特異性差、耐藥性等缺點[2]。近年來,光熱療法(photothermal therapy,PTT)已成為治療癌癥的一種有效且重要的方法。其主要原因是治療時間短(約幾分鐘),侵入性小,療效顯著,副作用少(大多數光敏劑在低濃度下相對無害)等[3]。PTT是一種典型的光子觸發治療方式,它通過光熱劑(photothermal agents,PTAs)在可見光或近紅外光(near-infrared,NIR)(600~900 nm)的激發下產生的局部高溫殺死腫瘤細胞[4]。癌細胞對高熱的敏感性高于正常細胞,高溫會對癌細胞膜造成不可逆的損傷,促進蛋白質變性[5]。近紅外光因其具有較高的組織穿透能力,對皮膚的吸光度較低,并且能夠聚焦于特定的組織部位,被廣泛用作光熱治療的外部激光源[2]。因此,PTT是一種對傳統癌癥治療的補充,具有創傷性小、靶向性高、恢復速度快等特點,被認為是一種極具應用前景的癌癥治療策略。PTAs是PTT應用中的一個重要的組成部分,它能通過非輻射機制將光能直接轉變成熱能,高溫消融病變組織或細胞。光熱轉換效率(photothermal conversion efficiency,PCE)是PTAs的一個關鍵因素,它直接決定光熱治療過程中所需要的激發光強度。已經報道了許多不同類型的光熱劑,包括無機納米材料(如貴金屬納米粒子、金屬硫化物納米粒子、碳基材料、過渡金屬納米粒子以及新興的二維納米材料等[1-2,6]),有機化合物納米材料(如吲哚菁綠[7]、聚苯胺[8]、卟啉環[9])。早期對PTAs的研究主要集中在貴金屬納米材料,這些貴金屬納米材料具有良好的光吸收能力,同時具有較高的光熱轉換效率[4]。但無機材料存在生物相容性低、不可降解等特點,而有機材料具有良好的生物相容性。因此,雜化納米材料是一種由有機或無機物質組成的混合物,它提供了每一組分的最佳特性,使雜化納米材料具有獨特的物理和化學性能[10],成為生物醫學研究的熱點領域之一。
隨著基因療法(gene therapy,GT)、免疫療法、光動力療法(photodynamic therapy,PDT)等新興療法的相繼發展,利用光熱治療與其他治療方案聯合應用,設計開發出多功能的雜化納米復合材料,實現多種具有協同效應治療策略的集成,從而提高治療效果和優化腫瘤治療方案[11]。在本綜述中,總結了不同雜化納米材料在光熱治療癌癥中的研究進展,并詳細討論了光熱治療的機理和3種典型的雜化材料的制備策略,如多種光熱材料摻雜、包覆、表面修飾等方法,解決了使用單一材料面臨生物相溶性差、穩定性差、毒性大、靶向性能差、缺少成像性等問題。此外,雜化納米材料通過融合光熱材料、靶向材料、成像材料、化療材料和放射性材料等從而達到聯合協同治療的效果。光熱治療與化療、放療、光動力治療的協同運用為其在臨床的應用提供可能。
1 碳基雜化納米材料
近年來,碳納米材料由于具有優異的熱學和光學性質被廣泛應用于生物醫學領域。碳基納米材料晶格中的雜化形式有利于分子中的電子在近紅外激光照射下從低軌道態激發到高軌道態。隨后,通過非輻射弛豫的方式將吸收的激光能量從被激發的電子傳遞到整個晶格的振動中,進而產生熱能[12]。因此,在近紅外波段具有較高的光熱轉換效率。其次,碳納米材料具有較低的細胞毒性,可在腫瘤環境中被過氧化物酶降解[13]。再者,碳納米材料具有較大的比表面積和孔體積[14],可作為藥物載體,用于化療和熱療協同治療腫瘤。
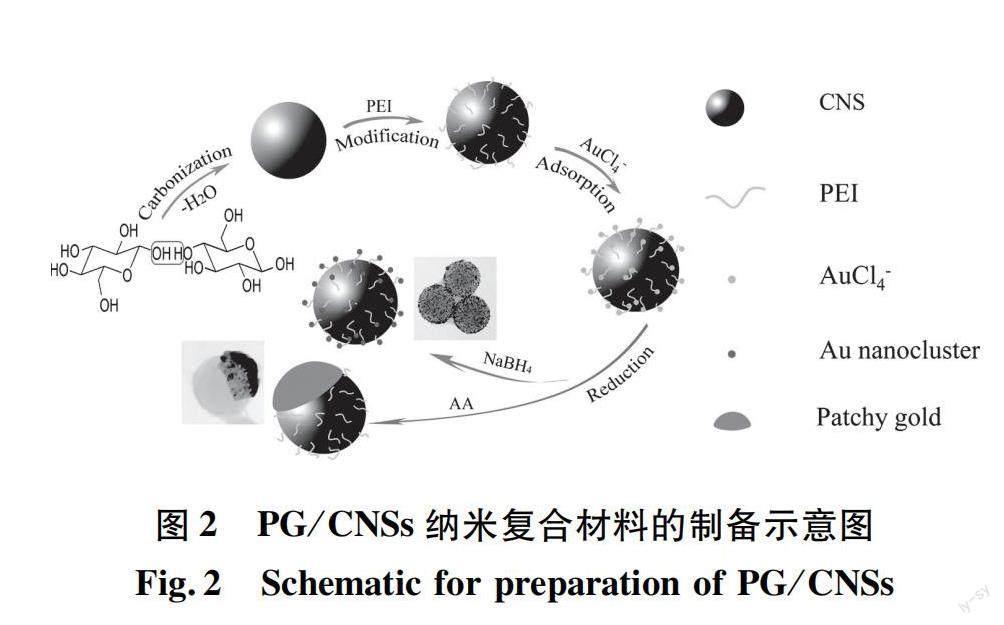
目前,癌癥發病率不斷上升,但傳統的給藥系統受到低生物利用度的限制,導致腫瘤部位藥物積累很少,循環時間短[15],缺乏選擇性[16]。此外,由于光散射的原因,單一的PTT技術難以治愈腫瘤。傳統藥物療效顯著,但副作用和耐藥性較大。與單獨PTT或化療相比,兩者聯合應用可協同治療腫瘤,達到藥物可控釋放,增強療效[17-19]。據此,Liu等[20]設計并合成了一種多孔核殼結構、且具有良好生物相容性的多功能納米載體Fe3O4@C/ZnO-DOX-FA。碳和ZnO均由ZIF-8于適當的溫度下,在Ar或空氣氛中煅燒獲得(圖1)。通過體外和體內實驗證實,復合材料中的介孔碳不僅可以作為光熱劑,還可與ZnO一起作為有效的藥物載體。Fe3O4和ZnO同時存在,可以實現藥物靶向細胞給藥和pH控制釋放,并且葉酸分子實現了癌細胞的特異性靶向[20]。Wang等[16]通過吸附-還原方法制備了一種金/碳納米球(PG/CNSs)材料(制備過程如圖2所示),其斑片狀金的形成主要是一個熱力學驅動的自發過程。通過葡萄糖水熱碳化法合成碳納米球,然后使用聚乙烯亞胺(polyethyleneimine,PEI)接枝到CNSs表面,將改性后的碳納米球移入HAuCl4溶液中,AuCl-4離子吸附在主粒子表面,最后使用抗壞血酸(ascorbic acid,AA)弱還原劑將AuCl-4離子還原為Au,獲得斑片狀金/碳納米球(PG/CNSs)。向體內注射一定量的PG/CNSs顆粒(0.2 mg),在激光照射下,腫瘤局部溫度迅速達到64.4 ℃,足以消融惡性細胞。結果表明,PG/CNSs納米材料以Janus結構的形式存在時,暴露在表面的斑片狀金和碳的組合吸收NIR,從而增加NIR吸收系數。與單獨的金納米棒相比,由于對碳的保護,這種薄金貼片的熱穩定性有望更高,所得的納米復合材料不僅具有更高的光熱轉換效率,而且具有更高的熱穩定性。
碳納米管(carbon nanotube,CNT)包括單壁碳納米管 (single-walled carbon nanotube,SWCNT)和多壁碳納米管(multi-walled carbon nanotube,MWCNT),在NIR區域有強光吸收和高光熱轉換效率[21-22]。此外,碳納米管具有高比表面積和體積,是核酸、蛋白質和藥物分子等細胞內轉運的潛在載體[23]。利用碳納米管可有效地將化療和光熱治療結合起來,Dong等[24]開發了一種新型的基于TAT-殼聚糖功能化多壁納米管(MWCNTs/TC)的阿霉素(DOX)給藥體系,并初步研究了抗腫瘤作用,探討了MWCNTs/DOX/TC在化學光熱聯合治療中的應用潛力,并評估藥物體外釋放、光熱效應、細胞攝取和細胞毒性。結果表明,該新型給藥體系不僅實現了DOX的顯著緩釋,而且保留了MWCNTs的光學特性,在近紅外照射下具有較高的光熱效應;同時,通過化療和光熱消融的協同作用,表現出顯著增強的抗腫瘤療效。
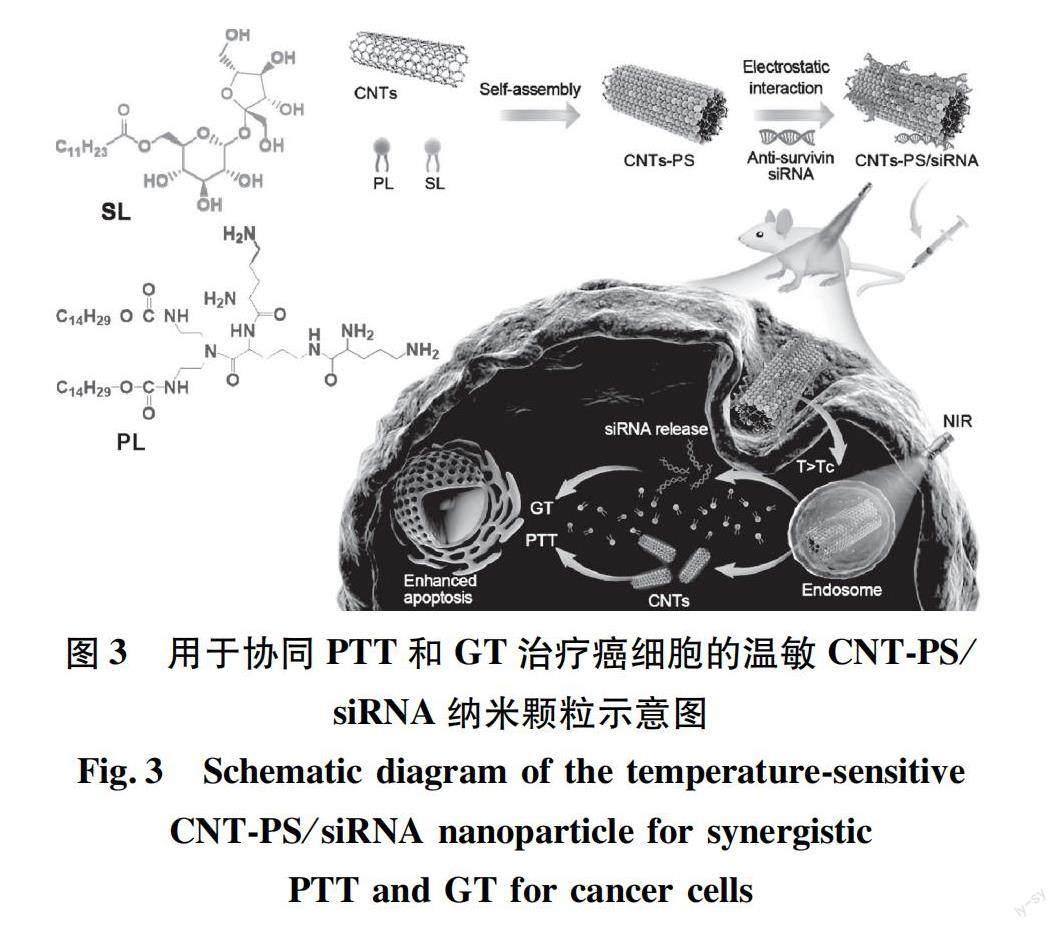
PTT與GT的聯合應用在協同抗腫瘤方面同樣具有很大潛力。光熱轉換材料作為基因傳遞載體,可以有效結合帶負電荷的基因[25]。目前,碳納米管被用作藥物載體和生物成像探針[26]。Zhao等[27]采用肽脂質和月桂酸蔗糖包裹單壁碳納米管(SWCNTs)和多壁碳納米管(MWCNTs)(圖3),形成了具有溫度敏感性和光熱性能的雙功能傳遞體系(分別為SWCNT-PS和MWCNT-PS),并將siRNA加載到碳納米管上,形成siRNA可控釋放的載體CNT-PS/siRNA。結果表明,CNT/siRNA能抑制腫瘤的生長,同時在NIR光照下表現出光熱效應。相較于MWCNT-PS/siRNA,SWCNT-PS/siRNA表現出非常高的抗腫瘤活性,可完全抑制部分腫瘤生長。
氮摻雜石墨烯量子點(N-GQDs)具有強電子供體基團[28]、較佳的生物相容性和光熱穩定性,是良好的光熱轉換劑(photothermal conversion agents,PTCAs)。Zhang等[29]通過在核殼氮摻雜石墨烯量子點(N-GQD)@中空介孔二氧化硅納米球(HMSN)上包覆介孔氮化碳(C3N4)層,并用P-PEG-RGD聚合物裝飾,構建了一種智能納米調節器R-NCNP(圖4)。N-GQDs使得R-NCNP納米調控器對高溫具有光熱效應,表現出較強的光熱效應和紅外熱成像(IRT)。
2 無機雜化納米材料
貴金屬納米材料具有較強表面等離子體共振效應(surface plasmon resonance effect,SPR)和可調諧性[30],特別是金顆粒(Au NPs),由于具有粒徑小、光熱轉換率高、增強滲透性和保留效果(enhanced permeability and retention,EPR)等優點,成為PTT的主要介質[31]。氧化石墨烯(graphene oxide,GO)具有良好的水相分散性、易于表面改性[32]、具有良好的生物相容性、無毒性和穩定性,以及大型離域π-電子系統有助于氧化石墨烯在可見光和近紅外區域獲得良好的吸附能力。球形金納米殼和石墨烯基納米材料是兩種主要的NIR熱療劑,已被報道用于癌癥的光熱治療。基于兩種材料的特征,He等[33]通過在氧化石墨烯涂上一層介孔二氧化硅,利用種子生長法構建了一層金納米片,形成GO@SiO2@AuNS材料(圖5)。氧化石墨烯上的二維結構和介孔二氧化硅層不僅為錨定金種子和金殼生長提供了模板,而且提高了氧化石墨烯的生物相容性和穩定性。GO@SiO2@AuNS雜化材料在近紅外區域具有較強的吸收能力和光熱轉換效率,在低激光劑量(0.3 W/cm2)下表現出良好的光熱穩定性,對癌細胞具有顯著的光消融作用。與GO@SiO2相比,GO@SiO2@AuNS雜化物在808 nm處的吸光度提高了近40倍。GO@SiO2@AuNS雜化物的光熱轉換效率約為30%,高于金納米棒(21.0%)。結果表明,GO@SiO2@AuNS雜化納米材料具有突出的癌癥光熱治療前景。
Liu等[34]通過DNA與稀土-金雜化納米粒子(UCNP-Au NPS)的靜電絡合,制備了一種新型的近紅外光響應的、可注射性的DNA雜化水凝膠DNA-UCNP-Au。采用溶劑熱法制備了Yb3+和Er3+共摻雜的單分散NaYF4納米粒子,并以其為核與NaYF4∶Nd形成雜化物。以聚醚酰亞胺(polyetherimide,PEI)為表面包覆劑將NaYF4∶Yb和Er@NaYF4∶Nd(UCNP)轉化為親水性的UCNP-PEI。接著,PEI與HAuCl4發生氧化還原反應生成UCNP-Au NPS(圖6)。與原始無機納米材料相比,DNA-UCNP-Au水凝膠具有較低的細胞毒性;同時,在相同的近紅外光輻照下,表現出較快的加熱速率,PTT可有效抑制腫瘤復發。
在各種捕光劑中,二元Cu基半導體(即Cu2-xS、Cu2-xSe和Cu2-xTe)由于無毒、成本低和銅空位在NIR區域表現出局域表面等離子體共振(localized surface plasmon resonance,LSPR)而具有較高的光熱轉換效率,近年來受到了廣泛關注[35]。為了提高光療效果,將PDT和PTT整合到一個系統中被認為是一種有效的策略[36]。Chen等[37]提出了由Cu-In-S(CIS)異質結納米棒(HS-rod)、氯素e6(Ce6)和透明質酸(HA)組成的Ce6-HA-CIS光熱治療納米雜化體(圖7),用于靶向PDT/PTT。雜化體中CIS-HS-rod作為PTT劑將光能轉化為熱能,Ce6作為PDT劑產生單線態氧(1O2)。HA包裹CIS-HS納米棒表面,并實現CIS-HS納米棒的水溶性。制備的Ce6-HA-CIS納米雜化體表現出較高的光熱轉換效率、良好的光穩定性和光動力活性。且體外和體內實驗表明,與單獨的PTT或PDT相比,Ce6-HA-CIS具有較低的細胞毒性和良好的協同光動力和光熱殺傷癌細胞的作用。
Yang等[38]設計并合成了空心結構的hCu2-xS@Au納米殼復合材料。通過在HCu2-xS@Au納米顆粒表面修飾二硫鍵橋接Au納米殼和多羧基石墨烯量子點(MC-GODs),實現可控給藥、監測和高光熱轉換效率的多模式治療。結果表明,在808 nm近紅外光照射下,hCu2-xS@Au@MC-GODs的光熱轉換效率為32%。
在臨床醫學應用中,由于血液和軟組織的吸收和散射,PTT需要具有相當深穿透力的近紅外光[39]。先前的大量研究主要集中在近紅外第一窗口(NIR-I ,750~1 000 nm),相比之下,近紅外第二窗口(NIR-II, 1 000~1 350 nm)具有更深的組織穿透、更低的光散射和更大的最大允許曝光量(maximum permissible exposure,MPE)[40]。窄帶隙的p型納米半導體和具有LSPR的納米金屬都有良好的NIR光響應特性[41-45],將等離子體金屬和窄帶隙半導體集成到異質結構單元中,可促進高效的PTT。金納米粒子作為最常用的等離子體納米材料,在光催化[46]、生物成像、光熱治療等領域得到了廣泛的應用[47]。傳統的研究主要集中在納米結構的形狀和尺寸上。當相同的物質在種子上生長(同金屬生長)時,界面完美匹配,生長材料將形成一個保形層,類似于液體層的潤濕性。由于其中有強鍵合,很少有方法可以調整同金屬界面。基于此,Jia等[48]報道了一種Au-on-AuNR雜化納米珊瑚結構材料,通過嵌入小的有機硫醇分子增加生長材料與底層種子之間的界面能,導致典型的潤濕生長轉變為島狀非潤濕生長模式,成功獲得了一系列Au-on-AuNR雜化結構。金納米棒上Au的生長情況可經優化結合界面能和反應動力學得到調節。通過改變AuNR上出現的Au域,可以在可見NIR光譜范圍內有效且連續地微調,結合對AuNRs的尺寸和長寬比的常規控制,進而有利于功能材料的結構精細化調控。通過體外和體內實驗得出材料在NIR-II區域具有強烈吸收和出色的光熱轉換行為,表明納米珊瑚結構具有較好光熱療法和光聲顯像劑。Li等[49]制備了超薄層狀雙氫氧化物(layered double hydroxides,LDHs)負載的Ag@Ag2O核殼納米顆粒(Ag@Ag2O/LDHs-U),極大地提高了NIR-II光熱性能,在1 064 nm激光下光熱效率高達76.9%。研究表明,超細Ag@Ag2O核殼納米顆粒(約3.8 nm)高度分散并固定在超薄LDHs納米片內,而Ag2O外殼具有豐富的空位型缺陷。此外,體內外活性測試進一步證實了Ag@Ag2O/LDHs-U在NIR-II區域具有良好的生物相容性和突出的PTT治療效果。
3 有機-無機雜化納米材料
近年來,開發的近紅外光熱材料可分為有機材料和無機材料兩大類。然而,現有的有機近紅外光熱材料往往存在光穩定性差、光熱轉換效率低、血液清除速率快等問題[50],而無機光熱材料通常存在生物相容性差、不可降解性、毒性大等缺點[51]。近紅外有機/無機納米雜化材料不僅可以結合有機和無機部分的原始性能,而且通過單個成分的協同作用(如理想的光學、生物和藥物特性等)[52-53],有望產生新的特性,在PTT領域引起了廣泛關注。通過無機納米活性結構與功能有機分子的偶聯和/或組裝,不僅可以提高NIR治療癌癥的療效,還可以增強NIR光熱治療劑的生物相容性和穩定性。
LDHs作為一種二維陰離子插層功能納米材料或前驅體,因其在物理化學性質和結構上的可變性而受到納米材料領域的廣泛關注[54]。Zhang等[55]報道了一種低帶隙的電子給體-受體效應誘導的有機/無機納米雜化物(ICG/Ag/LDHs)。將Ag納米粒子原位沉積到CoAl-LDHs表面(Ag/LDHs),然后將ICG耦合到Ag/LDHs上。結果表明,在808 nm激光照射下,ICG/Ag/LDHs的光熱轉換效率(~45.5%)比ICG(~28.4%)提高了1.6倍。且體外和體內實驗結果均證實了ICG/Ag/LDHs在NIR引發的癌癥治療中具有良好的生物相容性。
此外,Sun等[56]將金納米棒(gold nanorods,GNRs)封裝在聚吡咯(polypyrrole,PPy)外殼中,并通過修改SiO2硬模板來控制它們之間的空隙空間,形成具有可調諧的空隙空間(GNRs@Void@PPy)。雙NIR吸收的組分提供了協同增強光熱性能的作用,并通過體外和體內實驗證實了該雜化物具有較高的抗腫瘤活性。
目前,在NIR-II生物窗中已經開發了一系列用于腫瘤PTT和成像的PTAs,如WO3-x納米點(NDs)、Bi2S3-Ag2S-DATS@BSA-N3納米系統、Au NDs和TeO2/(NH4)xWO3NCs[57-60]等。此外,據報道,Cu2Se比Cu2S或Cu2SSe具有更好的光熱效應[61],可能是由Se2-最外層的電子產生的,比S2-更容易吸收光子并被激光激發。基于此,Hu等[62]報道了一種新型的NIR-II響應納米平臺(硒化鎳@聚多巴胺納米復合材料,NiSe@PDA NCs),用于雙模型成像引導光熱治療,在NIR-II激光(1 064 nm)照射下,NiSe@PDA NCs的光熱轉換效率可達48.4%,光熱轉換效率高于單個NiSe NPs。
無機納米材料二硫化鉬(MoS2)[63 ]作為PTT納米劑或放射增敏劑得到了廣泛的研究。由于無機納米級材料不能被生物降解,通常會在體內停留很長時間,造成潛在的長期毒性。聚苯胺(polyaniline,PANI)具有良好的光熱轉換效率、顯著的生物相容性和良好的光穩定性等特征。鑒于此,Wang等[64]通過靜電作用采用溶劑熱法制備了二硫化鉬量子點@聚苯胺(MoS2@PANI)雜化多功能納米材料。聚苯胺作為可生物降解和無毒的有機材料,可有效降低無機材料的治療濃度,進而降低MoS2在體內的保留量。通過與偶聯劑形成穩定的酰胺鍵,得到可溶性良好和穩定高的MoS2@PANI雜化納米材料,其具有較強的X射線衰減和較高的NIR吸收效率,可作為腫瘤X射線計算機斷層掃描(X-ray computed tomography,X-CT)和光聲(photoacoustic,PA)成像的造影劑。二硫化鉬納米量子點能產生強烈的熒光,有望作為體外和體內成像的探針或放射增敏劑。由于PTT誘導的適當水平的熱療可以增加腫瘤內血流,進而增強腫瘤微環境中的氧條件,導致細胞對放射治療(radiation therapy,RT)更加敏感[65]。簡言之,MoS2@PANI雜化納米材料可實現同步CT/PA成像和協同PTT/RT聯合治療癌癥。
霍氏小組報道了鎢氧化物納米顆粒(WO NPs)可以在NIR-II范圍內吸收光,并且具有良好的光熱轉換效果和穩定性。一些光熱劑,如PANI細胞毒性低,不僅具有優異的光熱轉化性能,而且可作為表面涂層材料,與其他光熱劑[66-68]形成復合光熱納米載體。鑒于PANI和W18O49在光熱治療中的優勢,Yang等[69]制備PANI@W18O49@Fe3O4(PWF)和PANI@W18O49(PW)的有機-無機雜化納米顆粒。不同波長(808和1 064 nm)下的納米顆粒的吸光度和光熱測量結果表明,其光熱性能是穩定的。PANI@W18O49在808和1 064 nm激光照射下的光熱轉換效率可分別達到50.43%和30.69%,PANI@W18O49@Fe3O4的光熱轉換效率也可達到63.9%和32.55%。藥物釋放實驗證明,混合納米顆粒可以在雙刺激反應(pH和溫度)條件下控制DOX的釋放,從而減少生理條件下藥物不受控制釋放引起的副作用。研究結果表明,制備的雜化納米顆粒具有應用于光熱和化療聯合治療的潛力;同時,雜化納米顆粒不僅不影響W18O49的光熱性能,而且提高了其抗氧化性能。
4 總結與展望
光熱治療由于具有高效快速、侵入性小、無創等優點,被廣泛開發用于治療惡性腫瘤、消炎、抗菌等生物醫學應用領域。本文總結了最近幾年光熱雜化材料的制備方法及其功能活性。隨著無機、有機光熱材料的發展,通過多種光熱材料的摻雜、包覆、表面修飾等方法開發雜化納米材料(包括碳基雜化材料、無機雜化材料、有機-無機雜化材料等)解決了使用單一材料面臨的生物相溶性差、穩定性差、毒性大、靶向性能差、缺少成像性等問題。雜化納米材料通過融合光熱材料、靶向材料、成像材料、化療材料和放射性材料等達到聯合協同治療的效果。同時,光熱治療與化療、放療、光動力治療的協同運用為其在臨床上的應用提供了可能。這些方法為進一步開發高光熱效率、高安全性的新型雜化光熱材料提供了思路,促進高效治療癌癥技術的發展,為光熱協同治療提供材料支持,使得光熱雜化納米材料在腫瘤的治療臨床應用具有廣闊的前景。
參考文獻:
[1] LV Z Q, HE S J, WANG Y F, et al. Noble metal nanomaterials for NIR-triggered photothermal therapy in cancer[J]. Advanced Healthcare Materials, 2021, 10(6): 2001806.
[2] BAO Z H, LIU X R, LIU Y D, et al. Near-infrared light-responsive inorganic nanomaterials for photothermal therapy[J]. Asian Journal of Pharmaceutical Sciences, 2016, 11(3): 349-364.
[3] ZOU Y, LI M L, XIONG T, et al. A single molecule drug targeting photosensitizer for enhanced breast cancer photothermal therapy[J]. Small, 2020, 16(18): 1907677.
[4] ZHAO R X, ZHU Y L, ZHOU J L, et al. Dual glutathione depletion enhanced enzyme catalytic activity for hyperthermia assisted tumor therapy on semi-metallic VSe2/Mn-CS[J]. ACS Nano, 2022, 16(7): 10904-10917.
[5] BIAN W Q, WANG Y K, PAN Z X, et al. Review of functionalized nanomaterials for photothermal therapy of cancers[J]. ACS Applied Nano Materials, 2021, 4(11): 11353-11385.
[6] NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Two-dimensional gas of massless Dirac fermions in graphene[J]. Nature, 2005, 438(7065): 197-200.
[7] YU J, JAVIER D, YASEEN M A, et al. Self-assembly synthesis, tumor cell targeting, and photothermal capabilities of antibody-coated indocyanine green nanocapsules[J]. Journal of the American Chemical Society, 2010, 132(6): 1929-1938.
[8] YANG J, CHOI J, BANG D, et al. Convertible organic nanoparticles for near-infrared photothermal ablation of cancer cells[J]. Angewandte Chemie-International Edition, 2011, 123(2): 461-464.
[9] LOVELL J F, JIN C S, HUYNH E, et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents[J]. Nature Materials, 2011, 10(4): 324-332.
[10]ALAMDARI S G, AMINI M, JALILZADEH N, et al. Recent advances in nanoparticle-based photothermal therapy for breast cancer[J]. Journal of Controlled Release, 2022, 349: 269-303.
[11]WANG J, WU X, SHEN P, et al. Applications of inorganic nanomaterials in photothermal therapy based on combinational cancer treatment[J]. International Journal of Nanomedicine, 2020, 15: 1903.
[12]HUANG J S, WANG J Q, HUANG Z C, et al. Photothermal technique-enabled ambient production of microalgae biodiesel: mechanism and life cycle assessment[J]. Bioresource Technology, 2023,369: 128390.
[13]KOTCHEY G P, ALLEN B L, VEDALA H, et al. The enzymatic oxidation of graphene oxide[J]. ACS Nano, 2011, 5(3): 2098-2108.
[14]CHENG L, RUAN W M, ZOU B F, et al. Chemical template-assisted synthesis of monodisperse rattle-type Fe3O4@C hollow microspheres as drug carrier[J]. Acta Biomaterialia, 2017, 58: 432-441.
[15]ZHANG Y L, LIU G N, WEI J Y, et al. Platelet membrane-based and tumor-associated platelettargeted drug delivery systems for cancer therapy[J]. Frontiers of Medicine, 2018, 12(6): 667-677.
[16]WANG J H, LI D, FAN Y, et al. Core-shell tecto dendrimers formed via host-guest supramolecular assembly as pH-responsive intelligent carriers for enhanced anticancer drug delivery[J]. Nanoscale, 2019, 11(46): 22343-22350.
[17]ZHANG M Y, LIU X J, LUO Q, et al. Tumor environment responsive degradable CuS@mSiO2@MnO2/DOX for MRI guided synergistic chemo-photothermal therapy and chemodynamic therapy[J]. Chemical Engineering Journal, 2020, 389: 124450.
[18]WANG Y Y, LIU X J, DENG G Y, et al. Se@SiO2-FA-CuS nanocomposites for targeted delivery of DOX and nano selenium in synergistic combination of chemo-photothermal therapy[J]. Nanoscale, 2018, 10(6): 2866-2875.
[19]LEE J H, GIBSON K J, CHEN G, et al. Bipyramid-templated synthesis of monodisperse anisotropic gold nanocrystals[J]. Nature Communications, 2015, 6: 1-9.
[20]LIU X, WANG C, WANG X Y, et al. A dual-targeting Fe3O4@C/ZnO-DOX-FA nanoplatform with pH-responsive drug release and synergetic chemo-photothermal antitumor in vitro and in vivo[J]. Materials Science & Engineering C-Materials for Biological Applications, 2021, 118: 111455.
[21]BAO Z H, LIU X R, LIU Y D, et al. Near-infrared light-responsive inorganic nanomaterials for photothermal therapy[J]. Asian Journal of Pharmaceutical Sciences, 2016, 11(3): 349-364.
[22]HUANG J S, JIAN Y M, LI H, et al.Lignin-derived layered 3D biochar with controllable acidity for enhanced catalytic upgrading of Jatropha oil to biodiesel[J]. Catalysis Today, 2022, 404: 35-48.
[23]QI X L, RUI Y, FAN Y C, et al. Galactosylated chitosan-grafted multiwall carbon nanotubes for pH-dependent sustained release and hepatic tumor-targeted delivery of doxorubicin in vivo[J]. Colloids and Surfaces B-Biointerfaces, 2015, 133: 314-322.
[24]DONG X, SUN Z T, WANG X X, et al. An innovative MWCNTs/DOX/TC nanosystem for chemo-photothermal combination therapy of cancer[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2017, 13(7): 2271-2280.
[25]KIM J H, KIM J H, JEONG C, et al. Synergistic nanomedicine by combined gene and photothermal therapy[J]. Advanced Drug Delivery Reviews, 2016, 98: 99-112.
[26]LIU Z, SUN X M, NAKAYAMA-RATCHFORD N, et al. Supramolecular chemistry on water-soluble carbon nanotubes for drug loading and delivery[J]. ACS Nano, 2007, 1(1): 50-56.
[27]ZHAO Y A, ZHAO T Y, CAO Y N, et al. Temperature-sensitive lipid-coated carbon nanotubes for synergistic photothermal therapy and gene therapy[J]. ACS Nano, 2021,15(4): 6517-6529.
[28]LIU Q, GUO B D, RAO Z Y, et al. Strong two-photon-induced fluorescence from photostable, biocompatible nitrogen-doped graphene quantum dots for cellular and deep-tissue imaging[J]. Nano Letters, 2013, 13(6): 2436-2441.
[29]ZHANG X, ONGACHWA MACHUKI J, PAN W Z, et al Carbon nitride hollow theranostic nanoregulators executing laser-activatable water splitting for enhanced ultrasound/fluorescence imaging and cooperative phototherapy[J]. ACS Nano, 2020, 14(4): 4045-4060.
[30]LV Z Q, HE S J, WANG Y F, et al. Noble metal nanomaterials for NIR-triggered photothermal therapy in cancer[J]. Advanced Healthcare Materials, 2021, 10(6): 2001806.
[31]CHEN H J, SHAO L, MING T, et al. Understanding the photothermal conversion efficiency of gold nanocrystals[J]. Small, 2010, 6(20): 2272-2280.
[32]MACKEY M A, ALI M R K, AUSTIN L A, et al. The most effective gold nanorod size for plasmonic photothermal therapy: theory and in vitro experiments[J]. The Journal of Physical Chemistry B, 2014, 118: 131326.
[33]HE S Y, LI J Y, CHEN M J, et al. Graphene oxide-template gold nanosheets as highly efficient near-infrared hyperthermia agents for cancer therapy[J]. International Journal of Nanomedicine, 2020, 15: 8451.
[34]LIU B, SUN J, ZHU J J, et al. Injectable and NIR-responsive DNA-inorganic hybrid hydrogels with outstanding photothermal therapy[J]. Advanced Materials, 2020, 32(39): 2004460.
[35]ALONSO M I, WAKITA K, PASCUAL J, et al. Optical functions and electronic structure of CuInSe2, CuGaSe2, CuInS2, and CuGaS2[J]. Physical Review B, 2001, 63(7): 075203.
[36]LI Q, HONG L, LI H G, et al. Graphene oxide-fullerene C60(GO-C60) hybrid for photodynamic and photothermal therapy triggered by near-infrared light[J]. Biosensors & Bioelectronics, 2017, 89: 477-482.
[37]CHEN S H, HUANG W W, DEHVARI K, et al. Photosensitizer-conjugated Cu-In-S heterostructured nanorods for cancer targeted photothermal/photodynamic synergistic therapy[J]. Materials Science & Engineering C-Materials for Biological Applications, 2019, 97: 793-802.
[38]YANG L, HU B, LIU A H, et al. A hollow-structured nanohybrid: intelligent and visible drug delivery and photothermal therapy for cancer[J]. Talanta, 2020, 215: 120893.
[39]LIU Y J, BHATTARAI P, DAI Z F, et al. Photothermal therapy and photoacoustic imaging via nanotheranostics in fighting cancer[J]. Chemical Society Reviews, 2019, 48(7): 2053-2108.
[40]LIN H, GAO S S, DAI C, et al. A two-dimensional biodegradable niobium carbide (MXene) for photothermal tumor eradication in NIR-I and NIR-II biowindows[J]. Journal of the American Chemical Society, 2017, 139(45): 16235-16247.
[41]JI M W, XU M, ZHANG W, et al. Structurally well-defined Au@Cu2-xS core-shell nanocrystals for improved cancer treatment based on enhanced photothermal efficiency[J]. Advanced Materials, 2016,28(16), 3094-3101.
[42]LI H, LI Y, FANG Z, et al. Efficient catalytic transfer hydrogenation of biomass-based furfural to furfuryl alcohol with recycable Hf-phenylphosphonate nanohybrids[J]. Catalysis Today, 2019, 319: 84-92.
[43]HUANG J S, JIAN Y M, ZHU P, et al. Research progress on the photo-driven catalytic production of biodiesel[J]. Frontiers in Chemistry, 2022, 10: 904251.
[44]ZHOU Z, LI B, SHEN C, et al. Metallic 1T phase enabling MoS2nanodots as an efficient agent for photoacoustic imaging guided photothermal therapy in the near-infrared-ii window[J]. Small, 2020, 16(43): 2004173.
[45]LI H, ZHAO W F, RIISAGER A, et al. A Pd-catalyzed in situ domino process for mild and quantitative production of 2, 5-dimethylfuran directly from carbohydrates[J]. Green Chemistry, 2017,19(9): 2101-2106.
[46]JIA H L, DU A X, ZHANG H, et al. Site-selective growth of crystalline ceria with oxygen vacancies on gold nanocrystals for near-infrared nitrogen photofixation[J]. Journal of the American Chemical Society, 2019, 141: 5083-5086.
[47]LIU Y J, BHATTARAI P, DAI Z F, et al. Photothermal therapy and photoacoustic imaging via nanotheranostics in fighting cancer[J]. Chemical Society Reviews, 2019, 48: 2053-2108.
[48]JIA J, LIU G Y, XU W J, et al. Fine-tuning the homometallic interface of au-on-au nanorods and their photothermal therapy in the NIR-II window[J]. Angewandte Chemie, 2020, 132: 14551-14556.
[49]LI K L, MA X T, HE S, et al. Ultrathin nanosheet-supported Ag@Ag2O core-shell nanoparticles with vastly enhanced photothermal conversion efficiency for NIR-II-triggered photothermal therapy[J]. ACS Biomaterials Science & Engineering, 2022, 8(2): 540-550.
[50]FORGACS E, CSERHTI T, OROS G. Removal of synthetic dyes from wastewaters: a review[J]. Environment International, 2004, 30(7): 953-971.
[51]LIU Z, FAN A C, RAKHRA K, et al. Supramolecular stacking of doxorubicin on carbon nanotubes for in vivo cancer therapy[J]. Angewandte Chemie-International Edition, 2009, 48(41): 7668-7672.
[52]ZHAO N N, YAN L M, ZHAO X Y, et al. Versatile types of organic/inorganic nanohybrids: from strategic design to biomedical applications[J]. Chemical Reviews, 2018, 119(3): 1666-1762.
[53]LI H, ZHAO W F, FANG Z. Hydrophobic Pd nanocatalysts for one-pot and high-yield production of liquid furanic biofuels at low temperatures[J]. Applied Catalysis B: Environmental, 2017, 215: 18-27.
[54]GUAN S Y, WENG Y Z, LI M N, et al. An NIR-sensitive layered supramolecular nanovehicle for combined dual-modal imaging and synergistic therapy[J]. Nanoscale, 2017, 9(29): 10367-10374.
[55]ZHANG G J, LI K, HE S, et al. Electron donor-acceptor effect-induced organic/inorganic nanohybrids with low energy gap for highly efficient photothermal therapy[J]. ACS Applied Materials & Interfaces, 2021, 13(15): 17920-17930.
[56]SUN X H, WANG J, WANG Z Y, et al. Gold nanorod@void@ polypyrrole yolk@shell nanostructures: synchronous regulation of photothermal and drug delivery performance for synergistic cancer therapy[J]. Journal of Colloid and Interface Science, 2022, 610: 89-97.
[57]ZHENG Z L, CHEN Q, DAI R, et al. A continuous stimuli-responsive system for NIR-II fluorescence/photoacoustic imaging guided photothermal/gas synergistic therapy[J]. Nanoscale, 2020, 12(21): 11562-11572.
[58]CHENG Y R, YANG F, XIANG G L, et al. Ultrathin tellurium oxide/ammonium tungsten bronze nanoribbon for multimodality imaging and second near-infrared region photothermal therapy[J]. Nano Letters, 2019, 19(2): 1179-1189.
[59]YIN C, LI X Z, WANG Y, et al. Organic semiconducting macromolecular dyes for NIR-II photoacoustic imaging and photothermal therapy[J]. Advanced Functional Materials, 2021, 31(37): 2104650.
[60]LI J, JIANG R C, WANG Q, et al. Semiconducting polymer nanotheranostics for NIR-II/photoacoustic imaging-guided photothermal initiated nitric oxide/photothermal therapy[J]. Biomaterials, 2019, 217: 119304.
[61]WANG X W, ZHONG X Y, LEI H L, et al. xHollow Cu2Se nanozymes for tumor photothermal-catalytic therapy[J]. Chemistry of Materials, 2019, 31(16): 6174-6186.
[62]HU W X, ZHEN W Y, ZHANG M C, et al. Development of nickel selenide@polydopamine nanocomposites for magnetic resonance imaging guided NIR-II photothermal therapy[J]. Advanced Healthcare Materials, 2021, 10(23): 2101542.
[63]YIN W Y, YAN L, YU J, et al. High-throughput synthesis of single-layer MoS2nanosheets as a near-infrared photothermal-triggered drug delivery for effective cancer therapy[J]. ACS Nano, 2014, 8: 6922-6933.
[64]WANG J P, TAN X X, PANG X J, et al. MoS2quantum dot@polyaniline inorganic-organic nanohybrids for in vivo dual-modal imaging guided synergistic photothermal/radiation therapy[J]. ACS Applied Materials & Interfaces, 2016, 8: 24331-24338.
[65]YONG Y, CHENG X J, BAO T, et al. Tungsten sulfide quantum dots as multifunctional nanotheranostics for in vivo dual-modal image-guided photothermal/radiotherapy synergistic therapy[J]. ACS Nano, 2015, 9: 12451-12463.
[66]LI H, GUO H X, SU Y Q, et al. N-formyl-stabilizing quasi-catalytic species afford rapid and selective solvent-free amination of biomass-derived feedstocks[J]. Nature Communications, 2019,10(1): 699.
[67]YU C C, XU L J, ZHANG Y Y, et al. Polymer-based nanomaterials for noninvasive cancer photothermal therapy[J]. ACS Applied Polymer Materials, 2020, 2: 4289-4305.
[68]LI H, ZHANG Q S, BHADURY P S, et al. Furan-type compounds from carbohydrates via heterogeneous catalysis[J]. Current Organic Chemistry, 2014 18(5): 547-597.
[69]YANG S S, YANG P F, XIE Y L, et al. Organic-inorganic hybrid photothermal nanomaterials for combined photothermal and chemotherapy therapy of tumors under the dual biological window[J]. Journal of Materials Science, 2021, 56: 18219-18232.
(責任編輯:曾 晶)
Advances in Photothermal Therapy of Tumors
Using Hybrid Nanomaterials
HUANG Xiaoxiu1,2, LI Hu*2, YANG Song2
(1.Panzhou Peoples Hospital, Liupanshui 553500, China; 2.Center for Research & Development of Fine Chemicals, Guizhou University, Guiyang 550025, China)
Abstract: Photothermal therapy (PTT) is an efficient, rapid, less invasive or even non-invasive technique. A single nanomaterial is usually used as a photothermal agent in the photothermal therapy, which, however, is affected by problems such as poor biocompatibility, poor stability, high toxicity, poor targeting performance, and lack of imaging. Therefore, the author mainly reviews the hybrid nanomaterials developed in recent years. Through a variety of photothermal materials doping, coating, surface modification and other methods, carbon-based hybrid, inorganic hybrid, organic-inorganic hybrid and other photothermal materials with excellent photothermal properties have been developed to solve the problems faced by using single photothermal materials.In addition, the fusion of photothermal materials, targeting materials, imaging materials, chemotherapy materials and radioactive materials are used to achieve the effect of joint synergistic therapy. Hybrid materials promote the development of efficient cancer treatment technology and supply material support for photothermal synergistic therapy. These methods provide ideas for the further development of new hybrid photothermal materials. It is expected to develop hybrid photothermal materials with high photothermal efficiency and high safety based on the currently reported materials with photothermal potential, which makes photothermal hybrid nanomaterials have broad prospects in the clinical photothermal therapy of tumors.
Key words: photothermal therapy; photothermal materials; targeting specificity; biocompatibility; cancer cell

