不同溫型巨大側耳菌株的生物學特性及液體發酵條件研究
李婧怡 駢永茹 嚴廷良 楊陽 李勤奮 李玉
關鍵詞:巨大側耳;不同溫型;營養需求;生長條件;生物量
巨大側耳[Pleurotusgiganteus(Berk.)Karun.&K.D.Hyde],又名大杯蕈、巨大香菇、豬肚菇,是國內新開發的一種珍稀食藥用菌[1-2]。其營養豐富、口味獨特,具有抗腫瘤、抗氧化、降低肝損傷等多種藥用功能,備受消費者青睞,具有較高的潛在市場價值[3]。巨大側耳的纖維素降解能力強、環境適應性高、栽培技術相對簡單,逐步引起食用菌生產者的重視,其栽培規模不斷擴大,目前已涵蓋浙江、山東、北京、上海、云南、廣東、福建、海南等多個省(市)[4]。熱帶地區年平均氣溫較高,對食用菌出菇溫度要求嚴格,但多數食藥用菌屬于中低溫型,如雙孢菇(16~18℃)[5]、金針菇(10~15℃)[6]、黑木耳(20~25℃)[7]等,適合熱區規模化栽培的食用菌種類相對較少。研究發現,野生巨大側耳多于夏末秋初的炎熱季節出現,主要分布于我國華中、華南地區,以及東南亞和大洋洲等熱帶及亞熱帶地區,人工栽培時也適宜在氣溫較高的夏季出菇,對于解決食用菌生產淡季和調節市場供應具有一定意義,特別是為熱區食用菌產業發展提供新機遇[8]。
種質資源是食用菌研究的基礎,高質量的菌種在食用菌產業中至關重要[9]。近年來,隨著溫室效應的不斷加劇,高溫已成為限制食用菌在熱區栽培的主要因素,耐高溫菌株的選育十分迫切。課題組通過前期在熱區進行巨大側耳的規模化栽培,篩選到2株具有不同出菇溫型的巨大側耳菌株,中溫型菌株PG79的適宜出菇溫度為22~24℃,適合熱區的涼季(干季)栽培;高溫型菌株PG46可耐受25℃以上高溫,適宜出菇溫度為26~30℃,適合熱區的熱季(濕季)栽培。不同溫型巨大側耳菌株的獲得,為我國熱區全年栽培巨大側耳提供了寶貴材料。
菌絲階段是食用菌生長發育的重要階段,菌絲體培養質量的優劣直接影響食用菌出菇產量的高低[10]。因此,探究2株不同溫型巨大側耳菌絲體生長的營養需求和環境條件,對巨大側耳的擴大化培養和穩定栽培至關重要。本研究采用單因素和正交試驗的方法,對不同溫型巨大側耳菌株進行生物學特性分析和液體發酵條件優化,并對液體發酵中菌絲體生長的動態變化規律進行研究,旨在獲得巨大側耳菌絲體生長的最佳培養基配方和培養條件,以及不同溫型菌株間的營養需求和生長條件差異。研究結果可為巨大側耳的規模化栽培奠定基礎,進而推動熱區食用菌產業的快速發展。
1材料與方法
1.1材料
1.1.1供試菌株實驗室通過前期在熱區進行規模化栽培,篩選到2株不同溫型的巨大側耳菌株,分別為高溫型菌株PG46,中溫型菌株PG79,菌種現保存于中國熱帶農業科學院環境與植物保護研究所菌種保藏中心。
1.1.2供試培養基使用的基礎培養基配方為:葡萄糖20g,蛋白胨3g,磷酸二氫鉀0.5g,硫酸鎂0.5g,瓊脂20g,加水混勻后定容至1L。
1.2方法
1.2.1生物學特性分析取4℃試管斜面保存的菌種,接種于基礎培養基平板上進行活化,28℃恒溫暗培養至菌絲長至平板直徑的3/4,用于后續試驗。
(1)碳源對菌絲體生長的影響。分別以可溶性淀粉、蔗糖、果糖、麥芽糖、葡萄糖為碳源,以不加碳源為對照。用直徑8mm的無菌藍槍頭在已活化菌落邊緣打孔取菌塊,將菌塊接種至碳源培養基正中央,28℃恒溫暗培養至菌絲長滿平板,每個處理設3次重復。采用“十”字交叉法,每隔24h測量記錄菌落直徑,并拍照觀察。
(2)氮源對菌絲體生長的影響。分別以酵母浸粉、蛋白胨、尿素、硫酸銨和氯化銨為氮源,以不加氮源為對照。方法同1.2.1-(1)。
(3)溫度對菌絲體生長的影響。以基礎培養基為供試培養基,按照1.2.1-(1)接種后,分別置于15、20、25、30、35、40℃培養箱恒溫暗培養,分析適宜菌絲體生長的溫度范圍。然后,在適宜溫度范圍內劃分為20、23、25、28、30℃,明確菌絲體最適生長溫度。測量方法同1.2.1-(1)。
(4)pH對菌絲體生長的影響。以基礎培養基為供試培養基,用1mol/LHCL和1mol/LNaOH調節培養基pH為5、6、7、8、9,自然pH為對照。方法同1.2.1-(1)。
(5)正交試驗。基于單因素試驗結果,分別從各因素中選取3個長勢最好的培養條件,組成4因素3水平的正交試驗,對培養條件進行驗證和優化。方法同1.2.1-(1)。
1.2.2液體發酵條件優化基于生物學特性試驗,在PG46和PG79的最適培養條件下,開展巨大側耳液體發酵的最適裝液量、轉速和接種量探究試驗,并探究菌絲動態生長規律[11-12]。
(1)裝液量試驗。配制液體培養基時,在250mL三角瓶中,分別加入80、100、120、150、180、200mL培養基。高溫滅菌后,調節pH為7,每瓶接入10片直徑5mm的菌塊,置于搖床中恒溫暗培養,設置轉速150r/min,溫度28℃。培養10d后,烘干稱菌絲體干重。
(2)轉速試驗。在250mL三角瓶中加入120mL培養基,接種后分別置于轉速為100、120、150、180、200r/min的搖床中培養10d。方法同1.2.2-(1)。
(3)接種量試驗。在250mL三角瓶中加入120mL的培養基,分別設置6%、8%、10%、12%、15%的接種量,置于150r/min搖床振蕩培養10d。方法同1.2.2-(1)。
(4)生物量動態檢測。以干重法測生物量。在液體發酵條件優化的基礎上,分別以120mL裝液量(250mL三角瓶)、150r/min轉速和12%接種量為最適條件,進行液體發酵。從發酵第3天開始,每隔2d取樣進行烘干稱重,直至菌絲體的干重趨于平穩為止,菌絲干重即為菌絲生物量。方法同1.2.2-(1)。
1.3數據處理
利用SPSS26軟件對試驗數據進行統計分析[13-15]。
2結果與分析
2.1生物學特性分析
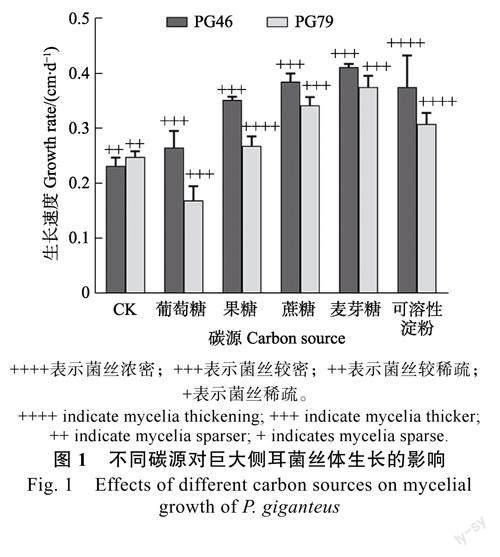
2.1.1碳源對菌絲體生長的影響由圖1可知,PG46和PG79在5種供試碳源上均可生長。以麥芽糖為碳源時,2株菌的菌落形態規則,菌絲較濃密且生長速度最大,分別為0.41、0.38cm/d;以可溶性淀粉為碳源時,2株菌的菌絲生長速度較快,但菌落形態不規則;以果糖和葡萄糖為碳源時,PG46菌絲生長速度較快且菌落規則,但PG79菌絲的生長速度較慢且菌落不規則。綜上,2株巨大側耳的最適碳源均為麥芽糖,但以單糖為碳源時,2株菌的利用效果存在差異。
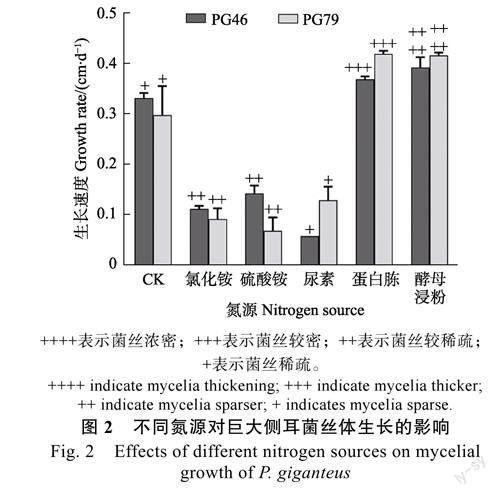
2.1.2氮源對菌絲體生長的影響由圖2可知,PG46和PG79在5種供試氮源上均可生長,但生長速度和長勢存在顯著差異。以酵母浸粉和蛋白胨為氮源時,菌落形態規則,菌絲濃密且生長速度最快,分別為0.39cm/d和0.37cm/d(PG46)、0.41cm/d和0.42cm/d(PG79);以硫酸銨、氯化銨和尿素為氮源時,菌落形態均不規則且長勢較差;不添加氮源時,菌絲生長速度雖較快,但均為氣生菌絲且接近透明,不適宜菌絲生長。綜上,2株巨大側耳的最適氮源相同,均為酵母浸粉和蛋白胨。
2.1.3溫度對菌絲體生長的影響前期研究結果顯示,PG46和PG79菌絲生長的適宜溫度范圍均為20~30℃,在該范圍內進一步篩選各菌株的最適生長溫度。結果顯示(圖3),隨著溫度的升高,2株菌的生長速度均呈先上升后下降的趨勢。其中,PG46在25℃和28℃時,菌絲生長速度快且濃密,分別為0.50cm/d和0.53cm/d;PG79在28℃時,菌絲生長速度最快且濃密,為0.56cm/d;當溫度高于28℃時,菌絲生長速度均開始下降,并且中溫菌株PG79的生長速度下降較明顯且菌絲形態發生改變,菌落形態變得不規則(圖4)。綜上,2株巨大側耳菌株的菌絲最適生長溫度大致相同,均為25~28℃,但菌絲體耐受溫度范圍不同,30℃時中溫菌株PG79開始遭受高溫脅迫。
2.1.4pH對菌絲體生長的影響由圖5可知,PG46和PG79在pH為5~9范圍內均可生長,且生長速度變化不大。當培養基偏酸性時,菌絲潔白濃密且形態規則,但生長速度較慢。隨著pH升高,菌絲生長速度加快,在pH為7時生長速度最快,分別為0.55cm/d和0.54cm/d。當培養基偏堿性時,隨著pH的升高,菌絲變稀疏且呈明顯放射狀,但整體生長速度較快。綜上,2株巨大側耳的菌絲均適宜偏中性(pH7)環境生長,但適應的酸堿度范圍較廣。
2.1.5正交試驗由于單因素試驗不能檢測各因素的交互影響,因此,基于單因素試驗結果,開展正交試驗(表1),以進一步探究2株菌的最適生長條件。由表2和表3可知,PG46和PG79在9種組合下均可生長,且與單因素試驗結果大致相同,即以麥芽糖為碳源、酵母浸粉為氮源、培養溫度為28℃、培養基pH為7(組合1)時,為最適生長條件。但也存在一定差異,除組合1外,PG46在組合7(可溶性淀粉為碳源、酵母浸粉為氮源、培養溫度為25℃、培養基pH為8)中,菌絲生長也可達到最佳狀態;PG79在組合4(蔗糖為碳源、酵母浸粉為氮源、培養溫度為30℃、培養基pH為6)和組合7中,均可達到最佳生長狀態。以上結果說明,各因素間的交互作用對菌絲生長影響較大,在統計分析中不可忽略。另外,方差分析結果(表4,表5)還顯示,4個因素對菌絲生長的影響程度依次為:氮源>pH>溫度>碳源。
2.2液體發酵條件優化
2.2.1裝液量對液體發酵的影響在液體發酵過程中,250mL三角瓶中裝液量直接影響菌絲體的供氧情況。由圖6可知,在一定范圍內,隨著裝液量的增加,PG46和PG79的菌絲體生物量均呈先上升后下降的趨勢。在裝液量為120mL時,菌絲生物量均達到最大,分別為5.58g/L和6.83g/L,且與100mL裝液量無顯著性差異,但菌絲球大小更均勻。綜上,2株巨大側耳液體發酵的最適裝液量均為120mL。
2.2.2轉速對液體發酵的影響由圖7可知,隨著搖床轉速的增加,PG46和PG79的菌絲體生物量呈先增加后趨于平穩的趨勢。當轉速為150r/min時,PG46和PG79的菌絲生物量達最高,分別為0.62g和0.82g;轉速繼續增大,菌絲體生物量無顯著變化,但菌絲球大小均一度和生長點數量有所下降。因此,綜合菌絲生物量和菌絲球均一度指標,確定150r/min為2株巨大側耳液體發酵的最適搖床轉速。
2.2.3接種量對液體發酵的影響由圖8可知,PG46和PG79的菌絲體生物量隨著接種量的增加而增大。當接種量為12%時,菌絲生物量達到最大,分別為0.79g和0.93g;其中,PG79接種量為10%、12%、15%的菌絲體生物量無顯著差異,但接種量為12%的菌絲球大小更均勻;PG46接種量為12%、15%的菌絲體生物量無顯著差異。因此,最終確定2株巨大側耳菌株的最適接種量為12%。
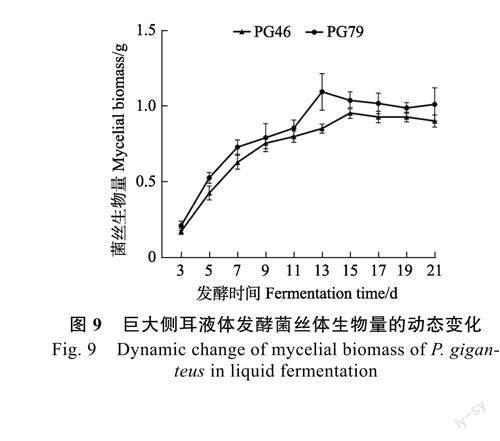
2.2.4菌絲生長動態變化由圖9可知,PG46和PG79的菌絲體生長均呈“對數增長”模式,且PG79的菌絲生物量始終高于PG46,與平板上的生長速度差異相符(PG79>PG46)。PG46在發酵3~9d時生長速度最快,第9天后生長變緩,第15天菌絲生物量最高(0.95g),之后趨于穩定;PG79在發酵3~7天時生長速度最快,第7天后生長變緩,第13天菌絲生物量最高(1.09g),之后趨于平穩。
3討論
由于巨大側耳的研究起步較晚,現有研究主要集中在分類地位、營養價值、活性成分、生物學特性、栽培技術等方面[3,8],但涉及的研究報道較少并且不夠深入。其中,生物學特性研究大多只針對1株菌株開展,由于菌株間的遺傳多樣性,導致試驗結果的通用性較差[16-17]。本研究以2株具有代表性的不同溫型巨大側耳菌株為材料,采用單因素和正交試驗相結合的方法,從碳源、氮源、溫度和pH4個方面開展生物學特性研究,并對液體發酵條件進行優化,分析菌絲生長的動態變化。
在生物學特性試驗中,PG46和PG79的最適碳源均為麥芽糖,麥芽糖為二糖,與多數食用菌優先利用單糖或雙糖的結果一致[18]。以酵母浸粉和蛋白胨為氮源時,2株菌株菌絲濃密且長速較快,但以硫酸銨和氯化銨為氮源時,菌絲長勢較差且菌落形態不規則,說明有機氮比無機氮更適宜巨大側耳菌絲生長,可能與有機氮中提供的維生素、微量元素等營養物質相關[13,19]。PG46和PG79菌絲的最適生長溫度均為25~28℃,但菌絲體耐受溫度范圍不同,30℃時PG46菌絲可正常生長,但PG79菌落形態變得不規則,這一現象與出菇溫型相符。2株菌株均適宜偏中性(pH7)環境生長,與孟靈思等[20]的研究結果一致。在試驗范圍內(pH為5~9),菌絲均長勢較好,說明巨大側耳適應的酸堿度范圍較廣,適合進行規模化推廣。正交試驗論證了單因素試驗結果,但也存在部分差異,進一步說明在多因素試驗中正交試驗的必要性[21]。
液體發酵具有周期短、成本低、產量高的特點,是目前食用菌進行規模化栽培的主要發酵方式,同時也是生理活性物質提取的重要工藝[22-23]。三角瓶中的裝液量直接影響菌絲體的供氧情況。隨著裝液量的增加,營養物質含量增加但氧氣含量不斷降低[24]。本研究中,當裝液量達到120mL時,菌絲生物量最大且菌絲球大小更均勻,說明此時營養物質含量和供氧水平達到平衡,過高或過低均不利于菌絲生長。同樣,搖床轉速也直接影響到發酵液中的溶氧水平[25]。搖床轉速過低時菌球過大,當轉速為150r/min時,菌絲生物量最高,且菌絲球大小均勻,但轉速過高形成的菌球過小甚至無法形成完整菌球,影響下一步研究。在工業化生產中,接種量高低直接影響生產成本。當接種量為12%時,菌絲生物量最高,但與15%接種量無顯著差異,考慮成本,最終確定12%為最適接種量。在液體發酵中,發酵終點也是必須考慮的重要環節。由于培養過程中,菌球處于封閉狀態,營養物質的消耗、氧氣的耗損、菌球生長過程中生存空間的縮小及其所產生的次級產物,均會影響菌球的生長[26]。本研究中,2株菌株的菌絲體生長呈“對數增長”模式。在發酵前7d(PG79)或前9d(PG46)時,菌絲處于對數生長期,菌絲活力旺盛,長速最快,可用于酶活性測定、原生質體制備等菌絲活力相關的研究[27-28];在發酵至15d或13d時,菌絲生物量最高,可用于生理活性成分提取和菌袋接種等菌絲生物量相關研究[22-23];繼續發酵,菌絲生物量降低,不利于巨大側耳的菌絲體生長。
綜上,PG46和PG79菌絲體的生物學特性基本一致,最適碳源為麥芽糖,最適氮源為酵母浸粉和蛋白胨,最適pH為7,最適溫度為25~28℃。在生物學特性研究的基礎上,當搖床轉速為150r/min,裝液量為120mL,接種量為12%時,更適宜巨大側耳菌絲體的液體發酵,且PG46和PG79的菌絲體生物量均呈“對數增長”的模式。研究結果可為不同溫型巨大側耳的規模化栽培奠定基礎,以進一步推動熱區食用菌產業的發展。

