LncRNA FoxP4-AS1靶向miR-136-5p影響人乳腺癌細胞株SKBR-3侵襲與遷移能力
孫傳偉 蔣曼妃 吳煌福 王璐瑤 譚光宏
(海南醫學院第二附屬醫院 1乳甲外科,海南 海口 570100;2全科醫學科)
乳腺癌是最致命和最普遍的癌癥之一,2020年全球新增226萬例乳腺癌患者,占所有女性癌癥新增病例的1/4,嚴重威脅著廣大女性健康,其中人表皮生長因子受體(HER)-2陽性乳腺癌占所有乳腺癌的20%~30%,惡性程度較其他分型乳腺癌高,預后較差〔1〕。目前臨床上多采用手術切除并輔以放化療的方式治療乳腺癌,但治療后腫瘤的復發轉移使得乳腺癌的遠期生存率仍然不容樂觀,因此探究乳腺癌侵襲轉移的機制并找到有效的治療靶點意義重大。近年來研究發現〔2〕,長鏈非編碼核糖核酸(LncRNA)和微小核糖核酸(miRNA)表達譜的異常與各種惡性腫瘤的發生發展有密切關系。LncRNA FoxP4-AS1已被證實在胰腺癌、食管鱗狀細胞癌和鼻咽癌等惡性腫瘤中異常表達且能夠影響腫瘤細胞的多種生物學功能〔3~5〕。有多個報道指出〔6,7〕,miR-136-5p在宮頸癌、甲狀腺癌等多種癌癥中發揮抗腫瘤功能。遷移侵襲增強因子(MIEN)1在包括乳腺癌在內的多種惡性腫瘤中大量表達,促進腫瘤細胞的侵襲和遷移,有文獻報道〔8〕,miR-136-5p與MIEN1存在著靶向作用關系。有研究顯示〔9〕FoxP4-AS1在宮頸癌細胞中呈高表達水平,且能夠通過靶向調控miR-136-5p表達,提高宮頸癌細胞的增殖和轉移能力,然而其對乳腺癌細胞遷移、侵襲的作用仍不清楚。本研究選取HER-2陽性乳腺癌細胞株SKBR-3進行體外細胞實驗,探究FoxP4-AS1靶向miR-136-5p對人乳腺癌細胞侵襲、遷移能力的影響及作用機制。
1 資料與方法
1.1細胞 人乳腺癌細胞株SKBR-3(生產批號BFN60700185,購自美國ATCC細胞庫)。
1.2藥物與試劑 脂質體轉染試劑盒(購自美國GENMED公司,生產批號GMS10026);si-FoxP4-AS1(正義5′-CCAUCGUAUGCAAUUGA-3′,反義5′-CGUUAACGUAUAGA-3′)、pcDNA-FoxP4-AS1(正義5′-CGUAAGAUGAUAGAUA-3′,反義5′-GUAAGUA-GCAGCUAACGU-3′)、FoxP4-AS1-NC(正義5′-CC-GAUAAUGUAGCUCU-3′,反義5′-AGUAGUAGAUGCAUAAU-3′)、miR-136-5p mimic(正義5′-AGUA-UAGUCCUACC-3′,反義5′-GUGUAAUGAUCCCUAA-3′)、miR-136-5p inhibitor(正義5′-GUGAAUCAUUC CUAC-3′,反義5′-CUAAAUUAGAUAUACGG-3′)、miR-NC(正義5′-UGAAUGCUAUCAUUG-3′,反義5′-AAUGCUAUAUCAAC-3′)、野生型和突變型熒光素酶報告載體(Luc-3′UTR-WT/MUT)及引物(由上海賽百盛公司合成);結晶紫染液(購自上海康朗生物科技有限公司,生產批號KL805211);;雙熒光素酶報告基因檢測試劑盒(生產批號D0010,購自北京索萊寶)兔抗人MIEN1、基質金屬蛋白酶(MMP)9、E-鈣黏蛋白(E-cadherin)、β肌動蛋白(β-actin)單克隆及羊抗兔多克隆抗體(生產批號PA1-1110、PA1-830、PA5-11393、PA3-031A、PA5-27188、PA5-27192、PA5-11722、PA5-20126,購自美國Invitrogen公司)。
1.3實驗器材 BC 190型CO2培養箱,瑞士SALVIS;alpha 300S型光學顯微鏡,自德國WITec;Revolve Generation 2型熒光顯微鏡(購自美國ECHO公司);3422型Transwell小室(購自美國Owens Corning公司);S1000TMDual 48 Well型聚合酶鏈反應(PCR)儀(購自美國BIO-RAD公司);Biosens 850型凝膠成像系統,上海山富科學儀器有限公司;EPS-300型電泳儀,韓國Lab Companion。
1.4細胞培養、轉染和分組 SKBR-3細胞在DMEM培養基中培養,添加100 U/ml青霉素、100 μg/ml鏈霉素和10%胎牛血清(FBS),培養箱條件37 ℃、5%CO2。取對數生長期的SKBR-3細胞,細胞懸液于96孔板(5.0×105個細胞/孔)中,37 ℃、5%CO2培養2 h。細胞分別轉染si-FoxP4-AS1(FoxP4-AS1下調組)、pcDNA-FoxP4-AS1(FoxP4-AS1上調組)、FoxP4-AS1-NC(FoxP4-AS1對照組)、miR-136-5p inhibitor(miR-136-5p下調組)、miR-136-5p mimic(miR-136-5p上調組)、miR-NC(miR對照組),根據制造商的說明采用脂質體轉染法轉染。另以未轉染的SKBR-3細胞為空白組,每組設置6個復孔。48 h后,在光學顯微鏡和熒光顯微鏡下拍照計數,測定轉染效率。
1.5Transwell測定侵襲、遷移能力 分別取各組人乳腺癌細胞株SKBR-3用胰蛋白酶消化,磷酸鹽緩沖液沖洗,使用無血清培養基重懸,調整密度為1×105個/ml。在Transwell小室上室(預先用基質膠覆蓋)中加入200 μl細胞懸液,下室加500 μl 10%血清培養基。常規培養24 h,用棉簽擦去基質膠和上室中未遷移細胞,磷酸鹽緩沖液(PBS)沖洗,用4%多聚甲醛固定30 min,棄固定液后加入結晶紫染液染色10 min,用自來水沖洗膜,干燥,然后在光學顯微鏡下觀察和計數細胞。對于遷移實驗,無需在Transwell上室膜孔用基質膠提前覆蓋,其余步驟同上。
1.6實時逆轉錄聚合酶鏈反應(RT-qPCR)測定FoxP4-AS1、miR-136-5p表達及MIEN1、E-Cadherin、MMP-9信使核糖核酸(mRNA)表達 分別取各組人乳腺癌細胞株SKBR-3,RT-qPCR檢測各目的基因mRNA的表達。FoxP4-AS1上游引物5′-CGTTAGACAGCAGCA-3′,下游5′-TGTAACGGATACGC-3′,產物長度136 bp;miR-136-5p上游引物5′-TGACGATGAGTAACG-3′,下游5′-GTCAATGTAGATGTAC-3′,產物長度184 bp;MIEN1上游引物5′-TTACGTAGTAGCCAC-3′,下游5′-GACCGTAGTACGTAAC-3′,產物長度155 bp;E-cadherin上游引物5′-TAAGTCGTAGTATCCAGTC-3′,下游5′-CTGAATGCCTGTAAG C-3′,產物長度214 bp;MMP-9上游引物5′-AGTGTAGTACGTACGTATG-3′,下游5′-AGTCCTAGTATGCCTAAC-3′,產物長度259 bp;U6上游引物5′-TTAACGTAGAGCTCTGACC-3′,下游5′-CGAGATGC TTAACCGT-3′,產物長度104 bp;β-actin上游引物5′-TGCCTAGTAGCTCGTAGA-3′,下游5′-CCGTAGTAGCTCGTAAG-3′,產物長度301 bp。除miR-136-5p(U6為內參)的其余基因以β-actin為內參,用2-ΔΔCt法計算各基因表達。
1.7Western印跡測定MIEN1、E-cadherin、MMP-9蛋白表達 分別取各組人乳腺癌細胞株SKBR-3,使用細胞裂解液從各組細胞提取總蛋白,Bradford法測定蛋白濃度。蛋白樣品經電泳分離,然后轉移到聚偏氟乙烯(PVDF)膜上,用5%脫脂牛奶阻斷膜1 h,與一抗(1∶2 000)抗體在4 ℃孵育過夜。次日,與辣根過氧化物酶(HRP)耦聯的二抗(1∶5 000)在室溫下孵育2 h,顯色反應,Biosens 850型凝膠成像系統分析處理。以β-actin為內參,通過ImageJ軟件分析蛋白條帶灰度值。
1.8雙熒光素酶報告基因實驗驗證FoxP4-AS1與miR-136-5p的靶向關系 TargetScan miRNA靶基因預測軟件(https://www.targetscan.org/vert_80/)用來預測FoxP4-AS1與miR-136-5p的結合位點。使用PCR擴增miR-136-5p與FoxP4-AS1的結合片段。隨后,將擴增產物插入Luc-3′UTR-WT載體,構建野生型報告基因(野生型FoxP4-AS1)。對結合片段進行定點誘變以構建一個FoxP4-AS1突變體報告基因(突變型FoxP4-AS1)。接下來,用重組報告質粒和miR-136-5p mimics或miR-NC共轉染SKBR-3細胞。轉染后48 h,收集細胞,使用雙熒光素酶報告試劑盒檢測熒光素酶活性。以螢火蟲熒光素酶與海腎熒光素酶活性的比值代表熒光素酶相對活性。
1.9統計學分析 采用SPSS25.0軟件進行方差分析和SNK-q檢驗。
2 結 果
2.1各組細胞轉染效率 FoxP4-AS1對照組、FoxP4-AS1下調和上調組、miR對照組、miR-136-5p下調和上調組轉染效率分別為(90.41±3.15)%、(85.92±1.83)%、(87.70±2.26)%、(85.44±1.61)%、(91.26±2.27)%、(88.52±1.42)%,見圖1。

圖1 各組細胞轉染效率(×100)
2.2各組細胞FoxP4-AS1、miR-136-5p表達、MIEN1、E-cadherin、MMP-9 mRNA及蛋白表達 與空白組和FoxP4-AS1對照組比較,FoxP4-AS1下調組miR-136-5p表達、E-cadherin mRNA及蛋白表達明顯升高,FoxP4-AS1表達、MIEN1、MMP-9 mRNA及蛋白表達明顯降低(P<0.05);FoxP4-AS1上調組miR-136-5p表達、E-cadherin mRNA及蛋白表達明顯降低,FoxP4-AS1表達、MIEN1、MMP-9 mRNA及蛋白表達明顯升高(P<0.05),與空白組和miR對照組比,miR-136-5p下調組miR-136-5p表達、E-cadherin mRNA及蛋白表達降低,FoxP4-AS1表達、MIEN1、MMP-9 mRNA及蛋白表達升高;miR-136-5p上調組miR-136-5p、E-cadherin mRNA及蛋白表達明顯增加,FoxP4-AS1表達、MIEN1、MMP-9 mRNA及蛋白表達下降(P<0.05),見圖2、表1。
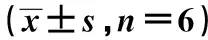
表1 各組細胞FoxP4-AS1、miR-136-5p表達及MIEN1、E-cadherin、MMP-9 mRNA及蛋白表達

1~7:空白組、FoxP4-AS1對照組、FoxP4-AS1下調組、FoxP4-AS1上調組、miR對照組、miR-136-5p下調組、miR-136-5p上調組圖2 各組細胞MIEN1、E-cadherin、MMP-9蛋白表達
2.3各組細胞侵襲、遷移能力 與空白組和FoxP4-AS1對照組比較,FoxP4-AS1下調組的侵襲、遷移細胞數目明顯下降,FoxP4-AS1上調組侵襲、遷移細胞數目明顯升高(P<0.05)。與空白組和miR對照組比較,miR-136-5p下調組侵襲和遷移細胞數目明顯升高,miR-136-5p上調組侵襲和遷移細胞數目明顯降低(P<0.05),見圖3、表2。

表2 FoxP4-AS1及miR-136-5p表達對各組細胞侵襲和遷移細胞數的影響個,n=6)

圖3 各組侵襲和遷移細胞數(結晶紫染色,×200)
2.4FoxP4-AS1靶向調控miR-136-5p驗證 TargetScan數據庫提示miR-136-5p和FoxP4-AS1之間存在潛在的結合位點因,見圖4。miR-136-5p mimic組轉染野生型FoxP4-AS1細胞的熒光素酶相對活性明顯低于miR-NC組(P<0.05);miR-136-5p mimic組轉染突變型FoxP4-AS1細胞的熒光素酶相對活性與miR-NC組相比差異無統計學意義(P>0.05),見表3。
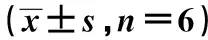
表3 熒光素酶相對活性比較
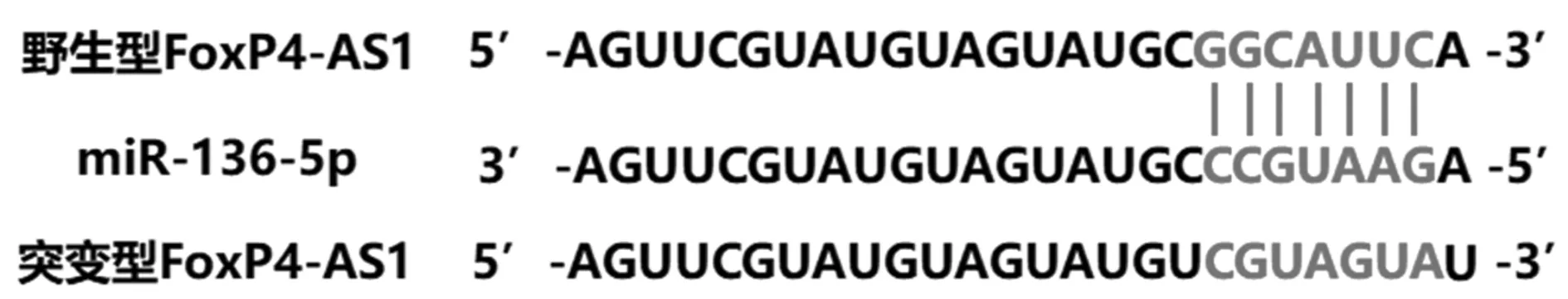
圖4 FoxP4-AS1與miR-136-5p之間的結合位點
3 討 論
乳腺癌的發病是遺傳和環境共同作用的結果,其中包括年齡、月經及生育情況、性激素水平、壓力、肥胖、抽煙酗酒等多種因素〔10〕。目前臨床上多采用手術、放療、化療及內分泌治療等方法治療乳腺癌,但存在不良反應較大、易復發轉移等問題〔11〕。近年來,分子靶向藥物的出現為治療HER-2陽性乳腺癌提供了新的方向,因此有關乳腺癌的發病機制和治療靶點的研究亦成為近幾年的研究熱點。
本研究結果提示,FoxP4-AS1在乳腺癌細胞的侵襲遷移中起促進作用,miR-136-5p在乳腺癌細胞的侵襲遷移中起抑制作用。有研究顯示〔12〕,FoxP4-AS1在胃癌中高表達,敲低FoxP4-AS1表達可阻礙胃癌細胞增殖,抑制其侵襲、遷移和血管生成。另有報道指出〔13〕,LncRNA FAM83H-AS1通過抑制miR-136-5p的表達促進三陰乳腺癌細胞的侵襲、遷移和增殖,與上述研究相一致。
本研究提示,FoxP4-AS1可提高MIEN1、MMP-9的表達,降低miR-136-5p、E-cadherin表達,而miR-136-5p可下調MIEN1、MMP-9表達,上調E-cadherin表達。雙熒光素酶實驗結果證實了FoxP4-AS1可直接靶向調控miR-136-5p,因此合理推測FoxP4-AS1可能是通過靶向抑制miR-136-5p來促進MIEN1、MMP-9的表達,抑制E-cadherin的表達進而實現增加乳腺癌細胞侵襲遷移能力的作用的。FOXP4-AS1可通過推進腫瘤細胞周期轉變,促進細胞增殖〔14〕。Li等〔15〕發現,FOXP4-AS1在結直腸癌患者腫瘤組織中呈顯著高表達,且表達量與患者預后較差有密切關系。MIEN1是近幾年新發現的一種促癌基因,在多種惡性腫瘤中通過增強腫瘤細胞的上皮間充質轉化(EMT)促進細胞的侵襲和遷移〔16〕。E-cadherin是EMT的重要標志之一,E-cadherin下調可導致細胞間黏附性降低,細胞由上皮樣轉化為間質樣〔17〕。MMP-9主要通過降解細胞外基質抑制腫瘤細胞間的黏附性,誘導腫瘤細胞浸潤、轉移〔18〕。有研究發現〔19〕,FoxP4-AS1能夠通過靶向調控miR-136-5p的表達,促進結直腸癌細胞的增殖、侵襲和遷移,加快癌癥進展,本研究結果與該研究相一致。

