不同微生物菌處理對番茄土壤微生物多樣性的影響
王丹丹,李 燕,張慶銀,李世東,龐永超,馬琨芝,馬 龍,牛瑞生,鐘增明,齊連芬,師建華
(1.石家莊市農林科學研究院,石家莊 050041;2.中國農業科學院植物保護研究所,北京 100091;3.高邑縣農業執法大隊,河北高邑 051330;4.高邑縣農業技術推廣中心,河北高邑 051330,5.北京啟高生物科技有限公司,北京 100000)
0 引 言
【研究意義】番茄是世界范圍內栽培面積最廣的蔬菜作物之一[1-4]。連作種植,土壤連作會造成番茄產量下降、品質不佳、生長狀況變差、土傳病害嚴重等。研究不同微生物菌處理對番茄土壤微生物的影響,對改善土壤微生物多樣性、提高產量有實際意義。【前人研究進展】馬云華等[5]、孫艷艷等[6]研究表明隨著黃瓜、番茄連作茬次的增加,根際土壤微生物由細菌型向真菌型過渡;而與細菌相比,真菌的繁殖不需要活體細胞提供營養,因此,其傳播途徑更廣、速度更快,對植株產生的危害也就更嚴重[7]。通過改良土壤、調整土壤微生態環境,可以明顯改善土壤連作障礙造成的一系列問題[8]。土壤微生物是土壤中肉眼看不到的細小生物的總稱,是土壤不可或缺的重要組成部分,土壤微生物群落的組成和多樣性會影響番茄的生長、產量、土傳病害發生的程度等[9-12]。微生物可提高土壤酶的活性、增加土壤微生物的復雜性、改善土壤的抗逆能力[13],近年來常被用于改良土壤微生態環境及防治土傳病害問題[14,15]。目前,放線菌已在番茄[16]、甜瓜[17]、辣椒、茄子[18]得到應用,枯草芽孢桿菌已在番茄[19]、黃瓜[20]、枸杞[21]等上應用,哈茨木霉菌已在茄子[22]、馬鈴薯[23]、蘋果[24]上應用。【本研究切入點】微生物菌處理對番茄土壤微生物群落影響的研究已有較多報道,但多種微生物菌處理連作番茄土壤對土壤微生物群落多樣性及與番茄生長相關性的分析較少。需評估不同微生物菌處理對番茄土壤微生物多樣性的影響。【擬解決的關鍵問題】研究放線菌、枯草芽孢桿菌、哈茨木霉菌3種微生物菌劑處理連作栽培番茄土壤微生物多樣性、與番茄生長相關性,篩選適宜的微生物菌劑,為促進土壤生態修復、改善番茄根系環境提供理論依據。
1 材料與方法
1.1 材 料
試驗在石家莊市農林科學研究院趙縣3號溫室進行。試驗溫室肥力中等,地力均勻,水利條件良好。
供試番茄品種為農博粉18109,由石家莊市農林科學研究院提供,穴盤苗由河北省石家莊市高邑鄗豐種苗公司代育。
放線菌(密旋鏈霉菌及婁徹氏鏈霉菌活性孢子)購自陜西博秦生物工程有限公司,有效活菌數≥20×108/g;枯草芽孢桿菌由中國農業科學院,北京啟高生物科技有限公司聯合研發,有效活菌數≥2.0×108/g;哈茨木霉由中國農業科學院植物保護研究所研制、海南金雨豐生物工程有限公司出品,有效活菌數≥2.0×108/g;大量元素水溶肥(N-P2O5-K2O為12-6-40)由四川農業大學研制、四川愛隆植物營養科技有限公司生產。
1.2 方 法
1.2.1 試驗設計
設置4個處理,CK對照為常規施肥(沖施大量元素水溶肥),T1為常規施肥+放線菌、T2為常規施肥+枯草芽孢桿菌、T3為常規施肥+哈茨木霉,3種菌劑施用量依菌劑活性而定,均于定植前撒施于栽培壟內。每個處理3次重復,隨機區組排列,共12個小區,小區面積16 m2。行距為大小行90 cm×70 cm,株距40 cm,2021年3月18日定植,單稈整枝,每株留5穗果,2021年7月10日拉秧。
1.2.2 土壤樣品采集
于番茄的拉秧期采集根圍土壤樣品 (根圍2 cm),采用五點取樣法進行采樣。將采集的土壤樣品置于無菌自封袋低溫(干冰)保存并運送至實驗室,然后存儲于-80℃超低溫冰箱保存用于微生物多樣性測定。
1.2.3 測定指標
土壤微生物多樣性:可以根據不同的相似度水平,對所有序列進行OTU劃分,每個OTU對應于一種代表序列。該方法能提高測序分析的準確性[25]。將采集的土壤樣品送至深圳微科盟科技集團有限公司,采用Illumina MiseqTM測序技術進行測定,對細菌的16S rRNA基因和真菌 ITS 基因擴增及測序,通過Reads拼接、過濾、去嵌合體等數據預處理,對有效數據進行操作分類單元(OTU)聚類,進行物種注釋及豐度分析,并進行Alpha多樣性分析、βeta多樣性分析和顯著物種差異分析等。
株高:用卷尺測量植株最下部到最上部的距離。莖粗:游標卡尺測量最上面一穗花的下部莖的粗度。葉長、葉寬:直尺測量成熟葉片的最大葉長和葉寬。產量:電子秤稱重測量。
1.3 數據處理
用Qiime軟件構建UPGMA樣本聚類樹。采用SPSS18.0進行統計分析和方差分析,用Microsoft Excel 2010進行繪圖,LEfSe軟件估算相對豐度差異。
2 結果與分析
2.1 土壤微生物數量
研究表明,T3處理的細菌含量最多,為109.8×107CFU/g,顯著高于對照和T2,T2的細菌含量最少。T1的真菌含量最高,為48.6×105CFU/g,與對照和T2間無顯著差異,但顯著高于T3。除T2處理外,其他處理的細菌和真菌比例均大于對照。表1

表1 土壤中的微生物數量
2.2 OTU聚類分析
研究表明,4個處理的細菌共有的OTUs為1 410個,CK、T1、T2、T3的OTU分別為2 344、2 430、1 845、2 513個,T1和T3的細菌種類多于CK,而T2的細菌種類少于CK,是由于T1和T3的微生物菌里含有糖類、蛋白質等易被細菌利用的物質利于細菌繁殖。真菌共有的OTUs為85個,CK、T1、T2、T3的OTU分別為157、139、98、133個,微生物菌處理的真菌種類均少于對照。圖1

圖1 土壤中細菌和真菌的OTU分布
2.3 不同微生物菌處理對番茄土壤微生物Alpha多樣性的影響
研究表明,T2處理的Shannon和Simpson指數均低于對照,T1和T3處理的Shannon和Simpson指數均高于對照,放線菌和哈茨木霉的施用可以增加土壤微生物的豐富度和均勻度,而枯草芽孢桿菌的施用未增加土壤微生物豐富度和均勻度。放線菌和哈茨木霉的施用均能提高土壤細菌群落的多樣性。圖2

圖2 細菌SHANNON (A)和SIMPSON (B)指數變化
放線菌、枯草芽孢桿菌和哈茨木霉處理后的Shannon和Simpson指數均高于對照,放線菌、枯草芽孢桿菌和哈茨木霉處理均提高土壤中真菌群落的多樣性。圖3
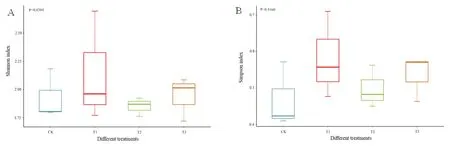
圖3 真菌Shannon (A)和Simpson (B)指數變化
2.4 不同微生物菌處理對番茄土壤微生物Beta多樣性的影響
研究表明,對照、放線菌、枯草芽孢桿菌、哈茨木霉4個處理中3個重復的微生物菌群均能聚于一個區域,各個處理明顯分開,不同處理細菌間存在差異,相同處理間存在較強的一致性。對每個處理3次重復取均值,T1和T3首先聚為一類,然后和CK聚為一類,最后和T2聚為一類,T1和T3微生物菌處理的細菌多樣性較為相似,T1、T3與T2微生物菌處理的細菌多樣性相似性較差。圖4,圖5

圖4 細菌NMDS分析
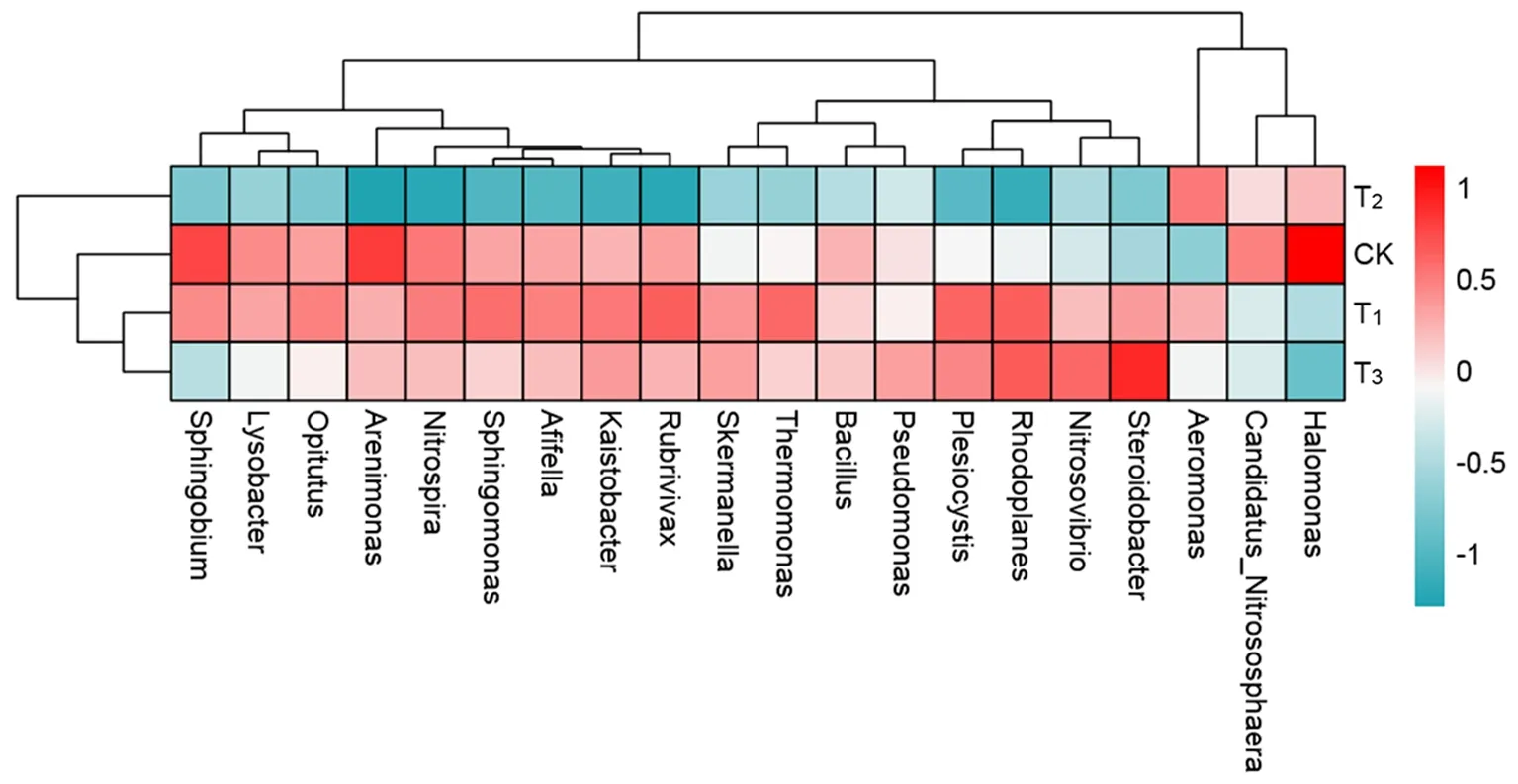
圖5 細菌屬水平聚類熱圖
各個樣本在圖中的分布較為分散,4個處理間的區分度較差,不同處理之間的真菌多樣性的差異較小。CK和T2首先聚為一類,T1和T3聚為一類,最后兩類聚為一類。T1和T3微生物菌處理的真菌多樣性較為相似。圖6,圖7
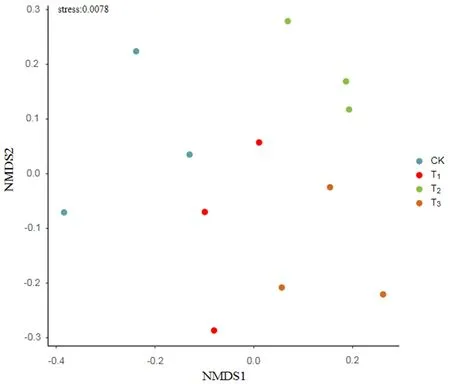
圖6 真菌NMDS分析

圖7 真菌屬水平聚類熱圖
2.5 不同微生物菌處理后番茄土壤微生物群落組成
研究表明,細菌中Unspecified_iii1_15、Unspecified_RB41、Unspecified_Gemm_5、Unspecified_Syntrophobacteraceae、Kaistobacter為優勢細菌屬。圖8B真菌中Fusarium(鐮刀菌屬)、Unspecified_Chaetomiaceae(未分類毛殼菌科)、Unspecified_Pezizales、Unspecified_Hypocreales_fam_Incertae_sedis、Mortierella(被孢霉屬)為優勢真菌屬,4個不同處理均是鐮刀菌屬(Fusarium)的相對豐度最高,分別為73.63%、61.53%、69.67%、65.32%,其次均為未分類毛殼菌科,相對豐度分別為17.06%、24.59%、21.68%、25.03%。圖8
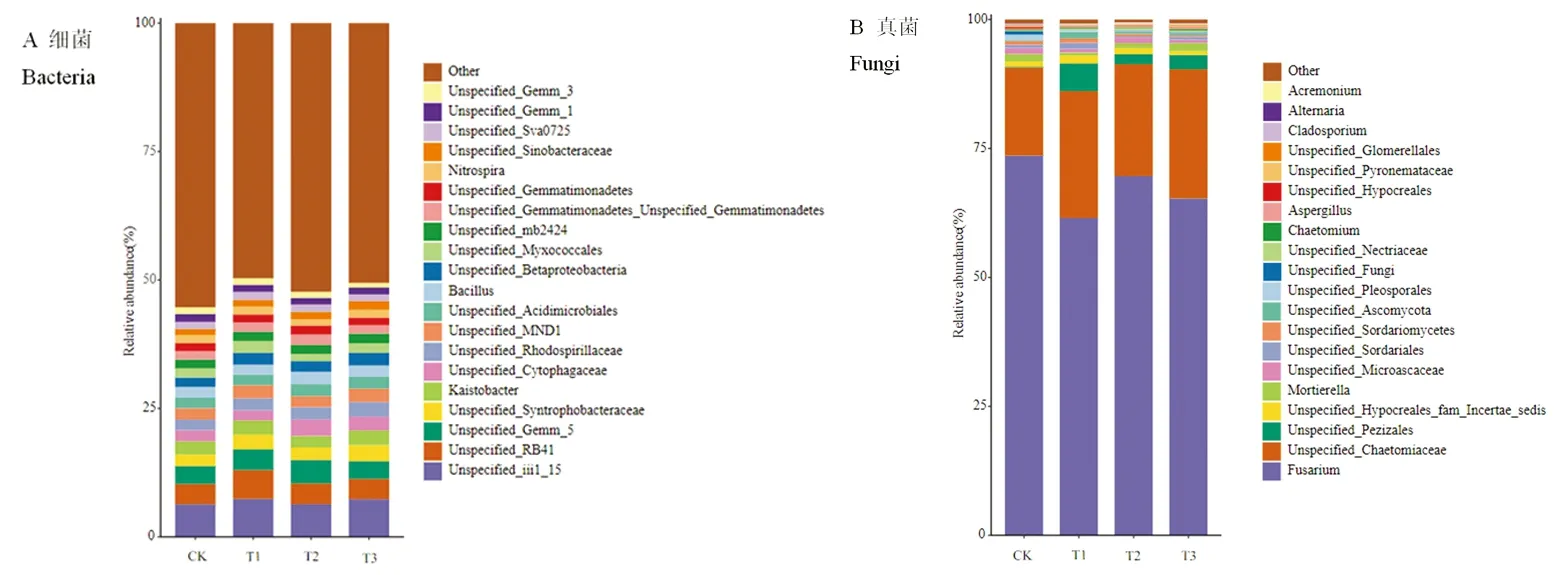
圖8 土壤微生物群落在屬水平上的相對豐度
2.6 與環境因子的RDA分析
研究表明,細菌和真菌的3個重復點距離較近,重復性好,類群組成相似,且P值均小于0.01,微生物群落變異的解釋方差極顯著。主成分1、2對細菌群落差異的解釋貢獻率值分別為25.95%和23.25%,對細菌群落差異的解釋貢獻率值分別為28.94%和25.00%。細菌和真菌的RDA分析中葉寬的箭頭均最短,葉寬與微生物群落分布間的相關性最小,葉長、株高、莖粗和產量與微生物群落分布間的相關性高;細菌分析中葉長和株高間夾角為銳角,葉長和株高間的相關性高,而兩者與產量間的相關性低;真菌分析中葉長與葉寬、株高、莖粗間的夾角都為銳角,葉長與這三者間的相關性高,與產量間的相關性低。葉長和株高處于CK象限內,這兩者與CK的相關性最高,莖粗與T1的相關性高,產量與T3的相關性高;真菌分析中,株高同樣與CK的相關性高,葉長、葉寬、莖粗與T1的相關性高,產量與T3的相關性高。圖9
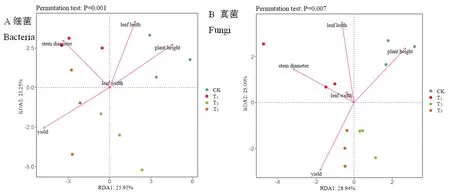
圖9 樣品與環境因子RDA
3 討 論
3.1微生物菌處理土壤是當前農業生產中常用的提高土壤有益微生物種群多樣性、復雜性,抑制病原菌繁殖很有效的一項農藝措施[14, 15]。目前,放線菌、枯草芽孢桿菌、哈茨木霉菌已在多種作物上得到很好的應用。放線菌是一類主要呈菌絲狀生長和以孢子繁殖的陸生性較強大的原核生物,放線菌中的鏈霉菌分泌的某些物質對叢枝菌根真菌的孢子萌發和菌絲生長有促進作用[26],而叢枝菌根真菌分泌的某些物質又能使有益微生物的活性提高,進而改善土壤微生物群落結構多樣性[27, 28]。枯草芽孢桿菌是土壤生態系統中較為常見的根際促生細菌,具有良好的促生、防病及改善土壤微生態群落的作用[29, 30]。鄧開英等[31]研究表明,木霉屬真菌可以在根區占領根部空間,改變土壤中微生物群落組成和功能多樣性,可以防治西瓜土傳病害、誘導產生系統抗性、促進生長等作用。研究比較了放線菌、枯草芽孢桿菌、哈茨木霉3種微生物菌處理對番茄栽培土壤中的微生物數量的影響,結果顯示哈茨木霉處理的土壤中細菌含量最高,放線菌處理的土壤中真菌含量最高,T1、T3的細菌和真菌的比例均大于對照,土壤微生物呈現“細菌化”。細菌和真菌是土壤微生物重要組成部分,能促進土壤有機質的分解和養分的轉化[4],其數量和比例變化能夠較為敏感地反映土壤環境改變帶來的影響、決定土壤功能多樣性[32]。施用微生物菌可以使土壤中細菌含量上升,真菌含量降低,土壤微生物由“真菌型”轉變為“細菌型”,土壤微生態趨于平衡,控制土傳病害[33]。馬慧媛等[22]、李鳳霞等[34]研究表明微生物菌劑的施用可以增加土壤中細菌和真菌的數量,土壤呈現細菌化狀態,與研究結果一致。但是微生物數量指標不能很明確的反映不同微生物菌處理直接的差異。
3.2高通量測序技術能夠準確測出微生物的序列,在研究土壤微生物群落結構的復雜性和功能多樣性等方面被越來越多地采用[35, 36]。研究結果表明,T1和T3的細菌種類多于CK,T1、T2、T3的真菌種類均少于CK;T2處理的細菌Shannon和Simpson指數均低于CK,T1和T3處理的細菌Shannon和Simpson指數均高于CK,3種微生物菌處理的真菌Shannon和Simpson指數均高于CK,放線菌和哈茨木霉菌處理后可以提高土壤微生物群落多樣性。細菌NMDS分析的結果顯示,對照、放線菌、枯草芽孢桿菌、哈茨木霉4個處理中3個重復的微生物菌群均能聚于一個區域,不同處理細菌間存在差異,相同處理間存在較強的一致性。屬水平上的聚類熱圖分析顯示,T1和T3首先聚為一類,然后和CK聚為一類,最后和T2聚為一類,T1和T3微生物菌處理的細菌多樣性較為相似。真菌NMDS分析和屬水平聚類熱圖分析結果說明,T1和T3微生物菌處理的真菌多樣性較為相似。分析發現細菌中Unspecified_iii1_15、Unspecified_RB41、Unspecified_Gemm_5、Unspecified_Syntrophobacteraceae、Kaistobacter為優勢細菌屬,除其他(Other)外,CK、T1、T3中Kaistobacter的相對豐度均最高,T2中芽孢桿菌屬的相對豐度最高。真菌中Fusarium(鐮刀菌屬)、Unspecified_Chaetomiaceae(未分類毛殼菌科)、Unspecified_Pezizales、Unspecified_Hypocreales_fam_Incertae_sedis、Mortierella(被孢霉屬)為優勢真菌屬,鐮刀菌屬(Fusarium)在4個不同處理中相對豐度最高,鐮刀菌是一種植物病原真菌,廣泛存在于自然界中,鐮刀菌是一種重要的植物病原真菌,可造成番茄、黃瓜、苜蓿等多個器官多個組織的腐爛[37-39]其中,致病性尖孢鐮刀菌侵染引起的植物枯萎病是一種土傳真菌病害,危害嚴重[40]。
3.3不同微生物菌處理與環境因子RDA分析結果表明,細菌和真菌的微生物群落變異的解釋方差極顯著。細菌和真菌中葉寬與微生物群落分布間的相關性均最小,葉長、株高、莖粗和產量與微生物群落分布間的相關性高;葉長和株高間的相關性高,而兩者與產量間的相關性低;真菌分析中葉長與葉寬、株高、莖粗三者間的相關性高,與產量間的相關性低。細菌分析中,葉長和株高與CK的相關性最高,莖粗與T1的相關性高,產量與T3的相關性高;真菌分析中,株高同樣與CK的相關性高,葉長、葉寬、莖粗與T1的相關性高,產量與T3的相關性高。微生物菌劑通過多種作用機制可促長增產[41],研究結果與其一致。
4 結 論
哈茨木霉處理的土壤中細菌含量最高,放線菌處理的土壤中真菌含量最高,放線菌和哈茨木霉處理的土壤中細菌和真菌的比例均大于對照,土壤微生物呈現“細菌化”。放線菌和哈茨木霉微生物菌處理的細菌和真菌多樣性較為相似。鐮刀菌屬在4個不同處理中相對豐度最高,易引發番茄發生枯萎病,危害嚴重。放線菌和哈茨木霉對番茄土壤微生物的影響相對較大,葉長、葉寬、莖粗與放線菌的相關性最高,哈茨木霉與產量的相關性最高。

