生物酶解法提取干姜精油的工藝及其生物活性評價
賴文靜 張星 黃友 楊莎莎 林夏 張臻 傅超美 代文東 孫穎
摘 要:采用生物酶解法提取干姜精油,考察其感官特征、理化性質、化學成分及生物活性,為干姜精油的進一步開發提供研究基礎.運用Box-Behnken優化生物酶解法提取干姜精油的工藝,并與傳統水蒸氣蒸餾法比較精油得率、感官特征、理化性質與化學成分差異;同時選用化妝品原料功效評價經典方法,研究2種方法提取所得干姜精油對DPPH和ABTS自由基清除能力及酪氨酸酶活性抑制能力,揭示二者體外抗氧化和美白活性.結果表明,生物酶解法提取的干姜精油得率為0.74%,與傳統水蒸氣蒸餾法相比,蒸餾時間縮短,精油得率提高了57.45%;生物酶解法提取對干姜精油的品質有一定提升,成分分析結果表明,生物酶解法提取干姜精油使其化合物種類和含量發生變化,主要有效成分α-姜烯的含量增加了4.48%;2種方法提取的干姜精油均有DPPH和ABTS自由基清除能力和酪氨酸酶活性抑制能力.通過響應面分析法優化后的生物酶解法提取干姜精油工藝穩定可行、可控,干姜精油得率高、品質好,具有良好的抗氧化和酪氨酸酶活性抑制作用,為化妝品開發提供了一種兼具抗氧化和美白作用的天然原料.
關鍵詞:干姜;精油;酶法;抗氧化;酪氨酸酶
中圖分類號:TQ654.2
文獻標志碼:A
文章編號:1004-5422(2023)03-0239-09DOI:10.3969/j.issn.1004-5422.2023.03.004
0 引 言
精油是從芳香植物中提取的揮發性化合物[1],因其具有抗氧化、抗衰老、抗菌、抗病毒、抗炎和抗癌等生物活性,在制藥、衛生、農業、食品和化妝品等領域廣泛應用[2].隨著消費者對天然綠色的化妝品逐漸重視,用植物來源的天然化合物替代化學合成品已成為化妝品行業的發展趨勢[3].與一般天然提取物不同,精油不僅含有多種活性成分,同時具有較好的透皮促吸收能力,并且擁有豐富的芳香氣味,能有效滿足市場對化妝品健康有效的需求,還能提升化妝品的產品價值[4].
姜作為常見的傳統中藥材,應用于美容護膚由來已久.明朝《奇效良方》中載有藥方:“一斤生姜半斤棗,二兩白鹽三兩草,丁香沉香各半兩,八兩茴香一處搗,蒸也好,煮也好,修合此藥勝似寶,每天清晨飲一杯,一世容顏長不老”[5].據報道,用作化妝品原料的姜成分有姜根、姜根粉、姜根提取物、姜根油、姜水和姜提取物等.干姜來源于姜科植物姜(Zingiber officinale Rosc.)的干燥根莖,藥用和食用歷史悠久,具有溫中散寒、回陽通脈和溫肺化飲的功效[6].干姜揮發油也稱為干姜精油[7],通常由單萜或倍半萜類化合物及其衍生物組成[8].相對于生姜精油,干姜精油中高含量倍半萜類成分能夠更好地滯留在角質層中,干擾脂質的萃取,打開角質層脂質中的通道[9].現代研究表明,干姜精油具有抗氧化、抗衰老、抑菌和抗炎等生物活性,在醫藥、食品、香料和化妝品等領域具有極高的應用潛力和開發利用價值[10].
干姜精油的提取方法較多,除了傳統的水蒸氣蒸餾法[11]外,目前已報道了同時蒸餾萃取法、超臨界CO2萃取法和微波輔助水蒸氣蒸餾提取法等提取新技術[12-13].新技術的應用提高了精油得率,但仍存在儀器設備昂貴、工藝條件復雜與提取溫度較高等缺點[14].因此,探尋一種綠色、高效與低能耗的干姜精油提取方法依然是研究的熱點.近年來,生物酶解法提取揮發油作為一種新工藝已有一些基礎研究[15-16].生物酶解法具有提取時間短、工藝簡單、提取條件溫和、能耗低、有效成分破壞少與經濟安全等優點.目前,尚未有生物酶解法用于干姜精油提取的相關報道.因此,本研究利用響應面分析法,對生物酶解法提取干姜精油進行工藝優化,并與傳統水蒸氣蒸餾法在精油得率、感官特征、理化性質與化學成分等方面進行比較;最后考察干姜精油體外抗氧化和酪氨酸酶抑制活性,以期為化妝品的開發提供一種兼具抗氧化和美白作用的天然原料.
1 材 料
1.1 儀 器
CAP225D型十萬分之一電子天平、BS200S型萬分之一電子天平(德國賽多利斯公司),MH-1000型調溫型電熱套(北京科偉永興儀器有限公司),DZKW-4型電熱恒溫水浴鍋(北京中興偉業儀器有限公司),UV756-CRT型紫外可見分光光度計(上海佑科儀器儀表有限公司),Spectra Max iD3型多功能酶標儀(美谷分子儀器(上海)有限公司),7890A-5975C型氣相色譜—質譜聯用儀(GC-MS)(安捷倫科技有限公司).
1.2 材 料
干姜飲片(批號為2101055),購自四川新荷花中藥飲片股份有限公司,經粉碎過40目篩后于干燥器中保存;一水合檸檬酸(批號為2017080501)、二水合檸檬酸三鈉(批號為2022022801),均購自成都市科隆化學品有限公司;纖維素酶(批號為R033589,50 U/mg),購自上海易恩化學技術有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)(批號為C14103877,純度為96%)、2,2′-聯氨-二(3-乙基苯并噻唑啉-6-磺酸)二胺鹽(ABTS)(批號為C14003 395,純度為98%)、酪氨酸酶(批號為C14357304,500 U/mg)、L-酪氨酸(批號為C13900078,純度為99%)、熊果苷(批號為C13610961,純度為98%)、維生素C(批號為C13995299,純度為99.99%),均購自上海麥克林生化科技有限公司;水為純水,纖維素酶和酪氨酸酶為生物技術級,其他試劑均為分析級.
2 方法與結果
2.1 生物酶解法提取干姜精油
稱取過篩的干姜粉50 g,置于1 000 mL圓底燒瓶中,將纖維素酶溶于一定pH值條件下的檸檬酸緩沖液中,充分振搖混勻后,于一定溫度下進行酶解預處理,酶解結束后轉移至揮發油提取裝置,水蒸氣蒸餾3 h.分離油層,加入無水硫酸鈉脫水,4 ℃靜置12 h,用移液槍轉移精油至棕色容量瓶中,精密稱定質量.精油得率計算公式為,
R=m/M×100%(1)
式中,R為精油得率,%;m為干姜精油質量,g;M為干姜粉末質量,g.
2.1.1 單因素考察
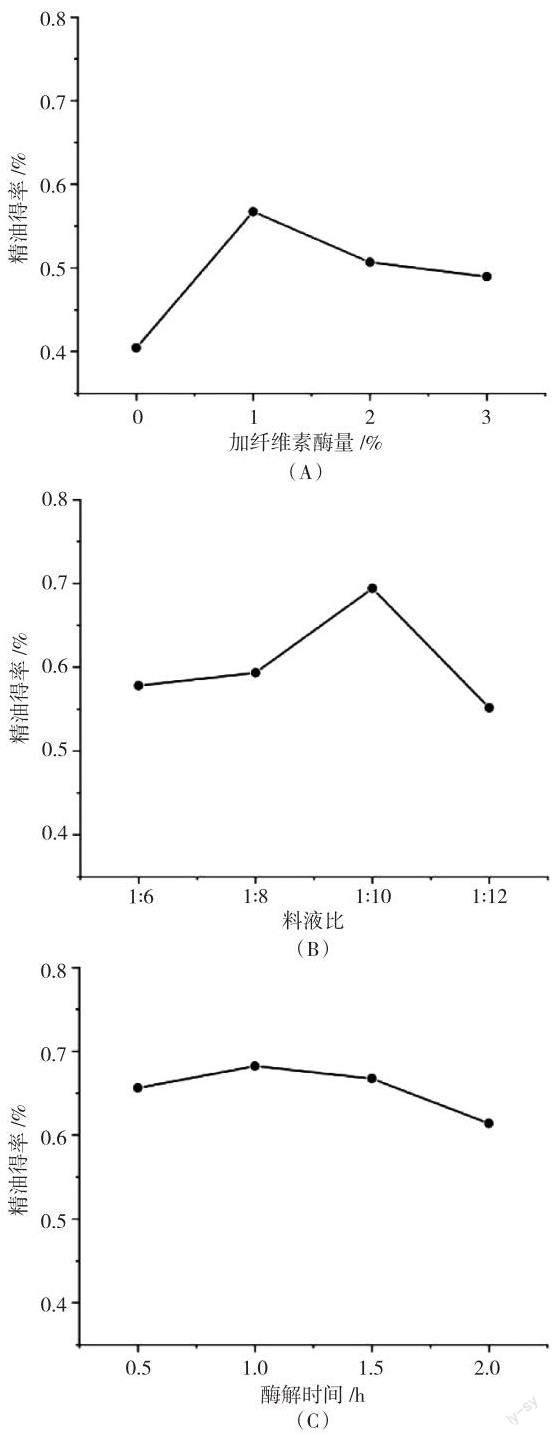
依次對纖維素酶用量(0、1%、2%和3%),料液比(1∶6、1∶8、1∶10和1∶12),酶解時間(0.5、1.0、1.5和2.0 h),酶解溫度(40、50、60和70 ℃),酶解pH值(4、5、6和7)等進行單因素試驗,試驗結果如圖1所示.由圖1(A)可知,纖維素酶的加入明顯提高了干姜精油得率,主要是由于纖維素酶能有效破壞植物細胞壁,加速干姜精油的溶出,當加酶量為1%時,干姜精油得率最大為0.57%,當加酶量大于1%后,干姜精油得率略有降低,但仍保持在0.50%左右,酶與底物趨于飽和.由圖1(B)可知,隨著提取溶劑體積的增加,干姜粉末與提取溶劑充分接觸,干姜精油得率不斷提高,當料液比為1∶10時,干姜精油得率最大為0.69%,當提取溶劑體積過大時,可能由于操作難度的相應增加,從而導致干姜精油流失,精油得率也相應降低.由圖1(C)可知,隨著酶解時間的延長,植物細胞壁纖維素水解度提高,精油得率也相應提高,酶解時間1 h時,干姜精油得率最大為0.68%,隨著時間繼續延長,干姜中非揮發性物質也隨之溶出,降低了精油的分離效果,從而使精油得率有所下降.由圖1(D)可知,干姜精油得率隨著酶解pH值的升高先上升后下降,酶解pH值為5時,干姜精油得率最大為0.76%,這與纖維素酶最適pH值相一致.由圖1(E)可知,干姜精油得率隨著酶解溫度的升高先上升后下降,酶解溫度為50 ℃時,干姜精油得率最大為0.71%,這與所選纖維素酶的最佳作用溫度相一致.
2.1.2 Box-Behnken響應面法
根據Box-Behnken設計原理,在單因素試驗的基礎上,將對干姜精油得率影響較大的料液比、酶解pH值和酶解溫度作為獨立變量,每個變量設計3個水平.以干姜精油得率為響應值,試驗因素與水平見表1,設計與結果見表2.
利用Design-Expert 10.0.7軟件分析,得到回歸方程為Y=0.73+0.013A+0.01B-0.01AB-0.020AC-0.12A2-0.037B2-0.002 5C2,方差分析結果見表3.
由表3可知,模型的P=0.030 8<0.05(顯著),而失擬項的P=0.152 6>0.05(不顯著),說明生物酶解法提取干姜精油的模型與實際情況擬合程度較好,可以預測生物酶解法提取干姜精油的條件.各因素交互作用對干姜精油得率影響的三維響應面圖如圖2所示.在三維響應面圖中,響應面坡度越陡峭,則表明響應值越敏感.由圖2(A)可知,酶解溫度50 ℃時,在相同酶解pH值條件下,隨著提取溶劑體積逐漸增加,干姜精油得率先上升后下降,變化趨勢顯著;在料液比不變的條件下,隨著酶解pH值升高,精油得率先上升后下降,變化趨勢較顯著.由圖2(B)可知,在酶解pH值為5時,酶解溫度不變的條件下,隨著提取溶劑體積逐漸增加,干姜精油得率先上升后下降,變化趨勢顯著;在料液比不變的條件下,隨著酶解溫度升高,精油得率先上升后下降,變化趨勢較顯著.由圖2(C)可知,當料液比為1∶10時,酶解溫度不變的條件下,精油得率隨酶解pH值先上升后下降,變化趨勢不顯著,反之亦然.各項因素對干姜精油得率的影響大小順序是依次為料液比(A)>酶解pH值(B)>酶解溫度(C).
當料液比為1∶10.14(g/mL),pH值為5.13,酶解溫度為47.28 ℃時,測試變量的預測值最大,精油得率為0.73%.為便于試驗的可操作性,確定干姜精油最佳提取條件為:料液比為1∶10(g/mL),pH值為5,酶解溫度為47 ℃.因此,干姜精油最佳提取工藝為:取干姜粗粉,加入10倍量的檸檬酸緩沖液及1%纖維素酶,調節pH值為5,在47 ℃下酶解1 h后,水蒸氣蒸餾提取3 h,即得干姜精油.在此工藝條件下進行驗證試驗,平行設置3組,獲得3份精油,經計算干姜精油的平均得率為0.74%,與預測值基本一致,表明該提取工藝穩定、可行.
2.2 傳統水蒸氣蒸餾法提取干姜精油
稱取過篩的干姜粉50 g,置于1 000 mL圓底燒瓶中,加入10倍量蒸餾水,置于揮發油提取裝置中,加熱回流使整個裝置保持在微沸狀態下,提取約5 h,當提取器中的揮發油不再增加時停止加熱,分離油層,加入無水硫酸鈉脫水,4 ℃靜置12 h,用移液槍轉移精油至棕色容量瓶中,精密稱定質量,按公式(1)計算精油得率.實驗結果表明,傳統水蒸氣蒸餾法耗時5 h提取干姜精油得率僅為0.47%,生物酶解法耗時4 h提取干姜精油得率為0.74%,比傳統水蒸氣蒸餾法提高了57.45%,表明生物酶解法不僅能明顯縮短提取時間、節約能耗、降低成本,還能提高干姜精油的得率.
2.3 干姜精油理化指標分析
分別測定2種方法提取的干姜精油的感官特征、相對密度、酸值和酯值,并根據酸值和酯值結果計算皂化值,結果見表4.
由表4可知,2種方法提取的干姜精油都具有較好的感官品質,為淡黃色澄清透明、擁有純正干姜辛辣氣味的油狀液體,其他的理化指標也基本一致.表明生物酶解法對干姜精油的理化性質沒有影響.
2.4 干姜精油成分分析
2.4.1 樣品處理
精密吸取一定量干姜精油,加乙酸乙酯稀釋10倍,用0.22 μm微孔濾膜過濾,即得供試品溶液.
2.4.2 色譜條件
參考文獻[17],并稍作修改,確定了GC-MS色譜條件.色譜柱為HP-5MS石英毛細管柱(30 m×0.25 mm×0.25 μm);載氣為氦氣(99.999%),載氣流速為1 mL/min;離子源為EI源,電離能量70 eV,離子源溫度230 ℃;進樣口溫度250 ℃;進樣體積1 μL;分流比為100∶1;升溫程序為起始溫度70 ℃,保持2 min,以8 ℃/min升至170 ℃,保持4 min,以10 ℃/min升至250 ℃,保持2 min.
2.4.3 成分分析
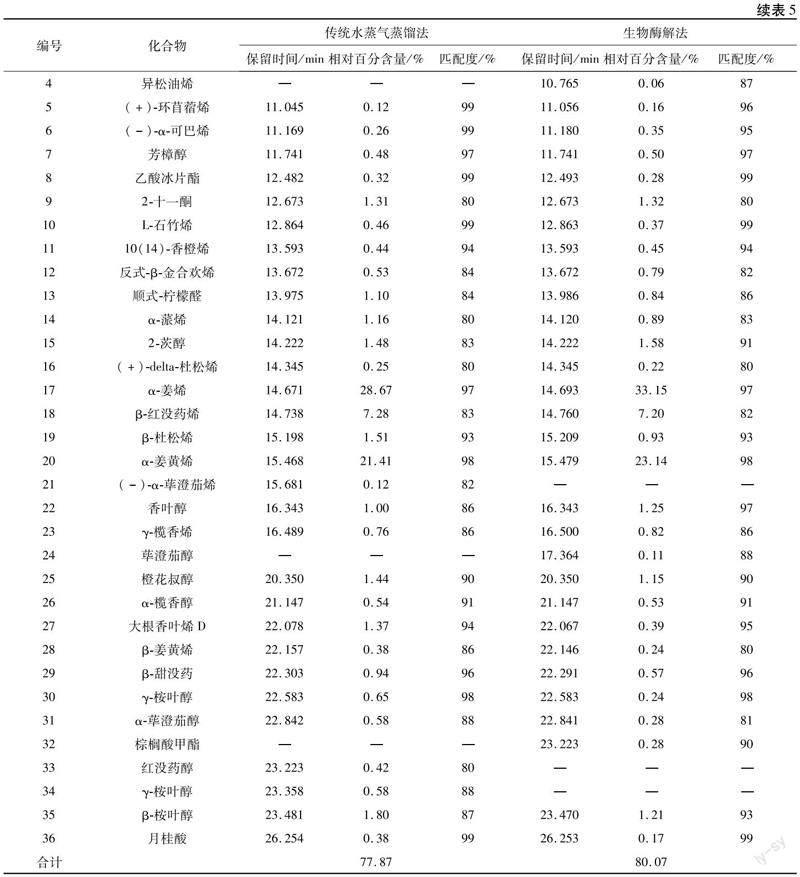
按照“2.4.2”項下色譜條件進行GC-MS檢測,并利用NIST14.L質譜數據檢索標準譜庫解析成分,采用峰面積歸一化法計算各組分相對百分含量,成分解析結果見表5.傳統水蒸氣蒸餾法提取的精油共鑒定出31種化合物,占總干姜精油含量的77.87%.其中,含量最高的是α-姜烯(28.67%),其次是α-姜黃烯(21.41%)和β-紅沒藥烯(7.28%).生物酶解法提取的精油共鑒定出33種化合物,占總干姜精油含量的80.07%.其中,α-姜烯和α-姜黃烯含量均有一定程度的升高,分別為33.15%和23.14%,β-紅沒藥烯的含量稍有降低為7.20%.在傳統水蒸氣蒸餾法中檢測到的(-)-α-蓽澄茄烯、紅沒藥醇和γ-桉葉醇,在生物酶解法中未檢測到.在生物酶解法中檢測到的莰烯、甲基庚烯酮、異松油烯、蓽澄茄醇和棕櫚酸甲酯等,在傳統水蒸氣蒸餾法中也未檢測到.GC-MS結果表明,纖維素酶處理后會出現干姜精油中化合物種類和含量的變化,使得干姜精油主要活性成分α-姜烯和α-姜黃烯含量升高,有效提高了干姜精油的提取率.
2.5 干姜精油抗氧化活性測定
2.5.1 DPPH自由基清除能力的測定
DPPH用無水乙醇配制成濃度為0.08 mmol/L的溶液,4 ℃下避光保存,現配現用,4 h內有效.取1 mL干姜精油待測液與3 mL DPPH溶液混勻為A,取1 mL無水乙醇與3 mL DPPH溶液混勻為B.室溫避光孵育30 min后,在517 nm波長下分別測定A和B的吸光度值,以維生素C作為陽性對照,結果如圖3(A)所示.DPPH自由基清除率計算公式[18]為,
DPPH自由基清除率=(ODB-ODA)/ODB×100%(2)
2.5.2 ABTS自由基清除能力的測定
將用純水配制的7.4 mmol/L ABTS溶液5 mL和2.6 mmol/L K2S2O8溶液5 mL混合產生ABTS+自由基,室溫避光條件下靜置12~16 h,得ABTS儲備液,備用.使用前用無水乙醇稀釋40~45倍,使其在734 nm波長下的吸光度為0.7±0.02,得到ABTS工作液,現配現用.取0.5 mL干姜精油待測液與2 mL ABTS工作液混勻為A,取0.5 mL無水乙醇與2 mL ABTS工作液混勻為B.黑暗室溫反應10 min后,在734 nm波長下分別測定A和B的吸光度值,以維生素C作為陽性對照,結果如圖3(B)所示.ABTS自由基清除率計算公式[19]為,
ABTS自由基清除率=(ODB-ODA)/ODB×100%(3)
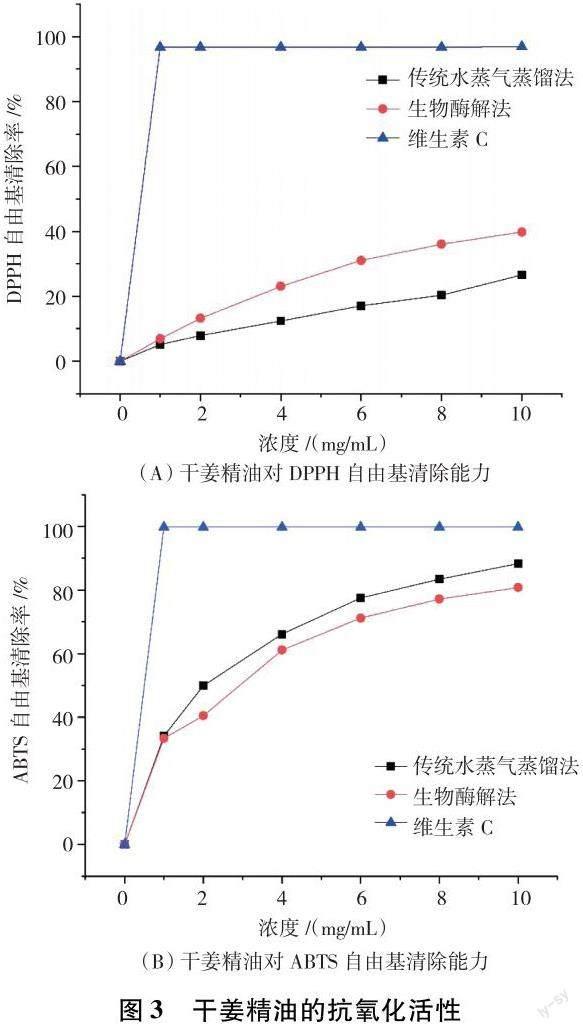
由圖3可知,在0~10 mg/mL范圍內,2種方法提取的干姜精油對DPPH和ABTS自由基均具有一定的清除作用,隨著干姜精油濃度的增加,清除率隨之增加,呈明顯量效關系.整體上來看,在相同濃度條件下,生物酶解法提取干姜精油對DPPH的清除能力略大于水蒸氣蒸餾法提取干姜精油對DPPH的清除能力,兩者的半抑制濃度(IC50)分別為12.10 mg/mL和13.74 mg/mL,差異不顯著(P>0.05).生物酶解法提取干姜精油對ABTS的清除能力略小于水蒸氣蒸餾法提取干姜精油對ABTS的清除能力,兩者IC50分別為2.834 mg/mL和1.999 mg/mL,差異不顯著(P>0.05).
2.6 干姜精油對酪氨酸酶活性抑制能力測定
用pH值為6.8的磷酸鹽緩沖液配制酶活力單位為100 U/mg的酪氨酸酶溶液.精密稱取L-酪氨酸0.027 2 g,磷酸鹽緩沖液分散溶解,并定容于100 mL容量瓶中,制得7.5 mmol/L L-酪氨酸溶液.試驗分為4組,在各組中按照表6中組分用量準確加入磷酸鹽緩沖液、酪氨酸酶、溶劑及干姜精油待測液,混勻,于37 ℃保溫5 min.在各組中加入L-酪氨酸溶液混勻,于37 ℃反應30 min,反應結束后立即在492 nm波長處測定4組吸光度值.酪氨酸酶活性抑制率計算公式[20]為,
酪氨酸酶活性抑制率=[1-(ODC-ODD)/(ODA-ODB)]×100%(4)
在0.1~1 mg/mL范圍內,隨反應體系中干姜精油濃度的增加,其對酪氨酸酶活性的抑制能力如圖4所示.整體上來看,在相同濃度條件下,生物酶解法和傳統水蒸氣蒸餾法提取的干姜精油對體系中酪氨酸酶抑制作用均略強于陽性對照熊果苷,且2種方法提取的干姜精油對酪氨酸酶的抑制能力相當,兩者IC50分別為0.868 7 mg/mL和0.816 9 mg/mL.
3 討 論
本研究借助纖維素酶高度專一的特性,將纖維素降解為葡萄糖,有效破除細胞壁,促進細胞中的活性成分溶出,從而提高干姜精油得率.通過生物酶解法提取干姜精油,同時運用響應面分析法對其提取工藝進行優化,確定最佳工藝為:取干姜粗粉,加入10倍量的檸檬酸緩沖液及1%纖維素酶,調節pH值為5,在47 ℃下酶解1 h后,水蒸氣蒸餾提取3 h,即得干姜精油.生物酶解法與傳統水蒸氣蒸餾法相比,縮短了蒸餾時間,明顯提高了干姜精油得率,可使精油得率提升57.45%.生物酶解法對干姜精油的感官品質和基本理化性質沒有影響.利用GC-MS技術定性定量測定干姜精油化學成分變化,結果表明,生物酶解法提取干姜精油使其揮發性成分的種類和含量發生變化,主要有效成分α-姜烯增加了4.48%,變化最為明顯.此外,2種方法提取的干姜精油均以倍半萜類成分為主,該類成分是干姜精油透皮促吸收作用的關鍵性成分,表明干姜精油可作為一種良好的透皮吸收促進劑來源[9].
酪氨酸酶又稱為多酚氧化酶,能夠催化生物體內黑色素合成,其反應需要有氧自由基參加[21].通過抑制酪氨酸酶活性和清除自由基,可以阻斷酪氨酸酶的催化反應,減輕或祛除色素沉著現象,起到美白和抗衰老作用[22].本研究通過測定并比較2種方法提取的干姜精油對DPPH和ABTS自由基的清除能力和酪氨酸酶的抑制活性,表明2種方法提取的干姜精油對DPPH和ABTS自由基均有一定的清除作用,具有明顯的抗氧化活性,對比傳統水蒸氣蒸餾法,生物酶解法提取的干姜精油對DPPH的清除作用稍強,對ABTS的清除作用稍弱.2種方法提取的干姜精油對酪氨酸酶具有較強的抑制能力,且在相同濃度條件下抑制能力相當,展現了干姜精油作為化妝品美白劑的潛力,為干姜精油的進一步開發奠定了研究基礎.
參考文獻:
[1]Aziz Z A A,Ahmad A,Setapar S H M,et al.Essential oils∶Extraction techniques,pharmaceutical and therapeutic potential-a review [J].Curr Drug Metab,2018,19(13):1100-1110.
[2]Carvalho I T,Estevinho B N,Santos L.Application of microencapsulated essential oils in cosmetic and personal healthcare products-a review [J].Int J Cosmet Sci,2016,38(2):109-19.
[3]張勇,龔盛昭,徐夢漪.化妝品中精油及其載運系統應用研究進展[J].香料香精化妝品,2021,49(5):103-109.
[4]馬永鵬,張紅霞,杜芝芝.云南高原芳香植物精油在化妝品中的應用[J].天然產物研究與開發,2018,30(1):146-154.
[5]陳堅生,雷登鳳,高合意.生姜在化妝品中的應用現狀[J].香料香精化妝品,2018,46(1):72-75.
[6]方文韜,詹志來,彭華勝,等.干姜、生姜、炮姜分化的歷史沿革與變遷[J].中國中藥雜志,2017,42(9):1641-1645.
[7]Pang X,Cao J,Wang D,et al.Identification of ginger (Zingiber officinale Roscoe) volatiles and localization of aroma-active constituents by GC-Olfactometry [J].J Agric Food Chem,2017,65(20):4140-4145.
[8]Sharifi-Rad M,Varoni E M,Salehi B,et al.Plants of the genus Zingiber as a source of bioactive phytochemicals:from tradition to pharmacy [J].Molecules,2017,22(12):2145-1-2145-20.
[9]蘇曼,陳軍,高潔,等.生姜炮制成干姜前后揮發油透皮吸收促進作用的比較研究[J].中草藥,2019,50(24):5988-5994.
[10]陳燕,倪元穎,蔡同一.生姜提取物的綜合利用與深加工研究[J].食品工業科技,2000,22(4):76-78.
[11]劉金環,楊玉琴,秦利芬,等.干姜中揮發性成分的GC指紋圖譜研究[J].中國實驗方劑學雜志,2013,19(1):153-156.
[12]劉紅霞,丁榮良,仝錦豪,等.姜精油提取工藝優化及對比成分分析[J].中國調味品,2021,46(8):101-104.
[13]李寶志,李鋒,樸永革,等.干姜化學成分提取及其在卷煙中的應用[J].廣州化工,2019,47(14):95-97.
[14]葛毅強,倪元穎,張振華,等.生姜精油的研究新進展[J].中國調味品,2004,29(9):3-9.
[15]Chen S,Xing X H,Huang J J,et al.Enzyme-assisted extraction of flavonoids from Ginkgo biloba leaves:Improvement effect of flavonol transglycosylation catalyzed by Penicillium decumbens cellulase [J].Enzyme Microb Technol,2011,48(1):100-105.
[16]秦宇仙,徐琳,余馮萍,等.纖維素酶輔助水蒸氣蒸餾提取肉豆蔻揮發油的品質及其活性評價[J].食品與發酵工業,2022,48(10):112-118.
[17]王志榮,黎志立,李明艷,等.福建鮮姜、干姜中主要成分比較[J].中成藥,2020,42(8):2230-2236.
[18]Cai L,Chen B,Yi F,et al.Optimization of extraction of polysaccharide from dandelion root by response surface methodology:Structural characterization and antioxidant activity [J].Int J Biol Macromol,2019,140:907-919.
[19]Kang J H,Song K B.Characterization of Job's tears (Coix lachryma-jobi L.) starch films incorporated with clove bud essential oil and their antioxidant effects on pork belly during storage [J].LWT-Food Sci Technol,2019,111:711-718.
[20]陸廷亞,陳琪,趙曉歌,等.大高良姜地下根莖揮發油化學成分及體外藥理活性研究[J].天然產物研究與開發,2020,32(11):1866-1875.
[21]周慧吉,張璐,李廷釗,等.超濾親和液質聯用技術篩選顯齒蛇葡萄葉中酪氨酸酶抑制劑[J].中草藥,2021,52(22):6796-6805.
[22]黃永紅,何秋星,李馨恩,等.基于美白功效對當歸補血湯藥效關系的分析[J].中國實驗方劑學雜志,2016,22(7):10-14.
(責任編輯:伍利華)
Abstract:The essential oil from Zingiben Rhizoma(GEO) was extracted by enzymatic hydrolysis,and its sensory characteristics,physical and chemical properties,chemical composition,and biological activity were investigated,which provided a research basis for further development of GEO.Box-Behnken method was used to optimize the extraction process of GEO by enzymatic hydrolysis,and the difference of yield,sensory characteristics,physical and chemical properties,and chemical composition of essential oil was compared with that extracted by traditional steam distillation.At the same time,the classical method of cosmetic raw material efficacy evaluation was used to study the free radical scavenging ability and tyrosinase inhibition of GEO extracted by the two methods on DPPH and ABTS,and to reveal their antioxidant activity and whitening activity in vitro.The results showed that the yield of GEO was 0.74% by enzymatic hydrolysis.Compared with the traditional steam distillation method,the distillation time was shorter,and the yield of essential oil increased by 57.45%.The quality of essential oil was improved by enzymatic hydrolysis.The results of GC-MS showed that the type and content of its compounds were changed by enzymatic hydrolysis,and the content of α-gingerol,the main effective component,increased by 4.48%.The GEO extracted by the two methods have DPPH free radical scavenging ability,ABTS free radical scavenging ability and tyrosinase inhibiting ability,which are equivalent at the same concentration.It can be concluded that the process of extracting GEO by enzymatic hydrolysis optimized by response surface analysis is stable,feasible,and controllable.The yield of GEO is high,the quality is good,and it has good antioxidant and tyrosinase inhibitory effects,which provides a natural raw material with antioxidant and whitening effects for todays cosmetic development.
Key words:Zingiberis Rhizoma;essential oil;enzymatic method;antioxidant;tyrosinase
基金項目:國家自然科學基金青年基金項目(81803742);四川省科技廳應用基礎研究項目(2021YJ0251);四川省教育廳自然科學重點項目(18ZA0187);四川省中醫藥管理局中醫藥科研專項項目(2021MS109)
作者簡介:賴文靜(1998—),女,碩士研究生,從事中藥新制劑、新劑型與新技術研究.E-mail:838708151@qq.com
通信作者:張 臻(1988—),女,博士,副教授,從事中藥新制劑、新劑型與新技術研究.E-mail:zhangzhendr@126.com
傅超美(1961—),男,博士,教授,從事中藥新制劑、新劑型與新技術研究.E-mail:chaomeifu@126.com

