建構模型 突破原電池問題
■湖北省英山縣長沖高級中學 張進華
原電池和化學電源是化學學科核心知識,也是高頻考點。它側重考查原電池工作原理、電極判斷、電極反應式和總反應方程式的書寫、電流(或電子流動)方向、離子移動方向、根據反應式進行相關化學計算等。原電池和化學電源考題常以社會生活和科技前沿等熱點問題為背景,題目圖表符號多,信息豐富,命題往往“源于教材而又高于教材”,要求考生有較強的陌生情境下信息獲取能力和分析解決問題能力,從而成為考生學習和考試的一個難點。那么如何學好原電池和化學電源知識,這里筆者從化學學科五大核心素養中的“證據推理與模型認識 ” 角度進行初步探究。
模塊一:建立模型認知
1.原電池建模。
原電池是一種將化學能轉變為電能的裝置。其實質是依據一定條件,將氧化還原反應中還原劑失去的電子經過導線傳給氧化劑,使氧化反應和還原反應分別在負、正兩極進行。形成條件有:①有兩種活潑性不同的金屬(或一種是非金屬導體)作電極;②有電解質溶液(一般與活潑的電極發生自發的氧化還原反應);③形成閉合回路。
2.從電極的角度認知原電池模型。
(1)電極:較活潑的金屬為負極,較不活潑的金屬(或非金屬導體)為正極。
(2)反應:負極發生氧化反應,正極發生還原反應。
(3)電子:電子流出(電流流入)的為負極,電子流入(電流流出)的為正極。正、負極通過的電子的量相等(電子守恒)。電子只能在導線中流動,不能在電解質溶液里流動(電子不下水)。
(4)離子:原電池工作時陽離子向正極運動,陰離子向負極運動。
(5)介質:在酸性介質的電極反應式中不出現OH-,在堿性介質的電極反應式中不能有H+出現。
模塊二:典例講解
例1根據反應2Ag++Cu══Cu2++2Ag,設計如下頁圖1所示原電池,下列說法錯誤的是( )。

圖1
A.X 可以是銀或石墨
B.Y 是硫酸銅溶液
C.電子從銅電極經外電路流向X 電極
D.X 極上的電極反應式為Ag++e-══Ag
解析:由電池反應2Ag++Cu══2Ag+Cu2+可知,銅作負極,電極反應為Cu-2e-══Cu2+;X 為正極,可以是比銅不活潑的銀或石墨等,電極反應為Ag++e-══Ag。電解質溶液中需含有Ag+,故B項說法錯誤。
答案:B
例2一種基于酸性燃料電池原理設計的酒精檢測儀,負極上的反應為CH3CH2OH-4e-+H2O ══CH3COOH+4H+。下列有關說法正確的是( )。
A.檢測時,電解質溶液中的H+向負極移動
B.若有0.4 mol電子轉移,則在標準狀況下消耗4.48 L氧氣
C.電 池 反 應 的 化 學 方 程 式 為CH3CH2OH+O2══CH3COOH+H2O
D.正極上發生的反應為O2+4e-+2H2O ══4OH-
解析:在原電池中,陽離子要往正極移動,故A 項錯誤。因電解質溶液是酸性的,不可能存在OH-,故正極的反應式為O2+4H++4e-══2H2O,D 項錯誤。轉移4 mol電子時消耗 1 mol O2,則轉移0.4 mol電子時消耗2.24 L 標準狀況O2,故B 項錯誤。電池反應式即正、負極反應式之和,將兩極的反應式相加可得CH3CH2OH + O2══CH3COOH+H2O,故C項正確。
答案:C
例3一種熔融碳酸鹽燃料電池原理示圖2所示。下列有關該電池的說法正確的是( )。
B.電極A 上H2參與的電極反應為H2+2OH--2e-══2H2O
D.電極B 上發生的電極反應為O2+
解析:A 項則該反應中每消耗1 mol CH4轉移6 mol電子,錯誤。B 項,該電池的傳導介質為熔融的碳酸鹽,所以A電極即負極上H2參與的電極反應為H2-,錯誤。C 項,原電池工作時,陰離子移向負極,而B 極是正極,錯誤。D 項,B 電極即正極上O2參與的電極反應為正確。
答案:D
例4微生物電池是指在微生物的作用下將化學能轉化為電能的裝置,其工作原理如圖3所示。下列有關微生物電池的說法錯誤的是( )。
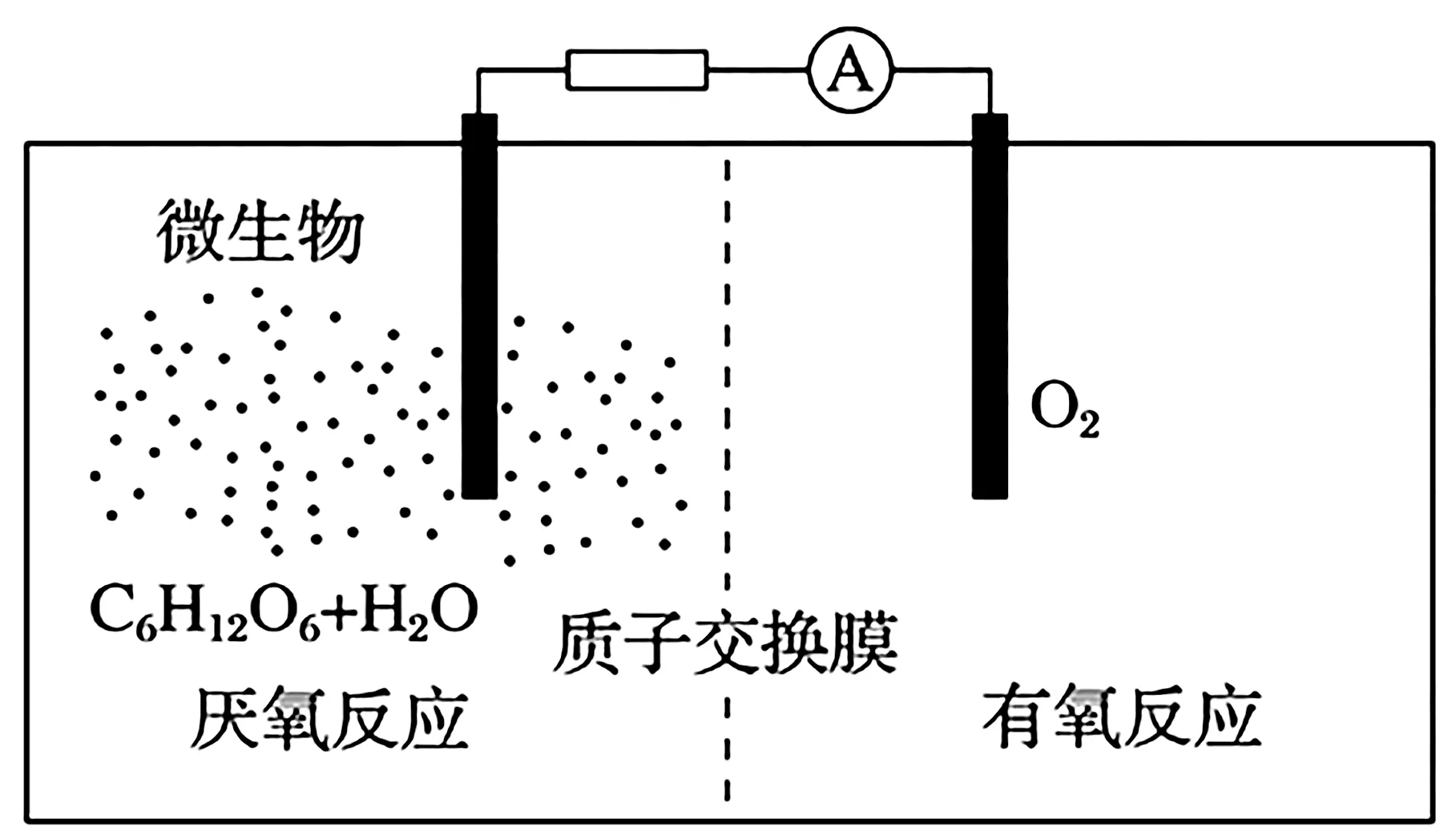
圖3
A.正極反應中有CO2生成
B.微生物促進了反應中電子的轉移
C.質子通過交換膜從負極區移向正極區
D.電池總反應為C6H12O6+6O2══6CO2+6H2O
解析:由題意可知,氧氣在正極反應,由于質子交換膜只允許H+通過,則正極反應為O2+4e-+4H+══2H2O,正極沒有CO2生成,A 項錯誤。微生物電池的原理是在微生物作用下O2與C6H12O6發生氧化還原反應,將化學能轉化為電能,B 項正確。負極發生反應C6H12O6-24e-+6H2O ══6CO2+24H+,H+在負極區生成,移向正極區,在正極被消耗,C 項正確。電池總反應為C6H12O6+6O2══6CO2+6H2O,D 項正確。
答案:A
例5酸性鋅錳干電池是一種一次性電池,外殼為金屬鋅,中間是碳棒,其周圍是由碳粉、MnO2、ZnCl2和NH4Cl等組成的糊狀填充物。該電池放電過程產生MnOOH。
(1)該電池的正極反應式為_____,電池反應的離子方程式為_____。
(2)維持電流強度為0.5 A,電池工作5 min,理論上消耗鋅____g。(已知F=96 500 C·mol-1)
解析:(1)根據酸性鋅錳干電池的構造可知,放電時,負極Zn 失去電子生成Zn2+,正極MnO2得到電子生成MnOOH,從而可寫出正極和負極的電極反應式,然后在遵循電子守恒的前提下將兩極反應式加合可得電池反應的離子方程式。
(2)電池工作5 min,通過的電量Q=0.5 A×5 min×60 s·min-1=150 C,因此通過電子的物質的量
答案:(1)MnO2+e-+H+══MnOOH
Zn+2MnO2+2H+══Zn2++2MnOOH
(2)0.05
模塊三:訓練與提高
1.由我國科學家研發成功的鋁錳電池是一種比能量很高的新型干電池,以氯化鈉和稀氨水混合溶液為電解質,鋁和二氧化錳-石墨為兩極,其電池反應為Al+3MnO2+3H2O ══3MnO(OH)+Al(OH)3。下列有關該電池放電時的說法不正確的是( )。
A.二氧化錳-石墨為電池正極
B.負極反應式為Al-3e-+3NH3·H2O══Al(OH)3+3NH+4
C.OH-不斷由負極向正極移動
D.每生成1 mol MnO(OH)轉移1 mol電子
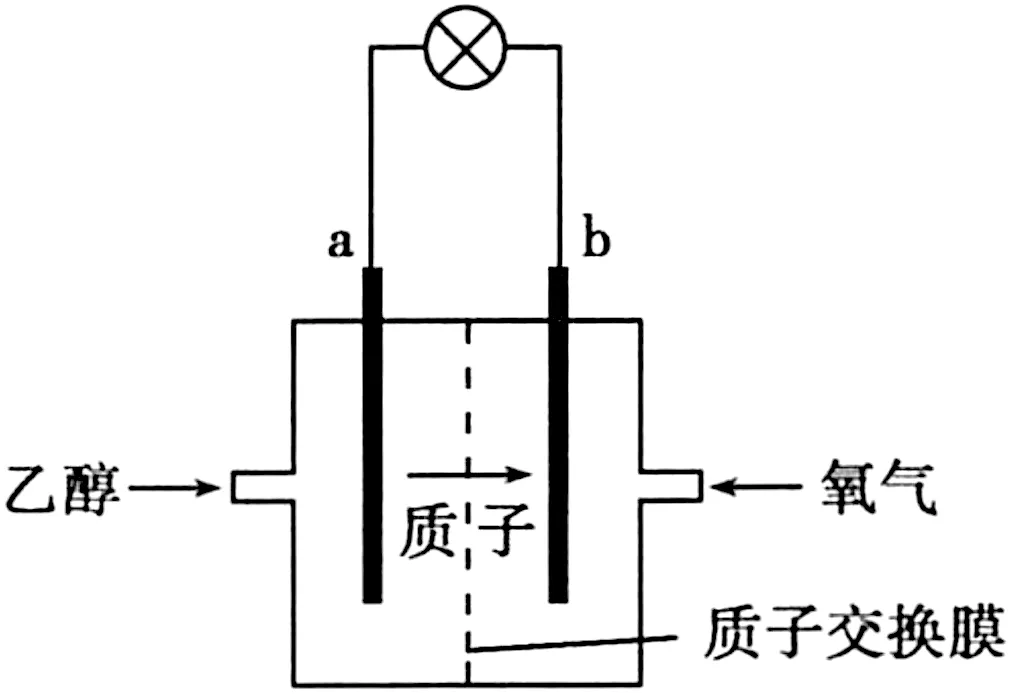
圖4
A.a極為電池的正極
B.電池工作時電流由a極沿導線經燈泡再到b極
C.電池負極的電極反應為4H++O2+4e-══2H2O
D.電池工作時,1 mol乙醇被氧化時有12 mol電子轉移
3.鋅銅原電池裝置如圖5 所示,其中陽離子交換膜只允許陽離子和水分子通過,下列有關敘述正確的是( )。
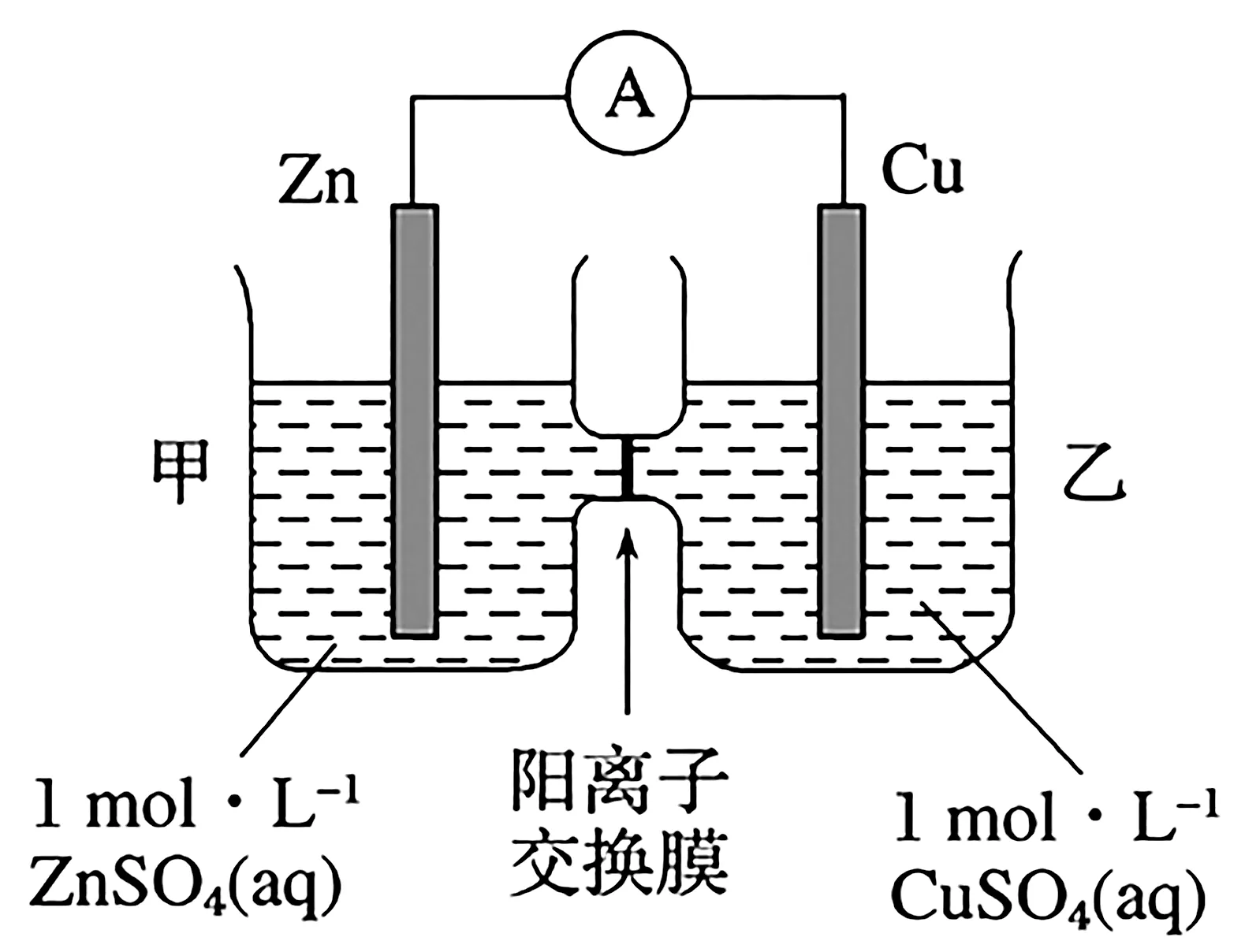
圖5
A.銅電極上發生氧化反應
C.電池工作一段時間后,乙池溶液的總質量增加
D.陰陽離子分別通過交換膜向負極和正極移動,保持溶液中電荷平衡
參考答案:1.C 2.D 3.C

