VEGF、HIF-1α與上皮性卵巢癌血管生成及生物學行為的關系
王 穩 馬軍霞 崔秀娟 田翔宇
(1.滕州市中心人民醫院婦產科,山東 棗莊,277599;2.滕州市中心人民醫院計生辦,山東 棗莊,277599;3.滕州市中心人民醫院醫學影像中心,山東 棗莊,277599)
由于缺乏有效的早期篩查手段,上皮性卵巢癌(Epithelial Ovarian Cancer,EOC)大多在處于廣泛盆腹腔轉移的晚期被發現,因早期無特異性臨床表現,病死率在所有女性生殖系統惡性腫瘤中位居第一。越來越多的研究表明,在EOC的發生、發展和浸潤轉移過程中,血管生成發揮著極其重要的作用。血管內皮生長因子( Vascular Endothelial Growth Factor,VEGF)是由單一基因編碼的同源二聚體糖蛋白,具有促進血管通透性增加等作用,是目前發現促血管生成作用最強的血管生成因子[1]。
腫瘤血管生成涉及血管內皮細胞(Endothelial cell,EC)、細胞外基質(Extracellular matrix,ECM)以及腫瘤細胞等之間的相互作用,過程尤為復雜,其中調節VEGF的重要因素包括:缺氧誘導因子(Hypoxia inducing factor 1,2,HIF-1,HIF-2)、環氧化酶(Cyclo-oxygenase,COX)以及促性腺激素等[2-5]。最新的分子生物學研究表明,在腫瘤免疫逃逸過程中,VEGF和HIF-1/2等血管生成相關因子發揮了決定性作用[6]。EOC惡性程度高,早期難以發現,本文研究者進行該試驗,擬分析VEGF、HIF-1α以及MVD在上皮性卵巢癌中的表達及其與預后的關系,應用免疫組織化學方法,評估相關指標在血管形成中發揮的作用,分析其與上皮性卵巢癌臨床指標間的關系。
1 材料與方法
1.1 研究材料
收集2012年1月—2017年12月滕州市中心人民醫院收治的46例EOC患者的臨床資料,以及同期因子宮肌瘤等良性疾病切除卵巢的39例患者的正常卵巢組織。所有EOC標本均經滕州市中心人民醫院經驗豐富的病理學專家進行病理分析證實,并根據世界衛生組織(World Health Organization,WHO)對組織學類型和分級進行評估[7]。本研究已被滕州市中心人民醫院醫學倫理委員會批準,所有患者均知情同意并簽署知情同意書。
1.2 納入與排除標準
納入標準:①EOC組織學亞型為漿液性、粘液性、透明細胞癌和子宮內膜樣癌;②所有EOC患者在初次手術前均未進行新輔助化療或放療;③滕州市中心人民醫院規范治療,病理科保存石蠟標本;④隨訪5年以上。
排除標準:①轉移性卵巢腫瘤;②外院手術治療;③術前接受放化療。臨床病理特征包括年齡、分期、組織學分級和淋巴結轉移。
1.3 研究方法
按照說明書提供的方案進行免疫組化染色,先經室溫脫蠟、水化處理,再用Tris-EDTA緩沖液(pH=9.0)進行抗原修復,封閉采用含5%山羊血清TBS,室溫孵育1.5 h,經二抗孵育、顯色、復染、脫水、封片,最后進行圖像采集。測定 VEGF和HIF-1α在EOC和正常卵巢組織中的表達情況,利用CD34對新生血管的微血管密度(MVD)進行評估,評估相關指標在血管形成中發揮的作用,分析其與EOC臨床指標間的關系。VEGF抗體(VEGFA Polyclonal antibody,生產企業:武漢Proteintech生物技術有限公司,型號:19003-1-AP)、HIF-1α抗體(HIF-1 alpha Polyclonal antibody,生產企業:武漢Proteintech生物技術有限公司,型號:20960-1-AP)和CD34抗體(CD34 Polyclonal antibody,生產企業:武漢Proteintech生物技術有限公司,型號:14486-1-AP)。臨床預后的測量指標為中生存期(Overall Survival,OS),指術后第1天至死亡的時間,未出現事件的為截尾數據。
1.4 結果判定
(1)組織化學評分(Histochemistry Score,H-Score):H-Score是一種半定量處理免疫組織化學結果的方法,同時考慮特異性染色的分布和強度。目視染色強度進行評分,按0(無染色)、1(弱染色)、2(中度染色)、3(強染色)分層,以陽性腫瘤細胞占百分比的比例評分,將百分比和強度評分相乘,得到每個病例的最終組織化學評分。H-Score的公式為:H-Score=∑(pi×i),其中i=染色強度,pi=染色腫瘤細胞的百分比,最終得分范圍為0~300。高分值組的VEGF和HIF-1α表達水平等于或超過中位數,低分值組的VEGF和HIF-1α表達水平低于中位數。染色切片由兩名觀察員在光學顯微鏡下盲法檢查和評分,所有切片均由兩名觀察員和一名病理學專家獨立評分,對病理和臨床特征不知情。
(2)CD34與MVD的測定:參照微血管計數方法,新生血管定義為與鄰近的微血管及腫瘤組織有明確的邊界,染色呈棕黃色的內皮細胞結構。結構不相連可能來源于一個新生血管時,也作為一血管計數。管腔結構不作為判定的必要條件,管腔較大且有較厚肌層的成熟血管結構需排除在外。在低倍鏡視野中,選取3個微血管密集度區為血管熱點,然后在高倍鏡視野下計數所有的微血管,將3個數值的平均數作為MVD。
1.5 統計學分析
使用GraphPad Prism 5進行統計學分析。采用Fisher精確試驗評價VEGF、HIF-1α、MVD表達與臨床病理特征的關系;log-rank檢驗進行比較分析;Kaplan-Meier生存曲線進行預后分析;所有結果均以P<0.05為差異有統計學意義(*P<0.05,**P<0.01,***P<0.001)。
2 結果
2.1 EOC患者臨床資料
VEGF、HIF-1α及MVD與EOC患者臨床病理特征的相關性,見表1。研究結果表明,EOC患者腫瘤組織中VEGF、HIF-1α和MVD的表達與FIGO分期、病理學分級和有無淋巴結轉移有關,差異有統計學意義(P<0.05),與年齡、組織學
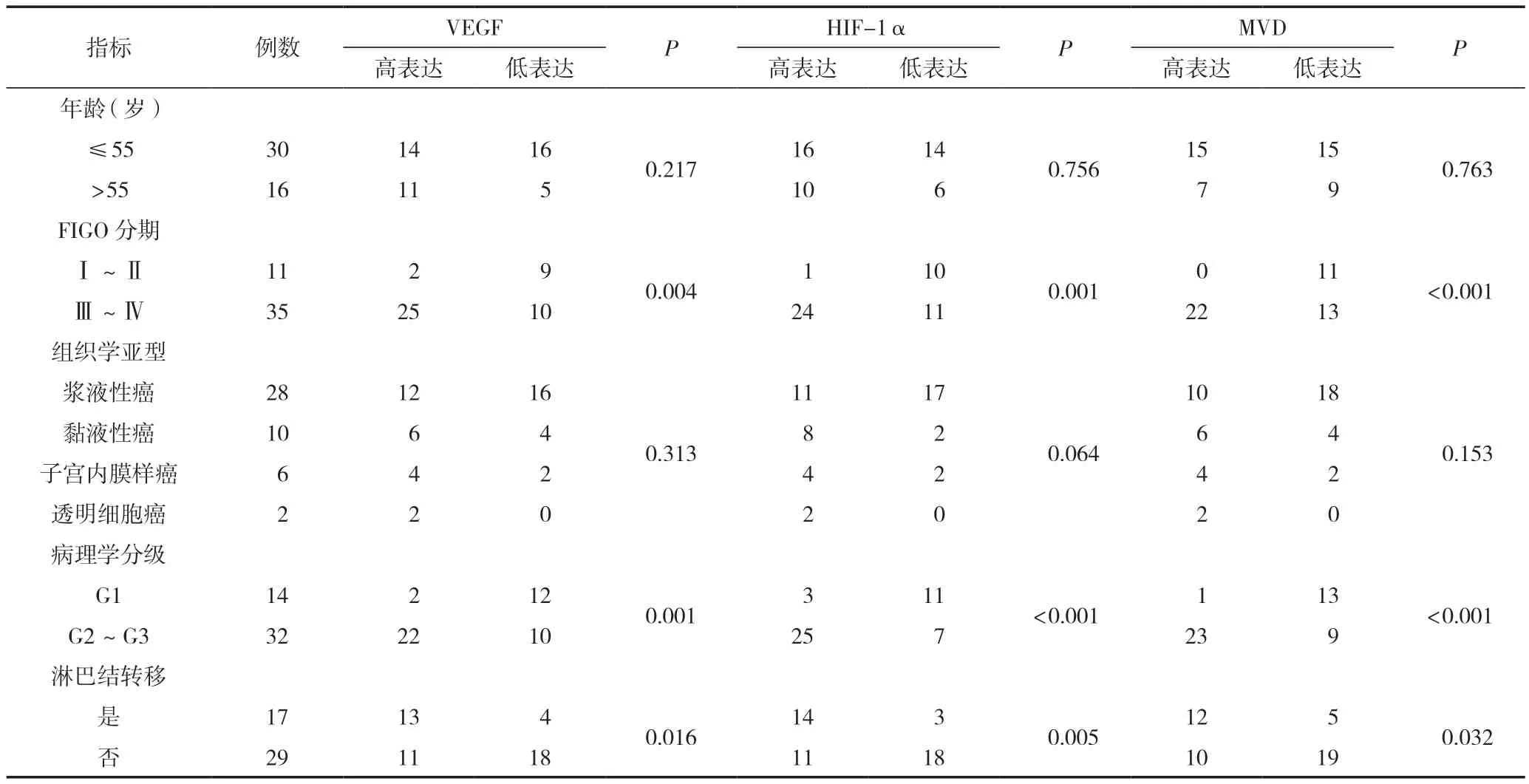
表1 EOC患者臨床病理特征與VEGF、HIF-1α和MVD表達的關系
2.2 EOC以及正常卵巢組織中VEGF、HIF-1α、MVD的表達
VEGF著色于細胞漿,HIF-1α在細胞核和細胞漿中同時出現,研究顯示,細胞核內的HIF-1α具有轉錄活性,以棕黃色染色出現在細胞核為陽性。研究結果顯示,VEGF和HIF-1α在EOC組織中的免疫組化染色強度和百分比明顯高于正常卵巢組織,差異有統計學意義(P<0.05)。通過免疫組化分析CD34的表達,根據Weidner法評估MVD,結果顯示,與正常卵巢組織相比,EOC組織中MVD的平均值顯著升高,差異有統計學意義(P<0.05),見表2及圖1。
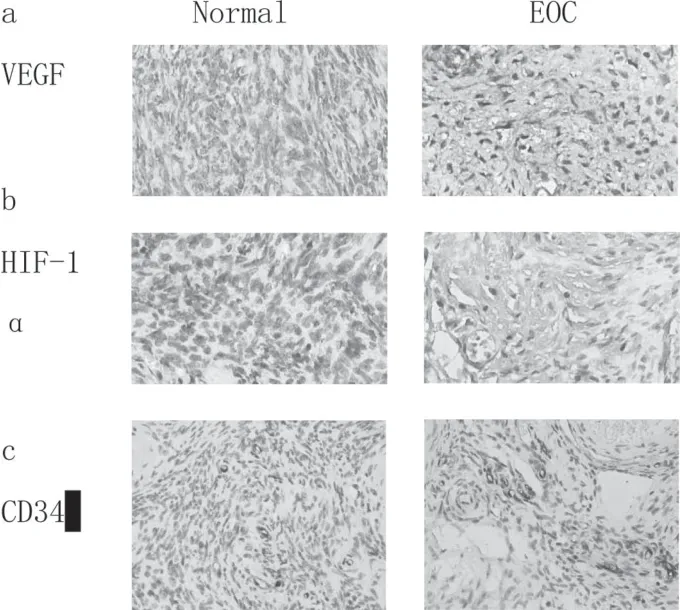
圖1 EOC及正常卵巢組中VEGF、HIF-1α、MVD的表達
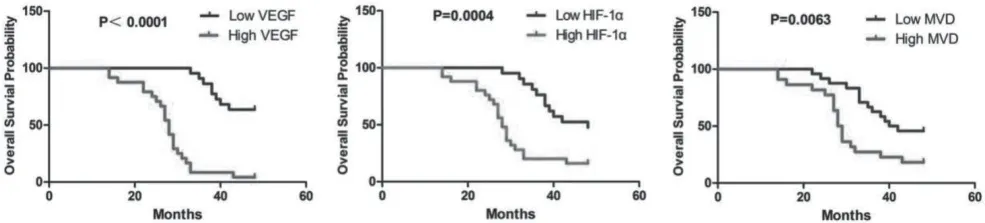
圖2 VEGF、HIF-1α、MVD的表達與OS的關系
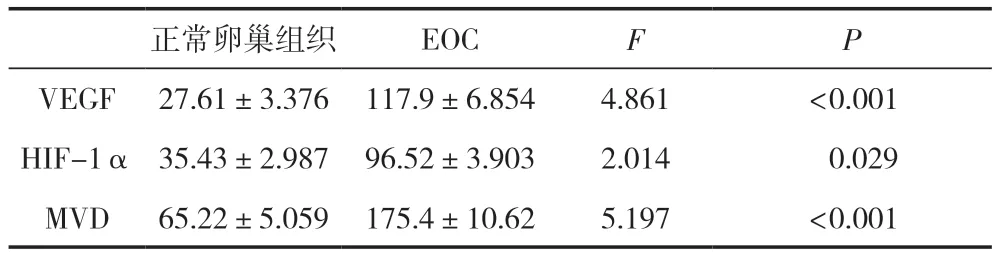
表2 EOC及正常卵巢組織中VEGF、HIF-1α、MVD的表達
VEGF、HIF-1α和CD34在正常卵巢組織和EOC腫瘤組織中的免疫組化染色結果(放大倍數:400X),a、b:VEGF和HIF-1α在EOC組織中的免疫組化染色度和百分比明顯高于正常卵巢組織,差異有統計學意義(P<0.05);c:與正常卵巢組織相比,EOC組織中MVD的平均值顯著升高,差異有統計學意義(P<0.05)。
2.3 VEGF、HIF-1α、MVD的表達與OS的關系
根據VEGF和HIF-1α表達的免疫組化評分,將46例EOC患者分為高分組和低分組進行Kaplan-Meier生存分析。結果顯示,VEGF、HIF-1α、MVD高分組患者的總體生存概率明顯低于低分組,差異有統計學意義(P<0.05)。隨訪結束時,VEGF低表達組有超過半數的患者仍然存活,因此不計算中位生存時間,而VEGF高表達組患者中位生存時間為28個月(HR=0.081,95%CI:0.035~0.186,P<0.001)。HIF-1α高表達組和低表達組中位生存時間分別為28個月和48個月(HR=0.259,95%CI:0.123~0.547,P<0.001)。MVD高表達組和低表達組中位生存時間分別為28.5個月和41個月(HR=0.347,95%CI:0.162~0.742,P=0.006)。
生存分析研究結果顯示,VEGF、HIF-1α、MVD的表達與EOC患者的預后明顯相關,高表達組預后更差。
3 討論
血管生成與腫瘤細胞的生長、侵襲和轉移有著密切的關系,顯著影響患者的預后,因此,在腫瘤治療的領域里,抗血管生成已成為不可或缺的手段之一。細胞黏附因子(Cell Adhesion Molecule,CAM)可以降低自然殺傷(Natural Killer cell,NK)細胞的毒性,有助于異位組織逃避機體的免疫攻擊,從而促進血管生成。血管內皮細胞參與機體的免疫活動,血管生成因子可以通過提高內皮細胞的遷移和增殖能力促進血管生成,抑制該過程可以使腫瘤細胞的遷移和侵襲能力明顯降低。
VEGF主要集中在腫瘤血管周圍分泌,反應較正常血管更高,表明VEGF在腫瘤血管的生成過程中發揮著重要作用。多數腫瘤細胞VEGF均高水平表達,且與腫瘤的惡性程度呈正相關。人黑色素瘤細胞經VEGF基因轉染后,可分泌大量的VEGF,腫瘤血管生成的數目和結構均隨之發生了正性變化[8]。另有研究顯示,血管生成能力隨著上皮性卵巢惡性程度的進展而逐漸增強[9]。缺氧可以明顯調控VEGF的生成,直徑大于2 mm的實體腫瘤會因缺氧導致壞死,因此,為獲取血液供應需要誘導新的血管生成[2-5]。Peer等[10]進行的細胞試驗表明,VEGF的表達水平在缺氧條件下異常升高。另有研究發現,VEGF基因啟動子區域存在HIF-1結合位點[11]。此外,VEGF還受如白細胞介素-8(IL-8)、表皮生長因子(Epidermal Growth Factor,EGF)、轉化生長因子(Transforming Growth Factor,TGF)、粒細胞巨噬細胞集落刺激因子(GMCSF)等非血管特異性生長因子的調控。有研究表明,在缺氧發生時,HIF-1可結合VEGF轉錄起始點上的缺氧增強子序列,從而啟動或增強該基因的轉錄[12]。
血管生成擬態(Vasculogenic Mimicry,VM)是一種全新的腫瘤微循環模式,該血管生成模式不依賴機體細胞,是經典血管生成理論的重要補充[13]。缺氧環境下VEGF環境濃度升高,誘導VEGF表達的能力提高,從而加速了卵巢癌的惡性進程。化療耐藥的原因之一在于腫瘤細胞在缺氧環境下,為適應微環境的改變, HIF表達水平升高,從而激活腫瘤細胞,使之繼續增殖,細胞凋亡水平下降,從而促進血管新生[14-17]。當前的研究熱點是檢測腫瘤組織中VEGF和HIF-1α的表達率,以幫助早期診斷卵巢癌并且預測其侵襲性[3]。
本研究結果證實,EOC組織中VEGF和HIF-1α的免疫組化染色強度和百分比明顯高于正常卵巢組織,且EOC組織中MVD的平均值顯著升高,而VEGF、HIF-1α、MVD高表達組的EOC患者預后明顯更差,表明缺氧微環境在腫瘤血管生成過程中扮演著重要角色。體內外研究結果表明,缺氧是決定微環境組成的共同因素,可加快腫瘤進展,低氧環境下細胞因子和細胞合作促進癌癥的發展和轉移,因此,減輕腫瘤微環境缺氧的新方法為卵巢癌免疫治療策略帶來了希望[3,18-19]。
基于缺氧微環境在腫瘤發生發展中的重要作用,以及血管生成在腫瘤侵襲和轉移中的重要地位,針對HIF-1α的靶向治療研究已成為目前的熱點問題,例如利用缺氧微環境研發抗腫瘤藥物等。隨著腫瘤分子生物學的研究進展,VEGF以及HIF-1α等腫瘤生長依賴的因子成為腫瘤治療的新靶點,腫瘤晚期患者的預后有望通過分子免疫學治療得到改善。

