寧波市某醫院支氣管擴張癥患者合并銅綠假單胞菌感染的流行病學分析
屠金晶,張亮,陳益女,董肖琦,徐曙光,湯耀東
支氣管擴張癥典型的癥狀有慢性咳嗽、咳大量膿痰和反復咯血,可導致呼吸功能障礙及慢性肺源性心臟病[1]。在我國是一種非常普遍的慢性呼吸道疾病,但卻遠不及支氣管哮喘和慢阻肺一樣受到重視。廣泛性支氣管擴張可嚴重損害患者肺組織和功能、影響患者的生活質量,造成巨大的社會經濟負擔,是當前我國基層醫院面臨的嚴重挑戰。
銅綠假單胞菌(PA)是導致支氣管擴張癥患者急性或慢性感染的主要病原體之一[2]。現有研究表明PA 感染與支氣管擴張癥的嚴重程度及病情進展密切相關。然而,針對支氣管擴張癥患者合并PA 感染的治療研究非常有限。目前,多重耐藥和廣泛耐藥PA的檢出率呈逐年上升趨勢,給臨床治療帶來了嚴重威脅[3]。近年研究發現難治性PA 感染患者的校正死亡率高于碳青霉烯類耐藥PA[4]。本研究分析2022年寧波市醫療中心李惠利醫院分離的支氣管擴張癥患者PA 感染的分子流行病學特征,以期為PA 感染患者提供合理的抗菌藥物使用依據。
1 資料與方法
1.1 菌株來源 納入本院2022 年1—12 月臨床分離的38 株PA,排除同一患者重復菌株。質控菌株為銅綠假單胞菌ATCC27853。
1.2 PA 的菌種鑒定 將上述臨床分離菌株接種于MHA 培養基,37 ℃過夜培養。挑取單菌落涂布于MSP 96 target polished steel BC 板的靶點上,涂布應輕薄均勻。吸取1l 基質溶液分別加至各個靶點,應注意各個靶點溶液不要相連,室溫下自然晾干。將BC 板放入基質輔助激光解吸電離飛行時間質譜儀(MALDI-TOF MS)中,運行程序并記錄結果。
1.3 藥敏實驗 使用瓊脂稀釋法測定11 種抗菌藥物的最低抑菌濃度(MIC),包括哌拉西林/他唑巴坦、頭孢他啶、頭胞吡肟、氨曲南、亞胺培南、美羅培南、慶大霉素、阿米卡星、妥布霉素、環丙沙星和磷霉素。多黏菌素B 使用肉湯稀釋法測定MIC。折點解讀參考美國CLSI 標準[5]。當頭孢他啶≥32 mg/L、氨曲南≥32 g/L、哌拉西林/他唑巴坦≥128/4 mg/L、碳青霉烯類(亞胺培南或美羅培南)≥8 mg/L 和環丙沙星≥2 mg/L 時定義為難治性PA[4]。
1.4 全基因組測序及生信分析 采用第二代測序技術的建庫測序,經電泳檢測合格的DNA 樣品用Covaris 超聲波破碎儀隨機打斷成長度約為350 bp 的片段。處理完成后的DNA 片段,使用NEBNext?Ultra?DNA Library Prep Kit for Illumina(NEB,USA)試劑盒,經末端修復、加A 尾、加測序接頭、純化、PCR 擴增等步驟完成整個文庫制備。文庫構建完成后,先使用Qubit 2.0 進行初步定量,稀釋文庫至2 ng/l,隨后使用Agilent 2100 對文庫的插入片段進行檢測,insert size 符合預期后,使用Q-PCR 方法對文庫的有效濃度進行準確定量,最后進行PE150的上機測序,數據量1G,實現平均測序深度100×以上。38 株菌使用Illumina Nova-seq 6000 平臺(諾禾致源生物信息科技有限公司,中國北京)進行全基因組測序。耐藥基因和多位點序列分型(MLST)使用ResFinder v3.0 在線比對(http://www.genomicepidemiology.org)。
2 結果
2.1 納入患者基本信息 38 例中,男27 例,女11例;年齡為(69.0±14.0)歲。分別來源于ICU(13 株)、呼吸內科(10 株)、神經外科(10 株)、感染病科(2例)、肝膽胰外科(2 例)和胃腸外科(1 例)。
2.2 藥敏結果 38 株PA中對阿米卡星和妥布霉素敏感率為97.4%,所有菌株對多黏菌素B敏感,亞胺培南和美羅培南的耐藥率分別為84.2%和57.9%。38 株PA 中有17 株為難治性PA,見表1。

表1 12 種抗菌藥物的藥敏結果
2.3 MLST分型及耐藥基因分析 38 株PA中主要的ST 型為ST277(7/38,18.4%)、ST 1076(5/38,13.2%)和ST 3012(5/38、13.2%)(圖1)。所有ST1076、ST1623 和ST3012 菌株均為難治性PA。此外,所有分離菌株中均檢測到耐藥基因blaPAO、aph(3’)-IIb 和catB7。12 株(31.8%)攜帶aph(3’)-IIb基因的菌株仍對慶大霉素敏感。值得注意的是5 株ST 1076 均攜帶blaOXA-395和blaKPC-3,從而介導泛耐藥。
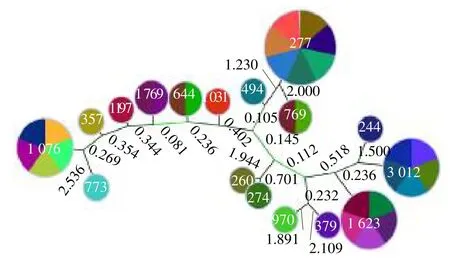
圖1 38 株銅綠假單胞菌的MLST 分型分析
3 討論
目前我國沒有支氣管擴張患病率的流行病學詳細資料,但隨著胸部高分辨率CT等檢查手段大范圍開展,支氣管擴張癥其實并非少見病。研究顯示,臨床診斷為慢性支氣管炎或慢性阻塞性肺病的患者中,15%~30%的患者可發現支氣管擴張,重度慢性阻塞性肺病患者合并支氣管擴張的甚至可達50%[5-6]。PA是支氣管擴張癥中檢出率最高的致病菌檢出率為18.5%~73.5%,也是我國支氣管擴張癥急性加重期檢出率最高的病原菌[7-8]。現有研究認為細菌定植、炎癥刺激和肺組織破壞是支氣管擴張的重要發病機制[9-11]。多項研究顯示,慢性呼吸道感染可導致支氣管擴張患者頻繁急性加重及生活質量下降[12-14],PA定植也是引起成人支氣管擴張癥的重要危險因素。研究顯示,PA感染是支氣管擴張患者急性加重的重要危險因素,根除PA 可以改善患者的預后[15-17]。
Shortridge 等[3]研究指出血流感染中難治性PA的感染率為2.3%。本研究中,有44.7%(17/38)的分離菌株為難治性PA,比文獻報道的高,可能和本研究所有分離菌株來自痰液有關。Shortridge 等[3]證實肺部感染患者(27.7%)中多重耐藥PA的分離率高于血流感染(23.7%),但慶幸的是97.4%的PA 對阿米卡星和妥布霉素敏感,且所有菌株對多黏菌素B 敏感,從而避免了無藥可選的困境。
支氣管擴張患者的預后還跟其感染的PA 耐藥性和毒力機制有重要關聯。為了使初始抗菌藥物能覆蓋可能的病原菌,尤其是耐藥PA,臨床可能會增加應用廣譜抗菌藥物或者聯合應用抗菌藥物的頻率,導致多重耐藥菌(MDRO)的出現[18-19]。碳青霉烯類抗生素是治療PA感染的關鍵藥物,但由于此類藥物的不合理使用,導致近年臨床上出現越來越多的耐碳青霉烯銅綠假單胞菌(CRPA),對支氣管擴張患者的治療提出重大挑戰。從全球來看,PA 對碳青霉烯類抗生素的耐藥情況差異較大。美國耐藥監測表明,2005—2014 年PA 對碳青霉烯類抗生素的耐藥率平均為8.71%[20];2004—2014 年拉丁美洲耐藥率也高達66%;歐洲地區的平均耐藥率則在14.5%以上;2010 年亞太地區PA 對美羅培南和亞胺培南的耐藥率分別是21.6%和27.7%[21];我國耐藥監測系統顯示,2015 年PA 對碳青霉烯類抗生素的平均耐藥率為22.4%,其中最低地區的耐藥率廣西壯族自治區為12.6%,而最高地區北京市的耐藥率32.7%。2013 年CHINET 細菌耐藥監測表明PA 對美羅培南和亞胺培南的耐藥率分別為25.1%和27.1%。本文在相關支氣管擴張患者中均檢測到了CRPA,突顯了本院支氣管擴張患者已面臨CRPA 的威脅。
現有PA 的耐藥機制包括外排泵、生物膜形成、抗菌藥物滅活酶、靶突變和通過水平基因轉移獲得耐藥基因[8-9]。本研究中,所有分離株均攜帶blaPAO、aph(3’)-IIb 和catB7,這3 個耐藥基因也常見于碳青霉烯類耐藥銅綠假單胞菌[10]。aph(3’)-IIb 基因表達產物是一種與氨基糖苷類抗菌藥物有交叉反應性的代謝酶[11],然而12 株攜帶aph(3’)-IIb基因的菌株對慶大霉素敏感,提示可能存在其他調控機制介導氨基糖胺類耐藥的發生。前期有研究指出銅綠假單胞菌存在克隆傳播,特別是ST175、ST235 和ST111可介導多重耐藥流行,且患者預后更差[12]。本研究中有5 株ST1076 均攜帶blaOXA-395和blaKPC-3,且分布在ICU 和神經外科。通常blaKPC-3基因常位于質粒上,推測ST1076 型菌株可能更容易捕獲攜帶blaKPC-3基因的質粒。
本研究仍有一定的局限性。首先樣本的數量有限,未進一步針對難治性PA 進行分層研究。其次未進行菌株毒力相關研究。未來需要進一步針對不同感染部位和耐藥機制的難治性PA 進行深入研究。
綜上所述,本院支氣管擴張癥患者合并PA感染呈散發流行,但難治性PA 的分離率較高,其中ST1076 需要引起臨床重視,加強監測,并采取有效措施防止該類菌的感染及傳播。
利益沖突所有作者聲明無利益沖突

