CircYPEL2通過miR-498/MSMO1軸調節宮頸癌細胞的放射敏感性
王 靜,易宣洪,汪 萍,黃曉智,熊 偉
(唐山市人民醫院,河北 唐山 063000)
宮頸癌是原發于子宮頸部位的女性惡性腫瘤,早期癥狀不明顯,導致多數患者因病情進展到晚期才發現,從而預后很差,該病是造成女性癌癥死亡的重要原因。放療是晚期宮頸癌的標準治療方法之一,但放療過程中產生的放射線抵抗性可嚴重限制其療效,因此增強宮頸癌細胞的放射敏感性是改善宮頸癌患者預后的關鍵[1-3]。環狀RNA表達失調是宮頸癌的主要發病機制之一[4],其中環狀RNA yippee樣2(circular RNA yippee-like 2,CircYPEL2)在宮頸癌組織中呈現顯著的高表達,CircYPEL2的敲除可導致宮頸癌細胞增殖、遷移和侵襲活力降低[5],因此CircYPEL2可稱為宮頸癌的潛在臨床治療靶點。環狀RNA調節癌癥發生及進展的機制之一是與包括miR-498在內的微小RNA結合并調控其表達[4,6],miR-498作為一種抗癌因子,在食管癌、胃癌、宮頸癌等多種癌組織中表達降低,預示患者預后不良,上調其表達可抑制胃癌和宮頸癌細胞增殖[7-8],并增強食管癌細胞的放射敏感性[9]。甲基甾醇單加氧酶1(methyl sterol monooxygenase 1,MSMO1)是一種獨特的腫瘤生物標志物,在食管癌、宮頸癌等各種癌癥的惡性進展中起著重要作用,可顯著增強食管癌細胞增殖、侵襲和遷移[10],在宮頸鱗狀細胞癌腫瘤組織中高表達并與其CD4+T細胞、巨噬細胞、嗜中性粒細胞浸潤水平呈顯著負相關[11],另外查詢Starbase數據庫可知CircYPEL2與miR-498之間及miR-498與MSMO1之間有結合位點,因此推測CircYPEL2可能通過miR-498/MSMO1軸調節宮頸癌細胞的放射敏感性。本研究通過建立人宮頸癌放射線抵抗細胞株C33A-RR,對此推測進行驗證。
1 材料與方法
1.1 試劑與材料
人宮頸癌細胞株C33A、MEM完全培養基(含10%胎牛血清)購于南京科佰生物科技有限公司;CCK-8試劑盒、兔源抗人β-actin一抗、Hoechst 33258染色染料溶液(ab228550)、兔源抗人Anti-天冬氨酸特異性半胱氨酸蛋白酶3(cysteine-containing aspartate-specific proteases 3,caspase-3)一抗、辣根過氧化物酶標記山羊抗兔IgG二抗、兔源抗人Anti-B淋巴細胞瘤-2(B-cell lymphoma-2,Bcl-2)一抗均購于美國Abcam公司;野生型miR-498報告質粒、CircYPEL2過表達質粒、突變型miR-498報告質粒、野生型MSMO1 3’-UTR報告質粒、突變型MSMO1 3’-UTR報告質粒、miR-498 mimics、miR-498 mimics陰性對照、miR-498 inhibitor、miR-498 inhibitor陰性對照組、CircYPEL2 siRNA質粒、CircYPEL2空載質粒、miR-498及CircYPEL2、MSMO1、β-actin、U6引物購于上海吉瑪制藥技術有限公司;Trizol(總RNA提取試劑)、結晶紫染色液、脂質體2000、雙熒光素酶報告基因檢測試劑盒購于北京索萊寶科技有限公司;FITC/PI雙染法Annexin V凋亡檢測試劑盒、一步法反轉錄熒光定量試劑盒購買于上海生工生物工程股份有限公司;兔抗人Anti-MSMO1抗體購于上海士鋒生物科技有限公司;兔源抗人Anti-Bcl-2相關X蛋白(Bcl2-associated X protein,Bax)抗體、兔源抗人Anti-細胞周期蛋白 D1(cyclin D1,CCND1)抗體、兔源抗人Anti-增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)抗體購于上海碧云天生物技術有限公司等。
1.2 主要儀器
電子直線加速器購于美國Varian公司,熒光定量PCR儀購于濟南好來寶醫療器材有限公司,轉印模塊、電泳系統、全波長酶標儀、流式細胞儀購買于賽默飛世爾科技(中國)有限公司,生物光學顯微鏡購于南京新睿之鴻光學儀器有限公司,研究級倒置熒光顯微鏡購于廣州市明美光電技術有限公司。
1.3 方法
1.3.1 實時熒光定量PCR和免疫印跡法檢測人宮頸癌細胞株C33A和其放射線抵抗細胞株C33A-RR中CircYPEL2、miR-498、MSMO1表達
人宮頸癌放射線抵抗細胞C33A-RR的建立:人宮頸癌細胞系C33A在39℃溫水浴中解凍后以MEM完全培養基復蘇培養,傳代后以電子直線加速器對其以6Gy射線進行放射治療[12],24h后以新鮮MEM完全培養基洗去死亡細胞并繼續培養剩余細胞,然后重新放射治療后重復操作,如此培養細胞30d后即可獲得穩定生長的人宮頸癌放射線抵抗細胞株C33A-RR。
取傳代的C33A和C33A-RR細胞加入Trizol混勻后,按照其說明書方法指導提出其中總RNA,然后測量其濃度后以一步法反轉錄熒光定量試劑盒進行PCR擴增后獲得各基因Ct值,具體反應體系的配制和反應條件的設定按照試劑盒說明書進行,以β-actin作為CircYPEL2、MSMO1的內參,以U6作為miR-498的內參,采用算法2-ΔΔCt分析各組基因Ct值得到其相對表達,引物序列見表1。
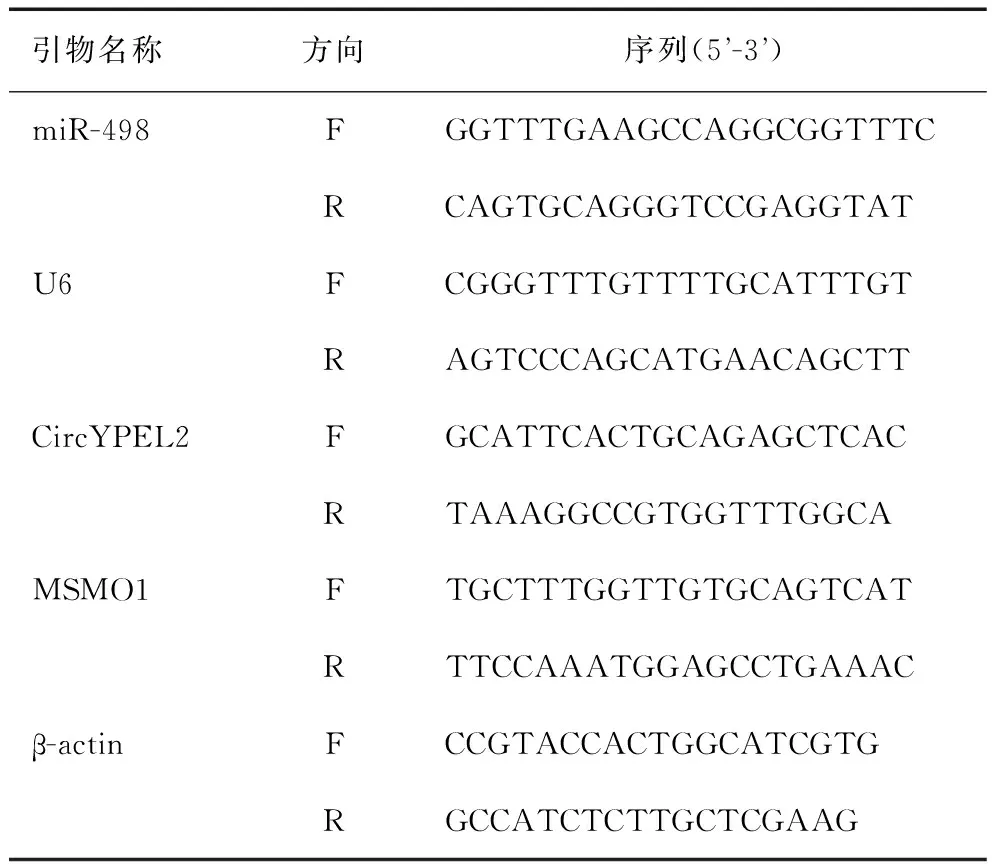
表1 基因引物序列Table 1 Sequences of gene’s primers
取傳代的C33A和C33A-RR細胞加入RIPA裂解液混勻,按照說明書提出其中總蛋白后以BCA法測量其濃度,每種細胞取15μg總蛋白100℃變性后通過跑電泳進行分離,然后以120V恒壓進行電轉使蛋白移至硝酸纖維素膜上,將MSMO1、β-actin蛋白自膜上裁下,孵育兔源抗人MSMO1、β-actin一抗和辣根過氧化物酶標記山羊抗兔IgG二抗,洗膜后化學發光法顯色各組蛋白條帶,攝取其圖像后以Image J軟件定量分析各組蛋白相對表達。
1.3.2 分組處理C33A-RR細胞后收集標本
取傳代的C33A-RR細胞以每孔1.5×105個的密度接種在12孔板,無菌培養36h,再隨機分為對照組、放射組、放射+陰性對照組、放射+CircYPEL2敲低組、放射+CircYPEL2敲低+miR-498 inhibitor組。對照組不做任何處理,放射組細胞以6Gy的射線進行放射治療,放射+陰性對照組細胞以6Gy的射線進行放射治療同時采用脂質體2000轉染miR-498 inhibitor陰性對照和空載質粒,放射+CircYPEL2敲低組細胞以6Gy的射線進行放射治療同時采用脂質體2000轉染CircYPEL2 siRNA質粒,放射+CircYPEL2敲低+miR-498 inhibitor組細胞以6Gy的射線進行放射治療同時采用脂質體2000轉染CircYPEL2 siRNA質粒和miR-498 inhibitor,各組細胞都在放射治療及轉染24h后收集其細胞沉淀作為標本備用。
1.3.3 實時熒光定量PCR和免疫印跡法檢測各組C33A-RR細胞中CircYPEL2、miR-498、MSMO1表達
提取1.3.2中收集的各組細胞中總RNA和總蛋白后進行實時熒光定量PCR和免疫印跡實驗,檢測出各組C33A-RR細胞中miR-498與CircYPEL2相對表達、MSMO1 mRNA及蛋白相對表達,具體方法見1.3.1。
1.3.4 CCK-8和平板集落形成實驗檢測各組C33A-RR細胞增殖
CCK-8法:取傳代的C33A-RR細胞以每孔1×104個的密度接種在96孔板中無菌培養36h后,以1.3.2的方法分組處理24h后,采用CCK-8試劑盒按照其說明書指導檢測各組細胞吸光值后算出各組細胞增殖率,公式為:細胞增殖率=實驗組吸光值/對照組吸光值×100%。
平板集落形成實驗:取傳代的C33A-RR細胞以每孔50個的密度接種在24孔板中無菌培養36h后,以1.3.2中方法分組處理24h后,以新鮮MEM完全培養基繼續培養3周后即發現各組細胞形成集落,漂洗、固定后采用結晶紫染色液按照說明書指導染色,采用生物光學顯微鏡觀察著色后的各組細胞集落并攝取圖片,以Image J軟件分析定量各組細胞集落數目后計算集落生成率,公式為:集落生成率=實驗組細胞集落數目/對照組細胞集落數目×100%。
1.3.5 Hoechst 33258染色和流式細胞實驗檢測各組C33A-RR細胞凋亡
Hoechst 33258染色:取傳代的C33A-RR細胞以每孔1.5×105個的密度接種在12孔板中無菌培養36h后,以1.3.2中方法分組處理24h后,漂洗、固定后采用Hoechst 33258染色染料溶液按照說明書指導染色,倒置熒光顯微鏡觀察著色后的各組細胞并攝取其圖片,以Image J軟件分析定量各組細胞總數目和凋亡細胞數目后算出凋亡細胞比例(正常細胞:圓潤并呈微弱藍色;凋亡細胞:固縮破碎并呈明亮藍色)。公式為:凋亡細胞比例=凋亡細胞數目/細胞總數目×100%。
流式細胞實驗:取傳代的C33A-RR細胞以每孔1.5×105個的密度接種在12孔板中無菌培養36h后,以1.3.2中方法分組處理24h后,收集各組細胞沉淀后清洗、計數,每組取5×105個細胞采用FITC/PI雙染法Annexin V凋亡檢測試劑盒按照說明書檢測每組細胞凋亡率。
1.3.6 免疫印跡實驗檢測各組C33A-RR細胞增殖及凋亡蛋白表達
提取1.3.2中收集的各組細胞總蛋白后進行免疫印跡實驗,檢測出各組C33A-RR細胞中PCNA、CCND1、Bcl-2、Bax、caspase-3相對表達,具體方法見1.3.1。
1.3.7 檢測C33A-RR細胞中CircYPEL2對miR-498及miR-498對MSMO1的靶向調控
取傳代的C33A-RR細胞以每孔1.5×105個的密度接種在12孔板中無菌培養36h后,隨機分為miR-498突變+CircYPEL2空載組(轉染突變型miR-498報告質粒+空載質粒)、miR-498突變+CircYPEL2過表達組(轉染突變型miR-498報告質粒+CircYPEL2過表達質粒)、miR-498野生+CircYPEL2空載組(轉染野生型miR-498報告質粒+空載質粒)、miR-498野生+CircYPEL2過表達組(轉染野生型miR-498報告質粒+CircYPEL2過表達質粒)、MSMO1突變+miR-498 mimics陰性對照組(轉染突變型MSMO1 3’-UTR報告質粒+miR-498 mimics陰性對照)、MSMO1突變+miR-498 mimics組(轉染突變型MSMO1 3’-UTR報告質粒+miR-498 mimics)、MSMO1野生+miR-498 mimics陰性對照組(轉染野生型MSMO1 3’-UTR報告質粒+miR-498 mimics陰性對照)、MSMO1野生+miR-498 mimics組(轉染野生型MSMO1 3’-UTR報告質粒+miR-498 mimics),采用脂質體2000按照說明書分組轉染,24h后采用雙熒光素酶報告基因檢測試劑盒檢測各組細胞雙熒光素酶相對活性值。
1.4 統計學方法

2 結果
2.1 CircYPEL2、miR-498、MSMO1在C33A及C33A-RR中的表達
與C33A細胞相比,C33A-RR細胞中CircYPEL2表達、MSMO1 mRNA與蛋白表達均升高(P<0.05),miR-498表達降低(P<0.05),見表2、圖1。

圖1 免疫印跡檢測C33A及C33A-RR細胞 MSMO1表達Fig.1 Expressions of MSMO1 in C33A cells and C33A-RR cells by immunoblotting detection
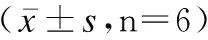
表2 C33A細胞、C33A-RR細胞的miR-498與CircYPEL2、MSMO1 mRNA及MSMO1表達水平Table 2 Expression levels of miR-498,CircYPEL2 and MSMO1 mRNA in C33A cells and C33A-RR cells
2.2 各組C33A-RR細胞CircYPEL2與miR-498、MSMO1表達檢測結果
各組的CircYPEL2、miR-498、MSMO1 mRNA、MSMO1蛋白表達比較差異均有統計學意義(P<0.05)。與對照組相比,放射+CircYPEL2敲低組細胞CircYPEL2、MSMO1 mRNA與MSMO1蛋白表達均降低(P<0.05),miR-498表達升高(P<0.05);與放射組相比,放射+CircYPEL2敲低組細胞CircYPEL2、MSMO1 mRNA與MSMO1蛋白表達均降低(P<0.05),miR-498表達升高(P<0.05);與放射+CircYPEL2敲低組相比,放射+CircYPEL2敲低+miR-498 inhibitor組細胞的CircYPEL2表達無明顯變化(P>0.05),miR-498表達降低(P<0.05),MSMO1 mRNA與蛋白表達均升高(P<0.05),見表3、圖2。
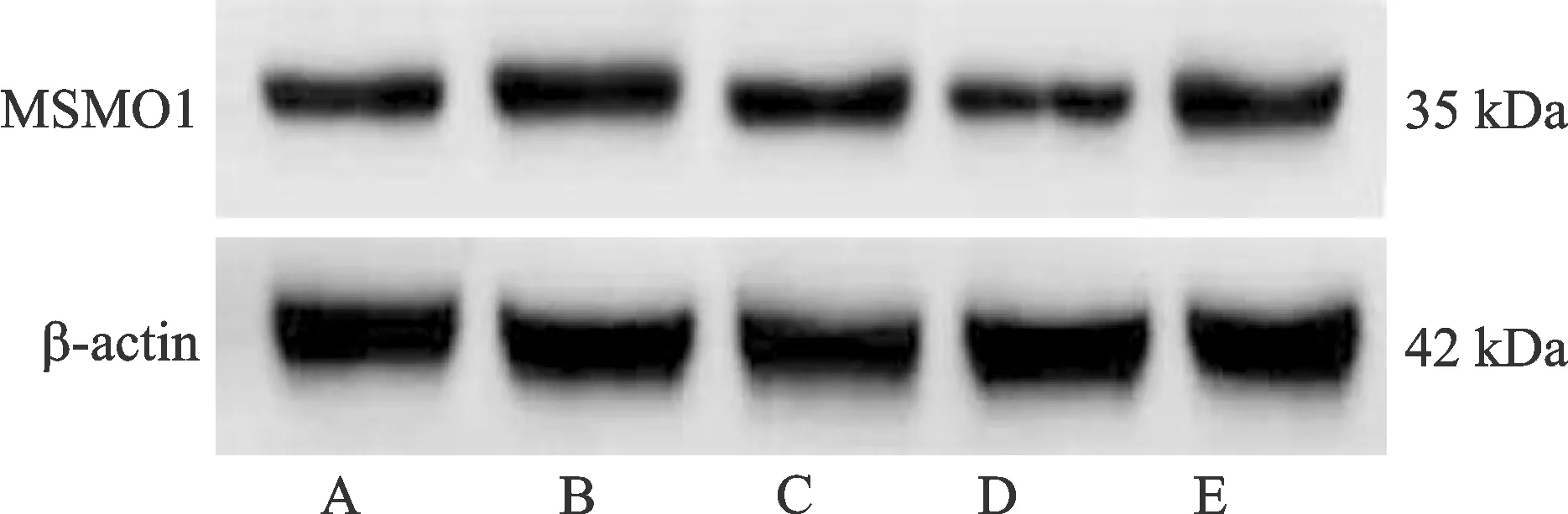
注:A.對照組;B.放射組;C.放射+陰性對照組;D.放射+CircYPEL2敲低組;E.放射+CircYPEL2敲低+miR-498 inhibitor組。圖2 免疫印跡法檢測各組C33A-RR細胞MSMO1表達Fig.2 Expression of MSMO1 in C33A-RR cells detected by immunoblotting method
表3 各組C33A-RR細胞miR-498、CircYPEL2、MSMO1 mRNA與MSMO1蛋白相對表達水平Table 3 Relative expression levels of miR-498,CircYPEL2,MSMO1 mRNA and it’s proteins in C33A-RR cells in the five groups
2.3 各組C33A-RR細胞增殖檢測結果
各組細胞增殖率與集落生成率比較差異有統計學意義(P<0.05)。與對照組相比,放射+CircYPEL2敲低組的細胞增殖率、集落生成率均降低(P<0.05);與放射組相比,放射+CircYPEL2敲低組的細胞增殖率、集落生成率均降低(P<0.05);與放射+CircYPEL2敲低組相比,放射+CircYPEL2敲低+miR-498 inhibitor組的細胞增殖率、集落生成率均升高(P<0.05),見表4、圖3。
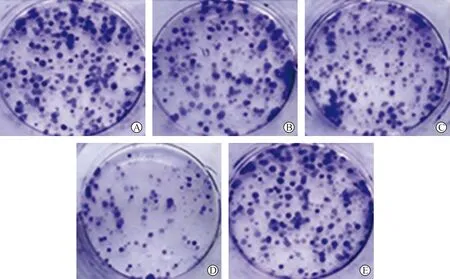
注:A.對照組;B.放射組;C.放射+陰性對照組;D.放射+CircYPEL2敲低組;E.放射+CircYPEL2敲低+miR-498 inhibitor組。圖3 結晶紫染色檢測各組C33A-RR細胞集落生成Fig.3 C33A-RR cell colony formation in the five groups detected by crystal violet staining method
2.4 各組C33A-RR細胞凋亡檢測結果
各組凋亡細胞比例與細胞凋亡率比較差異有統計學意義(P<0.05)。與對照組相比,放射+CircYPEL2敲低組的凋亡細胞比例與細胞凋亡率均升高(P<0.05);與放射組相比,放射+CircYPEL2敲低組的凋亡細胞比例與細胞凋亡率均升高(P<0.05);與放射+CircYPEL2敲低組相比,放射+CircYPEL2敲低+miR-498 inhibitor組的凋亡細胞比例與細胞凋亡率均降低(P<0.05),見表5、圖4、圖5。

注:A.對照組;B.放射組;C.放射+陰性對照組;D.放射+CircYPEL2敲低組;E.放射+CircYPEL2敲低+miR-498 inhibitor組。圖4 Hoechst 33258染色檢測各組C33A-RR細胞凋亡Fig.4 C33A-RR cell apoptosis in the five groups detected by Hoechst 33258 staining method

注:A.對照組;B.放射組;C.放射+陰性對照組;D.放射+CircYPEL2敲低組;E.放射+CircYPEL2敲低+miR-498 inhibitor組。圖5 流式細胞實驗檢測各組C33A-RR細胞凋亡Fig.5 C33A-RR cell apoptosis in the five groups detected by flow cytometry
表5 各組C33A-RR凋亡細胞比例與細胞凋亡率比較Table 5 Comparison of proportion of apoptotic cells and apoptosis rate of C33A-RR cells among the five groups
2.5 各組C33A-RR細胞增殖與凋亡相關蛋白表達檢測結果
各組PCNA、CCND1、Bcl-2、Bax、caspase-3蛋白相對表達比較差異均有統計學意義(P<0.05)。與對照組相比,放射+CircYPEL2敲低組的細胞PCNA、CCND1、Bcl-2蛋白表達降低(P<0.05),Bax、caspase-3蛋白表達升高(P<0.05);與放射組相比,放射+CircYPEL2敲低組的細胞PCNA、CCND1、Bcl-2蛋白表達降低(P<0.05),Bax、caspase-3蛋白表達升高(P<0.05);與放射+CircYPEL2敲低組相比,放射+CircYPEL2敲低+miR-498 inhibitor組的細胞PCNA、CCND1、Bcl-2蛋白表達升高(P<0.05),Bax、caspase-3蛋白表達降低(P<0.05)。見表6、圖6。

注:A.對照組;B.放射組;C.放射+陰性對照組;D.放射+CircYPEL2敲低組;E.放射+CircYPEL2敲低+miR-498 inhibitor組。圖6 免疫印跡法檢測各組C33A-RR細胞PCNA、CCND1、Bcl-2、Bax、caspase-3的表達Fig.6 Expressions of PCNA,CCND1,Bcl-2,Bax, and caspase-3 in C33A-RR cells in the five groups detected by immunoblotting method
表6 各組細胞PCNA、CCND1、Bcl-2、Bax、caspase-3蛋白相對表達水平Table 6 Relative expression levels of PCNA,CCND1,Bcl-2,Bax and caspase-3 proteins in the five groups
2.6 C33A-RR細胞中CircYPEL2對miR-498的靶向調節及miR-498對MSMO1的靶向調節
在Starbase數據庫中查詢到CircYPEL2和miR-498之間的結合位點,見圖7。各組相對熒光素酶活性比較差異有統計學意義(P<0.05)。與miR-498野生+CircYPEL2空載組比較,miR-498野生+CircYPEL2過表達組的相對熒光素酶活性降低(P<0.05);miR-498突變+CircYPEL2空載組與miR-498突變+CircYPEL2過表達組之間的相對熒光素酶活性差異無統計學意義(P>0.05),見表7。

圖7 CircYPEL2和miR-498之間的結合位點Fig.7 Binding sites between CircYPEL2 and miR-498 found in the Starbase database
表7 各組C33A-RR細胞相對熒光素酶活性值Table 7 Relative luciferase activity of C33A-RR cells in the five groups
在Starbase數據庫中查詢到miR-498和MSMO1之間的結合位點,見圖8。各組相對熒光素酶活性比較差異有統計學意義(P<0.05)。與MSMO1野生+miR-498 mimics陰性對照組比較,MSMO1野生+miR-498 mimics組的相對熒光素酶活性降低(P<0.05);MSMO1突變+ miR-498 mimics陰性對照組與MSMO1突變+miR-498 mimics組之間相對熒光素酶活性差異無統計學意義(P>0.05),見表8。

圖8 miR-498和MSMO1之間的結合位點Fig.8 Binding sites between miR-498 and MSMO1 found in the Starbase database

表8 各組C33A-RR細胞相對熒光素酶活性值Table 8 Relative luciferase activity of C33A-RR cells in the five groups
3 討論
3.1 構建人宮頸癌放射線抵抗細胞株C33A-RR
宮頸癌的主要病因是高危型HPV持續感染、多伴侶性行為及多次分娩等,放療作為其臨床標準治療手段之一可有效殺傷癌細胞,抑制宮頸癌病情進展,但癌細胞放射敏感性會隨著放療次數增多而降低,極大影響了放療效果,因此探尋有效的放射敏感性增強方法在宮頸癌的臨床治療中意義重大[13-14]。本文以6Gy的射線誘導建立人宮頸癌放射線抵抗細胞株C33A-RR,結果顯示,與對照組相比,放射組細胞凋亡細胞比例、細胞凋亡率、細胞增殖率、集落生成率均無明顯變化,表明以6Gy的射線對C33A-RR細胞進行照射不影響其增殖及凋亡,提示人宮頸癌放射線抵抗細胞株C33A-RR建立成功。
3.2 敲低CircYPEL2表達可增強宮頸癌細胞放射敏感性
有研究顯示環狀RNA是調控宮頸癌發生及進展的關鍵因子[4,15],CircYPEL2作為具有明顯致癌活性的環形RNA在宮頸癌組織和細胞中表達顯著升高,可作為宮頸癌臨床研究的潛在生物標志物,敲除CircYPEL2可明顯抑制宮頸癌細胞增殖、遷移和侵襲[5],本文研究結果顯示,CircYPEL2在C33A-RR細胞中表達相比C33A細胞明顯升高,表明CircYPEL2參與介導宮頸癌的放射線抵抗過程;與放射組相比,放射+CircYPEL2敲低組細胞CircYPEL2表達、細胞增殖率、集落生成率、PCNA、CCND1、Bcl-2蛋白表達降低,凋亡細胞比例、細胞凋亡率、Bax及caspase-3蛋白表達升高,表明敲低CircYPEL2表達可增強放射敏感性,提高射線對宮頸癌的殺傷力,顯著抑制6Gy的射線照射的C33A-RR細胞增殖并促進其凋亡,揭示CircYPEL2是調控宮頸癌放射敏感性的重要靶點,對其敲除是提高宮頸癌患者放療效果的潛在手段。
3.3 CircYPEL2調節miR-498/MSMO1軸對宮頸癌細胞放射敏感性的作用
有研究顯示,環狀RNA是通過海綿作用下調miR-654-3p、miR-498等介導癌癥的發生發展[4,6,16],其中miR-498在食管癌、宮頸癌等腫瘤組織中顯著低表達,對其過表達可抑制食管癌進展[17],并可抑制宮頸癌細胞的增殖和侵襲[18],miR-498還可介導食管癌細胞放射線抵抗性的產生,增強其表達可促進放射線殺傷食管癌細胞[9];MSMO1作為一種致癌基因在宮頸鱗狀細胞癌腫瘤組織中表達明顯升高[11],可通過調控膽固醇生物合成促使胰腺癌細胞存活和化療敏感性減弱[19],敲除MSMO1可顯著降低三陰型乳腺癌細胞對紫杉醇耐藥性[20],查詢Starbase數據庫進行生物信息學分析可知CircYPEL2可能通過miR-498調控MSMO1表達,因此推測CircYPEL2可能通過調控miR-498/MSMO1軸影響宮頸癌細胞的放射敏感性。本研究結果顯示,MSMO1 mRNA與蛋白表達在C33A-RR細胞中相比C33A細胞明顯升高,但miR-498表達明顯降低,且雙熒光素酶報告基因實驗結果證實CircYPEL2可靶向下調C33A-RR細胞miR-498表達,而miR-498可靶向下調C33A-RR細胞MSMO1表達,表明CircYPEL2可通過調控miR-498/MSMO1軸介導宮頸癌細胞的放射敏感性;以CircYPEL2 siRNA質粒和miR-498 inhibitor聯合干預6Gy射線處理的C33A-RR細胞,相比CircYPEL2 siRNA質粒單獨處理,可升高細胞增殖率、集落生成率、PCNA及CCND1、Bcl-2蛋白表達,降低細胞凋亡率、凋亡細胞比例、Bax及caspase-3蛋白表達,表明下調miR-498可減弱CircYPEL2的敲低對宮頸癌放射敏感性的增強作用,拮抗其對6Gy射線照射的C33A-RR細胞的促凋亡和抗增殖作用,揭示敲低CircYPEL2增強宮頸癌細胞放射耐藥性是通過上調miR-498實現的。
綜上所述,CircYPEL2可通過靶向下調miR-498來抑制MSMO1表達,進而促使人宮頸癌細胞的放射抵抗性,敲低CircYPEL2可通過促進miR-498表達而下調MSMO1,從而提高宮頸癌細胞的放射敏感性,增強放射線對C33A-RR細胞的殺傷力,最終對其發揮抗增殖和促凋亡作用。本研究為闡釋宮頸癌放射敏感性的調控機制提供了新的科學資料,有利于宮頸癌放療效果的提高。

