基于生物信息學分析幽門螺桿菌感染與骨質疏松癥的相關性*
唐 楊,邵高海
(重慶醫科大學附屬永川醫院脊柱外科,重慶 402160)
幽門螺桿菌(HP)是一種革蘭陰性螺旋狀致病菌,可通過水解尿素產生二氧化碳和氨,從而中和胃酸,使HP長期定居于胃黏膜表面。長期的HP感染可引起慢性胃炎、消化性潰瘍和胃癌等疾病。HP有引起全身炎性反應的能力,與幾種胃外表現有關,包括內分泌疾病,如自身免疫性甲狀腺疾病、糖尿病、血脂異常和肥胖[1]。目前的流行病研究顯示,全球一半以上人口感染了HP,其中超過4億人有臨床癥狀[2],而我國的HP感染率在41.5%~72.3%[3],HP及其相關疾病對社會及經濟造成了巨大負擔。骨質疏松癥(OP)是以骨量減少、骨微結構破壞、骨強度下降、骨脆性增加、易發生骨折為特征的一種全身性、代謝性骨病[4]。OP可分為原發性和繼發性。導致原發性OP的原因包括絕經后雌激素水平降低、增齡造成骨重建失衡等,繼發性OP指由任何影響骨代謝的疾病和(或)藥物及其他明確病因導致的骨質疏松。最新的一項多中心橫斷面研究估計,在我國40歲或以上成年人中,男性OP發生率為5.0%,女性為20.6%[5]。OP的臨床表現為骨痛及骨質疏松性骨折,嚴重影響患者生活質量。HP感染和OP作為2種臨床上常見疾病可能有著密切關系.有研究認為,HP感染可誘發炎癥和免疫反應,如增加白細胞介素(IL)1和腫瘤壞死因子(TNF)-α水平[6],從而可能引發骨吸收并調節骨再生。OP的危險因素有年齡、性別、體重指數、飲酒和吸煙等[7]。有研究指出,HP感染也是OP的危險因素[8-9],但這一結論存在爭議[10-11]。因此,HP感染可能與OP密切相關,但二者關系尚不明確[12]。本研究主要通過生物信息學方法檢索獲得HP感染與OP的共同基因,構建疾病共同基因的蛋白互作(PPI)網絡并篩選出關鍵靶點基因,對關鍵基因進行基因本體論(GO)功能和京東基因與基因組百科全書(KEGG)通路富集分析,闡述HP感染與OP的共同發病機制,理解二者在疾病過程中的相關性,為相關治療藥物的研發提供理論參考。
1 資料與方法
1.1一般資料 在Disgenet、OMIM、TTD、GeneCards、Pharmgkb等基因數據庫中查找引起OP和HP感染的疾病基因,去重整合后獲得關鍵靶點。
1.2方法
1.2.1疾病靶點獲取 在Disgenet數據庫(https://www.disgenet.org/)、OMIM數據庫(https://omim.org/)、TTD數據庫(http://db.idrblab.net/ttd/)、GeneCards數據庫(https://www.genecards.org/)、Pharmgkb數據庫(https://www.pharmgkb.org/)中,以“helicobacter pylori”和“osteoporosis”為關鍵詞檢索HP感染及OP的疾病基因。在Disgenet、GeneCards數據庫中篩選獲得相關度較大的基因,將2組基因去重整合,通過在線網站Bioinformatics &Evolutionary Genomics(http://bioinformatics.psb.ugent.be/webtools/Venn/)取交集獲得韋恩圖,得到交集的共同靶點基因。
1.2.2PPI網絡分析與關鍵靶基因篩選 將獲得的HP感染與OP共同靶點基因導入STRING在線數據庫(https://cn.string-db.org/)構建PPI網絡,物種設置為“Homo sapiens”得到PPI網絡。使用Cytoscape_v3.9.1軟件優化PPI可視化網絡圖,并以度值大于或等于26篩選出PPI網絡中前10的關鍵靶點基因。
1.2.3基因富集分析 借助DAVID在線數據庫(https://david.ncifcrf.gov/)對HP感染與OP的共同靶點基因進行GO功能和KEGG通路富集分析,篩選并列出前10的關鍵信號通路。使用在線網站微生信(https://www.bioinformatics.com.cn/)繪制富集結果氣泡圖。
2 結 果
2.1HP感染與OP基因收集情況 通過檢索相關數據庫初步獲得HP感染相關基因2 572個,OP相關基因5 061個。在Disgenet數據庫中設置Score≥0.3進行篩選,最終獲得HP感染相關基因798個。在GeneCards數據庫中設置Relevance score≥10,在Disgenet數據庫中設置Score≥0.3進行篩選,最終獲得OP相關基因493個,HP感染相關基因798個,通過取交集后獲得69個HP感染與OP共同靶點基因。見圖1。
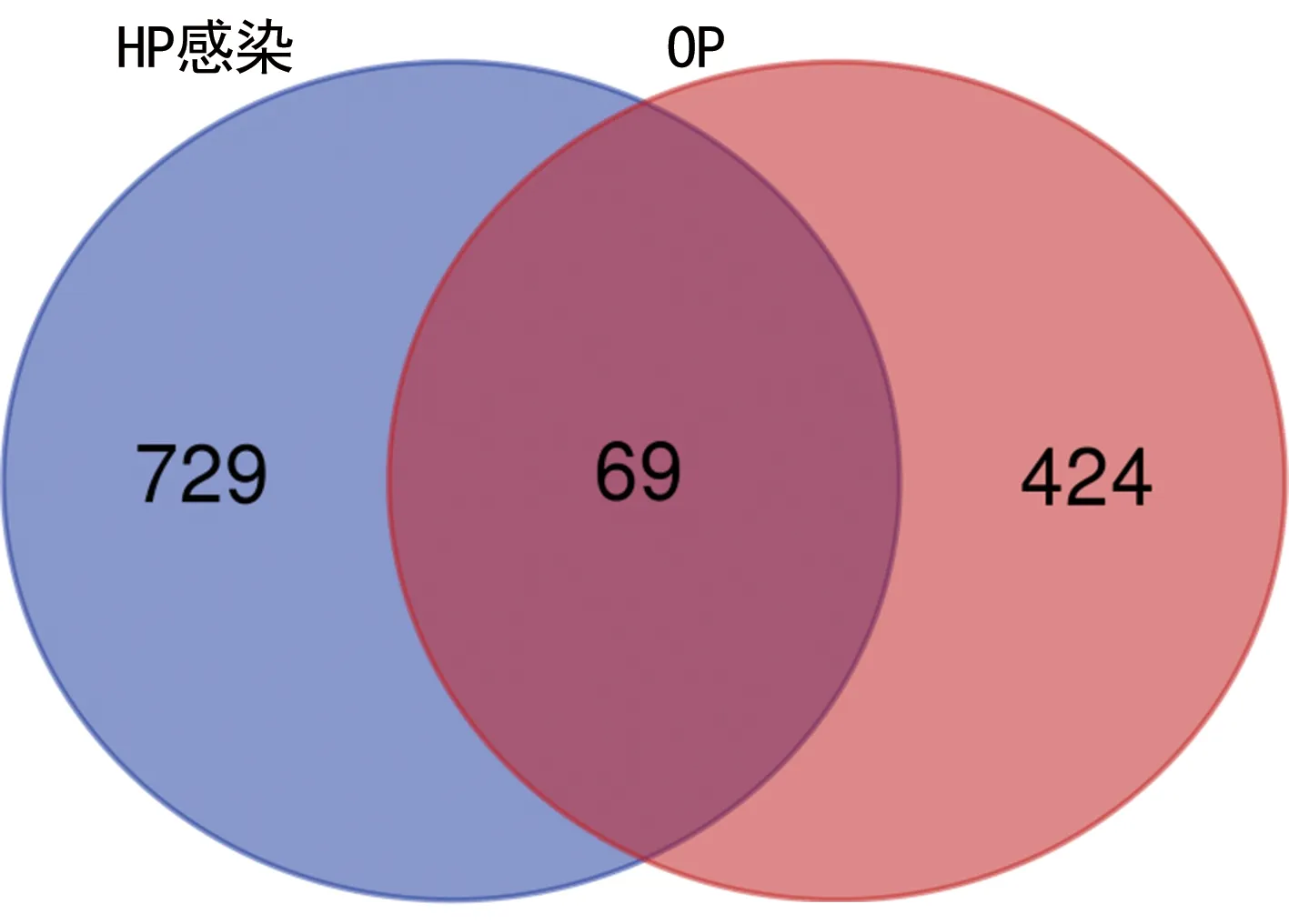
圖1 HP感染與OP共同靶點基因韋恩圖
2.2PPI網絡及關鍵靶點基因 通過STRING數據庫構建HP感染與OP共同靶點基因的PPI網絡,該網絡圖中包括66個節點和456條邊。見圖2。為確定HP感染與OP的關鍵靶點基因,利用Cytoscape_v3.9.1軟件篩選出PPI網絡中度值前10位的節點,包括絲氨酸/蘇氨酸蛋白激酶1(AKT1)、清蛋白(ALB)、CTNNB1、雌激素受體1(ESR1)、IL1B、IL6、瘦素(LEP)、基質金屬蛋白酶-9(MMP9)、MYC、TNF等。見圖3。

圖2 HP感染與OP共同靶點PPI網絡圖

圖3 HP感染與OP共同核心靶點PPI網絡圖
2.3GO功能和KEGG通路富集分析 將HP感染與OP共同靶點基因導入DAVID數據庫進行GO和KEGG富集分析。GO功能主要富集在序列特異性DNA結合轉錄因子活性的正向調節、Ⅰ-κB激酶/核因子κB信號傳導、IL-8合成的正向調節等方面。見表1、圖4。KEGG通路包括人巨細胞病毒感染、沙門菌感染等信號通路。見表2、圖5。

表2 KEGG通路富集分析(前10條)
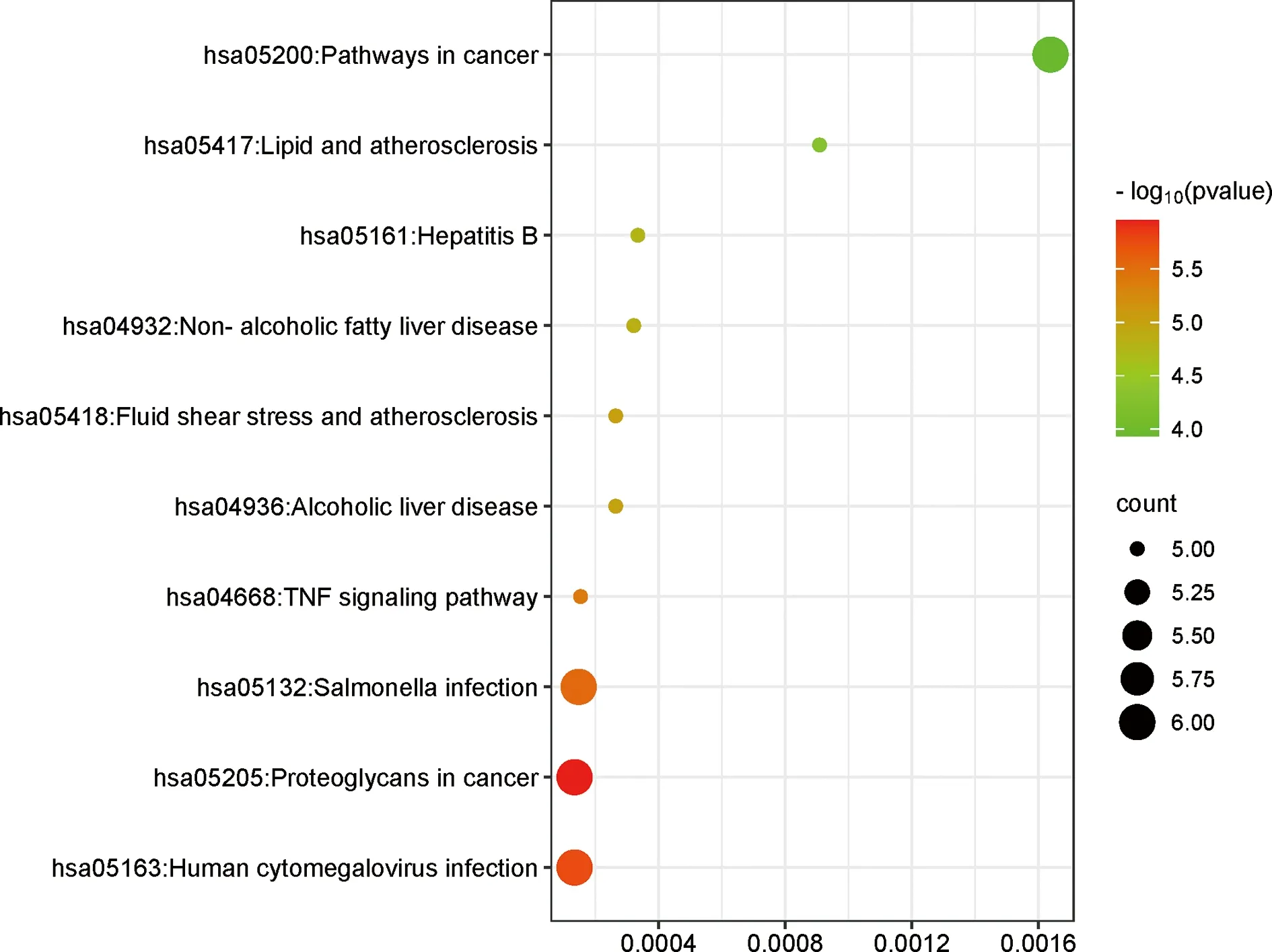
圖4 GO功能富集分析氣泡圖(前10條)

圖5 KEGG通路富集分析氣泡圖(前10條)
3 討 論
HP感染與OP作為2種常見的多發性疾病,其發病機制相對復雜,但在各自龐大的基因網絡中也有部分重合的基因信息。本研究應用生物信息學尋找龐大基因交叉部分,通過對核心靶點進行GO功能富集分析發現,HP感染與OP之間相互影響主要涉及以下生物過程:細胞凋亡過程的負向調節、神經膠質細胞增殖的正向調節、DNA模板化轉錄的正向調節、胰島素分泌調節、NO生物合成過程的正向調節等。同時,通過KEGG通路富集分析發現,HP感染與OP之間可涉及多條共同信號通路,主要涉及炎癥因子、感染、腫瘤代謝等方面。通過映射獲得OP與HP感染的核心交集靶點,AKT1、ALB、CTNNB1、ESR1、IL1B、IL6、LEP、MMP9、MYC、TNF等為影響二者的重要靶點。這些核心交集靶點是可以通過不同的作用機制來影響人體的HP感染和OP。有研究表明,可通過抑制AKT/叉頭框蛋白O1信號通路抑制OP,從而改善OP[13]。長鏈非編碼RNA DANCR和miR-320a通過CTNNB1抑制調節OP成骨分化過程中的Wnt/β-連環蛋白信號通路[14],從而影響OP。此外,ESR1包含許多多態性(Xbal和PvuⅡ),這可能在OP中起重要作用,其被認為是骨折的易感基因[15]。部分候選基因如ESR1(骨中雌激素作用的主要介質)和骨密度與OP有關[16-18]。miR-874-3p通過下調LEP的表達促進人骨髓間充質干細胞的增殖和分化,從而抑制OP[19]。MMP9的過表達減弱破骨細胞形成,并抑制促炎細胞因子分泌[20]。MYC通過調節miR-320a/磷酸酶與張力蛋白同源物通路增強核因子κB受體活化因子配體誘導的破骨細胞的形成[21]。這一系列核心靶點可通過不同的作用機制影響HP感染及OP的骨形成或骨吸收的病理生理過程。
在所有核心靶點中,TNF、IL1B和IL6是HP感染和OP相互作用的關鍵節點。HP感染可誘發與消化道外疾病相關的個體炎癥和免疫反應[22]。HP感染人體后可釋放細胞因子如TNF-α、IL1和IL6,這些細胞因子可調節骨骼的吸收和轉化,促進破骨細胞的形成,進而引起局部或全身性OP[6]。HUANG等[23]的一項研究駁斥了全身炎癥與OP有關的觀點,其認為HP感染除了引起炎癥外還可能導致OP。如慢性HP感染可能導致胃黏膜萎縮,減少胃酸分泌,進而抑制鈣的吸收,從而有可能對骨量產生不利影響[24]。同樣,長期使用質子泵抑制劑治療或預防胃十二指腸黏膜損傷與骨密度降低和骨折相關[25]。此外,對于男性患者而言,OP的另一個潛在機制可能是雌激素水平降低,這反過來又可能增加CagA+HP菌株的骨吸收[26]。因此,HP的感染主要通過炎癥因子及感染從而影響患者OP。
通過核心靶點富集分析可以發現,諸多靶點通過調控多條通路發揮對HP感染及OP的作用。這些信號通路多為炎癥感染有關的通路。乙型肝炎病毒相關性肝硬化是OP的危險因素,骨吸收增強是嚴重肝硬化患者OP風險增加的原因[27]。而肝硬化多為乙型肝炎感染所致。在對77 515例患者3年的隨訪中發現,HP感染女性患者OP發生率高于未感染女性患者[28]。最近的研究表明,HP感染不僅與胃腸道疾病有關,還與缺鐵性貧血、免疫性血小板減少性紫癜、維生素B12缺乏、非酒精性脂肪性肝病、冠狀動脈疾病、代謝綜合征和糖尿病等有關[29-30].因此,HP感染可導致胃腸道外的全身各種炎癥。HP感染可導致全身產生TNF因子,TNF超家族成員11調節多種生理或病理功能,包括破骨細胞分化和OP[31],TNF-α可誘導獨立于核因子-κB受體活化因子及其配體系統的破骨細胞分化[32],從而導致OP。肝臟炎癥和骨質流失病理生理學的潛在關鍵因素之一是TNF-α。幾位獨立研究人員報道了非酒精性脂肪性肝病患者TNF-α水平會增加[33]。HP感染多通過消化系統及全身的炎癥感染影響患者骨代謝變化,從而導致OP。這為合并有HP感染的OP患者的治療提供一個指導方向。在嚴重OP患者中可進行HP感染的篩查,若合并HP感染,抗骨質疏松治療的同時可予以抗HP治療,這樣可能比單純的抗OP治療具有更好的效果。目前關于此種治療方案的臨床報道較少見,值得進一步探索。本研究通過對多個基因數據庫進行基因信息整合發現了HP感染和OP的核心交集靶點,同時發現了炎性反應在2種疾病中扮演的角色。HP感染后可導致一系列炎性反應,而炎性反應可產生多種炎癥因子(如TNF、IL1和IL6等),該炎癥作用于多種信號通路,影響骨形成和骨吸收,從而導致OP。因此,對于OP患者或OP合并HP感染患者,積極地治療與控制HP導致的感染及炎癥,可能對控制OP有十分重要的作用。
綜上所述,HP感染多通過導致炎性反應產生炎癥因子,從而作用于影響骨吸收及骨形成的信號通路,最終導致或加重OP。本研究初步探討了HP感染與OP之間存在的相同致病基因和密切相關的信號調節途徑,為探索HP感染與OP的治療靶點提供了一定理論參考。本研究存在一定局限性,未對上述疾病靶點基因和信號通路進行驗證,需要在今后進一步臨床及基礎研究中明確其具體機制。