超聲造影聯合增強CT在腎腫瘤術前診斷中的應用價值
吳珍珍,張永東,鄒曉娟,岳瑾琢,朱茜文
西安大興醫院超聲醫學科,陜西 西安 710016
腎腫瘤在發病初期無典型性癥狀,發現時患者通常已經出現血尿、腹部包塊等嚴重癥狀[1]。超聲造影(contrast-enhanced ultrasound,CEUS)利用造影劑動態觀察腫瘤內部的血流灌注,從而能夠比較準確地對良惡性腫瘤作出診斷,且CEUS屬于無輻射、無毒性和無創傷性檢查,適用性較強[2];增強CT 能夠獲得腎皮質期、腎實質期、腎盂期等多個時期腎腫瘤的形態學特征和血流灌注情況[3],此外,利用CT 三維重建技術還能夠清晰獲得腎腫瘤的三維結構、血管以及與周圍組織的解剖學關系[4-5],在為腎臟腫瘤作出定性診斷的同時,還能夠為手術治療提供重要依據。本研究旨在探討超聲造影聯合增強CT在腎腫瘤術前診斷中的應用價值,現報道如下:
1 資料與方法
1.1 一般資料 選擇2020 年11 月至2022 年10月西安大興醫院收治且符合以下納入和排除標準的97 例腎腫瘤患者作為研究對象,其中男性51 例,女性46 例;年齡38~79 歲,平均(53.48±7.38)歲;病灶0.9~7.4 cm,平均(5.18±1.03)cm;病變位于左腎47例,右腎50 例。97 例腎腫瘤患者中惡性腫瘤73 例,其中腎透明細胞癌53 例,腎乳頭狀細胞癌10 例,腎嫌色細胞癌7 例,腎移行細胞癌3 例);良性腫瘤24 例,其中腎血管平滑肌脂肪瘤22例,腎囊腫2例。本研究經西安大興醫院倫理委員會審核批準,所有患者均詳細知情并簽署知情同意書。
1.2 納排標準 (1)納入標準:①腫瘤病灶均為單發病灶,位置均處于腎臟實質;②均經手術病理學結果證實;③術前均完成CEUS 和增強CT 檢查,患者均符合上述檢查要求。(2)排除標準:①既往有射頻消融治療、化學治療史者;②存在腎臟疾病或腎臟功能受損;③造影劑過敏等CT、CEUS檢查禁忌者;④意識障礙完成影像學檢查者;⑤其他重要臟器合并嚴重器質性病變者。
1.3 檢查方法
1.3.1 CEUS 檢查 選擇Sequoia512 彩色多普勒超聲診斷儀(購自德國西門子公司),探頭頻率為4~9 MHz。檢查體位取仰臥位,行常規二維和彩色多普勒超聲檢查,詳細記錄腫瘤位置及大小,同時仔細觀察腫瘤形態、邊緣、內部回聲及血流分布等。確定最佳體位及觀察切面之后進行CEUS檢查,造影劑為聲諾維(SonoVue,購自意大利Βracco公司),采用5 mL生理鹽水稀釋造影劑,經肘靜脈快速推注,連續動態觀察腫瘤及周圍組織4~6 min,同時動態保存清晰圖像。用于后期圖像分析及病情評估。
1.3.2 增強CT 檢查 檢查儀器為日本東芝公司的64排螺旋CT機。所有患者取仰臥位,行常規CT平掃,掃描位置從膈頂至恥骨聯合處。明確腹部臟器位置后進行增強掃描,造影劑為優維顯(370 mg/mL),經肘靜脈高壓單相注射60~100 mL,注射速率為3.0 mL/s。造影劑注入25~35 s后開始進行腎皮質期掃描,85~95 s開始進行腎實質期掃描,3~5 min 后進行腎盂期掃描。掃描完成后將圖像上傳至工作站進行后期處理,以多平面重組(MPR)為主,輔以容積再現(VR)、最大密度投影(MIP)等后處理技術進行CT三維重建。
1.4 腎腫瘤評判標準 由兩名具有5 年以上影像學診斷工作經驗的醫師負責閱片,閱片分析過程采用雙盲法進行。以病理學為“金標準”,結合不同診斷方式的影像學特點給出診斷結論。(1)CEUS檢查:以正常腎皮質為參照,腫塊顯影更快或同步為“快進”,消退更快或同步為“快出”;對照正常腎皮質,腫塊增強程度分為高增強或低增強。其中“快進快出”、“快進慢出”、造影劑注入后表現為強于腎皮質的不均勻高增強、假包膜證等診斷為腎臟惡性占位性病變;“慢進慢出”、“無增強或局部增強”診斷為腎良性腫塊。(2)增強CT檢查:腎惡性腫瘤,腎實質內可見低密度占位病灶,呈圓形或類圓形,注射造影劑后表現出“快進快出”,不均勻高增強或低增強,血供較少的腎腫瘤呈現輕-中度強化;良性腫塊,呈等密度或稍高密度,邊緣清晰,內部未見壞死或鈣化,各期呈現均勻強化。
1.5 統計學方法 應用SPSS20.0 軟件進行數據統計學分析。計量資料以均數±標準差()表示,計數資料比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 CEUS和增強CT的影像學表現比較 CEUS和增強CT在增強強度、均勻程度、消退時間以及假包膜方面的影像學表現比較差異均有統計學意義(P<0.05),見表1。典型病例見圖1~圖3。
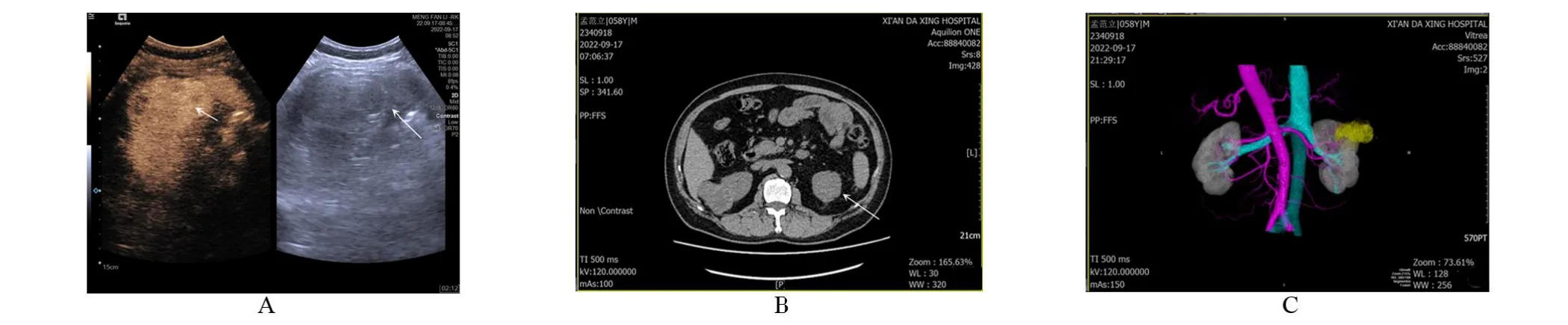
圖1 患者A,男性,56歲,右腎,病理證實為腎血管平滑肌脂肪瘤Figure 1 Patient A,56-year-old,male,had the right kidney pathologically confirmed as renal angiomyolipoma
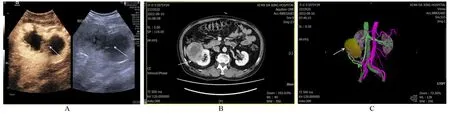
圖2 患者B,男性,右腎,病理證實為腎透明細胞癌Figure 2 Patient B,male,had the right kidney pathologically confirmed as renal clear cell carcinoma

圖3 患者C,男性,左腎,病理證實為腎透明細胞癌Figure 3 Patient C,male,had the left kidney pathologically confirmed as renal clear cell carcinoma
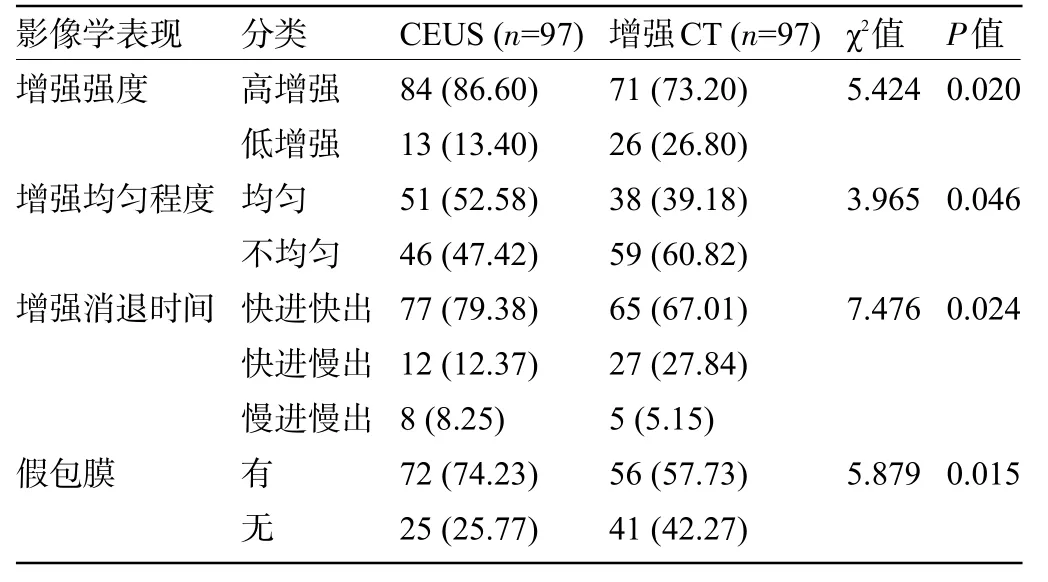
表1 兩種診斷方式檢查腎癌的影像學表現比較[例(%)]Table 1Comparison of imaging manifestations of renal cell carcinoma by two diagnostic methods[n(%)]
2.2 CEUS、增強CT 及兩者聯合在術前診斷腎腫瘤的診斷效能 以病理學診斷為“金標準”,CEUS聯合增強CT 在術前診斷腎腫瘤的敏感度、特異度、準確度以及陽性預測值、陰性預測值分別為93.15%、91.67%、92.78%、97.14%、81.48%,均明顯高于CEUS、增強CT,差異均具有統計學意義(P<0.05),見表2、表3。

表2 CEUS、增強CT及兩者聯合診斷的診斷結果與病理學結果比較(例)Table 2 Comparison of diagnostic results and pathological results of CEUS,enhanced CT,and their combination(n)

表3 不同診斷方式在術前診斷腎癌的效能比較(%)Table 3 Comparison of the efficacy of different diagnostic methods in preoperative diagnosis of renal cell carcinoma(%)
3 討論
近年來,腎癌的發病率呈逐漸上升趨勢發展,且發病人群逐漸趨向年輕化[6]。CEUS 具有安全、快速、不損害腎臟和可多次重復的優勢,能夠提供腎臟病灶及周圍的宏觀及微觀血流圖像[7]。增強CT 可通過多個方位和多個切面實時觀察腎臟病灶變化,同時還能夠清晰顯示其周邊的血流情況,為術前腎腫瘤的診斷提供參考依據[8-9]。
本研究對97例腎腫瘤患者的CEUS和增強CT的影像學結果進行觀察、分析,發現患者的腫瘤病灶多表現為“快進快出”型,較多病灶可見假包膜。分析原因,可能為腎癌患者的腫瘤內部血運豐富,病灶內存在動靜脈瘺或內部血管管徑粗大,因此表現為“快出”[10],但也有少部分良性腫瘤的血供相對豐富,也存在“快出”,影像學征象存在一定重疊。因此,僅憑借CEUS、增強CT對腎腫瘤進行術前定性診斷存在一定局限性。
本研究對比了腎腫瘤患者的CEUS、增強CT影像學表現,結果發現,CEUS在增強強度、增強均勻程度、假包膜存在情況以及增強消退時間上優于增強CT。CEUS 能夠實時觀察腫瘤病灶內部的血液供應情況,同時還能夠實時顯示對比劑注入后強化的全部過程,在一定程度上彌補了增強CT 的不足[11]。然而,CEUS僅能實時監測單側腎臟或腫瘤最大切面,并不能同時對雙側腎臟進行整體觀察,進而對腎腫瘤的臨床評估造成一定影響[12]。增強CT能夠同時觀察雙側腎臟、腎臟周圍及腹膜后的病灶,另外還能夠對腎腫瘤的轉移情況進行觀察,結合CT 三維重建技術還能夠清晰呈現腎腫瘤的三維結構、血管以及與周圍組織的解剖學關系,進而為腫瘤的臨床評估提供更加全面的參考依據[13]。然而,增強CT掃描也存在一定不足,隨著掃描時間的增加,對比劑容易彌散至組織間隙而產生信號衰竭,此時脂肪組織較少以及血運不豐富病灶的敏感度偏低[14]。CEUS 則不會因對比劑彌散至組織間隙而產生信號衰竭,另外CEUS 能夠動態反映病灶血運情況,因此在顯示較小體積的病灶上更具優勢,便于識別早期病灶的組織邊界[15-16]。
CEUS、增強CT 在診斷腎腫瘤上各具優勢,也各自存在一定的不足。本研究對比了CEUS、增強CT以及兩者聯合在術前診斷腎腫瘤的診斷效能,結果顯示,CEUS 聯合增強CT 在術前診斷腎腫瘤的敏感度、特異度、準確度以及陽性預測值、陰性預測值分別為93.15%、91.67%、92.78%、97.14%、81.48%,均明顯高于CEUS、增強CT。上述結果表明,CEUS、增強CT以及CT三維重建技術在術前診斷腎腫瘤上各具優勢,聯合診斷能夠進一步提高其診斷準確率。
綜上所述,CEUS、增強CT以及CT三維重建技術在術前診斷腎腫瘤上具有較高的診斷價值,CEUS 聯合增強CT 以及CT 三維重建技術能夠進一步提高其診斷準確率,從而為病情評估以及手術方案的制定提供重要參考。

