非洲豬瘟病毒基因Ⅰ型的雙重實時熒光定量PCR檢測方法建立
常 昊,邱英武,彭 杰,高 琦,宋澤布,陳 洋,5,李 薇,林麗苗,曹雪珍,周慶豐,張桂紅,李群輝*,鄭澤中*
(1.華南農業大學獸醫學院非洲豬瘟防控技術研究中心,廣州 510642;2.溫氏食品集團股份有限公司 廣東省畜禽健康養殖與環境控制企業重點實驗室,云浮 527400;3.國家非洲豬瘟區域實驗室(廣州),廣州 510642;4.廣東省動物源性人獸共患病預防與控制重點實驗室,廣州 510642;5.嶺南現代農業科學與技術廣東省實驗室茂名分中心,茂名 525000)
非洲豬瘟(African swine fever ,ASF)是由非洲豬瘟病毒(African swine fever virus,ASFV)感染家豬與野豬引起的高度傳染性出血性疾病,致死率高達100%。1921年,ASF首次在肯尼亞被報道[1],并于2018年傳入我國,隨后蔓延至全國范圍內且持續至今[2]。
ASFV基因組為線性、雙鏈DNA,全長約170~193 kb,編碼 150~171個開放閱讀框(ORFs)[3]。編碼ASFV衣殼蛋白P72的B646 L基因較為保守,常被用做ASFV檢測中的靶基因[4]。EP402R基因編碼ASFV的CD2v蛋白是ASFV的重要抗原之一,同時CD2v蛋白的細胞質區被認為是一種新的遺傳標記[5]。
目前中國以基因型Ⅱ ASFV(GenotypeⅡ ASFV)流行為主,隨著低毒力的基因Ⅰ型ASFV(GenotypeⅠ ASFV)在國內被報道[6],使得ASF的監測、預防和控制更具挑戰性。為有效針對ASFV進行診斷以及GenotypeⅠ、GenotypeⅡ 的鑒定,本研究使用中國動物疾病預防控制中心(CADC)推薦的B646L引物與探針,并針對GenotypeⅠ EP402R基因保守特異性區域設計引物與探針,建立了一種在診斷ASF的同時可進行GenotypeⅠ ASFV鑒別的快速檢測方法。
1 材料與方法
1.1 材料
1.1.1 病毒、質粒與臨床樣品 Genotype Ⅰ ASFV、Genotype Ⅱ ASFV、豬繁殖與呼吸綜合征病毒(PRRSV)、豬流感病毒(SIV)、豬圓環病毒Ⅱ型(PCV-2)、豬偽狂犬病病毒(PRV)、pUC57-B646 L質粒由本實驗室保存,連接有GenotypeⅠ ASFV EP402R基因保守特異性區域的質粒pMD18-T-ASFV-EP402R由擎科生物技術有限公司完成合成與測序。526份臨床樣品(口拭子263份,肛拭子95份,抗凝血146份,扁桃體22份)來自華南地區生豬養殖場。
1.1.2 主要試劑與儀器 MagaBio plus 病毒DNA/RNA純化試劑盒Ⅳ、博日NPA-32P核酸提取純化儀(杭州博日科技股份有限公司);PrimeScriptTM RT reagent Kit with gDNA Erase試劑盒(上海金畔生物科技有限公司);real-time PCR 2×AceQ Universal U kit+Probe Master Mix V2 PCR 檢測試劑盒(南京諾唯贊生物科技股份有限公司);ExCycle-48 real-time PCR儀。
1.2 方法
1.2.1 病毒核酸的提取 對Genotype Ⅰ ASFV、Genotype Ⅱ ASFV、PRRSV、PCV、PRV及臨床樣品進行病毒核酸提取。
1.2.2 引物的設計與合成 B646L引物與探針使用CADC推薦使用的B646L引物與探針序列進行合成。
使用Primer5.0軟件針對在NCBI中篩選的40條 GenotypeⅠ ASFV EP402R基因保守特異性區域設計引物與探針,所有引物和探針均由Thermo公司(Thermo Fisher Scientific, Waltham, MA, USA)合成。引物與探針相關信息見表1。
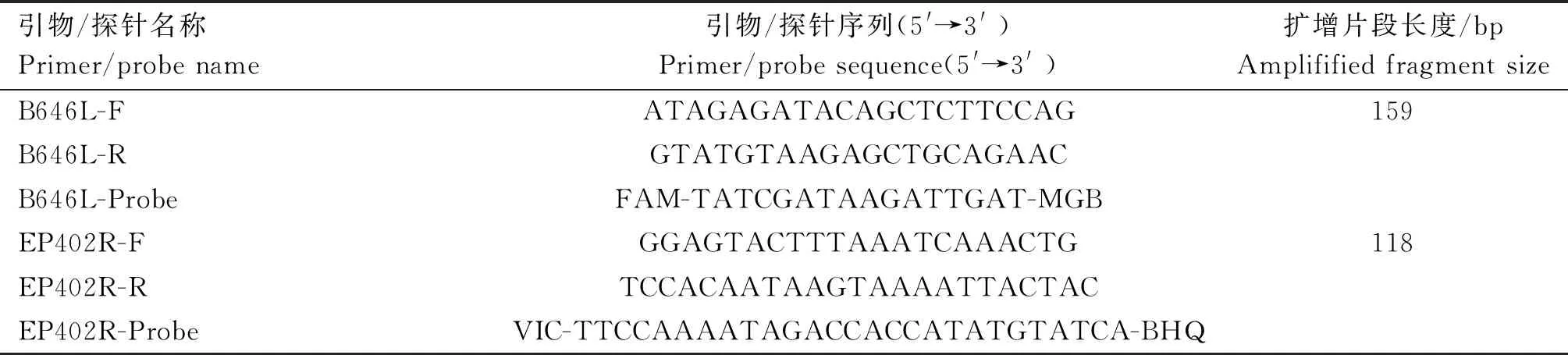
表1 引物與探針
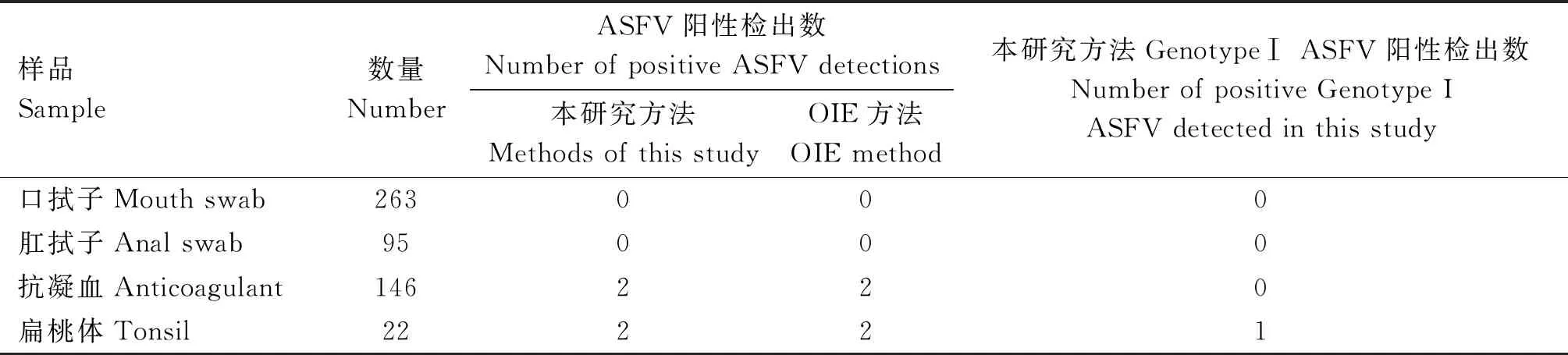
表2 臨床樣品檢測結果
1.2.3 雙重實時熒光定量PCR反應體系的建立 以1.06×105copies·μL-1的EP402R陽性質粒與1.07×105copies·μL-1的B646L陽性質粒1∶1等體積混勻作為模板,體系及反應條件參考real-time PCR 2×AceQ Universal U kit+Probe Master Mix V2 PCR試劑盒說明書,通過改變加入反應體系中兩對引物與探針的體積,使兩對引物終濃度分別為0.2、0.4、0.8 μmol·L-1三個梯度;兩對探針終濃度分別為50、100、150 nmol·L-1三個梯度進行試驗,篩選出引物與探針最優濃度。
1.2.4 ASFV EP402R基因檢測通道標準曲線建立及靈敏性檢測 10倍梯度稀釋pMD18-T-ASFV-EP402R質粒標準品(1.06×101~10copies·μL-1),使用“1.2.3”優化反應體系進行試驗,ddH2O為陰性對照,設計3次重復。依據擴增曲線檢驗該方法的靈敏度并根據測得的Ct值以及EP402R基因的拷貝數繪制標準曲線。
1.2.5 雙重熒光定量檢測方法的特異性檢測 以pMD18-T-ASFV-EP402R為陽性對照,GenotypeⅠ ASFV、GenotypeⅡ ASFV、GenotypeⅠ+GenotypeⅡ ASFV、PRRSV、PCV、PRV核酸為模板,ddH2O為陰性對照,使用“1.2.3”反應體系進行特異性檢測。
1.2.6 臨床樣品的檢測 使用本研究建立的雙重實時熒光檢測方法與世界動物衛生組織(OIE)推薦使用的方法對在華南地區526份送檢樣品進行檢測。
2 結 果
2.1 雙重實時熒光定量PCR反應體系的建立
根據對反應體系優化試驗的結果可知,EP402R基因與B646L基因的引物最適終濃度均為0.2 μmol·L-1,EP402R基因與B646L基因的探針最適終濃度均為100 nmol·L-1,故確定雙重實時熒光定量體系如下:
總體系20 μL:2×AceQ Universal U kit+Probe Master Mix V2 PCR 10 μL,EP402R-R、EP402R-F各0.4 μL,EP402R-Probe 0.2 μL,EB646L-R、B646L-F各0.4 μL,B646L-Probe 0.2 μL,模板2 μL,加ddH2O補足至20 μL。
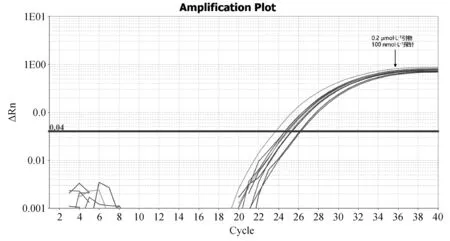
圖1 B646L實時熒光定量PCR不同引物、探針濃度擴增結果Fig.1 Real-time PCR amplification results of B646L with different primers and probe concentrations
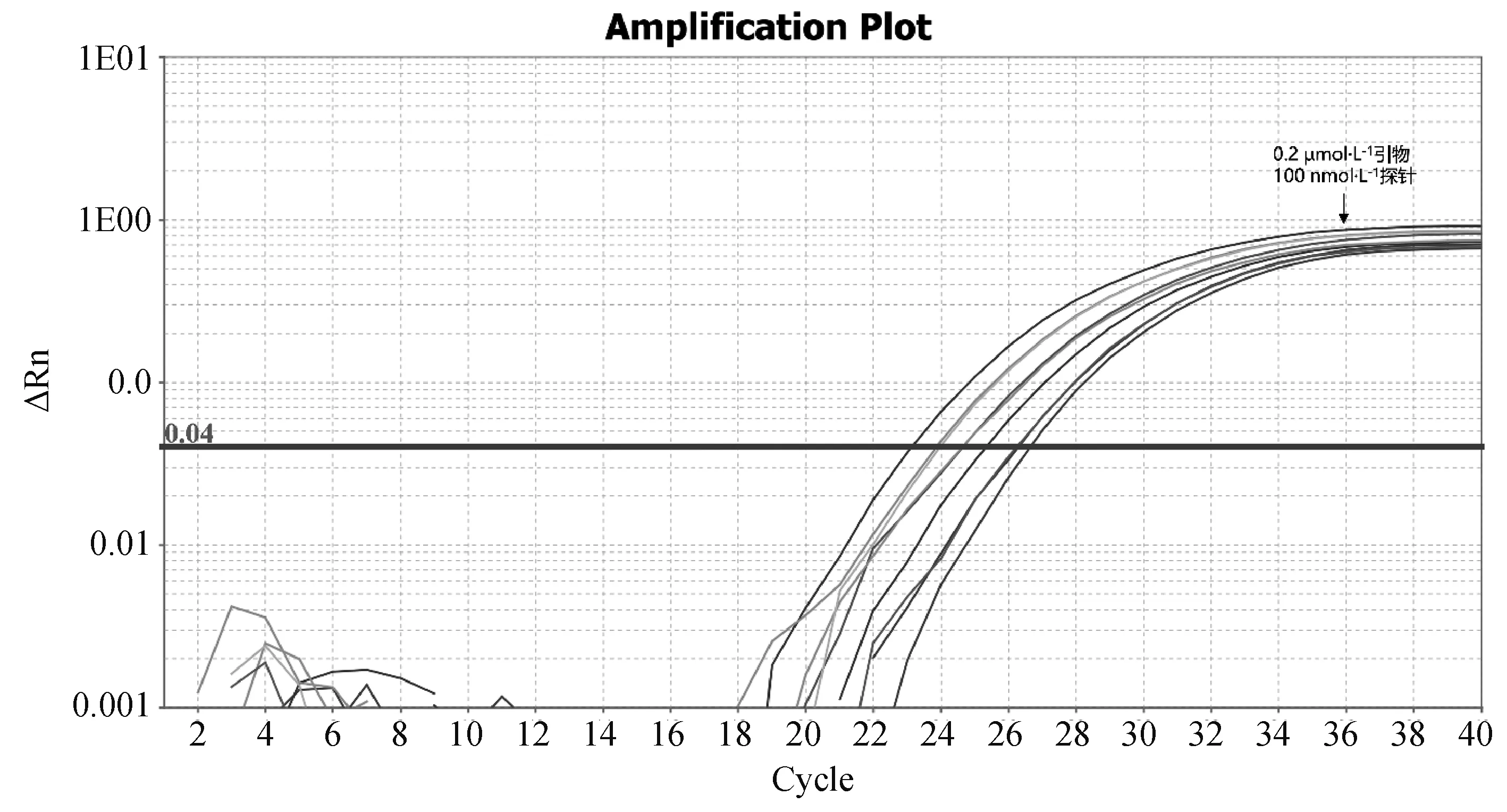
圖2 EP402R實時熒光定量PCR不同引物、探針濃度擴增結果Fig.2 Real-time PCR amplification results of EP402R with different primers and probe concentrations
2.2 針對ASFV EP402R基因檢測方法的靈敏性檢測
根據擴增曲線可知,該方法的檢測底限為1.06×101copies·μL-1,表明靈敏度較好。
根據“1.2.4”測得的Ct值以及EP402R基因的拷貝數進行標準曲線的繪制。結果顯示,在1.06×101~1.06×1010copies·μL-1范圍內,相關系數為0.988 8(介于0.95~1.05之間),表明存在良好的線性關系。
2.3 雙重熒光定量檢測方法的特異性試驗
該檢測方法的特異性結果顯示,FAM通道的GenotypeⅠ、GenotypeⅡ、GenotypeⅠ+GenotypeⅡ ASFV的混合樣品和VIC通道中的GenotypeⅠ、GenotypeⅠ+GenotypeⅡ ASFV的混合樣品均可顯示出擴增曲線。結果表明,該方法具有良好的特異性,且不與其他常見豬源病毒核酸發生交叉反應。
2.4 臨床樣品檢測試驗
使用本方法對526份送檢臨床樣品進行檢測,檢出4份ASFV陽性樣品,其中1份為GenotypeⅠ。
3 討 論
當前的ASFV檢測技術主要分為兩大類:針對病毒DNA的核酸檢測技術;針對病毒抗原、抗體反應的免疫學技術。由于針對抗體的檢測方法具有一定的滯后性[7],因此能夠在ASFV感染早期快速檢測病毒核酸的qPCR檢測的方法成為了主流。
隨著GenotypeⅠ ASFV在我國流行,Gao等[8]基于CADC推薦使用的ASFV B646L的引物與探針以及針對E183L設計的引物與探針建立了鑒別GenotypeⅠ與 GenotypeⅡ ASFV的檢測方法,并驗證了CADC推薦使用的ASFV B646L基因引物與探針具有良好的特異性、重復性以及檢測底限為1.07×102copies·μL-1的較強靈敏度。本研究針對GenotypeⅠ ASFV EP402R基因保守特異性區域設計的引物與探針同樣具有良好的特異性以及重復性,檢測底限為1.06×101copies·μL-1,對GenotypeⅠ ASFV檢測更為靈敏。此外,通過本研究建立的檢測方法對526份送檢臨床樣品進行檢測,檢出4份ASFV陽性,結果與世界動物衛生組織(OIE)推薦使用的方法結果一致,并且其中1份為 GenotypeⅠ ASFV。結果表明本研究建立的雙重熒光實時定量PCR檢測方法具有高靈敏性和高特異性,可有效用于ASFV的臨床診斷以及GenotypeⅠ ASFV的監測。
4 結 論
本研究通過針對使用中國動物疾病預防控制中心(CADC)推薦使用的B646L引物與探針,結合針對GenotypeⅠ ASFV EP402R基因保守特異性區域設計引物與探針,建立了一種在診斷ASF的同時可對ASFV進行GenotypeⅠ ASFV鑒別的快速檢測方法。通過試驗確定了EP402R基因與E646L基因的引物最適終濃度均為0.2 μmol·L-1,EP402R基因與E646L基因的探針最適終濃度均為100 nmol·L-1,并且經試驗證明了EP402R引物具有檢測底限為1.06×101copies·μL-1的靈敏性以及良好的特異性,可有效地用于GenotypeⅠ ASFV的檢測與監測。

