豬PPARγΔ5 組織表達及生物信息分析
宋蘇堤,魏 芳,李帥兵,符 璐,盧建雄,張國華
( 西北民族大學生命科學與工程學院,甘肅 蘭州 730124 )
轉錄因子過氧化物酶體增殖物激活受體γ(PPARγ)對細胞分化和脂質代謝起到重要調控作用。與其他核激素受體轉錄因子相同,PPARγ具有C-端配體結合域(LBD),與配體結合后被激活,結合到特定的DNA 序列過氧化物酶體增殖物反應元件(PPREs)反式激活靶基因轉錄。研究表明,PPARγ調控包括脂肪形成、脂肪儲存、脂肪因子分泌和胰島素敏感性在內的多個生物學過程,是調控脂肪細胞分化的核心調控因子[1],具有調節脂肪合成、糖脂代謝和細胞增殖分化等生物學功能[2]。
選擇性剪接(AS)是真核生物基因轉錄后調控的重要機制,可對基因表達譜進行重新編程,增加轉錄組和蛋白質組的多樣性。研究發現,PPARγ外顯子5跳躍是一種自然發生的選擇性剪接事件[3]。PPARγ基因外顯子6含有絲氨酸/精氨酸富集剪接因子1(SRSF1)的結合位點[4],SRSF1與PPARγ外顯子6結合有助于其前體mRNA跳過外顯子5發生選擇性剪接并產生亞型PPARγΔ5[3]。在人類皮下和內臟脂肪組織、脂肪細胞等均檢出PPARγΔ5表達,參與脂肪細胞分化及生脂調控[5]。豬脂肪組織高水平表達PPARγ3,是脂肪細胞分化的主要調控因子,其編碼基因與人PPARγ 基因均由7 個外顯子組成,具有很高的同源性。但豬機體組織是否也存在PPARγ 前體mRNA 外顯子5 跳躍的選擇性剪接及其可能的作用機制尚不清楚。本研究在檢測分析豬組織器官PPARγΔ5 表達的基礎上,利用生物信息學方法比較分析豬PPARγΔ5及PPARγ蛋白生物信息特征,為深入了解豬脂肪形成的調控機制提供參考。
1 材料與方法
1.1 樣品采集
選取健康的180 d“杜×大×長”三元雜交豬6頭,體重為(88.71±2.53) kg,由蘭州瑞源農業科技有限公司提供。禁食12 h,屠宰,立即采集心臟、肝臟、皮下脂肪組織和背最長肌,磷酸緩沖液(PBS)沖洗后放入液氮中凍存。
1.2 RNA提取及cDNA合成
TRIzol 法分別提取豬各組織總RNA。以提取的總RNA為模板,按照反轉錄試劑盒合成cDNA,-20 ℃保存。
1.3 引物設計與合成
以豬PPARγ mRNA序列(NM_214379.1)為模板,分別在PPARγ 基因外顯子4 和5 的序列內設計PPARγ PCR 擴增引物,在外顯子3 內和外顯子4 與6 的連接處序列設計PPARγΔ5 引物。PPARγΔ5 實時熒光PCR 擴增引物序列為F:5'-GG-GATAAAGCCTCGGGGTTC-3';R:5'-ACAAAGGGCGT-TATGAGACAT-3';產物長度212 bp。PPARγ 引物為F:5'-TTATTGACCCAGAAAGCG-3';R:5'-AGGATTTCATACCGCAGG-3';產物長度88 bp。β-actin(DQ845171.1)為內參基因,引物序列為F:5'-AGG-CCAACCGTGAGAAGATG-3';R:5'-CATGACAATGCCAGTGGTGC-3';產物長度122 bp。引物由湖南艾科瑞生物工程有限公司合成。
1.4 實時熒光PCR擴增
使用實時熒光定量PCR試劑盒進行PCR擴增,操作按生產商使用說明書進行。以β-actin為內參基因,用2-△△Ct法計算PPARγ和PPARγΔ5相對表達量。
1.5 生物信息學分析
利用NCBI 的BLAST 功能,比對豬PPARγ3 mRNA(NM_214379.1)和PPARγ 基因序列,獲得外顯子5跳躍的PPARγΔ5 mRNA序列,在線程序分析PPARγ蛋白序列。
使用在線預測軟件ProtParam(http://web.expasy.org/protparam/)分析PPARγ 和PPARγΔ5 蛋白理化性質;使用ProtScale(https: //web.expasy.org/protscale/)分析蛋白親疏水性;使用SOPMA(https: //npsa-prabi.ibcp.fr/)進行二級結構預測;使用SWISS-MODEL(https: //swissmodel.expasy.org/)進行三級結構預測;使用TMHMM(http: //www.cbs.dtu.dk/services/ TMHMM/)分析跨膜結構域;使用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)預測信號肽;使用PSORT Ⅱ Prediction (https: // psort.hgc.jp/form2.html)分析亞細胞定位;使用NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)分析磷酸化位點。
1.6 數據統計與分析
試驗數據采用SPSS 19.0 軟件進行單因素方差分析,Duncan's 法進行多重比較。結果以“平均值±標準誤”,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結果與分析
2.1 PPARγ 和PPARγΔ5在豬不同組織中的表達、相關性分析(見圖1、圖2)

圖1 PPARγ和PPARγΔ5在豬不同組織中的表達Fig.1 Expression of PPARγ and PPARγΔ5 in different tissues of pigs
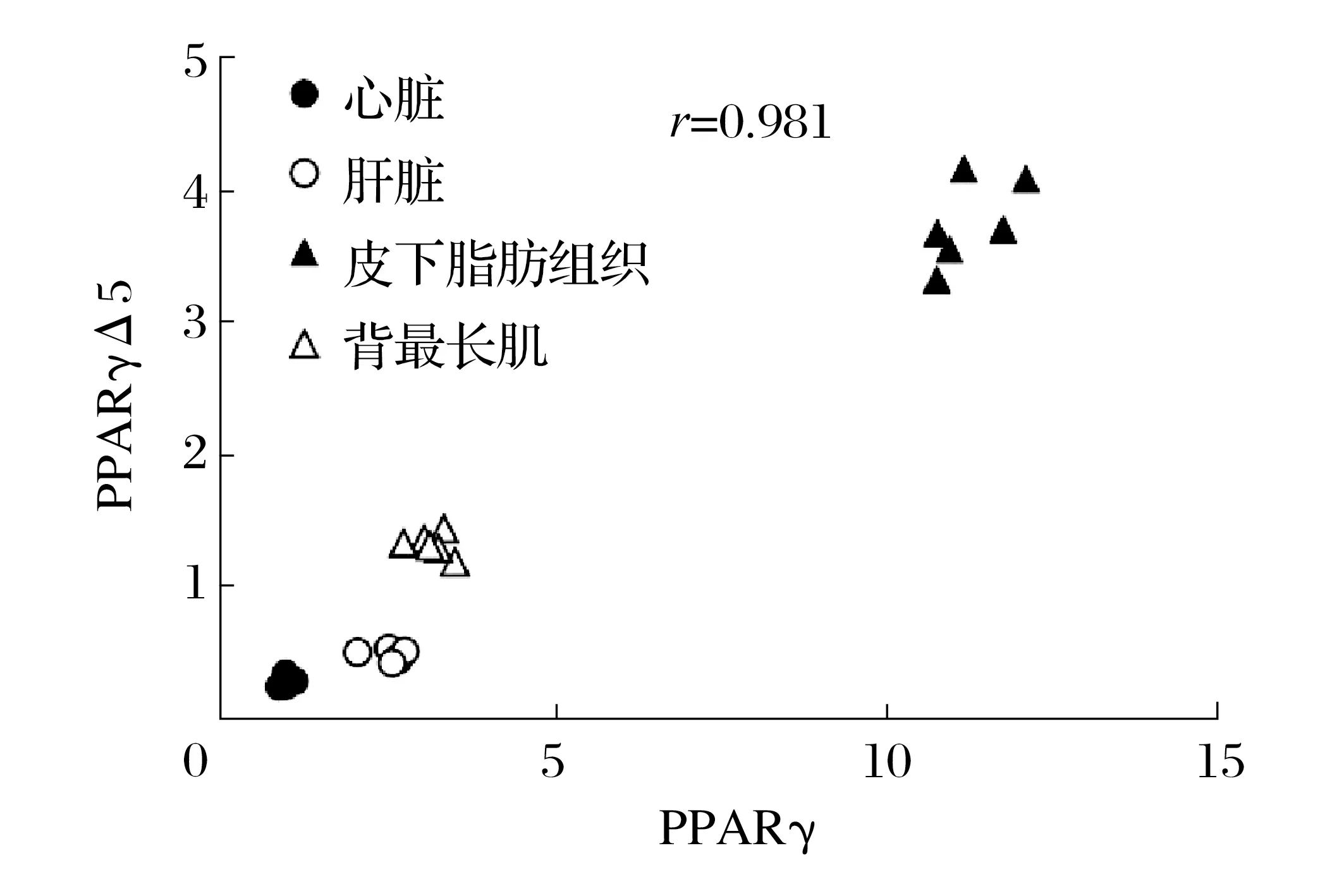
圖2 PPARγ和PPARγΔ5在豬不同組織中表達的相關性分析Fig.2 Correlation analysis of PPARγ and PPARγΔ5 expression in different tissues of pigs
由圖1、圖2可知,在豬心臟、肝臟、皮下脂肪組織和背最長肌中均檢測到PPARγΔ5 和PPARγmRNA 表達,表達水平依次為皮下脂肪組織、背最長肌、肝臟和心臟,PPARγΔ5 和PPARγmRNA 表達水平差異極顯著(P<0.01)。各組織PPARγΔ5mRNA 表達均極顯著低于PPARγ(P<0.01),且二者顯著正相關(P<0.05)。
2.2 PPARγ 和PPARγΔ5蛋白理化性質及氨基酸組成(見圖3、表1)
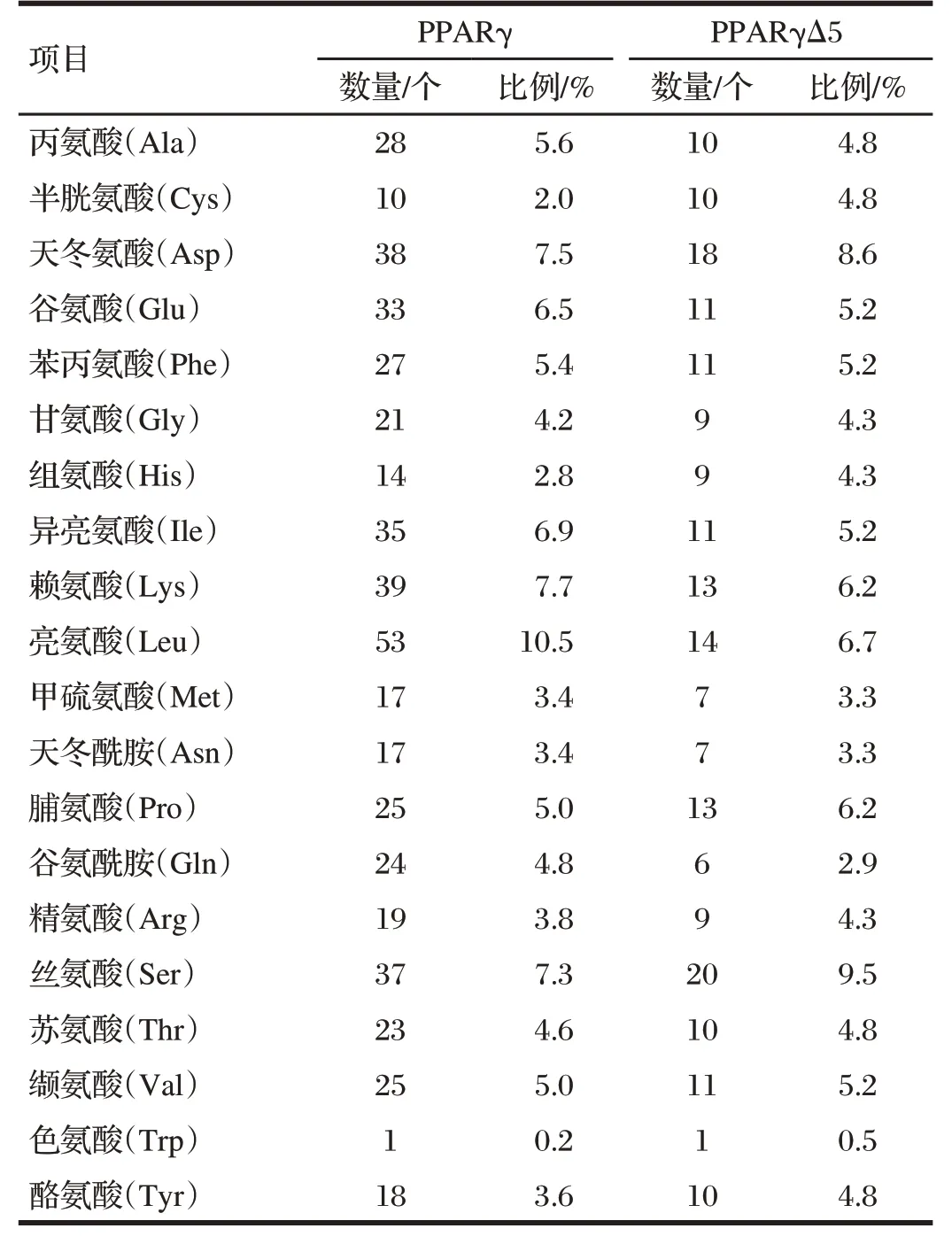
表1 PPARγ和PPARγΔ5蛋白的氨基酸組成Tab.1 Amino acid composition of PPARγ and PPARγΔ5 proteins

圖3 PPARγ和PPARγΔ5蛋白親疏水性分析Fig.3 Hydrophilic analysis of PPARγ and PPARγΔ5 proteins
采用ProtParam 在線軟件預測表明,PPARγ 和PPARγΔ5 蛋白分子量分別為57 512.10、23 929.09 u,分子式分別為C2575H4046N670O766S27、C1054H1610N282O322S17,脂肪族氨基酸指數分別為88.04、66.38,理論等電點(PI)分別為5.60、5.68,均屬酸性蛋白;不穩定系數分別為49.18、54.26,表明理化性質均不穩定,理論半衰期均為30 h。PPARγ帶負電荷與正電荷氨基酸殘基(Asp與Arg)總數分別為71和58,PPARγΔ5 帶負電荷與正電荷氨基酸殘基(Glu 與Lys)總數分別為29和22。
由圖3 可知,PPARγ 蛋白的肽鏈大部分位于親水區域,為親水蛋白。其中,第416位異亮氨酸殘基的疏水性最強,分值為3.65;第128 位谷氨酸殘基親水性最強,分值為-2.76。PPARγΔ5 蛋白的肽鏈大部分位于親水區域,為親水蛋白。其中,第137位谷氨酸殘基的疏水性最強,分值為1.47;第127位谷氨酸殘基的親水性最強,分值為-2.72。
由表1 可知,PPARγ 和PPARγΔ5 蛋白均含20 種氨基酸。PPARγ 由504 個氨基酸組成,其中亮氨酸占比為10.5%;賴氨酸占比為7.7%;組氨酸、半胱氨酸及色氨酸占比分別為2.8%、2.0%和0.2%。PPARγΔ5由210個氨基酸組成,其中絲氨酸占比為9.5%;天冬氨酸占比為8.6%;谷氨酰胺和色氨酸占比分別為2.9%和0.5%。
2.3 PPARγ 和PPARγΔ5蛋白的二級和三級結構預測(見表2、圖4、圖5)

表2 PPARγ和PPARγΔ5蛋白的二級結構占比Tab.2 Secondary structure proportion of PPARγ and PPARγδ5 proteins 單位:%

圖4 PPARγ和PPARγΔ5蛋白二級結構預測Fig.4 Secondary structure prediction of PPARγ and PPARγΔ5 proteins
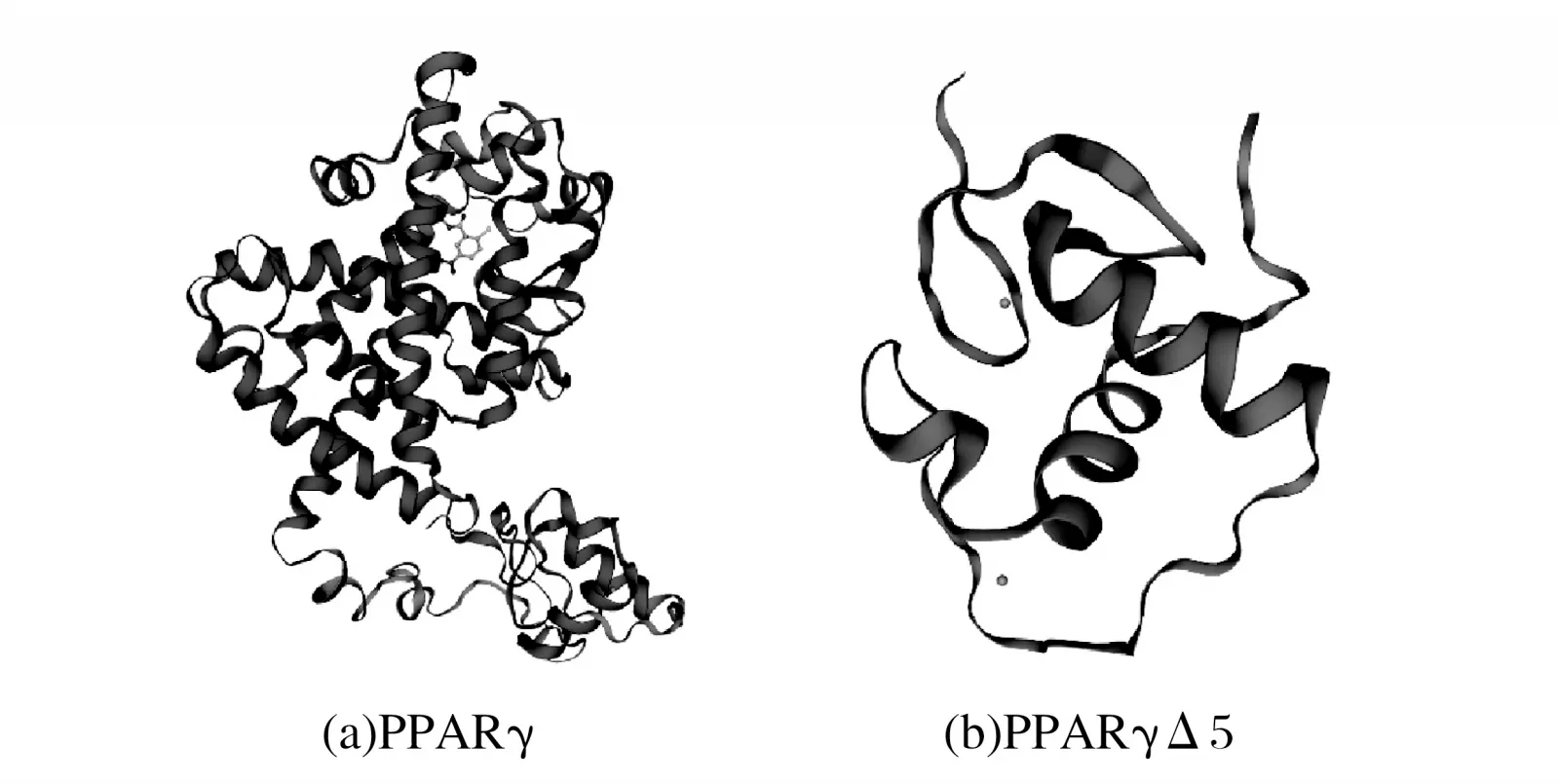
圖5 PPARγ和PPARγΔ5蛋白三級結構建模Fig.5 Tertiary structure modeling of PPARγ and PPARγΔ5 proteins
由表2可知,PPARγ、PPARγΔ5蛋白二級結構中α-螺旋、無規則卷曲、β-轉角和延伸鏈分別占50.00%、31.75%、6.35%、11.90%和21.43%、49.05%、7.62%、21.90%。
由圖5可知,PPARγ蛋白三級結構以α-螺旋和無規則卷曲為主,PPARγΔ5 蛋白三級結構以無規則卷曲和延伸鏈為主,與二級結構預測結果相符。
2.4 PPARγ 和PPARγΔ5 蛋白跨膜螺旋結構和信號肽預測(見圖6、圖7)
圖6 PPARγ和PPARγΔ5蛋白跨膜螺旋結構預測Fig.6 Prediction of transmembrane helical structure of PPARγ and PPARγΔ5 proteins
圖7 PPARγ和PPARγΔ5蛋白信號肽預測Fig.7 PPARγ and PPARγΔ5 protein signal peptide prediction
由圖6、圖7 可知,豬PPARγ 和PPARγΔ5 兩種蛋白均無跨膜螺旋結構、無信號肽,屬于非分泌蛋白。
2.5 PPARγ 和PPARγΔ5 蛋白亞細胞定位和磷酸化位點(見圖8、圖9)
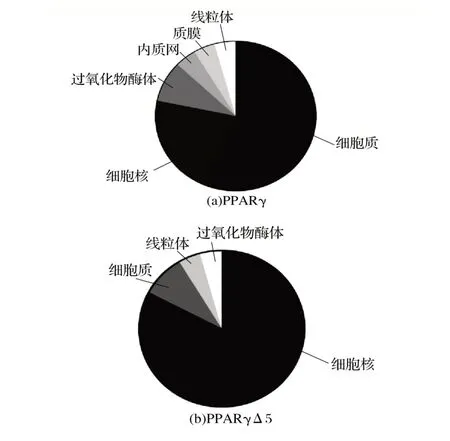
圖8 PPARγ和PPARγΔ5蛋白亞細胞定位Fig.8 Subcellular localization of PPARγ and PPARγΔ5 proteins
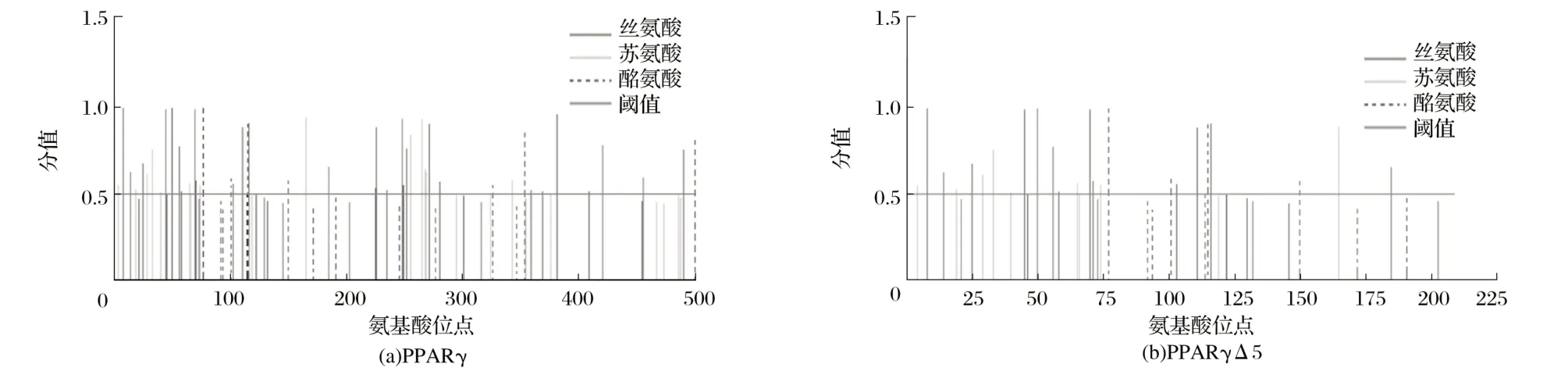
圖9 PPARγ和PPARγΔ5蛋白磷酸化位點Fig.9 Phosphorylation sites of PPARγ and PPARγΔ5 proteins
由圖8可知,PPARγ蛋白約56.6%定位于細胞質;細胞核約占21.8%;過氧化物酶體約占8.7%;內質網、質膜和線粒體均約占4.3%。PPARγΔ5 約82.7%定位于細胞核;細胞質約占8.7%;線粒體和過氧化物酶體均約占4.3%。
由圖9可知,PPARγ蛋白氨基酸序列中共有48個潛在的磷酸化位點,其中包括27個Ser磷酸化位點、13個Thr磷酸化位點、8 個Tyr 磷酸化位點。PPARγΔ5 蛋白氨基酸序列中共有25個潛在的磷酸化位點,其中包括13個Ser磷酸化位點、8個Thr磷酸化位點、4個Tyr磷酸化位點。
2.6 PPARγ和PPARγΔ5結構域預測(見圖10~圖13)
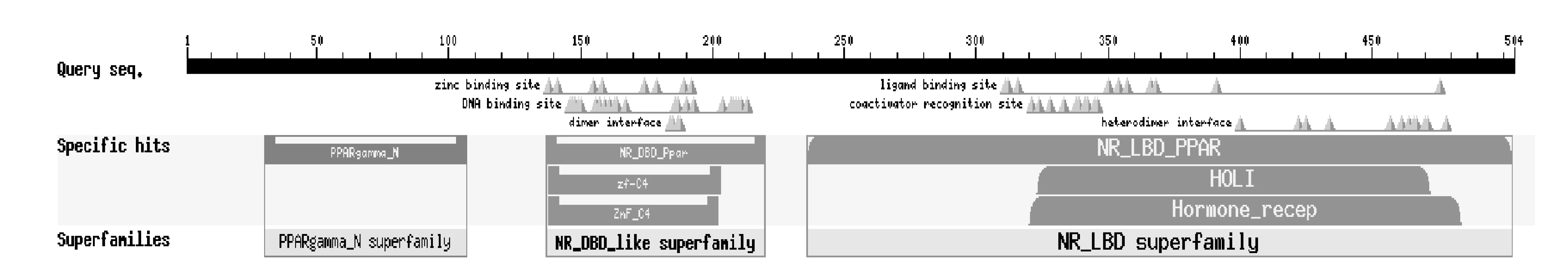
圖10 PPARγ蛋白結構域Fig.10 PPARγ protein domain
PPARγ 具有由鋅指結構(ZnF-C4)構成的DNA 結合域(DBD)、可變的N 端調控域、柔性鉸鏈和C 端配體結合域(LBD)。
由圖10、圖11 可知,豬PPARγ 外顯子5 由200 個核苷酸組成,編碼PPARγ 蛋白質第206~272 位氨基酸,第236~503位氨基酸構成其LBD。
由圖12、圖13 可知,PPARγ 外顯子5 跳躍產生的PPARγΔ5由于編碼框移位,終止密碼子提前,雖然具有完整的N端調控域和DBD結構域,但缺失了LBD結構。

圖12 PPARγΔ5蛋白缺失LBD氨基酸序列Fig.12 PPARγΔ5 protein lacks the LBD amino acid sequence
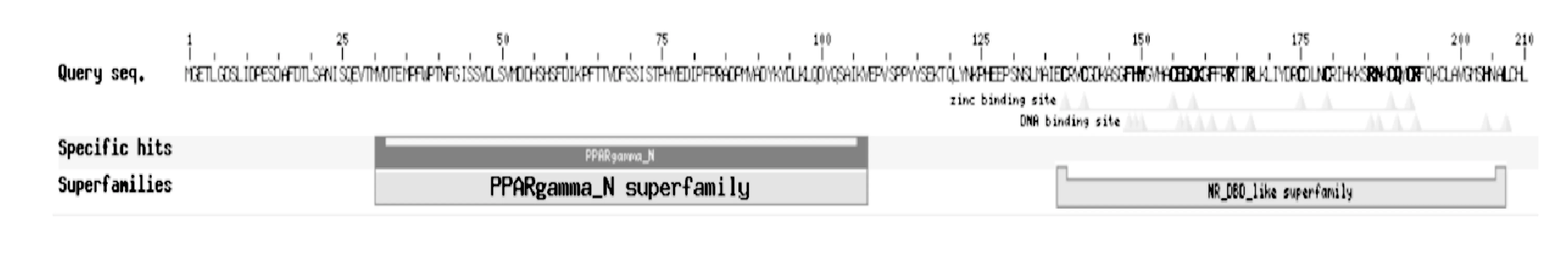
圖13 PPARγΔ5蛋白結構域Fig.13 PPARyΔ5 protein domain
3 討論
PPARγ是配體激活的核激素受體轉錄因子,調節脂肪細胞分化、脂肪生成和胰島素敏感性等多個生物學過程。PPARγ 是脂肪細胞分化的主要調控子,尚無在PPARγ 缺失時其他因子可促進該細胞進程的相關研究[6]。SRSF1與PPARγ外顯子6結合有助于其前體mRNA跳過外顯子5發生選擇性剪接,是因為PPARγ外顯子6中有SRSF1的結合位點[4]。有研究發現,人類脂肪組織及脂肪細胞均表達PPARγ Δ 5,并在脂肪形成的調控中起到重要作用[4]。PPARγ3 是豬脂肪細胞分化的主要調控因子,其mRNA 與人PPARγ序列均由7個外顯子序列組成,同源性較高。然而,豬PPARγ 前體mRNA 是否也通過選擇性剪接產生PPARγΔ5 的研究尚未見報道。本試驗對豬4 個組織器官進行檢測,結果表明,豬心臟、肝臟、皮下脂肪組織和背最長肌均表達PPARγΔ5,其組織表達變化與PPARγ一致,即在皮下脂肪組織表達水平最高,其次為背最長肌和肝臟,心臟表達水平最低,且表達水平在同一組織都顯著低于PPARγ。此外,PPARγΔ5 和PPARγ 的表達顯著正相關。上述結果均提示PPARγΔ5可能在豬脂肪細胞分化及脂肪形成中起到重要作用。
對蛋白質結構域的分析表明,與PPARγ 相同,PPARγΔ5 蛋白也具有DBD 結構域和N 端調控域,可與啟動子上的PPREs 序列結合調控靶基因轉錄[7]。研究表明,經天然配體脂肪酸衍生物或合成配體如羅格列酮激活后,PPARγ與其分子伴侶維甲酸X受體α(RXRα)形成異二聚體,通過激活靶基因表達[8],調控各種細胞過程,包括細胞成脂分化[9]。盡管PPARγΔ5 由于選擇性剪接產生的外顯子5 跳躍致使蛋白質編碼框移位,終止密碼子提前,導致PPARγΔ5 缺失LBD 結構,喪失了配體結合功能[3],但可通過競爭RXRα對野生型PPARγ活性產生顯性負性作用,從而調控脂肪細胞的分化[5]。因此,PPARγΔ5可能在豬脂肪細胞分化調控及其他生物學過程中發揮作用。
轉錄因子的反式激活活性調控包括蛋白質表達水平、配體結合及轉錄輔因子互作等多種方式。蛋白質翻譯后修飾可改變蛋白質構象、蛋白質互作及受體和配體間的親和力,從而調節下游基因的轉錄[10]。對磷酸化位點的信息分析表明,PPARγ 和PPARγΔ5 具有豐富的磷酸化位點。蛋白質磷酸化是調節PPARγ 活性的主要途徑之一[11]。在不同的刺激下,PPARγ 可以在不同的位點磷酸化,從而產生多樣的生物學效應[12]。細胞周期素依賴性蛋白激酶(CDK)和絲裂原激活蛋白激酶(MAPK)主要在Ser273[12-13]和Ser112 位點[14-15]磷酸化PPARγ。CDK5 介導的Ser273磷酸化降低PPARγ轉錄活性及脂肪形成,而CDK9/CDK7介導的Ser112 磷酸化可增強PPARγ 活性,促進細胞成脂分化[14-16]。CDK5 對PPARγ 的磷酸化可能有助于其與輔激活子過氧化物酶體增殖物激活受體-γ 輔激活因子1(PGC-1)和轉錄中介因子2(TIF2)的解離,促進與輔抑制子(SMRT)和核受體輔阻遏子(NCoR)相互作用[13]。NCoR可通過穩定CDK5 調節Ser273 位點的PPARγ 磷酸化[17]。當LBD 沒有與配體結合時,PPARγ/RXRα 與一些輔抑制因子如NCoR 結合;而當配體結合到LBD 時,PPARγ 構象改變,輔抑制因子被一些輔激活因子如cAMP反應元件結合蛋白(CREBP)、PGC-1 等取代[18]。PPARγ 與配體的結合及對輔因子的招募改變時,其反式激活活性和生物學功能將相應改變。PPARγΔ5 與PPARγ 相似,具有多個潛在的磷酸化位點,但由于其缺失LBD 結構域,可能對磷酸化修飾過程產生影響,從而導致生物學功能的改變。
PPARγΔ5 蛋白質的理化性質與PPARγ 類似,其肽鏈大部分位于親水區域,二級結構中主要為α-螺旋和無規則卷曲,β-轉角較少,容易形成球狀蛋白,符合親水性蛋白的特征。無規則卷曲通常也是蛋白質分子行使功能和構象變化的重要區域。對跨膜螺旋結構及亞細胞定位分析表明,兩種蛋白均無跨膜螺旋結構及信號肽結構,為非分泌蛋白,且主要定位于細胞核和細胞質,推測PPARγΔ5可能與PPARγ一樣作為核轉錄因子發揮作用。此外,蛋白結構的穩定性在很大程度上取決于分子內部的疏水作用,豬PPARγ 和PPARγΔ5 蛋白不穩定指數均大于40,說明兩個蛋白的結構穩定性較差,在細胞內發揮作用后可快速降解。
4 結論
PPARγΔ5 是PPARγ 的選擇性剪接亞型,豬皮下脂肪組織、背最長肌、肝臟和心臟均表達PPARγΔ5,且表達水平與PPARγ 正相關。對PPARγΔ5 和PPARγ 蛋白生物信息比較分析表明,PPARγΔ5為親水性非分泌蛋白,穩定性差,含有豐富的磷酸化位點,具有核轉錄因子的特征,可能通過競爭性的結合RXRα 抑制PPARγ 反式激活活性。PPARγΔ5 缺失LBD 結構域,其活性不依賴PPARγ 配體,可能具有與PPARγ不同的生物學功能,但尚需試驗驗證。

