植物褪黑素功能及其作用機制的研究進展
馬成 裴子琦 白雪 張騰國

摘要:褪黑素是一種重要的植物生長調節劑,在植物中具有多種功效。鑒于褪黑素在植物中的多種功能作用,為了給褪黑素在農業生產中的應用提供理論依據,通過查閱并梳理相關文獻,闡述了植物中褪黑素的合成及代謝途徑,褪黑素對植物生長發育的調控及對植物響應逆境脅迫的影響和褪黑素誘導作用的機制。褪黑素不僅參與植物種子萌發、根系發育、開花結果等生長發育過程,還能充當脅迫緩解劑,調節植物對多種生物脅迫/非生物脅迫的響應,且用外源褪黑素處理能夠有效地緩解低溫、干旱、鹽堿以及病蟲害等對植物的損傷程度,今后的研究應將盆栽試驗與田間試驗結合起來,以加速褪黑素在農業中的廣泛應用。
關鍵詞:褪黑素;植物;生長發育;脅迫響應;抗逆;信號通路
中圖分類號:S482.8? ? ? ? ? ? ? 文獻標志碼:A? ? ? ? ? ? ? 文章編號:2097-2172(2023)10-0883-06
doi:10.3969/j.issn.2097-2172.2023.10.001
Advances in Functions and Action Mechanisms of Phytomelatonin
MA Cheng, PEI Ziqi, BAI Xue, ZHANG Tengguo
(College of Life Sciences, Northwest Normal University, Lanzhou Gansu 730070, China)
Abstract: As a master plant growth regulator, melatonin possesses multiple functions in plants. Given the multiple functional roles of melatonin in plants, the synthesis and metabolic pathways of phytomelatonin, the regulation of plant growth and development, the effects on plant response to adversity stress by melatonin and the mechanism of melatonin-induced effects are elaborated through literature review to provide theoretical bases for melatonin's application in agricultural production. Melatonin is not only involved in the growth and development stages such as seed germination, root development, flowering, and fruiting, but also acts as stress mitigator to regulate the response of plants to a wide range of biotic/abiotic stresses, and the treatment with exogenous melatonin could effectively alleviate the damage of plants caused by low temperatures, droughts, salinity, as well as diseases and pests. Future research should link pot trials with field trials to accelerate the extensive use of melatonin in agriculture.
Key words: Melatonin; Plant; Growth and development; Stress response; Stress resistance; Signaling pathway
褪黑素(Melatonin)又名N-乙酰基-5-甲氧基色胺,是一種吲哚胺類物質。最初發現于牛的松果體中,因其能引起蝌蚪膚色由黑到白的變化而得名。此后的研究表明這種物質廣泛分布于動植物體中[1 ]。在動物中,它具有調節晝夜節律、增強免疫力、抑制衰老等多種功效[2 ]。在植物中,褪黑素扮演著生長促進劑和抗氧化劑的角色,參與植物各種各樣的生長發育和生理生化代謝過程,能促進種子萌發、調控根系形態建成、調節氣孔的開度、調節碳同化和ATP積累等[3 - 5 ]。基于褪黑素具有自由基清除和抗氧化等功能,褪黑素在植物響應生物或非生物脅迫過程中同樣發揮著重要的作用,并且外源褪黑素處理能夠有效地緩解低溫、干旱、鹽堿以及病蟲害等脅迫對植物的損傷程度[6 ]。目前對于褪黑素生物學功能及其作用機制的研究較受關注,褪黑素已逐漸成為植物生長調節劑和激素研究的新熱點。隨著生命科學領域研究技術的不斷進步和突破,研究人員已對植物褪黑素的合成和代謝、不同物種和組織中褪黑素的含量和分布及植物褪黑素的生物學功能進行了全方位、深層次的闡述;鑒于褪黑素在植物響應逆境脅迫中的卓越貢獻,研究人員也已分別從表型、生理和分子等不同層面揭示了褪黑素對逆境脅迫下植物的影響并對其具體作用機制進行了逐一解析。現從植物褪黑素的合成和代謝途徑、褪黑素對植物生長發育的調控、褪黑素對植物響應逆境脅迫的影響以及褪黑素誘抗作用的機制四個方面進行了綜述,以期為褪黑素的研究及其在農業生產中的應用提供參考。
1? ?褪黑素在植物體內的合成及代謝
在動物體內褪黑素的生物合成途徑已被廣泛研究,其以色氨酸為底物通過4個連續的步驟合成[7 ]。然而,研究發現植物中褪黑素的合成途徑與動物的明顯不同。植物中褪黑素合成的主要部位在葉綠體和線粒體中,這些細胞器根據共內生假說從他們的藍藻和α-變形菌祖先那里繼承了褪黑素生物合成能力[8 ];在植物中,色氨酸首先在色氨酸脫羧酶(TDC)作用下脫羧生成色胺,隨后色胺被色胺5-羥化酶(T5H)羥化生成5-羥色胺[9 ]。此后有兩個獨立的途徑合成褪黑素(圖1),第一個途徑與動物中的后兩步途徑類似:5-羥色胺被5-羥色胺-N-乙酰基轉移酶(SNAT)乙酰化為N-乙酰-5-羥色胺,最后在5-羥色胺-N-乙酰基轉移酶(ASMT)/咖啡酸-O-甲基轉移酶(COMT)作用下生成褪黑素。另外一個替代途徑,它的褪黑素合成順序剛好與動物中的順序相反:5-羥色胺首先在ASMT/COMT作用下生成5-甲氧基色胺,后被SNAT乙酰化為褪黑素[10 ]。值得注意的是在植物中,雖然這兩條途徑是平行存在的,但是在正常條件下前者是褪黑素合成的主要途徑,而在脅迫條件下,后者是褪黑素合成的主要途徑[7 ]。
在動物中褪黑素能夠通過酶促反應、假酶促反應以及非酶促反應分解產生多種代謝物,表明褪黑素在動物中的代謝是高度復雜的[11 ]。在植物中對于褪黑素代謝的研究相對滯后,研究發現,植物褪黑素能夠通過酶和非酶促反應降解;N1-乙酰基-N2-甲酰基-5-甲氧基犬尿酰胺(AFMK)是第一個在植物中被發現的褪黑素代謝物,它是由細胞色素P450、吲哚胺2,3-雙加氧酶等通過催化褪黑素產生的[12 ]。此外,在植物中還發現了另一種代謝物—羥基化褪黑素,其包括2-羥褪黑素(2-OHM)、4-羥褪黑素(4-OHM)、6-羥褪黑素(6-OHM)以及環-3-羥褪黑素(C3-OHM),2-OHM代謝途徑被認為是植物褪黑素分解的主要途徑,褪黑素2-羥基酶(M2H)催化褪黑素分解形成2-OHM[2 ]。最后,研究表明褪黑素催化效率要遠遠高于其合成速率,褪黑素的代謝速率在植物體始終維持在較高水平,說明褪黑素的生理活性與其分解代謝物密切相關[13 ]。
2? ?褪黑素在植物生長發育過程中的作用
自從1995年Dubbels等[14 ]在幾種植物中鑒定出褪黑素后,越來越多的研究開始關注褪黑素在植物中的作用。在目前看來,植物褪黑素具有多種作用,參與調控植物體內多種生理生化代謝過程[15 ]。研究表明,褪黑素可以自由穿透種皮,通過改變糖異生途徑為種子萌發提供能量,提高種子活力和萌發率[16 ]。此外,褪黑素也能整合ABA、赤霉素以及生長素信號調控種子的萌發[17 ],在植物根系形態建成過程中褪黑素同樣發揮著重要的作用,可在側根誘導階段能夠通過誘導IAA水平和上調MdWOX11促進蘋果不定根的形成[18 ],并且外源褪黑素以生長素信號通路依賴的方式顯著促進了水稻側根形成和發育[19 ]。10-9~ 10-6 M 的褪黑素能夠如同IAA一樣促進擬南芥野生型及pin-formed(pin)單突變體和雙突變體的初生根生長,然而,在高濃度的生長素生物合成抑制劑或極性轉運抑制劑存在下,褪黑激素處理對初生根生長幾乎沒有影響[20 ]。Yang等[21 ]發現,當褪黑素的濃度超過1 000 μM時,會抑制擬南芥初生根的生長,促進其側根的發育。在調控植物生長發育方面,褪黑素也是植物激素中的佼佼者;Teng等[5 ]發現,外源褪黑素處理促進了油菜幼苗莖和根的生長,同時提高了PSI中的循環電子傳輸速率、熒光量子產率與PSII和PSI之間的電子傳輸效率,并且通過引起由廣泛基因表達譜的協調變化引發的代謝調整來促進油菜生長。在培養基中添加較低濃度褪黑素(20 μM)能夠促進甜菊種子萌發,提高甜葉菊植株的鮮重、莖長以及葉片的數量[22 ]。在另外一項研究中,Mir等[23 ]發現40 μM的褪黑素能夠引起大多數指標(如生長、光合作用、養分和酶活性等)以濃度依賴性的方式增加,并且通過增強抗氧化酶活性來減少芥菜中活性氧(ROS)的積累。150 μM褪黑素處理通過增加葡萄幼苗的生物量和促進葉片的光合性能促進了葡萄幼苗的發育和生長;光合作用水平的提高則引起光合產物——蔗糖含量的增加。褪黑素處理同樣提高了蔗糖代謝相關酶的活性,使大量蔗糖水解為葡萄糖和果糖,滿足葡萄幼苗快速生長的需要,導致葡萄幼苗的抵抗力和對環境變化的適應能力更強[24 ]。在玉米中,50 μM褪黑素浸種顯著增加了玉米單粒重及優質、中等和劣質種子的種子灌漿率,且褪黑素的應用顯著增加了玉米素+玉米素核苷(Z+ZR)、吲哚-3-乙酸(IAA)和赤霉酸(GA)的含量[25 ]。外源應用褪黑激素(10、100、1000 μM)顯著增加了玉米幼苗根長、株高、葉表面積以及蛋白質、碳水化合物和葉綠素含量,對參與氮同化過程的酶的活性和基因表達產生了強烈的誘導作用。此外,也顯著誘導了檸檬酸合成酶和細胞色素氧化酶的基因表達、提高了Rubisco活性和Rubisco活化酶的基因表達水平[26 ]。木質素含量的變化在植物生長發育中起著重要作用。褪黑激素處理在茶葉中的第8天和第16天觸發了木質化,提高了參與木質素形成的POD的活性[27 ]。另外,Liu等[28 ]的研究發現褪黑素通過提高梨果實發育后期的凈光合速率和光系統II光化學的最大量子效率增加了梨果實的大小,并且褪黑激素通過調節vAINV、NINV、SUSY和SPS的活性,使可溶性糖和還原糖含量增加,進而引起蔗糖和山梨糖醇含量的升高。調控花發育方面,褪黑素通過保護花器官和參與光周期誘導的花轉變,直接或間接地調節花的節律和數量[1 ]。褪黑素作為一種強大的抗氧化劑,能有效清除冗余的ROS,抑制衰老相關基因的表達[29 ];褪黑素也能夠通過調控黃酮類化合物的合成來緩解葉片的衰老[30 ]。
3? ?褪黑素在植物響應逆境脅迫中的作用
隨著對褪黑素研究的不斷深入,越來越多的研究揭示了它在植物響應逆境脅迫中的作用。研究發現褪黑素能夠緩解滲透脅迫、極端溫度脅迫、鹽堿脅迫、營養元素匱乏脅迫以及重金屬離子脅迫等非生物脅迫和病蟲害等生物脅迫對植物的損傷,增強植物自身脅迫耐受性[31 ]。通過激活ICE-CBF-COR途徑,褪黑素能夠緩解低溫對植物造成的損傷,提高植物對低溫脅迫的耐受性[32 ]。過表達SNAT(5-羥色胺-N-乙酰基轉移酶)的水稻同樣表現出更強的耐寒性[33 ]。此外,研究發現褪黑素也能通過清除過量的ROS和維持氧化還原穩態來降低極端溫度脅迫對植物的損傷[34 ]。對于鹽脅迫而言,褪黑素可以緩解鹽脅迫對植物光合機構的氧化損傷,提高光合作用的效率[35 ];并且外源褪黑素的應用也能夠激活抗氧化酶系統、增加滲透調節物質含量以及誘導脅迫響應基因表達,減少ROS的過量積累[36 ]。干旱脅迫嚴重制約著農作物的產量,研究發現褪黑素通過調控滲透調節物質含量、糖代謝和ABA穩態以及抗氧化酶系統有效緩解了干旱脅迫誘導的馬鈴薯氧化應激[37 ]。鎘、鉛和鋅等重金屬對植物有較強的生長抑制作用,褪黑素可以控制植物對金屬離子的吸收和螯合,進而調控植物對重金屬脅迫的耐受性[38 ]。此外,褪黑素也能夠通過協同信號分子或激活信號轉導途徑,提高植物對眾多生物脅迫的抗性。過表達 N-乙酰血清素甲基轉移酶(ASMT)或血清素N-乙酰轉移酶(SNAT)的擬南芥株系表現出抗性基因PR1和PR5、轉錄因子基因 WRKY33和茉莉酸(JA)防御途徑標記基因PDF1.2的表達上調,從而減輕了植物病害癥狀,減少了葉片中灰霉病的病斑大小[39 ]。炭疽病是最具破壞性的辣椒病害之一,研究表明,褪黑素能夠有效調控幾丁質酶基因(CaChiIII2)和其他致病相關基因的表達,維持細胞內H2O2濃度的穩定,并增強抗氧化酶的活性,最終提高辣椒對炭疽病的抗性[40 ]。
4? ?褪黑素誘抗作用機制的探究
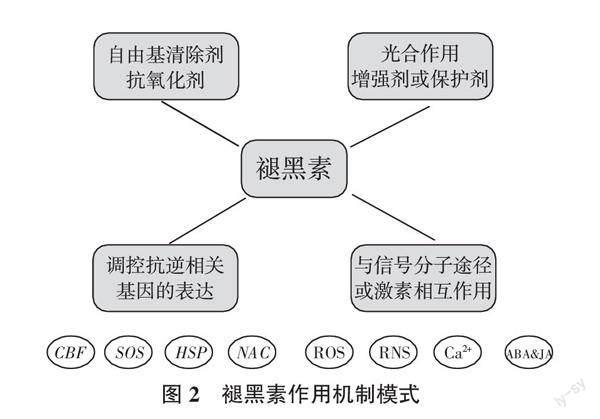
研究表明,褪黑素主要從以下幾個方面增強植物對逆境脅迫的抗性(圖2)。第一,褪黑素本身作為一種多功能的自由基清除劑和抗氧化劑,能夠參與清除植物體內過量積累的ROS,維持氧化還原穩態[41 ]。褪黑素能夠有效降低ROS的積累水平,緩解低溫、干旱等脅迫引起的氧化應激損傷[36 ]。外源褪黑素處理后,很多抗氧化酶的活性和抗氧化劑的水平都會出現不同程度的提高,抗氧化酶編碼基因的表達水平同樣會被上調,由此提高植物對脅迫的耐受性[6 ]。此外,研究證實褪黑素代謝物也具有抗氧化特性。相比褪黑素,3-OHM具有更強的抗氧化性,能夠有效清除·OH和·OOH[42 ]。第二,褪黑素在逆境脅迫中可以作為光合作用的增強劑或保護劑。研究發現褪黑素能夠對糖代謝和糖異生途徑產生影響,從而控制植物的光合碳循環;也有研究發現,褪黑素能夠調控光系統基因的表達水平,調節葉綠素的合成和降解以及促進葉黃素循環,減輕外界環境脅迫引起的光合抑制[43 ]。第三,褪黑素能夠參與調控抗逆相關基因的表達,提高植物脅迫耐受性。響應低溫脅迫的CBF、響應鹽脅迫的SOS、響應熱脅迫的HSP、響應干旱脅迫的NAC等脅迫響應基因的表達都會受到褪黑素不同程度的調節[15, 31 ]。此外,褪黑素也通過參與調控激素分解代謝基因和合成基因的表達來提高植物的抗逆性[44 ]。第四,褪黑素可直接與其他信號分子/途徑或植物激素信號相互作用,從而增強植物對逆境脅迫的抗性[31 ]。已有的研究表明,褪黑素賦予植物脅迫耐受性的過程與ROS或活性氮(RNS)信號以及植物激素信號之間存在著密切的關系[45 ]。褪黑素誘導西瓜幼苗CBF反應途徑和耐寒性的過程依賴于H2O2信號[32 ]。NO清除劑與褪黑素的復合處理顯著抑制了外源褪黑素對鹽漬脅迫下黃瓜幼苗氧化還原穩態和光合效率的調控作用[46 ]。褪黑素通過調節ABA信號和JA的積累促進了低溫脅迫下黃瓜種子的萌發和嫁接西瓜幼苗的耐寒性[47 - 48 ]。此外,鈣信號在褪黑素行使其生物學功能的過程中同樣發揮著重要的作用。褪黑素拮抗ABA信號促進甜瓜種子萌發的過程依賴于液泡H+/Ca2+反轉運體3(CAX3)介導的Ca2+外排[49 ]。RNA-seq分析同樣表明褪黑素提高棉花耐鹽性的過程需要鈣信號的參與[50 ]。由此可見,褪黑素介導植物對逆境脅迫的誘抗效應需要多種信號分子/途徑或激素的參與。
5? ?展望
作為一種多功能的植物生長調節劑,褪黑素已成為近些年來國內外研究的熱點。研究發現植物自身也能夠合成這種吲哚類物質,并且在植物整個生命進程中發揮著不可替代的作用。隨著對植物褪黑素研究的不斷深入,研究人員已分別從表型、生理和分子等不同層面揭示了褪黑素對逆境脅迫下植物的影響。然而,目前對于褪黑素作用機制的研究仍處于起始階段,一些參與褪黑素發揮功能的關鍵信號分子以及信號通路仍沒有被完全解析。因此使用多組學整合分析和CRISPR- Cas9技術來全面揭示褪黑素具體作用分子機制具有十分重要的意義。此外,CAND2/PMTR1是第一個被鑒定的植物褪黑素受體,是褪黑素誘導擬南芥氣孔關閉所必需的[51 ];研究發現與野生型Col-0相比,褪黑素介導的絲裂原活化蛋白激酶(MAPK)激活在cand2突變系中沒有被消除[52 ],因此對于植物褪黑素受體的研究仍然是需要的。最后,目前關于褪黑素在植物上的應用主要集中在實驗室可控環境下的盆栽試驗研究,今后的研究應該更多的將盆栽試驗與田間試驗結合起來,推廣褪黑素在農業生產上的應用。
參考文獻:
[1] WANG K, XING Q, AHAMMED G J, et al. Functions and prospects of melatonin in plant growth, yield, and quality[J].? Journal of Experimental Botany, 2022, 73(17): 5928-5946.
[2] ZENG W, MOSTAFA S, LU Z, et al. Melatonin-mediated abiotic stress tolerance in plants[J].? Frontiers in Plant Science, 2022, 13: 847175.
[3] PAN Y, XU X, LI L, et al. Melatonin-mediated development and abiotic stress tolerance in plants[J].? Frontiers in Plant Science, 2023, 14: 1100827.
[4] HU D, ZHANG X, XUE P, et al.? Exogenous melatonin ameliorates heat damages by regulating growth, photosynthetic efficiency and leaf ultrastructure of carnation[J]. Plant Physiology and Biochemistry, 2023, 198: 107698.
[5] TENG Z, ZHENG W, JIANG S, et al. Role of melatonin in promoting plant growth by regulating carbon assimilation and ATP accumulation[J].? Plant Science, 2022, 319: 111276.
[6] KHANNA K, BHARDWAJ R, ALAM P, et al. Phytomelatonin: A master regulator for plant oxidative stress management[J].? Plant Physiology and Biochemistry, 2023, 196: 260-269.
[7] TAN D X, REITER R J. An evolutionary view of melatonin synthesis and metabolism related to its biological functions in plants[J].? Journal of Experimental Botany, 2020, 71(16): 4677-4689.
[8] KHAN M S S, AHMED S, IKRAM A U L, et al. Phytomelatonin: A key regulator of redox and phytohormones signaling against biotic/abiotic stresses[J].? Redox Biology, 2023, 64: 102805.
[9] LIU G, HU Q, ZHANG X, et al.? Melatonin biosynthesis and signal transduction in plants in response to environmental conditions[J].? Journal of Experimental Botany, 2022, 73(17): 5818-5827.
[10] COLOMBAGE R, SINGH M B, BHALLA P L.? Melatonin and abiotic stress tolerance in crop plants[J].? International Journal of Molecular Sciences, 2023, 24(8): 7447.
[11] TAN D X, HARDELAND R, MANCHESTER L C, et al. The changing biological roles of melatonin during evolution: from an antioxidant to signals of darkness, sexual selection and fitness[J].? Biological Reviews, 2009,85(3): 607-623.
[12] BACK K.? Melatonin metabolism, signaling and possible roles in plants[J].? The Plant Journal, 2021, 105(2): 376-391.
[13] BYEON Y, TAN D X, REITER R J, et al.? Predominance of 2-hydroxymelatonin over melatonin in plants[J].? Journal of Pineal Research, 2015, 59(4): 448-454.
[14] DUBBELS R, REITER R J, KLENKE E, et al. Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry[J].? Journal of Pineal Research, 1995, 18(1): 28-31.
[15]ZHANG T, WANG J, SUN Y, et al. Versatile roles of melatonin in growth and stress tolerance in plants[J].? Journal of Plant Growth Regulation, 2021, 41: 507-523.
[16] KOBYLI?譵SKA A, BOREK S, POSMYK M M. Melatonin redirects carbohydrates metabolism during sugar starvation in plant cells[J].? Journal of Pineal Research, 2018, 64(4): e12466.
[17] LV Y, PAN J, WANG H, et al.? Melatonin inhibits seed germination by crosstalk with abscisic acid, gibberellin, and auxin in Arabidopsis[J].? Journal of Pineal Research, 2021, 70(4):e12736.
[18] MAO J, NIU C, LI K, et al.? Melatonin promotes adventitious root formation in apple by promoting the function of MdWOX11[J].? BMC Plant Biology, 2020, 20(1): 536.
[19] LIANG C, LI A, YU H, et al.? Melatonin regulates root architecture by modulating auxin response in rice[J].? Frontiers in Plant Science, 2017, 8: 134.
[20] YANG L, YOU J, LI J, et al.? Melatonin promotes Arabidopsis primary root growth in an IAA-dependent manner[J].? Journal of Experimental Botany, 2021, 72(15): 5599-5611.
[21] YANG L, SUN Q, WANG Y, et al.? Global transcriptomic network of melatonin regulated root growth in Arabidopsis[J].? Gene, 2021, 764: 145082.
[22] SIMLAT M, PTAK A, SKRZYPEK E, et al. Melatonin significantly influences seed germination and seedling growth of Stevia rebaudiana Bertoni[J].? PeerJ, 2018, 6: e5009.
[23] MIR A R, SIDDIQUI H, ALAM P, et al. Melatonin modulates photosynthesis, redox status, and elemental composition to promote growth of Brassica juncea—a dose-dependent effect[J].? Protoplasma, 2020, 257(6): 1685-1700.
[24] ZHONG L, LIN L, YANG L, et al.? Exogenous melatonin promotes growth and sucrose metabolism of grape seedlings[J].? PLOS ONE, 2020, 15(4): e0232033.
[25] AHMAD S, KAMRAN M, ZHOU X, et al.? Melatonin improves the seed filling rate and endogenous hormonal mechanism in grains of summer maize[J].? Physiologia Plantarum, 2021, 172(2): 1059-1072.
[26] ERDAL S.? Melatonin promotes plant growth by maintaining integration and coordination between carbon and nitrogen metabolisms[J].? Plant Cell Reports, 2019, 38(8): 1001-1012.
[27] HAN M HUA, YANG N, WAN Q WEN, et al.? Exogenous melatonin positively regulates lignin biosynthesis in Camellia sinensis[J].? International Journal of Biological Macromolecules, 2021, 179: 485-499.
[28] LIU J, YUE R, SI M, ET al.? Effects of Exogenous application of melatonin on quality and sugar metabolism in ‘zaosu pear fruit[J].? Journal of Plant Growth Regulation, 2019, 38(3): 1161-1169.
[29] JAHAN M S, SHU S, WANG Y, et al.? Melatonin pretreatment confers heat tolerance and repression of heat-induced senescence in tomato through the modulation of ABA- and GA-mediated pathways[J].? Frontiers in Plant Science, 2021, 12:650955.
[30] LIANG D, SHEN Y, NI Z, et al.? Exogenous melatonin application delays senescence of kiwifruit leaves by regulating the antioxidant capacity and biosynthesis of flavonoids[J].? Frontiers in Plant Science, 2018, 9: 426.
[31] WANG Y, REITER R J, CHAN Z. Phytomelatonin: a universal abiotic stress regulator[J].? Journal of Experimental Botany, 2018, 69(5): 963-974.
[32]CHANG J, GUO Y, LI J, et al. Positive interaction between H2O2 and Ca2+ mediates melatonin-induced CBF pathway and cold tolerance in watermelon (Citrullus lanatus L.)[J].? Antioxidants, 2021, 10(9): 1457.
[33] KANG K, LEE K, PARK S, et al. Enhanced production of melatonin by ectopic overexpression of human serotonin N-acetyltransferase plays a role in cold resistance in transgenic rice seedlings[J].? Journal of Pineal Research, 2010, 49(2): 176-182.
[34] QARI S H, HASSAN M U, CHATTHA M U, et al.? Melatonin induced cold tolerance in plants: physiological and molecular responses[J].? Frontiers in Plant Science, 2022, 13: 843071.
[35] YAN F, ZHANG J, LI W, et al.? Exogenous melatonin alleviates salt stress by improving leaf photosynthesis in rice seedlings[J].? Plant Physiology and Biochemistry, 2021, 163: 367-375.
[36]KHAN M, ALI S, MANGHWAR H, et al. Melatonin function and crosstalk with other phytohormones under normal and stressful conditions[J].? Genes, 2022, 13(10): 1699.
[37] EL-YAZIED A A, IBRAHIM M F M, IBRAHIM M A R, et al.? Melatonin mitigates drought induced oxidative stress in potato plants through modulation of osmolytes, sugar metabolism, ABA homeostasis and antioxidant enzymes[J].? Plants, 2022, 11(9): 1151.
[38] ALTAF M A, SHARMA N, SRIVASTAVA D, et al. Deciphering the melatonin-mediated response and signalling in the regulation of heavy metal stress in plants[J].? Planta, 2023, 257(6): 115.
[39] ZHU Y, GUO M J, SONG J B, et al. Roles of endogenous melatonin in resistance to Botrytis cinerea infection in an Arabidopsis model[J].? Frontiers in Plant Science, 2021, 12: 683228.
[40] ALI M, TUMBEH LAMIN-SAMU A, MUHAMMAD I, et al. Melatonin mitigates the infection of Colletotrichum gloeosporioides via modulation of the chitinase gene and antioxidant activity in Capsicum annuum L.[J].? Antioxidants, 2020, 10(1): 7.
[41]PARDO-HERN?魣NDEZ M, L?譫PEZ-DELACALLE M, RIVERO R M. ROS and NO regulation by melatonin under abiotic stress in plants[J]. Antioxidants, 2020, 9(11): 1078.
[42] ZHANG H M, ZHANG Y.? Melatonin: a well-documented antioxidant with conditional pro-oxidant actions[J].? Journal of Pineal Research, 2014, 57(2): 131-146.
[43] YANG S, ZHAO Y, QIN X, et al.? New insights into the role of melatonin in photosynthesis[J].? Journal of Experimental Botany, 2022, 73(17): 5918-5927.
[44]ARNAO M B, HERN?魣NDEZ-RUIZ J. Melatonin as a regulatory hub of plant hormone levels and action in stress situations[J]. Plant Biology, 2021, 23(S1): 7-19.
[45] ARNAO M B, HERN?魣NDEZ-RUIZ J.? Melatonin: A new plant hormone and/or a plant master regulator?[J].? Trends in Plant Science, 2019, 24(1): 38-48.
[46] SUN Y, MA C, KANG X, et al. Hydrogen sulfide and nitric oxide are involved in melatonin-induced salt tolerance in cucumber[J].? Plant Physiology and Biochemistry, 2021, 167: 101-112.
[47] ZHANG H, QIU Y, JI Y, et al.? Melatonin promotes seed germination via regulation of ABA signaling under low temperature stress in cucumber[J].? Journal of Plant Growth Regulation, 2023, 42(4): 2232-2245.
[48] LI H, GUO Y, LAN Z, et al. Methyl jasmonate mediates melatonin-induced cold tolerance of grafted watermelon plants[J].? Horticulture Research, 2021, 8(1): 57.
[49] LI H, GUO Y, LAN Z, et al.? Melatonin antagonizes ABA action to promote seed germination by regulating Ca2+ efflux and H2O2 accumulation[J].? Plant Science, 2021, 303: 110761.
[50] ZHANG Y, FAN Y, RUI C, et al.? Melatonin improves cotton salt tolerance by regulating ROS scavenging system and Ca2+ signal transduction[J].? Frontiers in Plant Science, 2021, 12: 693690.
[51] WEI J, LI D X, ZHANG J R, et al.? Phytomelatonin receptor PMTR1-mediated signaling regulates stomatal closure in Arabidopsis thaliana[J].? Journal of Pineal Research, 2018, 65(2): e12500.
[52] LEE H Y, BACK K. The phytomelatonin receptor(PMRT1) Arabidopsis Cand2 is not a bona fide G protein-coupled melatonin receptor[J]. Melatonin Research, 2020, 3(2): 177-186.
收稿日期:2023 - 09 - 08
基金項目:國家自然科學基金項目(32060711)。
作者簡介:馬? ?成(1997 — ),男,青海西寧人,博士在讀,主要從事褪黑素等激素及生長調節物對植物逆境脅迫的緩解作用及分子機制研究工作。Email: 799134494@qq.com。
通信作者:張騰國(1971 — ),男,甘肅會寧人,教授,博士生導師,研究方向為植物抗逆生理與分子生物學。Email:zhangtengguo@163.com。

