廣東省某三甲醫院取消頭孢菌素類抗菌藥物常規皮試實踐
王 燕,林雅靜,梁海明,蔡偉明(廣東醫科大學附屬醫院藥學部,廣東湛江 524001)
頭孢菌素類抗菌藥物因其抗菌譜廣、抗菌作用強、不良反應少,是臨床最常用的抗菌藥物之一[1]。頭孢菌素使用前是否進行皮膚試驗(以下簡稱“皮試”),國內外一直存在較大爭議。近年來,國家及地方學會相繼提出使用頭孢菌素前無需常規皮試[2-7],全國醫療機構頭孢菌素皮試現狀調查顯示,目前仍有48.2%的醫療機構選擇進行頭孢菌素常規皮試[8]。本文通過對廣東醫科大學附屬醫院(以下簡稱“我院”)取消頭孢菌素常規皮試的實踐成效進行分析總結,旨在為其他醫療機構規范頭孢菌素皮試提供參考。
1 資料和方法
1.1 數據收集
我院于2018 年10 月1 日正式取消頭孢菌素用藥前常規皮試。收集2014.10-2018.09 和2018.10-2022.09我院皮試管理規定發布實施前后4 a的頭孢菌素皮試相關數據及藥品不良反應上報數據,計算皮試率(皮試率=皮試樣本數/使用注射用頭孢菌素樣本數)、節省的直接醫療成本[1](直接醫療成本=皮試藥物費用+耗材費用+護理人員操作費用)、過敏反應發生率(過敏反應發生率=發生過敏反應的樣本數/使用注射用頭孢菌素樣本數),速發型過敏反應包括一般速發型過敏反應和嚴重速發型過敏反應。我院在用的頭孢菌素類藥物中,僅有注射用鹽酸頭孢替安(生產企業為上海上藥新亞藥業有限公司)按說明書要求做皮膚敏感試驗。
1.2 統計學處理
采用SPSS 27.0 軟件,選用χ2檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 皮試數量
本研究調查顯示發布《頭孢菌素皮試管理規定》后,全院51 個臨床科室,92.2%的臨床科室取消了常規皮試。2021.4.16 國家衛生健康委發布了《β內酰胺類抗菌藥物皮膚試驗指導原則(2021 年版)》(以下簡稱《指導原則》)后,所有臨床科室全面取消頭孢菌素常規皮試。取消頭孢菌素常規皮試前(2014.10-2018.09)頭孢菌素使用人次為82 656 人次,皮試人次為82 444 人次,皮試率為99.7%,取消常規皮試后(2018.10-2022.09)頭孢菌素使用人次為105 924 人次,皮試人次為10 242 人次,皮試率僅為9.7%,差異有統計學意義(P<0.01)。
2.2 皮試費用
2014.10 -2018.09 未做皮試人次212 人次,節省頭孢菌素皮試費用僅為9 324.06 元,2018.10-2022.09未做皮試人次95 682 人次,節省頭孢菌素皮試費用達3 693 113.85 元。
2.3 頭孢菌素過敏反應
2014.10 -2018.09 與2018.10-2022.09 上報頭孢菌素引起的速發型過敏反應和嚴重過敏反應發生率的差異均無統計學意義(P>0.05),見表1。
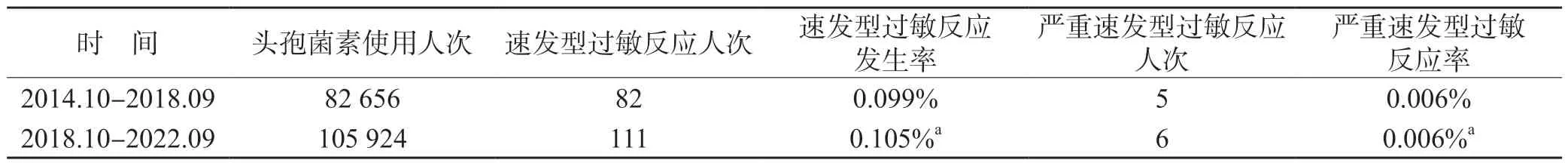
表1 頭孢菌素使用人次和過敏反應發生情況
2.4 頭孢替安使用人次、皮試率及過敏反應
與2014.10-2018.09 相比,取消頭孢菌常規皮試后,說明書要求皮試的頭孢替安的使用人次下降,皮試率下降(P<0.01),但均未發生嚴重過敏反應,且速發型過敏反應發生率差異無統計學意義(P>0.05),見表2。

表2 頭孢替安使用人次、皮試率及過敏反應發生情況
3 討論
取消頭孢菌素皮試得到了我院絕大多數醫護人員的支持,調查數據顯示我院頭孢菌素的皮試率明顯下降。從藥物經濟學角度分析,原藥皮試會造成很大的皮試資源浪費,與先前的研究結果一樣[9-12]。本研究顯示取消頭孢菌素常規皮試,大大降低了皮試直接醫療成本,此外先前研究顯示頭孢菌素皮試還會增加護理人力成本,由于皮試陽性率低,皮試產生的成本明顯高于通過皮試減少的過敏反應成本[1]。目前皮試帶來的直接醫療成本,主要由患者和醫保支付,因此取消頭孢菌素皮試,不僅可以為醫院和醫保節省成本,而且也會減輕患者的經濟負擔[11,13]。
對頭孢菌素過敏反應引發醫療糾紛的擔憂是部分醫院堅持頭孢菌素常規皮試的主要原因[14-15]。與國內外研究結果相似[16-17],本研究結果顯示,取消頭孢菌素常規皮試,并未增加速發型過敏反應特別是嚴重的速發型過敏反應的發生率,頭孢菌素皮試不能有效預測速發型過敏反應。
根據《指導原則》,我院僅在以下兩種情況才需要皮試:(1)既往有明確的青霉素或頭孢菌素I型(速發型)過敏史患者;(2)藥品說明書中規定需進行皮試的。根據《指導原則》及藥品說明書,我院僅有頭孢替安需常規行皮試。本研究發現取消頭孢菌素皮試后,頭孢替安的使用量下降,可能的原因是隨著醫生對頭孢菌素皮試認識不斷提高,部分醫生盡量避免選用說明書要求皮試的品種有關,通過詳細詢問過敏史,做好過敏性休克等嚴重過敏反應救治準備來替代進行頭孢替安皮試[7-8],本研究結果顯示隨著頭孢替安皮試率下降,速發型過敏反應發生率并未增加。因此說明書要求皮試的頭孢替安,其皮試意義不大。
關于頭孢替安皮試的描述,不同廠家說明書有所不同,如生產企業為上海上藥新亞藥業有限公司的說明書只提及“最好注射前做皮膚敏感試驗”,未提供具體的皮試方法、判定方法及配套的皮試試劑。而國內其他制藥企業說明書雖然給出了皮試液配制方法、皮試操作方法及判定方法,但推薦皮試液濃度為300 mg/L左右,皮內注射0.02 mL。說明書關于頭孢替安皮試液濃度和皮內注射用量,與《頭孢類抗菌藥物皮膚過敏試驗專家共識》推薦的皮試液濃度300~500 mg/L,皮內注射0.1 mL及《指導原則》推薦濃度2 g/L(即為2 000 mg/L),皮內注射0.02~0.03 mL差異較大,此外說明書給出的皮試結果判定方法與《指導原則》也存在差異[7,18-20]。頭孢替安是日本武田藥品工業株式會社研制的第二代頭孢菌素[21],1981 年首次在日本上市,上市時其說明書要求行皮試,2004 年日本取消頭孢菌素皮試,刪除了頭孢菌素說明書“重要警告”關于需要皮試的建議,頭孢替安原研藥說明書就不再要求皮試。因此目前不同廠家頭孢替安說明書對皮試的規定缺乏統一性、規范性,國家相關管理部門應督促制藥企業嚴格依照循證證據更新、修訂藥品說明書,對說明書規定皮試的頭孢菌素,在說明書中詳細闡明引發過敏反應的機理,皮試的靈敏度、特異度、陽性預測值和陰性預測值,并提供配套的皮試試劑。同時醫療機構可以通過避免采購說明書要求皮試的頭孢菌素,來推動制藥企業規范說明書。
綜上所述,通過推進取消頭孢菌素常規皮試的臨床實踐,可以降低醫院和患者成本,減輕醫務人員工作量,不增加過敏反應的發生。但本研究僅對一家醫院進行了調查,所得數據有一定的局限性。

