鹽酸小檗堿通過調節自噬抑制口腔鱗狀細胞癌增殖的研究
肖金枝,余 偉,張 昊
口腔癌是頭頸部最常見的一種惡性腫瘤,其中90%的患者病理診斷為口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)[1-2]。目前,多數患者接受以手術為主,聯合放化療的治療方案[3]。但因口腔癌高惡性、易復發、易引起其他臟器受損等問題[4],患者的5年生存率僅為50%~70%[2-3]。化療是輔助腫瘤治療的重要手段,但其在治療過程中會產生許多不良后果,其中化療藥物的耐藥性是困擾臨床工作者的一大難題,克服耐藥性是一項艱巨的挑戰[5]。有文獻指出一些化療藥物治療多種腫瘤時可發生細胞的自噬。自噬是細胞死亡的一種方式,其能幫助細胞自我降解,參與調節物質代謝平衡,在腫瘤中發揮著雙重作用,且有報道指出其與口腔鱗狀細胞癌密切相關[6-8]。
隨著現代醫學的發展,人們對中醫藥的研究逐漸深入,因其具有易提取、毒性低、抑制腫瘤生長等優勢,目前已有多種中藥應用于抗腫瘤治療[9]。鹽酸小檗堿(berberine hydrochloride,BH)是源于中草藥黃連的一種生物堿[10],目前多用于消炎殺菌,但有文獻報道其能抑制多種腫瘤[11-12]。本實驗通過探究鹽酸小檗堿對口腔鱗癌Cal-27細胞增殖及自噬的影響,為將來鹽酸小檗堿用于口腔癌治療提供一定的依據。
1 材料與方法
1.1 材料
人口腔鱗癌Cal-27細胞(豐暉生物,中國);鹽酸小檗堿(源葉生物,中國);高糖DMEM培養基、胎牛血清FBS以及胰蛋白酶(Hyclone,美國);CCK-8檢測試劑盒、RIPA蛋白裂解液(碧云天,中國);瑞氏-吉姆薩染液、一抗(PCNA、Beclin-1、LC3B、β-actin)、二抗(博士德生物,中國)。
1.2 方法
1.2.1 細胞培養 將人口腔鱗狀細胞癌Cal-27細胞在適宜條件下置于高糖DMEM培養基中培養。待細胞長至一定程度時,對其進行傳代,取活性、形狀良好的細胞用于后續實驗。
1.2.2 藥物配制 溶劑:DMSO及PBS溶液,利用溶劑與鹽酸小檗堿融合形成母液,且保證DMSO溶劑濃度低于0.1%,將藥物分裝后置于-20 ℃避光儲存。
1.2.3 CCK-8實驗 藥物濃度分組:對照組(0),鹽酸小檗堿組(60、90、120、240 μmol/L)。選狀態良好的Cal-27細胞,在96孔板中設計平行復孔,每孔的細胞數目為8×103個,過夜培養后,加入藥物。藥物作用24、48、72 h后,避光吸棄上清,加入CCK-8試劑后,培養箱中1 h進行孵育。用酶標儀檢測450 nm波長處的OD值,收集3次有效數據。計算細胞存活率及IC50。根據IC50選擇適宜濃度進行后續實驗。為了進一步闡明鹽酸小檗堿是否通過調節自噬從而抑制Cal-27細胞的增殖,使用CCK-8實驗篩選適宜濃度的自噬激活劑雷帕霉素(rapamycin,RAPA)進行后續實驗。設置分組:對照組(0),單獨藥物組(90 μmol/L BH),雷帕霉素組(50 nmol/L RAPA)以及鹽酸小檗堿+雷帕霉素共同處理組(90 μmol/L BH+50 nmol/L RAPA)。
1.2.4 單克隆形成實驗 在6孔板中的每孔中鋪數目為4×105個細胞,放于培養箱。細胞長至75%~80%時,分別加入0、60、90、120、240 μmol/L濃度的鹽酸小檗堿培養液。6 h后,消化,再以1×103個/孔種在6孔培養板中,4 d一換液。2個星期后,室溫下輕柔地加入PBS溶液,晃動6孔板(1 min),棄掉清洗液,反復3次后,固定液固定(15~30 min),棄去溶液,每孔加入瑞氏-吉姆薩A、B溶液,兩者混勻,染色3~5 min。沖洗干凈,晾干,拍照,計數分析。
1.2.5 Western Blot檢測相關蛋白表達 將4×105個Cal-27細胞接種于6孔細胞培養板,給予不同濃度鹽酸小檗堿處理24 h,提取總蛋白,測濃度,變性,分裝,貯藏于-20 ℃。室溫下制備SDS-PAGE凝膠電泳轉膜,封閉2 h,一抗4 ℃(Anti-PCNA 1∶2 000,Anti-Beclin-1 1∶1 000,anti-LC3B 1∶500)過夜孵育。次日洗膜3次。室溫下二抗(1∶5 000)孵育2 h,再次清洗。顯影,分析蛋白結果。
1.3 統計學分析
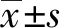
2 結 果
2.1 鹽酸小檗堿對Cal-27細胞活性的影響
如圖1所示,隨著鹽酸小檗堿濃度的提高,Cal-27細胞存活率逐漸降低。表明鹽酸小檗堿對Cal-27細胞的抑制呈濃度依賴性(圖1A)。根據實驗結果算出24 h的IC50為(92±10)μmol/L。
同一時間下,不同濃度鹽酸小檗堿對Cal-27細胞活性影響的量化圖。與同時段對照組(0 μmol/L)相比,Tukey檢驗,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.0001
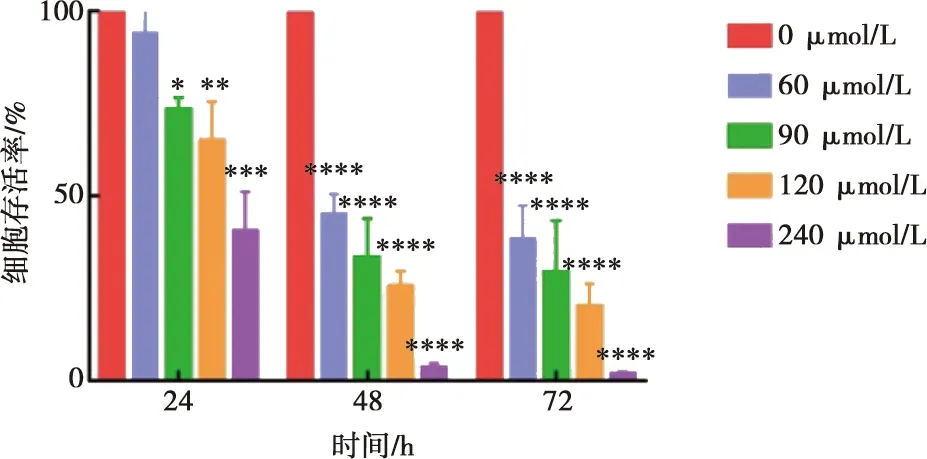
2.2 鹽酸小檗堿對克隆形成能力的影響
如圖2所示,隨著藥物濃度的提高,Cal-27細胞集落形成的數目逐漸降低(圖2A、B)。當藥物濃度逐漸上升至240 μmol/L時,Cal-27細胞培養14 d后幾乎無集落形成,說明鹽酸小檗堿抑制了Cal-27細胞的增殖能力。
A:Cal-27細胞培養14 d平板克隆形成結晶紫染色圖(相機拍照,96 dpi);B:克隆數目量化圖;與對照組(0 μmol/L)相比,Tukey檢驗,*:P<0.05,**:P<0.01,***:P<0.001
2.3 鹽酸小檗堿對Cal-27細胞增殖及自噬相關蛋白的影響
其影響如圖3所示(圖3A),與對照組相比,隨著鹽酸小檗堿濃度的提高,PCNA的蛋白量化值逐漸降低(圖3B);Beclin-1蛋白量化值及LC3Ⅱ/Ⅰ的比值也逐漸降低(圖3C、D),說明鹽酸小檗堿抑制Cal-27細胞的增殖及自噬。

A:Western Blot實驗檢測細胞PCNA、Beclin-1、LC3Ⅰ、LC3Ⅱ蛋白表達情況;B:PCNA蛋白相對表達量量化圖;C:Beclin-1蛋白相對表達量量化圖;D:LC3Ⅱ/Ⅰ蛋白相對表達量量化圖。與對照組(0 μmol/L)相比,Tukey檢驗,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1
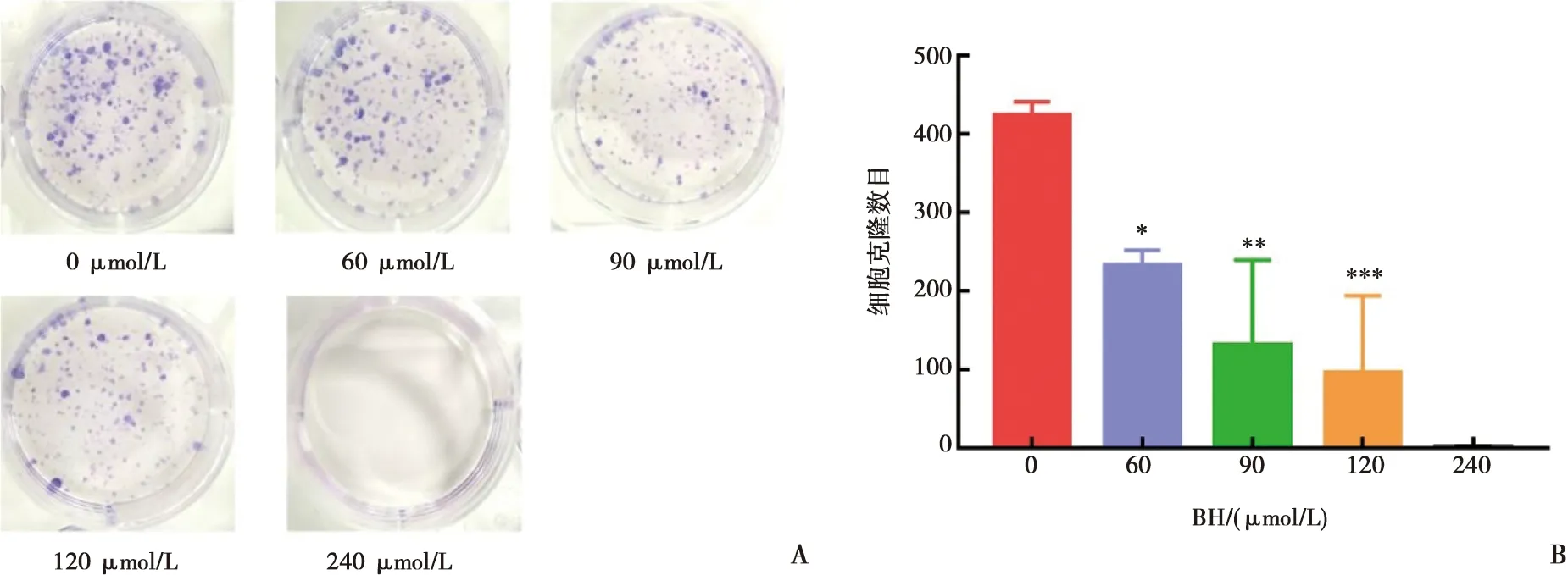
2.4 鹽酸小檗堿抑制細胞自噬與抑制Cal-27細胞增殖的關系
如圖4所示,CCK-8結果示濃度為50 nmol/L的RAPA對Cal-27細胞的毒性較小(圖4A)。與對照組相比,單獨藥物組(90 μmol/L BH)對Cal-27細胞的活性具有抑制作用,而當鹽酸小檗堿與雷帕霉素(90 μmol/L BH+50 nmol/L RAPA)共同處理后,Cal-27細胞的活性稍有提升(圖4B)。
A:雷帕霉素對Cal-27細胞活性影響的量化圖;B:鹽酸小檗堿與雷帕霉素分別及共同作用后對Cal-27細胞活力影響的量化圖;與對照組相比,Tukey檢驗,**:P<0.01,****:P<0.000 1;與RAPA相比,Tukey檢驗,####:P<0.0001;ns:無統計學差異
克隆形成實驗可以明顯看出,單獨藥物組(90 μmol/L BH)對Cal-27細胞的克隆形成能力具有明顯的抑制作用,而鹽酸小檗堿與雷帕霉素(90 μmol/L BH+50 nmol/L RAPA)共同處理后,Cal-27細胞集落形成的數目多于單獨藥物組,說明RAPA逆轉了鹽酸小檗堿對Cal-27細胞增殖的抑制作用(圖5A、B)。
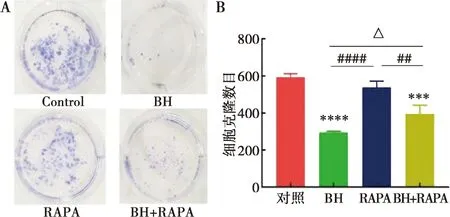
A:加入雷帕霉素后,Cal-27細胞培養14 d平板克隆形成結晶紫染色圖(相機拍照,96 dpi);B:其克隆數目量化圖;與對照組相比,Tukey檢驗,***:P<0.001,****:P<0.000 1。與RAPA相比,Tukey檢驗,##:P<0.01,####:P<0.000 1;與BH相比,Tukey檢驗,△:P<0.05
為進一步探究鹽酸小檗堿抑制Cal-27細胞的增殖與其自噬是否有關聯,我們又進行了蛋白印跡實驗。其結果顯示(圖6A),與單獨藥物組相比,加入雷帕霉素的共同處理組,PCNA的表達增多(圖6B),并且Beclin-1及LC3Ⅱ/Ⅰ的表達也增多(圖6C、D)。說明鹽酸小檗堿是通過抑制自噬從而抑制Cal-27細胞的增殖。
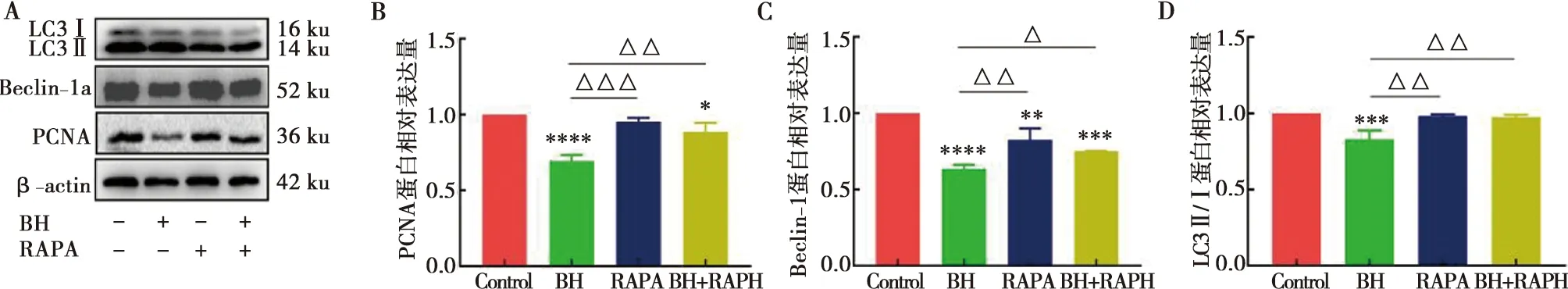
A:Western Blot實驗檢測細胞PCNA、Beclin-1、LC3Ⅰ、LC3Ⅱ蛋白表達情況;B:PCNA蛋白相對表達量量化圖;C:Beclin-1蛋白相對表達量量化圖;D:LC3Ⅱ/Ⅰ蛋白相對表達量量化圖;與對照組(control)相比,Tukey檢驗,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1;與BH相比,Tukey檢驗,△:P<0.05,△△:P<0.01,△△△:P<0.001
3 討 論
口腔鱗癌是頭頸部癌的一種主要亞型,與煙草、酒精和HPV等風險因素有關,是全球最常見的12種癌癥之一,并且危及生命[3]。其中化療藥物的耐藥性是患者生存率低的主要因素之一。
近年來,中醫藥在抗腫瘤領域逐漸成為焦點,因其介入可以降低腫瘤治療的不良反應,提高患者生活水平,并且還具有多種靶點、多條途徑、多類效應等優勢,逐漸成為臨床抗腫瘤的一線藥物[13]。先前有研究表明,鹽酸小檗堿這類藥物可作為抗腫瘤藥[14-15],對胃癌[16]、乳腺癌[17]、鼻咽癌等具有抑制作用[12,18-19]。
本研究通過體外CCK-8實驗、克隆形成實驗證實一定濃度的鹽酸小檗堿對口腔鱗癌Cal-27細胞活力有明顯抑制作用。并通過Western Blot實驗檢測出鹽酸小檗堿刺激Cal-27細胞后,增殖相關蛋白PCNA的表達量逐漸降低,進一步說明其對細胞增殖具有明顯的抑制作用。此外,有研究學者已證實當鹽酸小檗堿作用于人口腔鱗狀細胞癌時能夠抑制細胞的增殖,這與本研究的結果一致,但作者尚未對其作用機制深入研究[20]。
自噬是一種細胞代謝的途徑,是維持細胞穩態的關鍵調控者。同時在過去的10年中,自噬已成為腫瘤研究中重要角色,參與腫瘤抑制和腫瘤發展[21]。其中Beclin-1是自噬的關鍵調控基因,在自噬體成熟過程中起作用。而LC3B是自噬的關鍵蛋白家族之一,其獨特性在于能夠定位于自噬泡膜內[22]。且LC3B的表達水平反映著細胞自噬的發生是受到抑制或誘導[23]。近年有學者指出自噬標志物LC3B可與OSCC患者預后有著密切的聯系[23-25]。目前,關于鹽酸小檗堿對自噬作用的研究較少,我們通過Western Blot實驗檢測自噬標志物Beclin-1、LC3Ⅰ、LC3Ⅱ的表達,發現單獨藥物組LC3Ⅱ/Ⅰ比值以及Beclin-1的表達量與對照組比較顯著下調,表明自噬體的形成逐漸降低,說明鹽酸小檗堿能夠抑制Cal-27細胞的自噬效應。為了進一步探究鹽酸小檗堿能否通過抑制自噬從而抑制Cal-27細胞增殖,我們加入自噬激活劑RAPA后,發現與單獨藥物組相比,共同處理組抑制Cal-27細胞增殖及自噬的效果減弱,即RAPA逆轉了鹽酸小檗堿對Cal-27細胞自噬及增殖的抑制作用,表明鹽酸小檗堿可通過抑制細胞自噬從而抑制增殖。
基于自噬調節癌細胞增殖的具體分子機制,既往已有多項研究對其進行探索。有研究表明甘草素在體外作用于口腔癌細胞后,通過抑制AKT、mTOR的磷酸化使得PI3K/AKT/mTOR通路失活從而誘導自噬反應,進一步抑制細胞生長[26]。小檗堿作用于胃癌細胞后,阻斷MAPK/mTOR/p70S6K和AKT信號通路的表達,從而誘導細胞自噬抑制其生長[27]。目前有較多研究結果發現,PI3K/AKT/mTOR是調節細胞自噬與增殖的主要信號通路之一,其中磷酸化的mTOR可影響自噬相關蛋白的表達,但鹽酸小檗堿是否通過介導這條信號通路發揮抑制Cal-27細胞自噬的作用,需要我們進一步深入研究。
綜上所述,本次實驗證實鹽酸小檗堿抑制口腔鱗癌Cal-27細胞的增殖和克隆形成,并且誘導抑制性自噬從而抑制增殖,但其具體機制尚未探究。本實驗為鹽酸小檗堿作為抗口腔癌藥物提供一定的依據,為今后的研究提供新的思路。

