大葉楊干旱和水淹脅迫的轉錄組分析
張佳琪,張新新,馮佳珺,施婷婷,張鈺麟,王 婧
(四川大學 生命科學學院 生物資源與生態環境教育部重點實驗室,成都 610000)
大葉楊(Populuslasiocarpa)是楊柳科(Salicaceae)楊屬(Populus)大葉楊組的落葉喬木,主要分布于中國湖北、四川、陜西、云南、貴州等地,生長在海拔1 300~1 500 m的山坡、灌叢等水資源較為豐富的區域[1],是中國特有的楊屬物種。相較于其他廣域分布的楊屬植物如山楊、銀白楊、青楊等[2],大葉楊的分布范圍較為局限,這可能與其喜濕的生長習性有關。近年來,全球氣候變暖導致極端氣候事件頻發,這可能導致干燥地區變得更加干燥,潮濕地區則變得更加潮濕[3]。IPCC AR6報告指出,在過去的50余年,全世界范圍內強降水事件頻發以及干旱事件增加[4],而由此引發的干旱和洪水等自然災害已經嚴重阻礙了中國林業建設與發展和生態環境的改善。因此在地區生境條件日益惡劣的背景下,培育抗逆性較強的樹種并制定相應的保護和育種措施是恢復與重建生態系統平衡和提高林業生產力的重要方式。
長期的洪澇會使得土壤含水量處于飽和狀態,植物的有氧呼吸逐漸替換為無氧呼吸[5],其形態結構、生長生理和新陳代謝等逐步受到影響[6-8]。如楓楊在水淹12 h后,體內類黃酮合成、亞麻酸、茉莉酸等代謝途徑明顯活躍[9]。而缺水造成的干旱脅迫可能導致農作物和林木的減產,超過其他環境因子脅迫所造成減產的總和[10]。另外,缺水環境下也能夠引起植物的葉子或幼果釋放大量的乙烯,從而脫葉、落果[11]。植物也可通過增加體內的脫落酸含量以提高抗旱能力[12]。因此為了維持自身的生長發育,植物在分子水平上已進化出一系列響應非生物脅迫的機制。而外界的非生物脅迫也能影響植物體內功能基因和調控基因的表達[13-14],其中就包括調控基因表達的眾多轉錄因子家族成員[15]。AP2/ERF轉錄因子家族在植物的生長發育、代謝以及生物和非生物脅迫的響應中發揮了關鍵作用[16]。根據AP2/ERF結構域的數量以及是否含有其他結構域將其分為5個亞家族[17]:AP2、ERF(響應乙烯)、DREB(與脫水響應元件結合)、RAV、Soloist。AP2亞家族含有2個串聯重復的AP2/ERF結構域;ERF和DREB亞家族中只含有1個AP2結構域,其共同特點是基因結構中內含子數量很少[18],但是二者具有不同的作用,ERF亞家族主要與乙烯響應元件結合[19],而DREB亞家族,主要通過DRE/CRT順式作用元件來調控基因的表達[20];Soloist亞家族也只含有1個AP2/ERF結構域,但是核苷酸序列和基因結構與ERF等亞家族明顯不同,并且核苷酸序列在很多植物中高度保守[17];RAV亞家族除了含有1個AP2/ERF結構域外,還帶有1個B3結構域。AP2亞家族主要在植物生長發育階段起重要作用,例如開花[21]、種子生長與萌發[22]等;ERF主要作用于激素信號傳導、非生物脅迫響應等[23];RAV主要參與葉片衰老、生物與非生物脅迫響應調控[24];Soloist在擬南芥中僅包含1個基因,調控水楊酸的合成以及防御細菌病原體的入侵[25]。
目前對于大葉楊的研究多集中于種質資源調查和保存[26],而對于大葉楊如何響應非生物脅迫以及其脅迫耐受能力研究鮮有報道。本研究通過對水淹和干旱脅迫后的大葉楊進行轉錄組測序,結合生物信息學分析鑒定到一系列響應脅迫的差異表達基因,并發現大葉楊中AP2/ERF轉錄因子家族成員在脅迫響應基因中顯著富集,最后篩選出可能參與調控干旱或水淹脅迫耐受的候選基因。該研究結果將為今后深入探究極端水分環境下大葉楊的分子響應過程和適應性進化奠定基礎,為大葉楊分子遺傳育種提供理論參考。
1 材料和方法
1.1 試驗材料
大葉楊種子采集于四川省涼山彝族自治州美姑縣瓦候鄉(28°43′N,103°8′E),鋪種萌發后移至溫室進行培養,溫室生長條件為:光照16 h,(25±1) ℃,黑暗8 h,(20±1) ℃,空氣濕度在70%左右。待植株高度生長到30~40 cm時,挑選一部分進行預實驗以此確定水分脅迫時間(以出現表型變化但未枯死不影響測序為準),最終確定干旱脅迫時間為5 d,水淹脅迫為15 d。挑選出長勢均勻良好的植株用于正式試驗。
1.2 脅迫處理
正式試驗將材料分為3組:水淹(waterlogging stress,WS)處理組(水沒過盆土3 cm左右)、干旱(drought stress,DS)處理組(脅迫開始前保持正常澆水,脅迫開始后停止澆水,干旱脅迫結束時土壤含水量約在56%)以及對照(control group,CK)控制組(保持正常澆水,土壤含水量在70%~80%)。為確保脅迫結束的時間一致,于2021年11月18日早上9:00先開始水淹脅迫處理,在水淹脅迫的第10天早上9:00 DS組材料停止澆水,開始干旱脅迫處理,期間保持所有處理組及對照組材料在相同環境,水淹處理組的水每3 d更換1次,以免微生物滋生干擾結果。
在水淹和干旱脅迫第3天和脅迫結束的最后一天采集樣品,每組各取3株葉片材料用于轉錄組學測序,葉片統一取第5~6片新鮮的成熟葉片,并用液氮速凍后暫存于-80 ℃冰箱。將試驗樣品材料送至深圳華大基因股份有限公司(https://www.bgi.com/),使用T7 PE150平臺進行cDNA文庫構建和RNA-Seq測序,每組處理的3株材料作為生物學重復。
1.3 生物信息學分析
原始測序數據(raw reads)先用FastQC[27]檢驗數據質量,Trimmomatic[28]過濾接頭及低質量的reads。過濾后的reads用HISAT2[29]比對到組裝好的大葉楊參考基因組上,再用StringTie[30]統計基因表達量,得到標準化后的TPM(transcripts per kilobase of exon model per million mapped reads)值。根據腳本prepDE.py(https://github.com/gpertea/stringtie/blob/master/prepDE.py)生成用于DESeq2[31]差異表達分析的矩陣(count)文件,將錯誤發現率FDR(false discovery rate)≤0.05,差異倍數|log2αFD|≥1的基因定義為差異表達基因(differentially expressed genes,DEGs)。topGO[32]包對DEGs進行GO富集分析。
1.4 大葉楊AP2/ERF轉錄因子家族分析
在Pfam蛋白質家族數據庫(https://pfam-legacy.xfam.org/)下載AP2保守結構域的蛋白序列(序列號:PF00847)HMM文件,HMMER v3.1b2[33](http://hmmer.org/)鑒定大葉楊基因組數據庫中的AP2/ERF候選基因。SMART(https://smart.embl.de/)和NCBI CDD(https://www.ncbi.nlm.nih.gov/cdd/)在線數據庫對基因蛋白序列進行檢測,保留有AP2保守結構域的序列用于后續分析。
在PlantTFDB植物轉錄因子數據庫(http://planttfdb.gao-lab.org/)中下載擬南芥AP2/ERF基因家族成員的蛋白質序列。Muscle v3.8.31[34]對大葉楊和擬南芥的目的基因蛋白序列進行多序列比對,trimAL v.1.4.1[35]快速修剪和對齊,MEGA11[36]中采用 NJ(neighbor-joining)法構建系統發育樹,Bootstrap設置為1 000,在FigTree v1.4.4(http://tree.bio.ed.ac.uk/software/figtree/)對樹進行可視化。
1.5 qRT-PCR驗證
提取RNA后反轉錄得到cDNA原液用于實時熒光定量PCR[37]實驗。NCBI Primer(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)對12個大葉楊AP2/ERF家族成員在線設計候選基因和內參基因的特異性引物(表1),UBQ-10為內參基因[38]。采用南京諾唯贊生物科技股份有限公司的(https://www.vazyme.com/Home.html)試劑Taq Pro Universal SYBR qPCR Master Mix進行定量分析。每個孔總體系為20 μL:1 μL模板cDNA,0.4 μL上游引物,0.4 μL下游引物,10 μL 2×Tap Pro Universal SYBR qPCR Master Mix,8.2 μL無菌水。每個樣品有3個技術重復。擴增反應程序設置為:95 ℃預變性30 s;95 ℃ 10 s,60 ℃ 30 s,循環40次;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,循環1次。用2-ΔΔCT法[37]計算候選基因相對于內參基因的表達量。
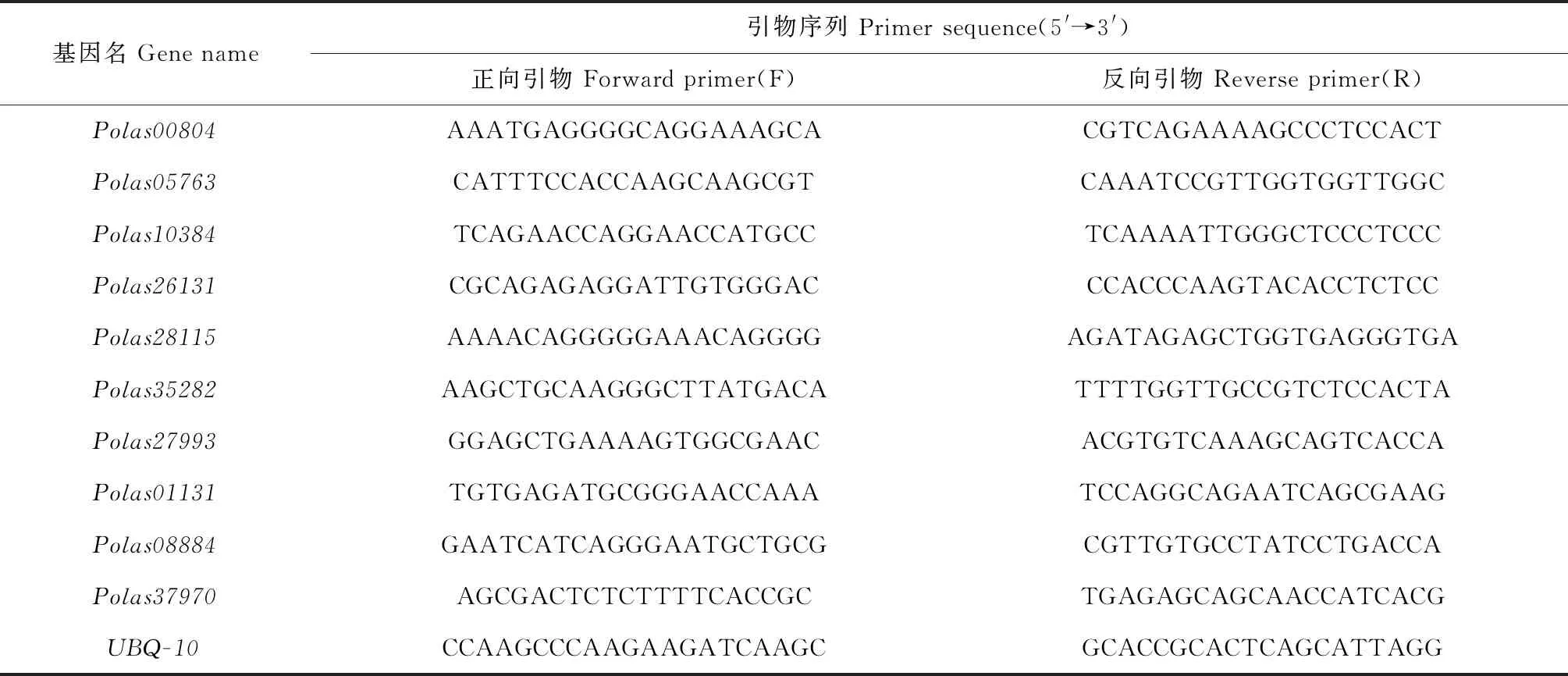
表1 引物設計信息
2 結果與分析
2.1 轉錄組數據分析
2.1.1 轉錄組數據比對結果
將不同脅迫下的處理組:水淹3 d(WS-3 d)、水淹15 d(WS-15 d)、干旱3 d(DS-3 d)、干旱5 d(DS-5 d)以及對照組(CK)各3個重復的總共15個轉錄組數據的原始數據(raw reads)進行質控,得到Q20和Q30的均值分別為97.59%和93.67%和平均GC含量為43.71%和測序深度均在30×以上的clean reads。將其比對到組裝好的大葉楊參考基因組上,平均比對率為93.82%(表2)。以上結果表明轉錄組測序數據質量較高,可用于后續分析。利用StringTie統計每個樣本中基因的TPM值,為了檢驗每組數據3個個體間的重復性,基于皮爾遜相關系數對不同處理組中3個生物重復的表達量數據繪制相關性熱圖(圖1)。結果顯示每個處理組內的3個個體間,其相關性都在0.9及以上,表明各處理組內的3個樣本具有良好一致性,可以進行下一步分析。
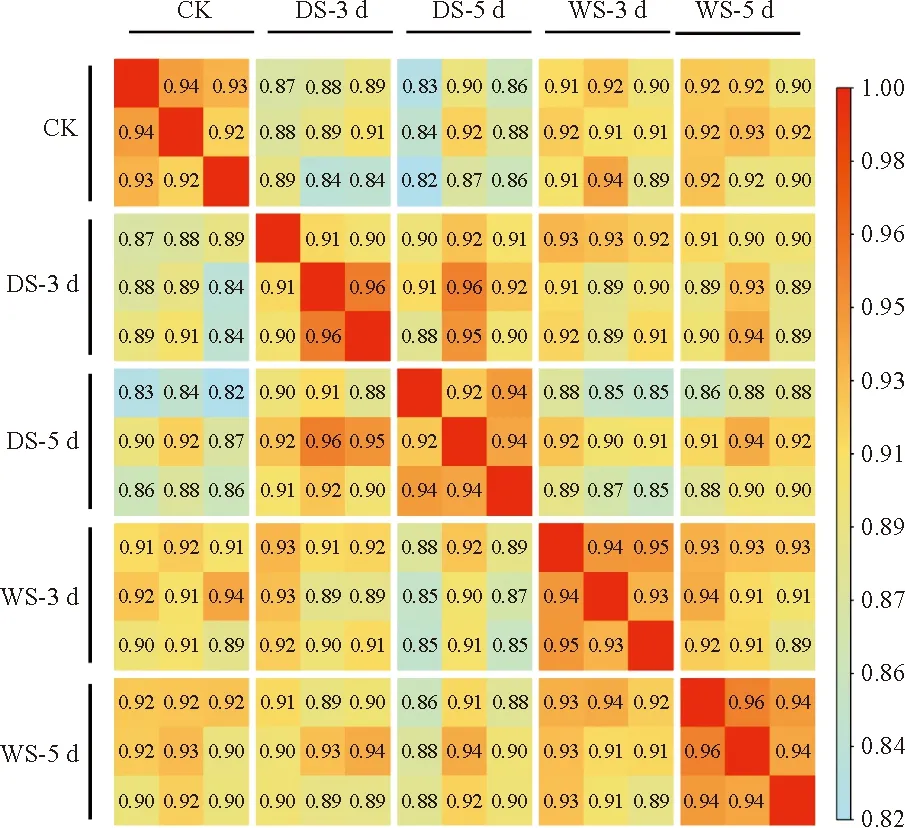
圖1 大葉楊對照和脅迫樣本相關性熱圖
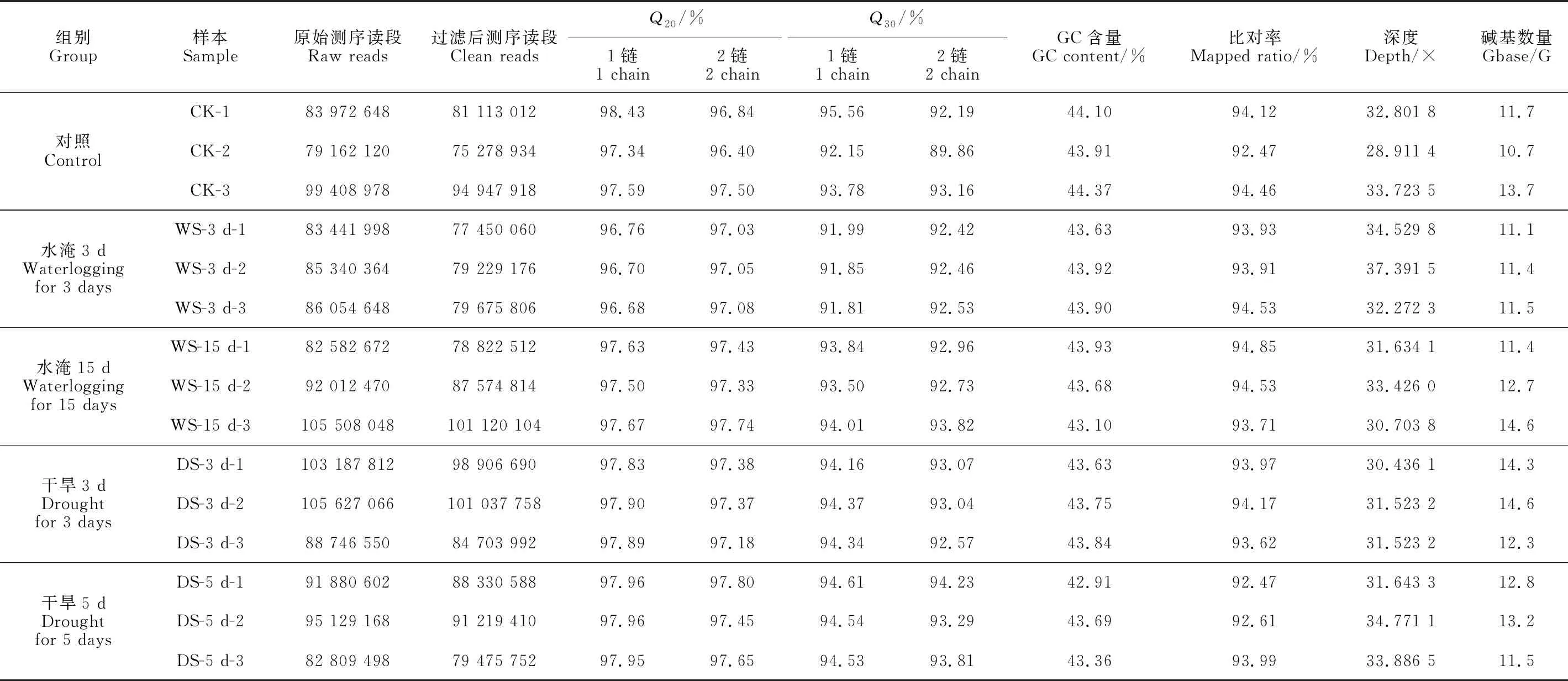
表2 轉錄組樣本數據概述
2.1.2 差異表達基因鑒定
利用DESeq2分別將處理組與對照組進行差異分析。干旱處理組:在DS-3d與CK組鑒定到5 747個DEGs,其中包含3 399個上調和2 348個下調的DEGs;在DS-5 d與CK組鑒定到8 486個DEGs,其中上調和下調的DEGs分別有4 035,4 451個(圖2,A,C)。水淹處理組:在WS-3 d與CK組共獲得2 114個DEGs,其中1 455個上調和659個下調;在WS-15 d與CK組共獲得1 077個DEGs,上調和下調的DEGs分別有572,505個(圖2,B,C)。隨著水淹脅迫的天數增加,DEGs的數量由水淹3 d的2 114個逐漸減少到1 077個;而隨干旱脅迫天數增加,DEGs數量明顯增加。接下來篩選出在WS-3 d和WS-15 d共享的DEGs作為全程響應水淹脅迫的DEGs(命名WS-DEGs),同理也篩選出全程響應干旱脅迫的DEGs(命名為DS-DEGs),分別鑒定出385個WS-DEGs和3 986個DS-DEGs(圖2,A,B)。對二者取交集,其中有237個WS-DEGs和DS-DEGs共享的DEGs(命名為Shared DEGs),還有148個WS-DEGs和3 749個DS-DEGs作為獨立響應水淹和干旱脅迫的DEGs(分別命名為WS-uniq DEGs和DS-uniq DEGs),見圖2,D。大葉楊中響應干旱脅迫的差異基因數量明顯多于水淹脅迫時差異基因數量。
2.1.3 差異表達基因GO富集
為了探究大葉楊在水分脅迫下的生物學過程及其響應脅迫的大致機理,將上述鑒定到的Shared DEGs、WS-uniq DEGs和DS-uniq DEGs分別進行基于Fisher檢驗的GO富集。Shared DEGs富集到的生物過程主要包括原花青素生物合成途徑、調控葉片衰老、對水分刺激的響應、光周期以及開花調控、獲得系統抗性、免疫防御等(圖3,A);在WS-uniq DEGs中,富集到色氨酸代謝、生長素介導的信號通路正調控、芳香族氨基酸代謝過程、吲哚類化合物的代謝過程等通路(圖3,B);在DS-uniq DEGS中,主要富集到光合通路、葉綠素代謝、獲得系統抗性、應激防御反應等(圖3,C)。依次以不同類型DEGs(Shared、WS-uniq、DS-uniq)的數量作為隨機取樣值,對大葉楊基因組中全部基因進行20 000次隨機抽樣,統計每次抽樣數據集中AP2/ERF家族成員的數量,比較后發現AP2/ERF家族成員顯著富集于差異表達基因中。觀測值表示不同類型DEGs中AP2/ERF基因的數量(圖3)。
2.2 大葉楊AP2/ERF家族成員鑒定和系統發育關系
參考Nakano等[18]在擬南芥中對AP2/ERF基因家族成員分類的方法,將大葉楊中的候選基因分為5類,包括AP2、ERF、DREB、RAV和Soloist。在大葉楊中,有65個(31%)DREB亞家族基因,103個(50%)ERF亞家族基因,30個(14%)AP2亞家族基因,6個RAV亞家族基因和1個Soloist亞家族基因,其中ERF亞家族中的基因數量最多,Soloist亞家族中只有1個Polas10384基因。利用NJ法則對205個大葉楊AP2/ERF家族成員和138個擬南芥AP2/ERF家族成員進行蛋白序列的多重比對,構建系統發育樹(圖4)。在前人研究中[39],將ERF與DREB亞家族統稱為ERF亞家族,二者主要的區別在于AP2/ERF結構域中第14位和第19位氨基酸殘基位置不同。因此可以看出,大葉楊中DREB與ERF亞家族成員之間親緣關系更近。

圓圈代表后續qPCR實驗中挑選的大葉楊AP2/ERF基因;黃色和藍色分別代表干旱和水淹脅迫。
2.3 qRT-PCR實驗驗證
根據大葉楊AP2/ERF基因家族成員在水淹和干旱脅迫下的轉錄水平變化,一共篩選出12個在水淹和干旱脅迫下基因表達存在明顯差異的基因進行qRT-PCR驗證(圖5、圖6)。
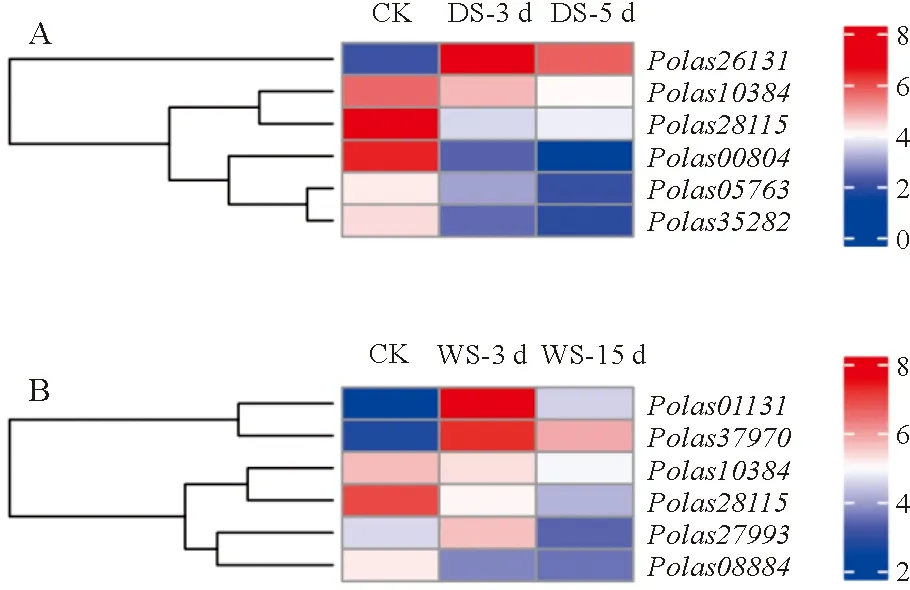
A.AP2/ERF基因在干旱脅迫下基因聚類熱圖; B.AP2/ERF基因在水淹脅迫下基因聚類熱圖。
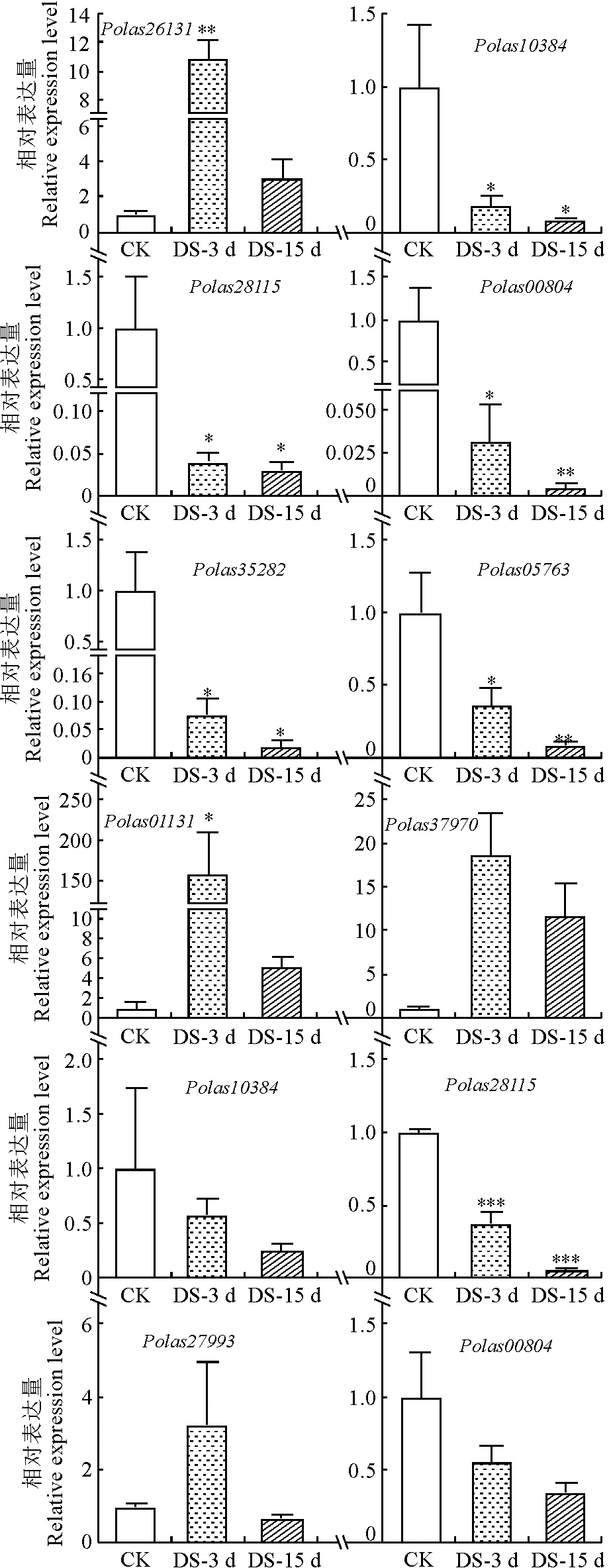
前6個為AP2/ERF基因在干旱脅迫下相對表達量,后6個為AP2/ERF基因在水淹脅迫下相對表達量。
所有候選基因在系統發育樹中的位置見圖4。結合試驗結果和基因熱圖發現Polas35282、Polas00804、Polas05763、Polas28115在干旱處理下具有明顯下調趨勢(圖5,A和圖6),其中Polas28115同時在水淹脅迫下也明顯下調(圖5,B,圖6)。qPCR實驗結果表明基因表達趨勢與轉錄組數據分析的結果一致,這不僅進一步證實了轉錄組數據的可靠性,也表明篩選的AP2/ERF轉錄因子家族成員基因在受到水分脅迫時發生差異表達,可能在大葉楊水淹和干旱脅迫下發揮重要的調控作用。
3 討 論
本研究運用高通量測序技術對水淹、干旱脅迫和對照的大葉楊樣本進行轉錄組測序,得到測序質量較好且相關性系數均在0.9以上的轉錄組數據。通過轉錄組數據分析比較大葉楊在不同水分條件刺激下差異基因的變化,發現干旱脅迫下DEGs的數量遠高于水淹脅迫,推測與大葉楊長期生長在水資源豐富地區有關,其體內可能已經進化出一系列應對水淹、洪澇等非生物脅迫的適應性機制。隨著干旱脅迫天數增加,DEGs的數量明顯增加。相反的是,持續水淹脅迫并沒有導致DEGs數量的增加。WS-uniq DEGs GO顯著富集在生長素介導的信號通路等,而生長素對植物新生根系的形成具有重要的調控作用,研究表明施加生長素與吲哚丁酸能夠促進蘋果幼苗產生新生根[40],因此推測大葉楊在水淹脅迫后期形成的不定根可能與生長素調控機制有關,而不定根的形成能夠緩解植物根系因水淹脅迫而產生的不良影響[41],這表明大葉楊可能具有較高的耐水淹能力。DS-uniq DEGs的GO結果顯著富集在光合作用通路、葉綠素代謝等過程,參與該過程的基因表達均呈下調趨勢。因此進一步推測干旱脅迫降低了大葉楊光合作用的能力,這與先前研究提出的楊樹在干旱脅迫下,光合速率和蒸騰速率顯著下降的結果[42]一致。
AP2/ERF是植物中特有的轉錄因子家族,參與了許多植物的非生物脅迫響應,它主要通過激素調節方式應對非生物脅迫。在擬南芥[18]、毛果楊等[43]模式植物中已經對AP2/ERF基因家族進行了研究。發現在擬南芥中At4g13040是Soloist家族中唯一成員,正向調控水楊酸的積累且能夠防御細菌病原體的入侵[25];玉米中的ZmEREB180屬于ERF亞家族,通過乙烯的誘導表達,從而促進不定根的形成來增強玉米的抗澇性[44],而目前尚未對大葉楊中的AP2/ERF基因家族進行探究。本研究鑒定了大葉楊中的AP2/ERF家族成員,一共有205個基因屬于該家族。根據基因表達聚類熱圖及qPCR實驗結果表明,發現Polas28115(AtRAP2.4)在水淹和干旱脅迫下均顯著下調,而RAP2.4在擬南芥中參與干旱脅迫應答,在提高植物抗旱性中有重要作用[45-46],但尚未有研究揭示其在水淹脅迫下的調控作用;Polas35282(ATRAP2.7)隨著干旱脅迫的天數逐漸增加,基因表達量明顯下調,在四倍體棉花的鹽脅迫和干旱脅迫研究中,發現RAP2.7的同源基因GhirPA0801G001500為差異表達基因[47]。該結果說明大葉楊Polas35282可能參與了干旱脅迫的應答過程,至于其調控機理還需進一步深入研究。
目前極端氣候事件頻發正在導致動植物遭受越來越多的非生物脅迫壓力,如氣溫升高、極端高溫事件頻繁發生、土壤干旱、土地沙漠化嚴重。干旱和水淹脅迫作為植物育種生產的一大難題,可能導致作物減產、林木等植物種群的地理分布和生存能力受限。因此探究植物脅迫響應的分子基礎并篩選識別與抗逆性有關的轉錄因子是植物非生物脅迫研究和作物育種的關鍵。本研究初步探究了大葉楊在水淹和干旱脅迫下基因的差異表達情況,同時對廣泛參與非生物脅迫的AP2/ERF轉錄因子家族成員進行了篩選與鑒定,未來可以聯合基因組學、群體遺傳學進一步對大葉楊的適應氣候變化潛力和適應性進化機制進行探究,為大葉楊分子遺傳育種和種質資源保護制定更為完善的方案,這也將為其他林木樹種的遺傳保護提供更多的思路及參考。

