NK細胞培養及殺傷前列腺癌細胞效率的研究*
王丙萍 劉彩云 高艷偉 高維實 陸相吉
(1.內蒙古自治區人民醫院腫瘤研究所,內蒙古 呼和浩特 010017;2.北京亦科諾生物科技有限公司,北京 100176;3.內蒙古自治區人民醫院腹部腫瘤外科,內蒙古 呼和浩特 010017;4.武警內蒙古自治區總隊醫院普外科,內蒙古 呼和浩特 010010)
前列腺癌(Prostate cancer,PCa)是危害老年男性健康的常見癌癥之一,并且在我國呈明顯的逐年上升趨勢[1-2]。細胞免疫治療(Cell immunotherapy, CIT)是免疫治療的一種,開始于20世紀70年代,1997年被美國食品藥品監督管理局(Food and drug administration,FDA)批準正式納入美國藥品法規接受監管,CIT原理是將人體內的抗腫瘤免疫細胞采集后,經過體外培養擴增后回輸患者,以增強人體免疫系統,從而達到抗腫瘤的目的。NK細胞(Natural killer cell)是機體除T細胞之外的另一抗腫瘤利器,本身具有廣譜的腫瘤殺傷能力。NK細胞數量減少或者功能受損與各種類型癌癥的進展相關。在應用NK細胞作為過繼性免疫治療的細胞時,NK細胞的主要來源是外周血,但外周血單個核細胞中NK細胞的數量僅占10%~15%,因此NK細胞的體外擴增培養十分重要。本研究建立了一種快捷、方便、高效的NK細胞體外擴增方法,將外周血中占比較少的NK細胞擴增到純度較高、數量充足,從而為NK細胞的過繼性免疫治療奠定基礎。通過NK細胞對3種PCa細胞系LNCaP、DU145、PC3殺傷率的研究,鑒定其用于后期治療PCa的可行性,為應用NK細胞過繼回輸治療PCa的研究奠定基礎。
1 材料與方法
1.1 實驗材料 PCa細胞株PC3、LNCaP、DU145購自中國科學院上海細胞所;VIVOTM15培養基、DMEM高糖培養基、1640培養基、胎牛血清(Fetal bovine serum, FBS)、胰酶、磷酸鹽緩沖液(PBS)(美國Gibco公司);IL-2、IL-7、IL-15、IL-18、IL-21、OKT3(美國R&D公司);抗人CD16單克隆抗體(中國北京同立海源生物科技有限公司);Ficoll淋巴細胞分離液(中國TBDTM公司);熒光標記單克隆抗體:CD3-FITC、CD56-PE、鼠抗人IgG-FITC(美國BD公司);CCK8試劑盒(中國博士德生物公司)。
1.2 實驗儀器 二氧化碳培養箱及生物安全柜(Thermo,美國);倒置熒光顯微鏡(Leica,德國);FACSCalibur流式細胞儀(BD,美國);高速離心機(Eppendorf,德國);超凈工作臺(蘇州泰安空氣技術有限責任公司,中國);ELx808吸收光酶標儀(Biotec,美國)。
1.3 方法
1.3.1 PCa細胞株的培養 PCa細胞株PC3的培養液為90% DMEM-F12 +10% FBS;LNCaP的培養液為90% RPMI-1640+10% FBS;DU145的培養液為90% DMEM高糖+10% FBS。從液氮罐取出需要解凍的細胞,立即放入37 ℃水浴鍋中,快速搖動,使凍存的細胞盡量在1 min內融化。將凍存管用酒精消毒后迅速移入超凈工作臺。用移液器將細胞液移入1.5 mL管中,1 500 rpm/min離心5 min,棄液,加入1 mL培養液輕輕懸浮細胞,細胞計數板計數,按細胞數1×106個/瓶的數量接種在T25的培養瓶中,37 ℃,5% CO2培養箱中培養。細胞培養至貼壁90%左右傳代培養,0.25%胰蛋白酶消化的時間分別是LNCaP、DU145為1 min,PC3為3 min。
1.3.2 外周血單個核細胞(PBMCs)分離 Ficoll密度梯度離心法分離PBMCs:使用肝素鈉采血管抽取靜脈血15 mL,Ficoll與血液體積比為1∶2,用移液管緩慢地在Ficoll上層加入血液;在水平轉頭離心機中離心(22 ℃,800 g,15 min,升速5,降速4);離心結束后,在不擾動白膜層的情況下,用注射器吸出血漿層,轉移至1支15 mL離心管,將血漿管置于56 ℃水浴鍋內保持30 min,之后置于4 ℃冰箱內10 min進行冷卻,離心(1 500 g,5 min,22 ℃,升速9,降速9)后轉移上清至1支新的15 mL離心管,保存于4 ℃備用;用巴氏吸管將白膜層仔細移出,移到另1支15 mL離心管,加入PBS至15 mL,吹打清洗,上離心機后(22 ℃,600 g,7 min,升速9,降速7),棄上清液,用2 mL VIVOTM15培養基重懸PBMCs細胞,顯微計數,取樣進行流式檢測。
1.3.3 NK細胞的誘導擴增 ①Day0接種:調整PBMCs細胞密度為1.5 M/mL, 加入自體血清10%,IL-2 1 000 IU/mL,IL-7 10 ng/mL,IL-15 50 ng/mL,IL-18 10 ng/mL,IL-21 50 ng/mL,OKT3 10 ng/mL,Anti-CD16 10 ng/mL,90% VIVOTM15培養基培養細胞,細胞接種密度≤1.5 M/mL,密度過大影響NK生長,放入37 ℃,5% CO2培養箱中培養。②Day3補液:細胞計數,根據細胞數量補充培養液,補液調節細胞的密度為1.0 M/mL;培養基=90% VIVOTM15培養基+自體血漿10%+IL-2 1 000 IU/mL,如果細胞團較小,或者無細胞團,本次不計數,不晃動培養瓶,直接補充原體積1/2培養基繼續培養。③Day5補液:細胞計數,調整細胞密度為1.0 M/mL,培養基=90% VIVOTM15培養基+自體血清10%+IL-2 1 000 IU/mL)。④Day7~Day14補液:每次補液調整細胞密度為0.5~1.0 M/mL, 自體血漿10%,加入IL-2 1 000 IU/mL,培養過程中細胞密度不可超過2.0 M/mL。⑤Day14收獲:流式細胞儀檢測結果,合格后收獲細胞。
1.3.4 流式細胞檢測 免疫熒光標記法進行流式細胞分析,取NK細胞1 mL,PBS洗滌,1 500 rpm/min離心5 min,棄液,加入50 uL PBS輕輕懸浮細胞20 μL CD3-FITC和20 uL CD56-PE,4 ℃避光保存30 min。PBS洗滌后流式細胞儀分析檢測,用異硫氰酸(FITC)標記IgG作為陰性對照,根據流式細胞分析圖中 CD3-CD56+的百分比,確定NK細胞所占比例。
1.3.5 CCK-8法檢測殺傷效率 以NK細胞為效應細胞,靶細胞分別為PCa細胞株LNCaP、DU145、PC3。將3種靶細胞以5×103個/孔 的數量分別接種于96孔板中,于37 ℃,5% CO2培養箱中培養12 h后,輕輕吸除培養液。按效靶比0.1∶1、0.5∶1、1∶1、2∶1、5∶1、10∶1、15∶1、20∶1的比例分別加入效應細胞,每孔200 μL培養液,同時設置單獨靶細胞孔和每種比例的單獨效應細胞孔,每個比例3個復孔。共同培養24 h后,加入CCK8試劑20 μL/孔,放于37 ℃,5% CO2培養箱中,孵育3.5 h后用酶標儀測定450 nm波長的OD值,以此方法檢測NK細胞的細胞毒活性,公式如下:殺傷率(%)=[1-(實驗組OD值-單獨效應細胞OD值)/單獨靶細胞組OD值]×100%。

2 結果
2.1 NK細胞的培養結果 健康人外周血分離PBMCs后,經細胞因子誘導擴增NK細胞。第0天為散落的顆粒狀細胞(圖1A),3~4 d后聚集成團,出現細胞集落(圖1B),培養10~14 d后,細胞重新分散為單個細胞(圖1C)。經流式細胞儀鑒定CD3-CD56+細胞(圖1D~F),外周血中占比較少的NK細胞(10.97±3.28)%,擴增到占比(83.20±8.54)%以上,細胞總數擴增倍數為(251.66±19.05)倍,NK細胞擴增倍數為(1 940.17±402.22)倍,見圖1G~I。

圖1 NK細胞的培養結果
2.2 NK細胞毒活性的檢測 以NK細胞為效應細胞,靶細胞分別為PCa細胞株LNCaP、DU145、PC3,在不同效靶比的情況下(0.1∶1、0.5∶1、1∶1、2∶1、5∶1、10∶1、15∶1、20∶1),加入CCK8 試劑,孵育3.5 h后,用酶標儀測定450 nm波長OD值的方法檢測NK細胞的細胞毒活性(圖2)。通過公式分別計算不同效靶比下NK細胞對靶細胞LNCaP、DU145、PC3的殺傷率,結果表明(圖3),NK細胞對靶細胞LNCaP在效靶比為1∶1時殺傷率最高(92.03±9.95)%,與效靶比為0.5∶1、2∶1、5∶1、10∶1、15∶1、20∶1的實驗組相比,各實驗組間差異無統計學意義(P>0.05),但與效靶比0.1∶1實驗組相比差異顯著(P<0.05)(表1~2);NK細胞對靶細胞DU145在效靶比為10∶1時殺傷率最高(72.40±8.30)%,與效靶比為5∶1的實驗組相比差異無統計學意義(P>0.05),但與其它實驗組相比差異顯著(P<0.05)(表1、3);NK細胞對靶細胞PC3的殺傷率在除了效靶比為0.1∶1、0.5∶1的實驗組外,其余各實驗組的殺傷率均為負數,并且各實驗組間差異顯著(P<0.05)(表1、4),說明NK細胞對前列腺癌PC3細胞株沒有殺傷效果;并且隨著效靶比逐步增高,其負數值越大,說明NK細胞對其有促進生長作用。
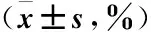
表1 NK細胞對靶細胞LNCaP、DU145、PC3的殺傷率

表2 NK細胞在不同效靶比時對LNCaP靶細胞的殺傷率分組

表3 NK細胞在不同效靶比時對DU145靶細胞的殺傷率分組

表4 NK細胞在不同效靶比時對PC3靶細胞的殺傷率分組

圖2 效應細胞NK對靶細胞LNCaP、DU145、PC3在效靶比為10∶1時的殺傷圖

圖3 NK細胞對靶細胞LNCaP、DU145、PC3的殺傷率
3 討論
PCa是目前全世界男性中最常見的惡性腫瘤之一,近年來死亡人數在持續增加[3]。在我國,PCa發病率近年來已出現逐步升高趨勢[4],并且PCa發病隱匿,導致大多數人發病時已處于癌癥晚期[5-6]。目前對于PCa的治療手段主要包括手術治療、內分泌治療、放療以及化療[7-8]。而對于晚期和轉移性的PCa患者,雄激素剝奪治療是其主要治療手段,但由于其副作用嚴重、發生概率高,且疾病進展后,患者將失去所有現有治療手段對生存期的收益。因此,對于這部分PCa患者急需開發出新的治療手段,以提高其生活質量、延長生存期。
NK細胞是大顆粒淋巴細胞,約占人體外周血淋巴細胞總數的10%左右[9]。NK細胞參與天然免疫和適應性免疫,是先天免疫系統中最具殺傷性的細胞毒性淋巴細胞,能夠介導強大的抗病毒和抗腫瘤作用[10]。NK細胞是除T細胞之外的機體抗腫瘤的另一重要利器,其本身具有廣譜抗腫瘤的作用,同時還具有強大的間接增強T細胞免疫應答的作用,是T細胞發揮抗腫瘤功能的基礎[11]。
有研究表明,NK細胞過繼性回輸在晚期非小細胞肺癌的治療中取得了令人滿意的效果[12]。免疫檢查點抑制劑與NK細胞聯合應用,在治療白血病和非小細胞肺癌患者時是安全、有效且具有生存益處的[13]。與T細胞相比,NK細胞的過繼性回輸具有耐受性良好,神經毒性、細胞因子釋放綜合征(Cytokine release syndrome,CRS)和移植物抗宿主病(Graft-versus-host disease GVHD)等嚴重不良反應的發生率大大降低;同種異體NK細胞的回輸還能避免或降低殺傷細胞免疫球蛋白樣受體(Killer-cell immunoglobulin-like receptors,KIRs)介導的抑制性信號,從而發揮更好的抗腫瘤作用[14-16]。
本研究建立了一種NK細胞體外誘導擴增的方法,將外周血中占比較少的NK細胞(10.97±3.28)%,擴增到占比(83.20±8.54)%以上,細胞總數擴增倍數為(251.66±19.05)倍,NK細胞擴增倍數為(1 940.17±402.22)倍。高效的NK細胞體外擴增方法的成功建立為NK細胞的過繼性免疫治療的廣泛應用奠定了基礎。
LNCap細胞系保留了PCa腫瘤細胞學及其早期分化功能的特征,代表著早期雄激素依賴性的PCa的顯著特征。LNCap細胞傾向分泌總前列腺特異性抗原(tPSA),而升高的tPSA提示為雄激素依賴性和早期腫瘤[17]。DU145細胞系分化程度低,為雄激素非依賴的PCa細胞,具有強大的轉移潛能,缺乏內源性的雄激素受體的表達[18]。DU145以分泌游離前列腺特異性抗原(fPSA)為主,而升高的fPSA應警惕雄激素非依賴性腫瘤的存在[19]。PC3細胞系分化程度低,為雄激素非依賴性PCa細胞,不含有內源性的雄激素受體,具有中等強度的轉移潛能,被廣泛用于雄激素抵抗型的PCa的研究[20]。本研究結果顯示效應細胞NK細胞對3種靶細胞的殺傷率差異極顯著(P<0.01),殺傷效率為由高到低分別為LNCaP細胞、DU145細胞、PC3細胞;并且對于PC3細胞,隨著效靶比的增高,不但沒有殺傷作用,反而促進其生長(殺傷效率為負數)。本研究通過對以往研究資料的梳理,發現在生物學特性方面[18],PC3細胞、DU145細胞是激素抵抗性前列腺癌(Castration resistant Pros-tate Cancer,CRPC),而LNCaP細胞是激素敏感性前列腺癌(Metastatic hormone-sensitive prostate cancerm,mHSPC),為什么NK細胞對LNCaP的殺傷效果好,而對PC3細胞反而無殺傷力?甚至促進其生長?可能的機制是NK細胞對mHSPC殺傷效果好而對于CRPC殺傷效果差甚至起到反作用。PC3與DU145均為低分化、雄激素非依賴的PCa細胞,均具有轉移潛能且缺乏內源性的雄激素受體的表達,均同時表達細胞生長因子CK5和CK8/18;而PC3與LN-CaP均表現為上皮細胞特性、高表達E-cadherin、不表達Vimentin。因此,除PC3細胞不表達野生型P53蛋白,而DU145和LNCaP細胞均可表達野生型P53蛋白外,并沒有發現PC3細胞系與另外兩株PCa細胞系的不同之處。然而,P53基因是人體的抑癌基因之一,其突變會導致原有抑癌功能的喪失,同時獲得新的致癌功能;有研究證明表達野生型P53基因的腫瘤細胞對放、化療的敏感性強于不表達野生型P53基因的腫瘤細胞[21]。這說明本研究中“NK細胞促進PC3細胞系生長”的結果,可能是由PC3細胞系不表達野生型P53蛋白引起的;也可能是由PC3細胞系的特殊性導致的,而這種“特殊性”在目前的研究資料中并沒有呈現出來,因此需要后續進行深入研究探索其作用機制。本研究的結果為腫瘤免疫逃逸的研究提供了可作為目標的研究細胞以及研究方向,為應用NK細胞過繼性回輸治療前列腺癌的臨床應用奠定了基礎。
4 結論
采用細胞因子誘導擴增PBMCs的方法能夠獲得純度較高、數量足夠的NK細胞,為NK細胞的臨床應用奠定基礎;NK細胞對3種PCa細胞系的殺傷率差異極顯著,為后續進行深入研究探索原因及作用機制提供了方向。

