鹽度對滸苔(Ulva prolifera)微觀繁殖體萌發生長及藻體繁殖的影響*
馬薇薇 王 楠 孫 妍 孫 松
鹽度對滸苔()微觀繁殖體萌發生長及藻體繁殖的影響*
馬薇薇1, 2, 3王 楠1, 2孫 妍1, 2孫 松1, 2, 3①
(1. 中國科學院海洋研究所 海洋生態與環境科學重點實驗室 山東青島 266071; 2. 中國科學院大學 北京 100049; 3. 山東膠州灣海洋生態系統國家野外科學觀測研究站 山東青島 266071)
黃海綠潮起源于蘇北淺灘, 每年夏天漂移到青島沿岸泛濫成災, 對生態環境造成嚴重破壞。蘇北淺灘受沿岸徑流輸入影響, 鹽度變化范圍大, 青島海域鹽度較穩定, 稍高于蘇北淺灘。鹽度對滸苔微觀繁殖體萌發、藻體生長及繁殖過程具有重要作用, 通過室內連續受控實驗, 系統研究了固定鹽度(5、10、15、20、25、30、33、35)和變化鹽度(鹽度逐漸降低)對滸苔微觀繁殖體固著、萌發、藻體生長和繁殖不同階段的影響, 主要結論如下: 固著階段, 鹽度5不利于滸苔微觀繁殖體的固著, 鹽度10~35對微觀繁殖體固著的影響不顯著, 相同鹽度下, 孢子的固著量顯著高于配子。萌發階段, 不同鹽度(5~35)及不同鹽度變化形式對微觀繁殖體(孢子和配子)的萌發沒有顯著影響, 孢子的萌發速度快于配子, 最終均能完全萌發。生長階段, 低鹽(5~15)不利于滸苔幼苗的生長。繁殖階段, 當鹽度≤10時, 滸苔不進行生殖活動; 鹽度15~35范圍內, 滸苔可以產生微觀繁殖體, 完成一個完整的生活史; 在綠潮形成過程中, 孢子的生殖策略為K對策, 配子的生殖策略為R對策。上述結論表明, 在蘇北淺灘和青島海域, 鹽度不是限制滸苔發生發展及繁殖過程的關鍵環境因子, 明確了鹽度在綠潮發生過程的作用, 為揭示綠潮暴發機制提供科學依據。
鹽度; 滸苔(); 滸苔微觀繁殖體; 萌發生長; 繁殖
自2007年以來, 黃海海域連年大規模暴發綠潮, 漂浮綠藻大量增殖、堆積及腐爛降解, 引發水體缺氧和水產養殖動物死亡, 對海洋生態環境安全及海洋經濟可持續發展造成嚴重威脅, 引起了科學家和政府的高度關注(Sun, 2008; Ye, 2011; Zhou, 2015; 于仁成等, 2018)。通過大量的海上調查和室內實驗, 確定我國黃海綠潮的原因種為滸苔(), 滸苔起源于蘇北淺灘, 在向北漂移過程中不斷增殖, 最終聚集在山東半島沿海(Ding, 2009; Leliaert, 2009; Duan, 2012; Wang, 2015; Zhang, 2020)。滸苔的發生與微觀繁殖體有關, 滸苔生殖過程產生的孢子、配子、合子以及不同生長階段的顯微個體統稱為微觀繁殖體,在其生活史中占據重要地位(Hoffmann, 1991; Liu, 2012; Cao, 2023)(圖1)。滸苔存在有性生殖和無性生殖等多種繁殖方式, 復雜的繁殖方式是滸苔適應變化環境的重要方式(Lin, 2008; Liu, 2015; Wang, 2016; Zhao, 2019)。滸苔生活史中除雌雄配子結合成合子發育成藻體外, 孢子和配子均可單獨發育成藻體, 在適宜的環境條件下, 微觀繁殖體附著在合適的基質上萌發成可見藻體, 對綠藻的生物量產生極大的影響(Huo, 2016; Wang, 2020)。因此, 厘清環境因子對滸苔微觀繁殖體的影響對于研究綠潮暴發機制, 解釋綠潮成因及綠潮預警預報尤為重要。
鹽度是影響大型藻類生長的重要環境因子, 對滸苔微觀繁殖體階段的萌發、藻體的生長、藻體的繁殖等過程中具有重要的作用(Rybak, 2018)。此外, 滸苔生活史中存在必需的微觀繁殖體固著過程, 微觀繁殖體繁殖經過固著后, 才會萌發生長, 固著階段是滸苔生活史的重要組成部分(顏天等, 2018)。研究表明, 滸苔對鹽度適應性較強, 藻體生長的鹽度范圍為12~40, 最適鹽度范圍是24~32; 藻體釋放微觀繁殖體的鹽度范圍在12~40, 最適鹽度范圍為28~40(王建偉等, 2007; 羅民波等, 2011; 張曉紅等, 2012)。蘇北淺灘為滸苔微觀繁殖體的“發源地”, 受到蘇北沿岸流以及地下水的影響, 該區域海水鹽度具有周期性波動的特征, 其鹽度變化范圍較大, 海水鹽度較低通常在30以下, 一般在25~30 (Huo, 2013, 2014; Zhao, 2021)。與蘇北淺灘相比, 青島海域的鹽度比較穩定, 平均鹽度在31左右, 稍高于蘇北淺灘海域。

圖1 滸苔的生活史
注: 改繪自王廣策等(2016)
鹽度對滸苔生活史不同階段影響的研究較多, 大部分研究都是圍繞其生活史中某一個或某幾個階段進行的, 連續觀察鹽度對滸苔整個生活史不同階段的影響方面的研究較少。兩地鹽度水平的差異是如何影響滸苔整個生活史過程的, 孢子和配子在應對蘇北淺灘變化的鹽度環境(鹽度降低)時是否存在差異, 孢子和配子在萌發和繁殖過程中對滸苔暴發的貢獻是否相同, 這些都是亟需解決的問題。
因此, 本研究綜合考慮蘇北淺灘和青島海域鹽度變化特點, 設置固定鹽度和變化鹽度兩組實驗, 系統研究了不同鹽度梯度及不同鹽度變化形式對滸苔微觀繁殖體固著萌發, 幼苗生長, 繁殖等關鍵生活史過程的影響, 進一步探討了不同鹽度條件下滸苔微觀繁殖體的萌發生長過程, 滸苔孢子配子對變化鹽度(蘇北淺灘)的響應及其生殖策略。本研究對認識滸苔在不同鹽度及鹽度變化環境下生長生殖的生物學特征, 深入理解滸苔生活史過程, 揭示鹽度在綠潮發生發展過程中作用機制具有重要意義。
1 材料與方法
1.1 滸苔的培養與微觀繁殖體的獲得
微觀繁殖體來自實驗室長期保種培養的滸苔, 通過斷裂法獲得微觀繁殖體(Dan, 2002), 挑選主枝明顯的成熟滸苔藻體, 去除多余的分支, 將其剪成1~2 cm的藻段, 放入裝有f/2培養液的培養皿中, 每天更換培養液, 2~3天后, 藻體逐漸發黃至變白, 釋放出微觀繁殖體, 培養皿的邊緣出現明顯的綠色痕跡。迅速收集微觀繁殖體, 加入Lugol’s試劑固定染色, 用血球計數板計算繁殖體的初始密度, 便于后續實驗接種使用, 整個過程需迅速完成, 避免微觀繁殖體固著。
1.2 鹽度實驗設計
實驗采用連續培養的方法進行鹽度對滸苔微觀繁殖體萌發、生長、繁殖影響實驗。實驗分為固定鹽度和變化鹽度兩部分。
1.2.1 固定鹽度實驗
(1) 固著萌發實驗
實驗設置8個鹽度梯度, 分別為5、10、15、20、25、30、33、35, 每個梯度設置4個重復。低鹽度通過自然海水(鹽度32)加蒸餾水稀釋而來, 高鹽度通過添加NaCl提高鹽度, 使用鹽度計(ATAGO PAL-06S, 日本)標定鹽度梯度。實驗使用GXZ-380B型光照培養箱進行培養, 溫度20 °C, 光照強度70 μmol/(m2·s), 光暗比12 h:12 h。實驗所用的微觀繁殖體為配子, 培養容器為50 mL小燒杯, 微觀繁殖體密度為1× 104ind./mL, 燒杯底部放置一塊蓋玻片用于鏡檢, 培養水體體積為40 mL, 燒杯的位置隨機擺放以保證受光均勻。實驗前先避光24 h確保微觀繁殖體的隨機固著, 24 h后每天鏡檢微觀繁殖體的萌發情況(以萌發分裂成兩個細胞為萌發標準), 顯微鏡下隨機選取20個視野(400倍), 記錄微觀繁殖體總數以及萌發的數量, 以此來計算固著量和萌發率。使用徠卡倒置顯微鏡(Leica, 德國), 每天拍照記錄微觀繁殖體的形態變化。實驗期間每天更換培養液, 培養水體為添加f/2營養鹽的滅菌海水, 確保營養鹽充足。
(2) 生長實驗
當微觀繁殖體完全萌發或者萌發率達到穩定時, 隨機取一定數量的滸苔進行生長實驗, 鹽度梯度與固著萌發階段相同。每個燒杯隨機取15根幼苗放入一個培養皿中培養, 每組4個重復, 每個鹽度組共60根幼苗。培養容器為100 mL培養皿(SPL 310100, 韓國)。溫度、光照等條件和萌發階段相同, 每3天測量一次幼苗的長度, 同時更換培養液。由于初始的幼苗太小, 肉眼測量困難, 使用蔡司光學顯微鏡(Zeiss SteREO Discovery.V20, 德國)拍照測量前期幼苗的長度, 待幼苗肉眼可見, 使用數顯游標卡尺進行長度測量。
(3) 繁殖實驗
生長試驗結束后取滸苔幼苗繁殖實驗, 鹽度梯度與萌發生長階段相同。每個培養皿中隨機取10根滸苔幼苗進行單株培養, 共設置8個梯度, 每組4個重復。繁殖實驗每個鹽度梯度下有40根(10根×4)單株培養的幼苗, 共320根幼苗。溫度光照等培養條件與固著萌發階段相同, 實驗容器為100 mm培養皿(NEST, 704004, 江蘇無錫), 定期更換培養液水體, 待幼苗長成成熟藻體后, 定期觀察藻體微觀繁殖體釋放情況。將釋放的微觀繁殖體進行鏡檢, 按照文獻報道通過大小、趨光性以及鞭毛數量判斷其類型(孢子或配子)。滸苔配子和孢子的區分標準: 配子大小約為5~10 μm, 孢子大小約為10~13 μm; 配子具有2根鞭毛, 具有正趨光性, 孢子具有4根鞭毛, 沒有趨光性(Zhang, 2013; Liu, 2015)。
1.2.2 變化鹽度實驗
(1) 固著萌發實驗
變化鹽度組一共設置5個處理組, 實驗組初始鹽度均為30, 之后每天逐漸下降一個鹽度直至保持穩定, 每個處理組設置4個重復, 各實驗組鹽度設置如下表1所示。不同鹽度通過自然海水(鹽度32)加蒸餾水稀釋而來, 使用鹽度計(ATAGO PAL-06S, 日本)標定海水鹽度。實驗使用GXZ-380B型光照培養箱進行培養, 溫度20 °C, 光照強度70 μmol/(m2·s), 光暗比12 h:12 h。實驗所用微觀繁殖體分別為配子和孢子, 微觀繁殖體的密度為1×104ind./L, 培養條件以及顯微觀測方法同1.2.1。
表1 變化鹽度實驗組每天培養的水體鹽度
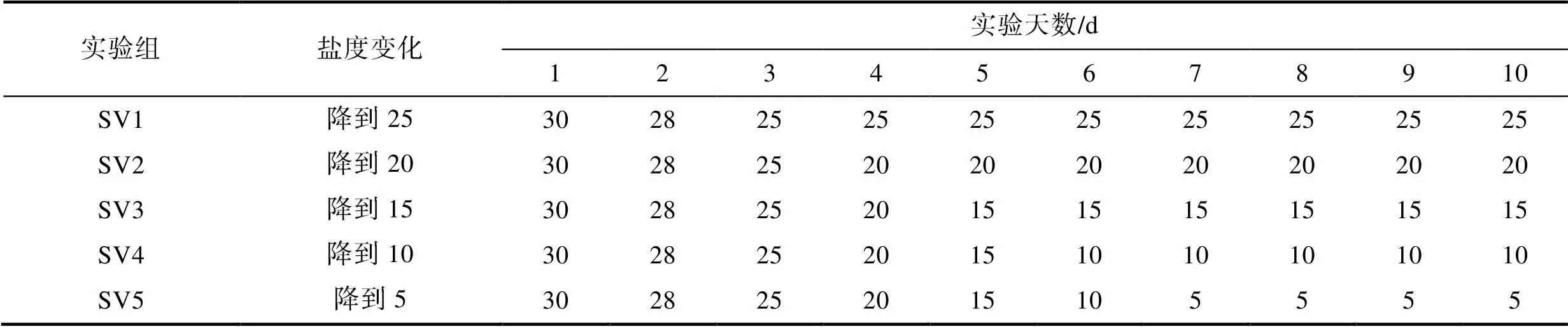
Tab.1 Daily salinity of the experimental group with various salinities
(2) 繁殖實驗
萌發實驗結束后, 每組隨機取10根滸苔幼苗單株培養進行繁殖實驗。繁殖實驗中各組培養鹽度與該組幼苗在萌發實驗結束時的培養鹽度相同, 共設置5個鹽度組, 分別為5、10、15、20、25, 每組實驗4個重復。繁殖實驗每個鹽度梯度下有40根(10根×4)單株培養的幼苗, 共200根幼苗。溫度光照等培養條件與萌發階段相同, 實驗容器為100 mm培養皿(NEST 704004, 江蘇無錫), 定期更換培養水體, 待幼苗長成成熟藻體后, 定期觀察藻體微觀繁殖體釋放情況。將釋放的微觀繁殖體進行鏡檢, 通過大小、趨光性以及鞭毛數量判斷其類型(孢子或配子), 方法同1.2.1。
1.3 數據處理與分析
固著量(單位: ind./mm2)計算公式:

式中,為單位面積內微觀繁殖體的固著量,A為一個視野中微觀繁殖體的數量均值,為Leica顯微鏡400倍下一個視野的面積。
萌發率(%)計算公式:
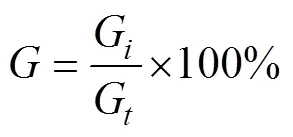
式中,為萌發率,G為一個視野中萌發的微觀繁殖體的數量,G為一個視野中微觀繁殖體的總數。
滸苔幼苗的總生長量(mm)計算公式:

式中,代表滸苔幼苗的總生長量,L表示最后一次測量的長度,0表示初始長度。
滸苔幼苗長度相對生長率(單位: %/d)計算公式:

式中,R代表第到第(+1)次測量之間每天滸苔幼苗長度的相對增長率,L代表第次測量的平均長度,L+1代表第(+1)次測量的長度,代表每次測量長度的時間間隔。
放散率計算公式:

式中為放散率,R釋放微觀繁殖體的滸苔數量,R用于釋放微觀繁殖體的滸苔總數。
實驗數據均采用均值±標準差表示, 使用Origin 2019繪圖, 采用SPSS 26進行ANOVA進行單因素方差分析, LSD進行多重比較差異性(<0.05)分析; 對于方差不齊的數據進行數據轉換, 無法進行方差分析時使用非參檢驗分析。
2 結果
2.1 不同鹽度下滸苔微觀繁殖體固著萌發、幼苗生長、藻體繁殖情況
2.1.1 不同鹽度下滸苔微觀繁殖體的萌發過程 不同鹽度水平下微觀繁殖體的萌發過程類似: 第1天配子固著在玻片上, 呈球形單細胞, 未萌發; 第4天配子開始萌發分裂成兩個細胞, 部分配子形成2~8細胞的絲狀體; 第7天, 各組配子幾乎完全萌發, 形成葉狀體。第10天, 隨著葉狀體的生長發育, 藻體長出大量分支, 藻體長度迅速增加。
2.1.2 不同鹽度下滸苔微觀繁殖體的固著量及萌發率 各鹽度組24 h滸苔微觀繁殖體固著量如圖2所示。不同鹽度水平下滸苔繁殖體固著量之間的差異顯著(<0.05)。當鹽度為5時, 微觀繁殖體固著量最低, 為(9±2) ind./mm2, 顯著低于其他鹽度組(<0.05)。微觀繁殖體固著量最大值為(47±8) ind./mm2, 出現在鹽度35組。當鹽度為20時, 微觀繁殖體固著量為(35±3) ind./mm2, 顯著低于鹽度35組(<0.05)。其余鹽度組微觀繁殖體固著量在(39±6)~(46±3) ind./mm2范圍內, 各組之間的差異不顯著(>0.05)。
當鹽度為5~35時, 滸苔微觀繁殖體各鹽度組萌發率隨著培養時間的增加逐漸升高, 各組變化趨勢相同(圖3)。統計結果顯示, 不同鹽度水平下滸苔微觀繁殖體萌發率之間的差異不顯著(>0.05), 7天左右完全萌發。前3天, 鹽度5水平下微觀繁殖體一直沒有萌發; 其余鹽度組微觀繁殖體萌發率也很低, 約為2%; 第4天所有鹽度組萌發率開始升高, 達到24%左右; 第5天萌發率迅速升高到80%左右; 第7天所有鹽度水平下微觀繁殖體完全萌發, 萌發率為100%。

圖2 不同鹽度水平下滸苔微觀繁殖體固著量
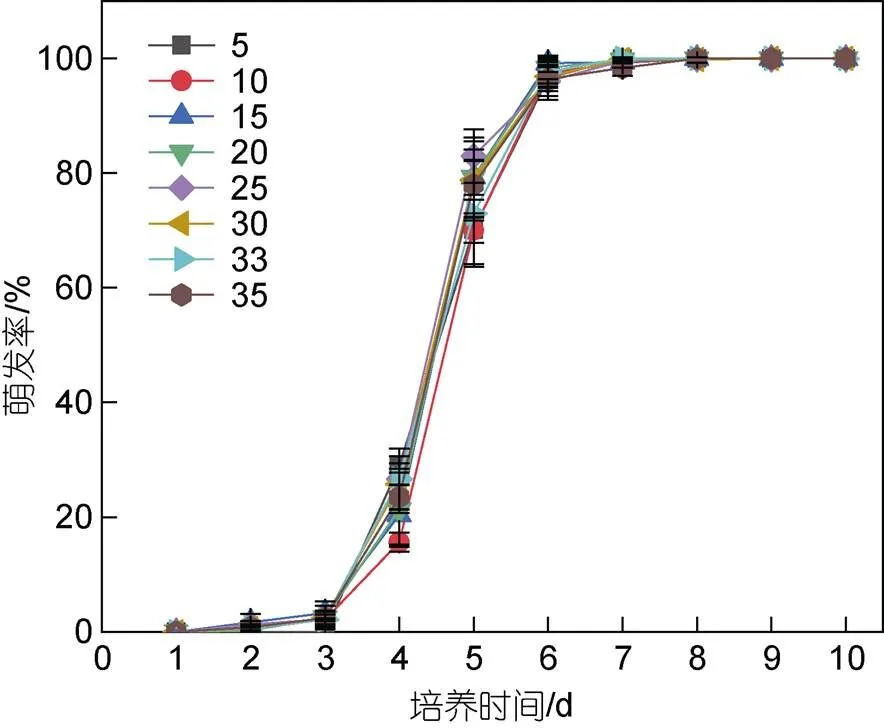
圖3 不同鹽度下滸苔微觀繁殖體萌發率隨時間的變化
2.1.3 不同鹽度下滸苔幼苗總生長量及相對生長率 不同鹽度下滸苔幼苗生長情況如圖4所示, 幼苗總生長量最大值為(44.9±20.7) mm, 出現在鹽度25實驗組; 最小值為(14.0±2.1) mm, 出現在鹽度5實驗組。鹽度顯著影響滸苔幼苗總生長量(<0.05), 當鹽度低于15時, 各組總生長量之間的差異不顯著(>0.05),整體低于鹽度20~35實驗組。隨著培養時間的增加, 滸苔幼苗相對生長率逐漸降低, 不同鹽度水平下相對生長率之間的差異顯著(<0.05, 圖5)。實驗1~12天, 鹽度5~15實驗組滸苔幼苗相對生長率低于鹽度20~35實驗組(<0.05); 實驗13~15天, 鹽度30~35實驗組相對生長率較高; 實驗16~18天, 不同鹽度水平下滸苔幼苗的相對生長率之間的差異不顯著(>0.05)。
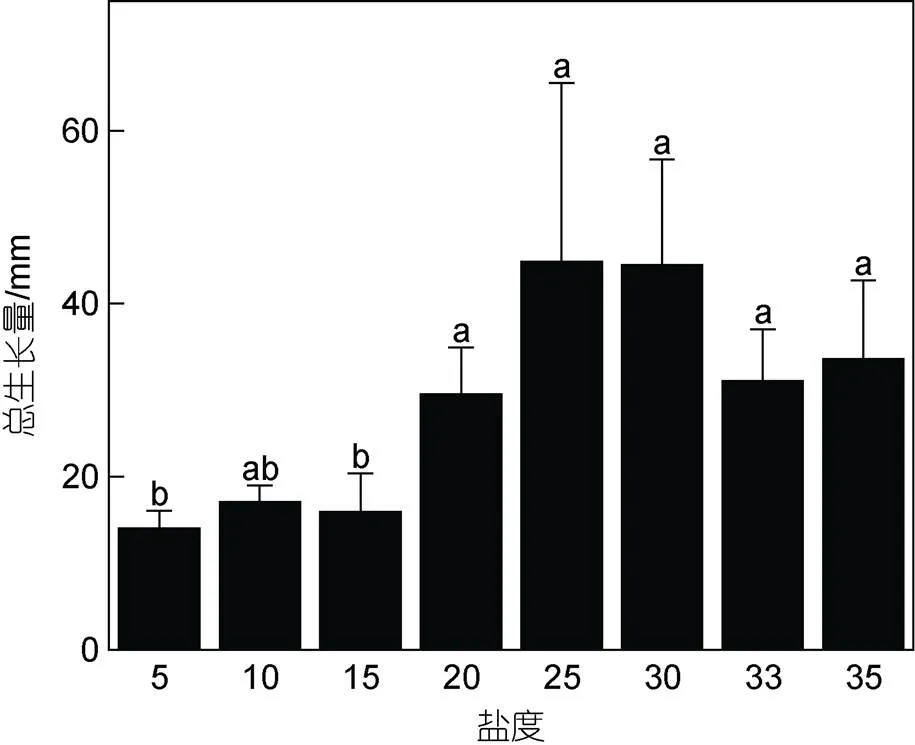
圖4 不同鹽度水平對滸苔幼苗總生長量的影響

圖5 不同鹽度水平對滸苔幼苗相對生長率的影響
不同鹽度下滸苔幼苗相對生長率隨時間的變化示意圖如圖6所示, 不同鹽度下滸苔幼苗的快速萌發期(滸苔幼苗相對生長率大于20 %/d的天數)不同, 低鹽條件下滸苔幼苗的快速萌發期約為9天, 高鹽條件下快速萌發期約為12天。
2.1.4 不同鹽度下滸苔藻體繁殖情況 本實驗所用藻體為配子萌發長成的藻體, 各組藻體的放散率如圖7所示。鹽度5和10實驗組沒有觀測到藻體釋放微觀繁殖體, 鹽度15~35范圍內滸苔均可釋放微觀繁殖體。統計結果顯示, 不同鹽度下滸苔放散率之間的差異顯著, 鹽度5和10實驗組放散率最低為0 (<0.05), 其余鹽度組放散率在43%~95%。藻體放散后, 鏡檢結果顯示, 不同鹽度水平下滸苔釋放出的微觀繁殖體均具有4根鞭毛, 具有負趨光性, 認為產生的微觀繁殖體為孢子。由于微觀繁殖體固著速度較快, 部分實驗組微觀繁殖體的鞭毛隨固著而消失, 實際鏡檢到4鞭毛孢子的藻體數量少于所有實驗組放散的藻體數量(表2)。
2.2 變化鹽度下滸苔微觀繁殖體的固著萌發及繁殖情況
2.2.1 變化鹽度組滸苔孢子和配子的萌發過程 變化鹽度下滸苔孢子和配子的萌發過程有所不同, 孢子整體萌發早于配子。前3天配子未萌發, 第4天配子開始萌發分裂。第1天孢子已經有萌發的跡象, 細胞膨大開始延伸, 第2天部分孢子已經開始萌發分裂成2細胞, 第3~5天孢子分裂生長形成絲狀體。孢子的萌發速度快于配子, 7天內孢子和配子完全萌發成葉狀體, 第10天隨著葉狀體的發育, 藻體可見大量分支, 部分藻體基部形成假根。

圖6 不同鹽度水平下滸苔幼苗相對生長率隨時間的變化示意圖

圖 7 不同鹽度水平對滸苔(微觀繁殖體萌發成藻體)放散率的影響
表2 不同鹽度水平下滸苔放散微觀繁殖體類型
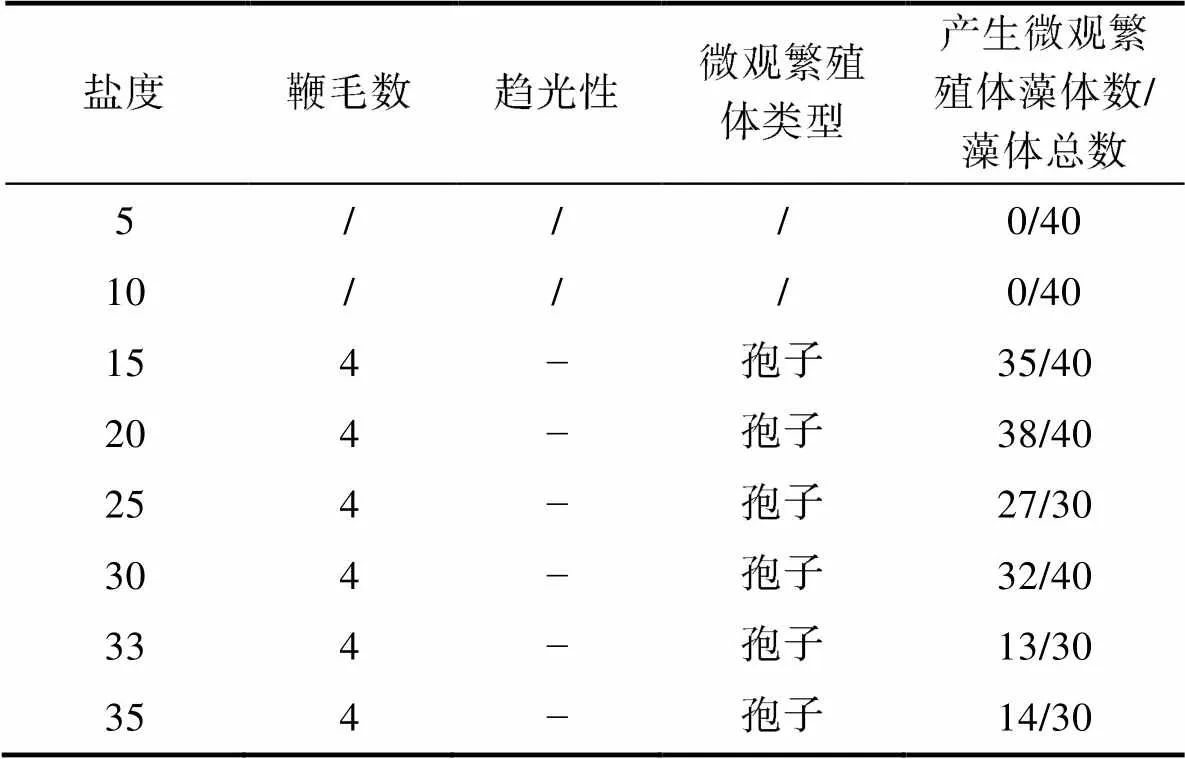
Tab.2 The dispersal micropropagules types of Ulva prolifera under different salinity levels
注: /代表未觀測到; ?代表負趨光性
2.2.2 變化鹽度組滸苔孢子和配子的固著量及萌發率 變化鹽度實驗中, 不同變化鹽度實驗組中第一天鹽度均為30, 滸苔配子和孢子固著量24 h固著量分別為(34±6)和(93±14) ind./mm2(圖8), 統計結果顯示, 孢子和配子固著量之間的差異極顯著(<0.01)。
滸苔孢子和配子的萌發率隨著培養時間的增加逐漸升高(圖9), 最終萌發率均為100%, 統計結果顯示, 鹽度變化對孢子和配子萌發率的影響不顯著(>0.05)。從萌發過程來看, 孢子萌發速度快于配子。前3天配子的萌發率較低, 不到1%; 第2天孢子開始快速萌發, 萌發率約為20%, 第3天孢子萌發率達到50%左右。第5天, 配子的萌發率達到50%左右, 孢子的萌發率約為90%。7天內孢子和配子幾乎完全萌發, 萌發率接近100%。

圖8 固著萌發實驗中滸苔孢子和配子24 h固著量
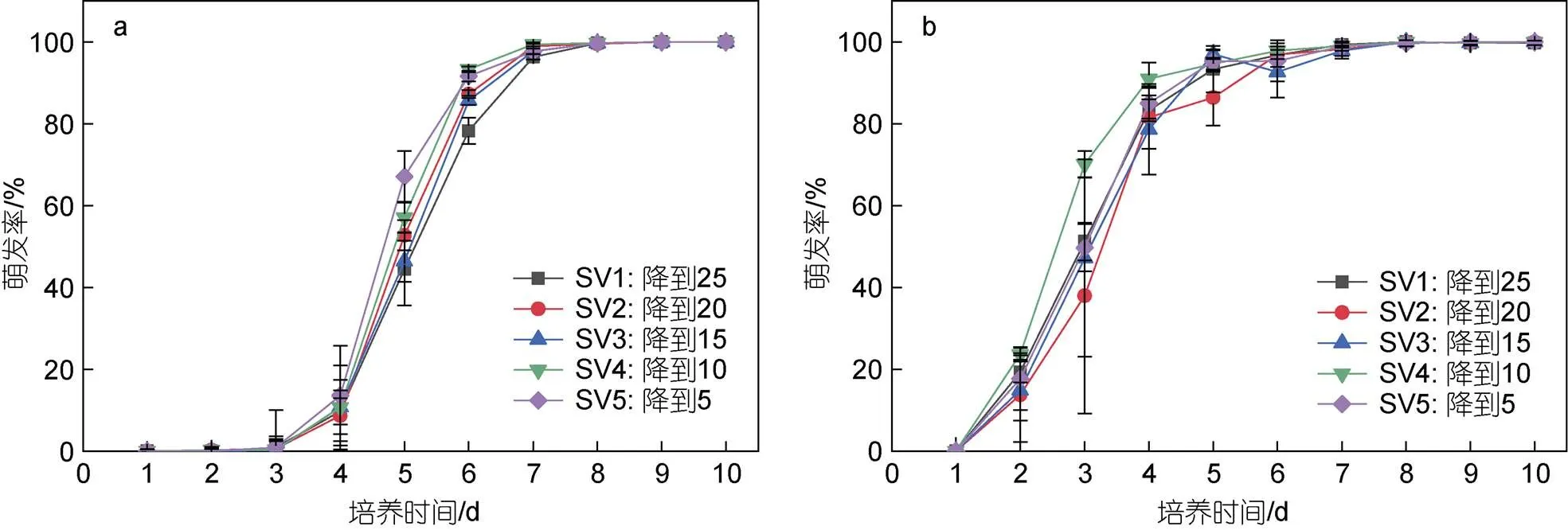
圖9 變化鹽度對滸苔孢子和配子萌發率隨時間的變化
注: a: 滸苔配子; b: 滸苔孢子
2.2.3 變化鹽度組滸苔藻體的繁殖情況 變化鹽度組的繁殖實驗中使用了兩種藻體, 一種藻體來自固著萌發實驗中配子萌發長成的成體, 下文簡稱為配子長成的藻體; 另一種藻體是由固著萌發實驗中孢子萌發長成的成體, 下文簡稱為孢子長成的藻體。變化鹽度實驗繁殖階段的鹽度為變化鹽度最后保持穩定的鹽度, 故鹽度不再變化。
圖10a展示了各鹽度梯度下配子長成的藻體的放散率, 鹽度顯著影響藻體的放散率(<0.05)。其中, 鹽度5和10實驗組, 藻體均未釋放微觀繁殖體。其他三個鹽度組藻體都釋放了微觀繁殖體, 放散率在70%~80%范圍內。統計結果顯示, 這三個鹽度下放散率之間的差異不顯著(>0.05)。鏡檢結果顯示, 配子長成的藻體釋放的微觀繁殖體均具有4根鞭毛, 具有負趨光性, 認為產生的微觀繁殖體為孢子。由于微觀繁殖體固著速度較快, 部分實驗組微觀繁殖體的鞭毛隨固著而消失, 實際鏡檢到4鞭毛孢子的藻體數量少于實驗中放散的藻體數量(表3)。

圖10 不同鹽度對滸苔(微觀繁殖體萌發長成的藻體)放散率的影響
注: a: 配子萌發而成的滸苔產生微觀繁殖體的放散率; b: 孢子萌發而成的滸苔產生微觀繁殖體的放散率
表3 不同鹽度水平下配子發育成滸苔放散微觀繁殖體類型

Tab.3 The dispersal micropropagules types of Ulva prolifera germinated from gametes under different salinity levels
注:/代表未檢測到; ?代表負趨光性
鹽度顯著影響孢子長成的藻體繁殖情況(<0.05),各鹽度梯度下藻體放散率如圖10b所示, 放散率的規律與配子長成的藻體相同。當鹽度為5和10時, 藻體沒有釋放微觀繁殖體。當鹽度為15~25時, 藻體均釋放了微觀繁殖體, 放散率在83%~98%范圍內。鏡檢結果顯示, 本組實驗中孢子長成的藻體釋放的微觀繁殖體均具有2根鞭毛, 具有正趨光性, 認為產生的微觀繁殖體為配子。由于微觀繁殖體固著速度較快, 部分實驗組微觀繁殖體的鞭毛隨固著而消失, 實際鏡檢到2鞭毛配子的藻體數量少于實驗中放散的藻體數量(表4)。
我們進一步分析了相同鹽度下, 配子長成的藻體的繁殖情況與孢子長成的藻體是否有差異。當鹽度為15和20時, 相同鹽度下孢子長成的藻體和配子長成的藻體的放散率之間的差異不顯著(>0.05)。當鹽度為25時, 相同鹽度下孢子的放散率顯著高于配子的放散率(<0.05)。
表4 不同鹽度水平下孢子發育成滸苔放散微觀繁殖體類型
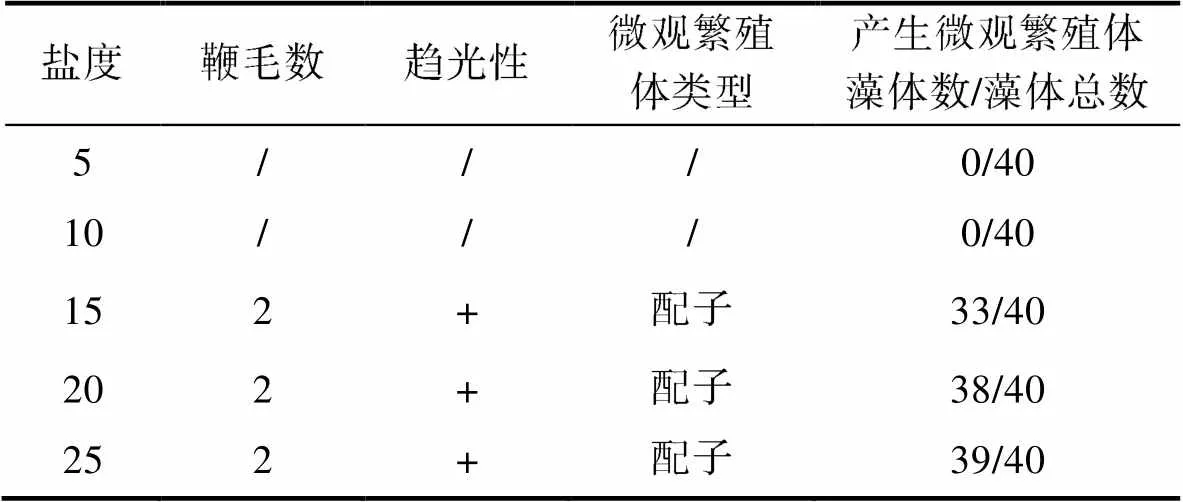
Tab.4 The dispersal micropropagules types of Ulva prolifera germinated from spores under different salinity levels
注: /代表未檢測到; +代表正趨光性
3 討論
本研究系統地研究了鹽度對滸苔的整個生活史不同階段的影響, 實驗設置的鹽度梯度(5~35)涵蓋了蘇北淺灘和青島海域的鹽度變化范圍, 同時設置變化鹽度模擬變化的鹽度環境對滸苔孢子和配子的影響, 下文將分別闡明鹽度在滸苔生活中微觀繁殖體的固著萌發、幼苗生長及藻體繁殖階段的作用。
3.1 鹽度對滸苔微觀繁殖體固著萌發階段的影響
鹽度對微觀繁殖體的萌發生長以及繁殖具有重要作用, 盡管滸苔微觀繁殖體對鹽度適應范圍廣, 在鹽度5水平下微觀繁殖體固著量顯著低于其他鹽度, 僅為其他鹽度的四分之一, 說明低鹽(≤5)不利于微觀繁殖體固著。已有研究表明, 鹽度在一定程度下會影響藻細胞的滲透壓, 鹽度過低會對藻細胞造成傷害, 導致微觀繁殖體固著量降低(Choi, 2010; Chokshi, 2017)。鹽度為30時, 滸苔孢子固著量高于配子, 這可能是因為孢子體積較大, 且具有負趨光性, 比配子更容易沉降附著到培養容器底部。
鹽度對滸苔微觀繁殖體萌發過程及最終萌發率的影響不大, 各鹽度下微觀繁殖體7天內均能完全萌發。趙瑾等(2018)發現在單株培養條件下不同鹽度對微觀繁殖體萌發階段沒有影響, 與本實驗結果一致, 在多種藻類共存時, 鹽度通過影響種間競爭, 進而對微觀繁殖體萌發率產生顯著影響, 未來需要進一步研究多種藻類共存情況下鹽度對滸苔微觀繁殖體固著萌發的影響。本實驗中, 鹽度5實驗組的微觀繁殖體萌發過程及萌發率均未受到低鹽的影響, 可能是因為實驗培養水體為f/2培養液(NO3-N為882 μmol/L, PO4-P為42 μmol/L), 為微觀繁殖體萌發提供了充足的營養鹽, 培養水體中高濃度的NO3-N減輕了低鹽對萌發過程產生的負面影響。Kamer等(2001)發現高濃度的NO3-N可以減輕低鹽對的負面影響, 其他學者在研究鹽度和營養鹽對石莼屬綠藻萌發生長過程也得出類似結論(Imchen, 2012; Bews, 2021)。
滸苔不同類型生殖細胞的萌發速度存在顯著差異, 孢子的萌發速度快于配子, 兩者完全萌發所需的時間相同, 均為7天。不同形式的鹽度變化對孢子配子的最終萌發率影響不顯著, 最終萌發率均為100%, 這說明微觀繁殖體對鹽度的適應性很強, 能夠在各種變化的鹽度環境中快速固著萌發。本實驗中發現相同鹽度下孢子的固著量是配子的2倍, 且孢子萌發速度快于配子, Zhang等(2013)發現在蘇北淺灘采集滸苔樣本中孢子萌發率為96.1%, 配子萌發率為91.6%, 與本實驗結果較為一致。然而Cui等(2018)研究滸苔不同類型微觀繁殖體的萌發過程發現, 孢子的萌發率(91.67%)是配子(30%)的三倍多, 整體低于本研究中孢子配子最終萌發率, 主要原因在于萌發率的計算方法不同。本實驗中通過計數顯微鏡下一個視野內微觀繁殖體的萌發個數與該視野下微觀繁殖體, 而其他研究中萌發率為萌發的幼苗數量和加入總數的比值來計算萌發率, 前者是通過萌發的幼苗數量和微觀繁殖體總量的比值計算萌發率, 不同的方法產生不同結果。此外, 實驗中滸苔微觀繁殖體的狀態和培養條件都會對萌發率產生影響。
3.2 鹽度對滸苔幼苗生長階段的影響
本實驗結果表明, 滸苔對鹽度適應范圍廣, 在5~35范圍內均可以生長, 與吳洪喜等人的研究結果一致(吳洪喜等, 2000; 王建偉等, 2007; Xiao, 2016)。低鹽通常會抑制大型藻類孢子的萌發, 對藻體生長也有類似抑制作用(Martins, 1999; Kamer, 2000; Choi, 2010)。本實驗中, 鹽度≤15時, 滸苔幼苗總生長量顯著低于其他鹽度組。因為低鹽條件下, 滸苔需要更多能量抵抗低鹽導致的滲透脅迫(Touchette, 2007), 因此光合作用產生的物質及能量主要用于調節滲透壓, 分配到生長的能量會降低, 表現為低鹽抑制了滸苔的生長(Li, 2017)。在石莼屬(Sousa, 2007),(Chen, 2015),(Bisson, 1979)中均存在低鹽限制其萌發生長的現象。本實驗中, 鹽度高于15時, 對滸苔幼苗的生長量影響不顯著, 該鹽度梯度涵蓋了蘇北淺灘和青島海域鹽度變化區間, 結果表明, 鹽度不是影響兩地滸苔幼苗生長的關鍵環境因子。
實驗發現不同鹽度下滸苔幼苗快速萌發期不同(圖6), 低鹽條件下滸苔幼苗的快速萌發期短于高鹽條件, 同時, 低鹽水平下滸苔幼苗的相對生長率低于高鹽水平, 與已有研究結果一致, 這可能是因為滸苔幼苗對環境更加敏感, 長期處于低鹽環境會抑制滸苔幼苗的生長(王津果等, 2022)。
3.3 鹽度對滸苔繁殖階段的影響
本實驗中滸苔釋放微觀繁殖體的鹽度范圍為15~ 35, 低鹽水平5和10不進行生殖活動, 與相關報道一致(Dan, 2002; 王建偉等, 2007)。這可能因為當鹽度低于10對滸苔造成了滲透脅迫, 抑制了滸苔孢子囊形成, 從而無法釋放微觀繁殖體(羅民波等, 2011)。Christie等(1962)曾發現腸滸苔在鹽度低于10時不會釋放孢子。當鹽度在15~30范圍內時, 對滸苔繁殖的影響不顯著, 這說明在蘇北淺灘和青島海域鹽度不是影響滸苔繁殖過程的關鍵環境因子。
在滸苔生活史中, 配子體孢子體交替出現的有性生殖類型較為常見, 此外滸苔可以進行單性生殖, 即配子可以直接萌發成新藻體, 但是在本實驗中, 配子體產生的配子不經單性生殖, 萌發成藻體釋放出四鞭毛的孢子, 即配子體釋放的配子直接發育成孢子體(圖11)。由于本實驗藻體都是單株放散, 排除雌雄配子融合的可能性, 認為配子出現了二倍體化現象。其他學者在進行滸苔室內生活史研究中也出現二倍體化的現象(劉青, 2015)。在石莼屬()綠藻中有過類似報道,在經過多個單性配子體世代后, 出現了配子體孢子體世代交替的過程, 由配子發育成孢子體(Hoxmark, 1974; Hoxmark, 1975)。為了進一步驗證二倍體化, 本實驗將收集的孢子液通過流式細胞儀檢測孢子的倍性, 由于收集到孢子濃度較低, 孢子液中硅藻數量過多(萌發實驗中顯微鏡下可見大量的硅藻), 干擾了孢子的峰值, 無法判斷四鞭毛孢子的倍性, 未來工作中需要分子生物學手段進一步確認微觀繁殖體的倍性研究。

圖11 鹽度實驗中滸苔生活史過程示意圖
漂浮滸苔藻體處于生活史的哪個階段, 孢子體還是配子體, 有性生殖還是無性生殖對于理解漂浮滸苔生物量劇增, 揭示滸苔生活史和繁殖方式在綠潮形成中作用具有重要意義。有學者認為, 單性生殖和無性生殖是漂浮滸苔主要生殖方式, 漂浮滸苔多為配子體, 能夠產生大量的配子, 同時配子具有正趨光性, 有利于附著在漂浮滸苔藻體上萌發生長; 此外, 配子無需結合可以直接附著萌發, 這種繁殖方式可以快速增加滸苔的繁殖速度和數量(張華偉等, 2011)。Zhao等(2019)通過細胞核型分析的方法鑒定滸苔的倍性, 證明漂浮滸苔基本是孢子體, 有性生殖是漂浮滸苔的典型生活史特征。原因在于孢子體生長期長于配子體, 有性生殖有利于清除有害突變, 積累有益突變, 更好地適應滸苔漂浮期間的環境變化。Liu等(2015)對漂浮滸苔進行生活史研究發現漂浮滸苔既有有性生殖又有無性生殖, 沒有明顯規律。對于漂浮滸苔處于哪個生活史階段, 仍沒有明確答案。
成熟滸苔可以持續釋放數量巨大的微觀繁殖體, 強大的繁殖能力是滸苔生物量快速增加引起暴發的原因之一(Lotze, 1999; 張華偉等, 2011)。滸苔主要存在孢子和配子兩種類型微觀繁殖體。漂浮滸苔在暴發期間迅速形成孢子囊, 釋放孢子可以直接在原來藻體上萌發生長, 加快滸苔繁殖速率(鄭陣兵等, 2018), 本實驗表明, 孢子具有更快的固著及萌發速度, 為滸苔生物量快速積累提供基礎。成熟滸苔產生的配子量約是孢子量的兩倍(王曉坤等, 2007), 配子可以直接固著萌發成新的藻體 (Zhang, 2013; 韓紅賓等, 2015), 萌發速度比孢子慢。
從孢子和配子兩類微觀繁殖體的產生量、固著量和萌發速度來看, 我們認為孢子和配子在綠潮形成中生殖策略不同: 孢子為K生殖對策, 個體大, 釋放量小, 固著萌發速度快, 在綠潮發生發展過程中以“質”取勝; 配子為R生殖對策, 個體小, 釋放量大, 固著萌發速度相對較慢, 以“量”取勝。
3.4 鹽度在黃海綠潮形成中的作用
通過對比固定鹽度和變化鹽度下滸苔配子固著、萌發、和藻體繁殖的影響發現, 滸苔微觀繁殖體對鹽度適應范圍廣, 對變化鹽度適應性很強, 固定鹽度和變化鹽度對滸苔發生發展過程的影響均不顯著。具體地說: 在固著階段, 實驗所涉及的固定鹽度和變化鹽條件下配子平均固著量在(34±5)~(38±12) ind./mm2。在萌發階段, 固定鹽度和變化鹽度下滸苔配子萌發過程相似, 7天內均能夠完全萌發。
綜上所述, 鹽度在5~35范圍內微觀繁殖體均可完全萌發生長, 鹽度在15~35可以生殖產生新的微觀繁殖體, 完成一個完整的生活史過程。但是, 低鹽(≤10)會限制滸苔的生長和繁殖過程。本實驗鹽度范圍涵蓋了蘇北淺灘鹽度區間(25~30), 在蘇北淺灘鹽度范圍, 微觀繁殖體可以萌發生長, 長成的藻體也可以完成繁殖過程, 產生新的微觀繁殖體, 為滸苔發生發展不斷補充微觀繁殖體; 在青島鹽度范圍(30~31)內, 鹽度不會影響微觀繁殖體的生長發育, 可以完成生活史。本文在已有科學認知上進一步明確了鹽度在滸苔生活史不同階段的作用, 揭示了鹽度不是限制蘇北淺灘和青島海域滸苔微觀繁殖體生長和藻體繁殖的關鍵環境因子, 推測在綠潮漂移過程中環境條件復雜多變, 當鹽度變化劇烈時, 微觀繁殖體也可以萌發生長完成生活史, 保證漂浮綠潮的生物量, 同時滸苔采用不同的生殖對策應對多變的環境, 滸苔產生的孢子量少但個體較大, 則通過快速固著萌發發育成藻體, 保證“質量”為漂浮綠藻提供來源; 配子產生量大, 固著萌發速度較慢, 通過“數量”為漂浮藻體提供生物量基礎。
4 結論
本文通過室內實驗研究了不同鹽度梯度以及變化鹽度對滸苔配子和孢子固著、萌發、生長以及繁殖過程的影響, 主要結論如下。固著萌發階段, 鹽度5不利于滸苔微觀繁殖體的固著; 鹽度5~35范圍內, 微觀繁殖體均可以在7天內完全萌發。鹽度變化對微觀繁殖體的萌發沒有影響。孢子固著及萌發速度均快于配子。生長階段, 低鹽條件下5~15不利于滸苔幼苗的生長。繁殖階段, 滸苔釋放微觀繁殖體的鹽度范圍為15~35, 低鹽(5~10)滸苔藻體不會進行生殖活動。在綠潮形成過程中, 孢子的生殖策略為K對策, 配子的生殖策略為R對策。
綜上, 在蘇北淺灘和青島海域, 鹽度不是限制滸苔發生發展及繁殖過程的關鍵環境因子, 明確了鹽度對滸苔生活史不同階段的影響及在綠潮發展過程中作用, 探討了不同微觀繁殖體類型應對變化環境的生殖策略, 加深對綠潮發生及發展機制的理解, 為應對和防控黃海綠潮問題提供重要的思路。今后研究中, 對于控制綠潮早期發展過程的關鍵環境因素, 以及綠潮防控治理等仍需開展進一步研究。
于仁成, 孫松, 顏天等, 2018. 黃海綠潮研究: 回顧與展望[J]. 海洋與湖沼, 49(5): 942-949.
王廣策, 唐學璽, 何培民等, 2016. 滸苔光合作用等關鍵生理過程對環境因子響應途徑的研究進展[J]. 植物生理學報, 52(11): 1627-1636.
王建偉, 閻斌倫, 林阿朋等, 2007. 滸苔()生長及孢子釋放的生態因子研究[J]. 海洋通報, 26(2): 60-65.
王津果, 陳澤宇, 倪嘉璇等, 2022. 光照強度和鹽度對滸苔幼苗生長和光合生理的影響[J]. 江蘇海洋大學學報(自然科學版), 31(4): 1-10.
王曉坤, 馬家海, 葉道才等, 2007. 滸苔()生活史的初步研究[J]. 海洋通報, 26(5): 112-116.
劉青, 2015. 黃海綠潮滸苔與浮游植物間的相互作用研究[D]. 青島: 中國科學院研究生院(海洋研究所).
吳洪喜, 徐愛光, 吳美寧, 2000. 滸苔實驗生態的初步研究[J]. 浙江海洋學院學報(自然科學版), 19(3): 230-234.
張華偉, 馬家海, 胡翔等, 2011. 綠潮漂浮滸苔繁殖特性的研究[J]. 上海海洋大學學報, 20(4): 600-606.
張曉紅, 王宗靈, 李瑞香等, 2012. 不同溫度、鹽度下滸苔()群體增長和生殖的顯微觀測[J]. 海洋科學進展, 30(2): 276-283.
羅民波, 劉峰, 2011. 黃海綠潮滸苔()的生長生殖對不同鹽度的響應研究[C] // 十一五農業環境研究回顧與展望——第四屆全國農業環境科學學術研討會論文集. 呼和浩特: 中國農業生態環境保護協會: 481-486.
鄭陣兵, 高山, 王廣策, 2018. 2017年綠潮滸苔()生理特征及孢子囊形成情況分析[J]. 海洋與湖沼, 49(5): 999-1005.
趙瑾, 馬瑩瑩, 解威峰, 等, 2018. 鹽度與種間競爭對漂浮生態型滸苔微繁體萌發和生長的影響[J]. 海洋與湖沼, 49(5): 991-998.
韓紅賓, 韋章良, 霍元子, 等, 2015. 溫度與光照強度對滸苔孢子/配子放散和萌發的影響[J]. 海洋漁業, 37(6): 517-524.
顏天, 于仁成, 周名江, 等, 2018. 黃海海域大規模綠潮成因與應對策略——“鰲山計劃”研究進展[J]. 海洋與湖沼, 49(5): 950-958.
BEWS E, BOOHER L, POLIZZI T, 2021. Effects of salinity and nutrients on metabolism and growth of: Implications for bioremediation of coastal watersheds [J]. Marine Pollution Bulletin, 166: 112199.
BISSON M A, KIRST G O, 1979. Osmotic adaption in the marine alga(Rhodophyceae): the role of ions and organic compounds [J]. Functional Plant Biology, 6(4): 523-538.
CAO J X, LIU J L, ZHAO S, 2023. Advances in the research on micropropagules and their role in green tide outbreaks in the Southern Yellow Sea [J]. Marine Pollution Bulletin, 188: 114710.
CHEN B B, ZOU D H, 2015. Altered seawater salinity levels affected growth and photosynthesis of(Ulvales, Chlorophyta) germlings [J]. Acta Oceanologica Sinica, 34(8): 108-113.
CHOI T S, KANG E J, KIM J H, 2010. Effect of salinity on growth and nutrient uptake of(Chlorophyta) from an eelgrass bed [J]. Algae, 25(1): 17-26.
CHOKSHI K, PANCHA I, GHOSH A, 2017. Salinity induced oxidative stress alters the physiological responses and improves the biofuel potential of green microalgae[J]. Bioresource Technology, 244: 1376-1383.
CHRISTIE A O, EVANS L V, 1962. Periodicity in the liberation of gametes and zoospores ofLink [J]. Nature, 193(4811): 193-194.
CUI J J, SHI J T, ZHANG J H, 2018. Rapid expansion ofblooms in the Yellow Sea, China through sexual reproduction and vegetative growth [J]. Marine Pollution Bulletin, 130: 223-228.
DAN A, HIRAOKA M, OHNO M, 2002. Observations on the effect of salinity and photon fluence rate on the induction of sporulation and rhizoid formation in the green alga(Muller) J. Agardh (Chlorophyta, Ulvales) [J]. Fisheries Science, 68(6): 1182-1188.
DING L P, FEI X G, LU Q Q, 2009. The possibility analysis of habitats, origin and reappearance of bloom green alga () on inshore of western Yellow Sea [J]. Chinese Journal of Oceanology and Limnology, 27(3): 421-424.
DUAN W J, GUO L X, SUN D, 2012. Morphological and molecular characterization of free-floating and attached green macroalgaespp. in the Yellow Sea of China [J]. Journal of Applied Phycology, 24(1): 97-108.
HOFFMANN A J, SANTELICES B, 1991. Banks of algal microscopic forms: hypotheses on their functioning and comparisons with seed banks [J]. Marine Ecology Progress Series, 79(1/2): 185-194.
HOXMARK R C, 1975. Experimental analysis of the life cycle of[J]. Botanica Marina, 18(2): 123-129.
HOXMARK R C, NORDBY ?, 1974. Haploid meiosis as a regular phenomenon in the life cycle of[J]. Hereditas, 76(2): 239-249.
HUO Y Z, HAN H B, HUA L, 2016. Tracing the origin of green macroalgal blooms based on the large scale spatio-temporal distribution ofmicroscopic propagules and settled maturevegetative thalli in coastal regions of the Yellow Sea, China [J]. Harmful Algae, 59: 91-99.
HUO Y Z, HUA L, WU H L, 2014. Abundance and distribution ofmicroscopic propagules associated with a green tide in the southern coast of the Yellow Sea [J]. Harmful Algae, 39: 357-364.
HUO Y Z, ZHANG J H, CHEN L P, 2013. Green algae blooms caused byin the southern Yellow Sea: identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period [J]. Limnology and Oceanography, 58(6): 2206-2218.
IMCHEN T, 2012. Recruitment potential of a green algaWulfen dark preserved zoospore and its development [J]. PLoS One, 7(3): e32651.
KAMER K, FONG P, 2000. A fluctuating salinity regime mitigates the negative effects of reduced salinity on the estuarine macroalga,(L.) link [J]. Journal of Experimental Marine Biology and Ecology, 254(1): 53-69.
KAMER K, FONG P, 2001. Nitrogen enrichment ameliorates the negative effects of reduced salinity on the green macroalga[J]. Marine Ecology Progress Series, 218: 87-93.
LELIAERT F, ZHANG X W, YE N H, 2009. Research note: identity of the Qingdao algal bloom [J]. Phycological Research, 57(2): 147-151.
LI Y H, WANG D, XU X T, 2017. Physiological responses of a green algae () exposed to simulated acid rain and decreased salinity [J]. Photosynthetica, 55(4): 623-629.
LIN A P, SHEN S D, WANG J W, 2008. Reproduction diversity of[J]. Journal of Integrative Plant Biology, 50(5): 622-629.
LIU F, PANG S J, ZHAO X B,, 2012. Quantitative, molecular and growth analyses ofmicroscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred [J]. Marine Environmental Research, 74: 56-63.
LIU Q, YU R C, YAN T, 2015. Laboratory study on the life history of bloom-formingin the Yellow Sea [J]. Estuarine, Coastal and Shelf Science, 163: 82-88.
LOTZE H K, SCHRAMM W, SCHORIES D, 1999. Control of macroalgal blooms at early developmental stages:versusspp. [J]. Oecologia, 119(1): 46-54.
MARTINS I, OLIVEIRA J M, FLINDT M R,, 1999. The effect of salinity on the growth rate of the macroalgae(Chlorophyta) in the Mondego estuary (west Portugal) [J]. Acta Oecologica, 20(4): 259-265.
RYBAK A S, 2018. Species of(Ulvophyceae, Chlorophyta) as indicators of salinity [J]. Ecological Indicators, 85: 253-261.
SOUSA A I, MARTINS I, LILLEB? A I, 2007. Influence of salinity, nutrients and light on the germination and growth ofsp. spores [J]. Journal of Experimental Marine Biology and Ecology, 341(1): 142-150.
SUN S, WANG F, LI C L, 2008. Emerging challenges: massive green algae blooms in the Yellow Sea [J]. Nature Precedings, doi: 10.1038/npre.2008.2266.1.
TOUCHETTE B W, 2007. Seagrass-salinity interactions: physiological mechanisms used by submersed marine angiosperms for a life at sea [J]. Journal of Experimental Marine Biology and Ecology, 350(1/2): 194-215.
WANG H, LIN A P, GU W H, 2016. The sporulation of the green algais controlled by changes in photosynthetic electron transport chain [J]. Scientific Reports, 6: 24923.
WANG H, WANG G C, GU W H, 2020. Macroalgal blooms caused by marine nutrient changes resulting from human activities [J]. Journal of Applied Ecology, 57(4): 766-776.
WANG Z L, XIAO J, FAN S L, 2015. Who made the world's largest green tide in China?-An integrated study on the initiation and early development of the green tide in Yellow Sea [J]. Limnology and Oceanography, 60(4): 1105-1117.
XIAO J, ZHANG X H, GAO C L, 2016. Effect of temperature, salinity and irradiance on growth and photosynthesis of[J]. Acta Oceanologica Sinica, 35(10): 114-121.
YE N H, ZHANG X W, MAO Y Z, 2011. ‘Green tides’ are overwhelming the coastline of our blue planet: taking the world’s largest example [J]. Ecological Research, 26(3): 477-485.
ZHANG J H, HUO Y Z, YU K F, 2013. Growth characteristics and reproductive capability of green tide algae in Rudong coast, China [J]. Journal of Applied Phycology, 25(3): 795-803.
ZHANG H B, WANG G S, ZHANG C S, 2020. Characterization of the development stages and roles of nutrients and other environmental factors in green tides in the Southern Yellow Sea, China [J]. Harmful Algae, 98: 101893.
ZHAO X H, CUI J J, ZHANG J H, 2019. Reproductive strategy of the floating algain blooms in the Yellow Sea based on a combination of zoid and chromosome analysis [J]. Marine Pollution Bulletin, 146: 584-590.
ZHAO S B, XU B C, YAO Q Z, 2021. Nutrient-rich submarine groundwater discharge fuels the largest green tide in the world [J]. Science of the Total Environment, 770: 144845.
ZHOU M J, LIU D Y, ANDERSON D M, 2015. Introduction to the Special Issue on green tides in the Yellow Sea [J]. Estuarine, Coastal and Shelf Science, 163: 3-8.
EFFECT OF SALINITY ON THE GERMINATION AND GROWTH OF MICROPROPAGULES AND ALGAL REPRODUCTION OF
MA Wei-Wei1, 2, 3, WANG Nan1, 2, SUN Yan1, 2, SUN Song1, 2, 3
(1. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Jiaozhou Bay Marine Ecosystem Research Station, Chinese Academy of Sciences, Qingdao 266071, China)
The Yellow Sea green tide originates from the Subei shoal and drifts to the coast of Qingdao every summer, causing serious damage to the ecological environment. The salinity of Qingdao coastal waters is more stable and slightly higher than that of Subei shoal. Salinity plays an important role in the germination of micropropagules, algal growth, and reproduction process of. Therefore, the effects of fixed salinity (5, 10, 15, 20, 25, 30, 33, 35) and variable salinity (salinity gradually decreases) on different stages oflife history attachment, germination, growth, and reproduction were systematically studied through indoor continuous controlled experiments. Results show that the effect of salinity 10~35 on micropropagules attachment was not significant, and the attachment amount of spores was significantly higher than that of gametes at the same salinity. In the germination stage, different salinities (5~35) and the forms of salinity changes did not show significant effects on the germination of micropropagules (spores and gametes), the germination of spores was faster than that of gametes, and both eventually germinated completely. In the growth stage, low salinity (5~15) was not conducive to the growth ofseedlings. In the reproduction stage, when the salinity was ≤10, thedid not reproduce. In the range of salinity 15~35,could produce micropropagules and completed its life history. In the process of green tide formation, the reproductive strategy of spores was the K response and that of gametes was the R response. The above findings indicate that salinity was not a key environmental factor limiting the development and reproduction process ofin the Subei Shoal and Qingdao coastal waters, clarifying the role of salinity in the process of green tide occurrence and providing a scientific basis for understanding the mechanism of green tide outbreak.
salinity;; micropropagules of; germination and growth; reproduction
* 嶗山實驗室科技創新項目資助, LSKJ202204005號。馬薇薇, 博士研究生, E-mail: 836938134@qq.com
孫 松, 博士生導師, 研究員, E-mail: sunsong@qdio.ac.cn
2023-04-13,
2023-05-05
P76
10.11693/hyhz20230400085

