2021~2022年榮成海域多相赤潮的分子鑒定*
劉奎艷 王洪淑 劉 峰 陳楠生①
2021~2022年榮成海域多相赤潮的分子鑒定*
劉奎艷1, 2, 3, 4王洪淑1, 2, 3劉 峰1, 2, 3陳楠生1, 2, 3, 4①
(1. 中國科學院海洋研究所 海洋生態與環境科學重點實驗室 山東青島 266071; 2. 嶗山實驗室 山東青島 266237; 3. 中國科學院海洋大科學研究中心 山東青島 266071; 4. 中國科學院大學 北京 100049)
山東半島瀕臨渤海和黃海, 海岸帶復雜, 海岸線長, 近岸海域赤潮事件頻發。然而, 由于部分赤潮物種的形態難以識別, 或易降解不穩定, 加上形態鑒定專業要求高, 導致致災赤潮物種未得到準確鑒定。2021年11月至2022年4月間山東榮成海域海帶養殖區暴發嚴重赤潮事件, 面積達1 440 km2, 導致海帶白化、潰爛, 造成嚴重經濟損失。對該海域水樣固定樣本的觀察鑒定到兩種致災赤潮物種, 紅色赤潮藻()和多紋膝溝藻(), 二者均為山東近海常見的致災赤潮物種。該研究通過對赤潮樣本中活體單細胞的顯微觀察和單細胞測序分析, 根據藻細胞形態特征與分子標記序列相似性鑒定到三種優勢致災赤潮物種, 包括紅色赤潮藻、多紋膝溝藻和灰白下溝藻()。其中灰白下溝藻由于在固定過程中不穩定而較少得到鑒定。對該赤潮海域水樣開展宏條形碼分析, 除了發現上述三種致災赤潮物種外, 還發現了另外一個致災赤潮物種紡錘環溝藻()。紡錘環溝藻也由于在固定過程中不穩定而較少得到鑒定。由此可見, 宏條形碼分析方法更加準確系統地鑒定了該赤潮事件的致災赤潮物種。由于宏條形碼分析流程比較便于規范化, 并且該方法可以獲得比僅利用細胞形態特征進行鑒定, 或兼用基于形態特征和分子標記方法進行鑒定更加全面的結果, 研究表明宏條形碼分析可以準確系統地鑒定組成較為復雜的多相赤潮事件的致災赤潮物種。
赤潮; 甲藻; 宏條形碼分析; 紅色赤潮藻; 多紋膝溝藻
隨著人類社會的進步, 人類活動對生態環境造成越來越嚴重的影響(周名江等, 2001; Anderson, 2008, 2012), 赤潮成為一種頻發海洋生態災害(俞志明等, 2019)。20世紀以來, 赤潮事件暴發呈增強趨勢, 持續時間延長、發生規模擴大、頻率增加(Hallegraeff, 2010; Zhang, 2012, 2022; McCabe, 2016), 赤潮暴發演替過程更加復雜化(俞秀霞, 2012; León- Mu?oz, 2018)。赤潮已經對全球的經濟持續發展、人類食品安全、海洋生態系統平衡穩定帶來了嚴重的威脅(周名江等, 2001; Yu, 2017)。
山東省瀕臨渤海和黃海, 海岸線居全國第三(周健等, 2020), 屬于溫帶季風氣候, 近海水文情況復雜(周斌等, 2013), 且近年來包括養殖業、旅游業等人類活動影響增加, 加劇了水體富營養化水平(宋建杰, 2011)。在氣候、海流和人類活動的多重影響下, 山東近海赤潮的規模不斷擴大、暴發頻率逐漸上升, 在生態環境、人類健康和經濟發展多方面帶來了嚴重負面影響。山東近海1952~2021年間共記錄赤潮事件140次, 其中原因種得到鑒定的共有114次, 以單相型赤潮為主, 偶有雙相型(陳楠生等, 2023)。得到鑒定的主要致災赤潮物種包括夜光藻()、紅色赤潮藻()、中肋骨條藻()、海洋卡盾藻()、球形棕囊藻()、赤潮異彎藻()、多紋膝溝藻()、具刺膝溝藻()、米氏凱倫藻()和大洋角管藻()(陳楠生等, 2023)。目前, 致災赤潮物種的鑒定主要根據其形態學特征, 對于細胞尺寸較小、形態特征高度相似的隱存種、形態特征不穩定或可塑性高以及固定過程中細胞不穩定性的赤潮物種往往很難獲得準確鑒定(黃長江等, 2000b; 甄毓等, 2006; Liu, 2020)。因此, 上述致災赤潮物種的鑒定結果有可能并不準確或者并不全面。
基于分子標記的物種鑒定大大地提高了分辨率(Lavrinienko, 2021)。基于通用分子標記擴增子高通量測序的宏條形碼分析技術也能夠用于系統分析浮游植物組成(Margulies, 2005; Stoeck, 2010; 陳楠生, 2020), 可以實現對致災赤潮物種鑒定的標準化、規范化, 具有較高的可操作性和可重復性, 規范化的宏條形碼分析流程可能用于在全面系統、準確地鑒定致災赤潮物種, 解析赤潮物種組成。
2021年11月至2022年4月在山東省榮成市的海帶養殖區海域發現海水顏色異常, 赤潮面積高達1 440 km2, 養殖區內海帶苗生長停滯, 部分海帶出現白化、潰爛, 海帶受災面積超過93 km2(李曉東等, 2023)。本研究對此次赤潮暴發區域的表層水體樣本進行致災赤潮物種的鑒定調查, 首先通過對活體樣本中浮游植物進行形態學觀察初步鑒定, 再利用分子生物學手段包括單細胞擴增、環境DNA克隆文庫測序以獲得優勢致災物種的分子標記序列從而進行鑒定。與此同時, 利用宏條形碼分析方法解析該赤潮樣本內的浮游植物組成以及相對豐度。比較兩種方法的鑒定結果, 證明本次赤潮事件是一次以紅色赤潮藻、多紋膝溝藻、紡錘環溝藻()和灰白下溝藻()為主導的多相赤潮事件, 從而表明宏條形碼分析方法可以用于準確鑒定赤潮事件的致災赤潮物種。
1 材料與方法
1.1 樣品采集及處理
2022年1月3日在山東省榮成市沿岸的赤潮暴發區域(37°22′6″N, 122°37′49″E)(圖1)采集到2.5 L表層海水, 借助倒置顯微鏡(Nikon Ts2, 日本)觀察活體水樣并進行拍照(ECHO RVL-100-G, 美國)。水樣經過200 μm篩絹(安平縣絲網制品有限公司, 中國)過濾去除海水中的大型浮游生物及雜質。將3個平行(各平行體積0.8 L)的水樣分別收集至0.22 μm聚碳酸酯膜(Millipore, 美國)上放入液氮保存直至DNA提取。
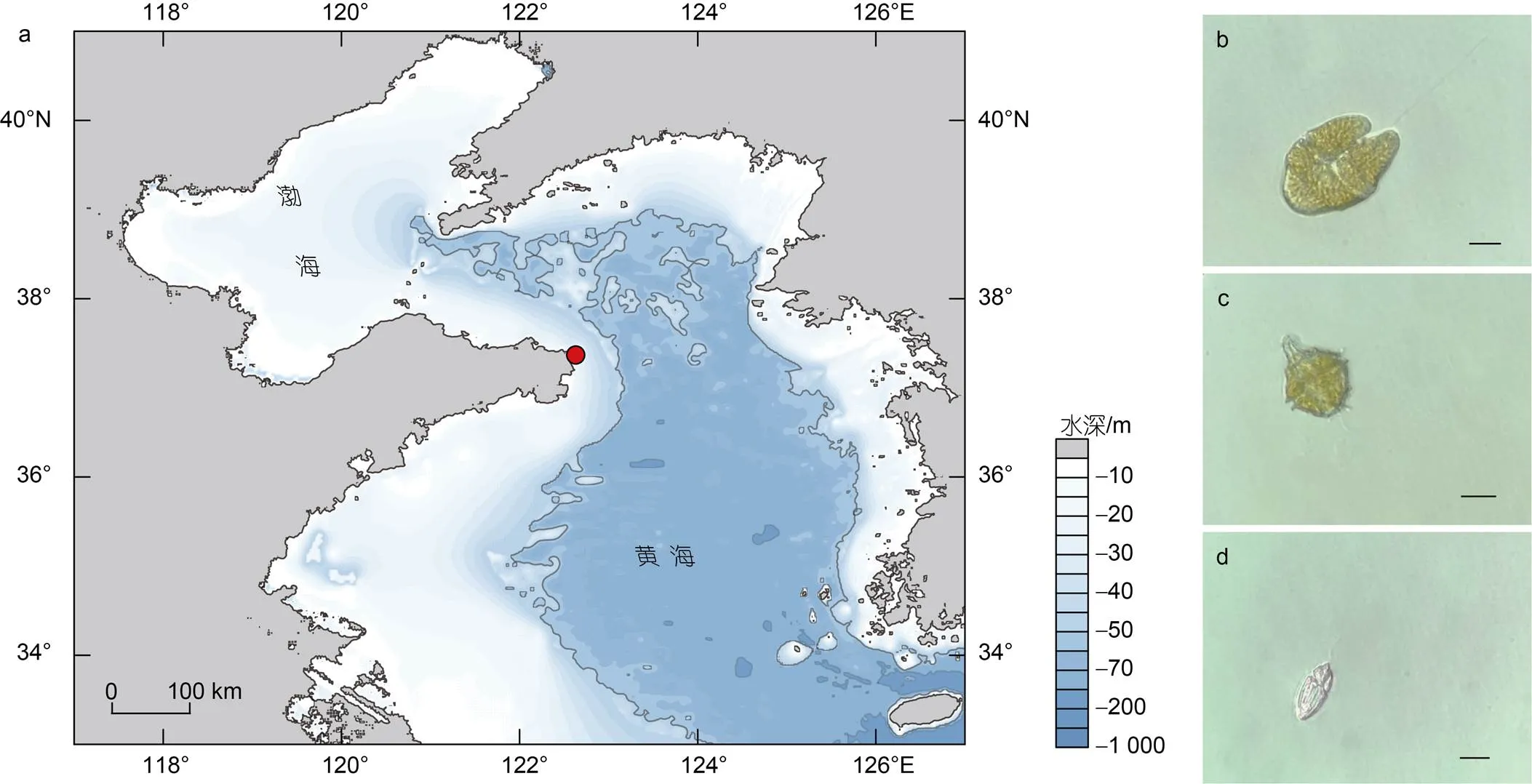
圖1 赤潮樣品采集位置及浮游植物優勢種
注: a: 采集位置(紅點); b: 鏡檢并分離的紅色赤潮藻; c: 鏡檢并分離的多紋膝溝藻; d: 鏡檢并分離的灰白下溝藻(圖b~d比例尺=10 μm)
1.2 單細胞PCR
借助毛細管單細胞分離法在倒置顯微鏡(Nikon Ts2, 日本)下從活體水樣中挑取占主導的赤潮物種單細胞, 作為模板擴增其18S rDNA全長序列。PCR流程按照Plant Direct PCR Kit試劑盒(諾唯贊, 中國)中加熱裂解法的說明操作進行, 將單細胞在10 μL Plant DirectLysis Buffer A中, 95 °C加熱5 min, 加熱后短暫離心, 取其2 μL上清作為25 μL擴增體系的模板。擴增引物為28F(5′-CGAATT CAA CCT GGT TGA TCC TGC CAG T-3′)和42R(5′-CCGGAT CCT GAT CCT TCT GCA GGT TCA CCT AC-3′)(Saldarriaga, 2003)。擴增條件: 98 °C預變性5 min; 然后95 °C變性10 s, 57 °C退火15 s, 72 °C延伸2 min, 共35個循環; 最后72 °C延伸5 min, 經1%瓊脂糖凝膠電泳檢測PCR產物。擴增產物純化及sanger測序由生工生物工程(上海)股份有限公司完成。測序獲得序列經ContigExpress軟件(ThermoFisher, 美國)組裝后, 共獲得6條序列CNT00031-CNT00036 (登錄號: OQ152428-OQ152432、OQ162335, 已提交至NCBI的GenBank數據庫)。
1.3 環境樣品DNA提取擴增、測序
環境濾膜樣品的DNA提取使用HP Plant DNA kit試劑盒(Omega, 美國), 流程參照(Liu, 2020)。環境DNA樣品用于兩項分析: (1) 用于18S rDNA全長序列的擴增、克隆測序: 擴增引物為28F和42R (上述1.2單細胞PCR流程提及)。擴增條件: 94 °C預變性4 min; 然后94 °C變性1 min, 57 °C退火30 s, 72 °C延伸2 min, 共32個循環; 最后72 °C延伸10 min, 經1%瓊脂糖凝膠電泳檢測PCR產物。使用Hieff Clone?ZeroTOPO-TA Cloning Kit 試劑盒(上海翊圣生物科技有限公司, 中國)將純化后產物與pESI-T載體連接, 隨后轉化至DH5 α感受態細胞。從中挑選出30個克隆進行第一代DNA測序(即Sanger測序), 測序引物為M13F(5′-TGTAAAACGACGGCCAGT-3′)和 M13R(5′-CAGGAAACAGCTATGACC-3′)。以上擴增產物的純化、克隆測序由上海生工生物工程完成。測序獲得序列經ContigExpress軟件(ThermoFisher, 美國)組裝后, 共獲得30條序列CNT00001-CNT00030 (登錄號: OQ152393、OQ152394、OQ152408-OQ152427、OQ162327-OQ162334, 已提交至NCBI的GenBank數據庫); (2) 用于宏條形碼分析的18S rDNA V4區擴增、測序: 流程參照(Stoeck, 2010; Liu, 2021), 原始數據已提交至NCBI, BioProject編號為PRJNA936563。
1.4 系統進化分析
對本研究所獲得的共36條18S rDNA全長序列(包括6條單細胞PCR產物序列和30條環境樣本擴增克隆序列)借助NCBI的BLAST (http://www.ncbi. nlm.nih.gov/BLAST/)默認參數進行序列相似性比對。以從NCBI獲得的來自世界各海域的19條紅色赤潮藻、6條多紋膝溝藻和1條底刺膝溝藻()的18S rDNA全長序列為參考序列(Gunderson, 2001; Hee, 2004; Jeong, 2005; Takano, 2006; Ki, 2007; Chen, 2015, 2018; Kim, 2023), 結合本研究中獲得的紅色赤潮藻的17條序列和多紋膝溝藻的10條序列(Genbank登錄號: OQ152393、OQ152394, OQ152408-OQ152432), 以三角異帽藻()為外類群(Saunders, 1997), 借助IQtree軟件(Nguyen, 2015)分別選擇了最適合的核苷酸置換模型TN+F+I, 自展值為1 000, 重構自展一致樹(Bootstrap consensus tree)。
1.5 宏條形碼分析
宏條形碼測序結果的分析借助R軟件包DADA2 (Callahan, 2016), 分析流程參考(Liu, 2021), 生成的擴增子序列變異(amplicon sequence variants, ASVs)序列基于Protist Ribosomal Reference (PR2) 數據庫(Guillou, 2013)進行初步的分類學信息注釋。進一步地, 以相對豐度>0.01%的ASV為重點研究對象, 基于NCBI NT數據庫借助BLAST將各ASV序列注釋至最高PID結果所對應的物種信息(PID閾值為99%, coverage閾值為95%)。對注釋為浮游植物門類的ASV進行后續分析, 使用R軟件包ggplot2 (Wickham, 2009)基于ASV數目和ASV相對豐度分別繪制柱狀圖和餅圖。另外借助POPART 1.7軟件(Leigh, 2015)對注釋為紅色赤潮藻和多紋膝溝藻的單倍型分別構建了TCS網絡圖以展示多樣性。
2 結果
2.1 致災赤潮物種的形態和分子鑒定
光學顯微鏡下對活體水樣鏡檢觀察, 發現該樣本中主要存在3種可運動的藻類細胞(圖1b, 1c, 1d)。依據參考文獻報道描述的典型形態特征(Daugbjerg, 2000; Kim, 2006; 劉瑞玉, 2008; Gómez, 2016), 將3個物種依次鑒定為疑似紅色赤潮藻、膝溝藻和疑似灰白下溝藻。為了驗證形態觀察結果, 對3種藻細胞進行單細胞分離并對其進行18S rDNA全長序列的單細胞PCR, 最終共成功獲得6個18S rDNA全長序列的測序結果(圖1b物種登錄號: OQ152428- OQ152430; 圖1c物種登錄號: OQ152431和OQ152432; 圖1d物種登錄號: OQ162335)。其中, 圖1b物種的3個18S rDNA全長序列皆以100%的相似度比對至紅色赤潮藻(登錄號: OK638976); 圖1c物種的兩個18S rDNA全長序列分別以99.83%和99.72%的相似度比對至多紋膝溝藻(登錄號: AJ833631) (Jeong, 2005); 圖1d物種的1個18S rDNA全長序列以99.93%的相似度比對至灰白下溝藻(登錄號: KP790161)(Re?é, 2015)(附表)。單細胞分子標記擴增結果證實了對活體水體樣本的形態學鑒定結果, 即該赤潮是一次以紅色赤潮藻、多紋膝溝藻和灰白下溝藻為主導的多相赤潮。
進一步借助從赤潮位點的環境DNA樣本所獲得的共30個18S rDNA全長克隆測序結果(附表), 分別比對到紅色赤潮藻(13條, 相似度99.67%~99.94%)、多紋膝溝藻(7條, 99.61%~99.72%)、紡錘環溝藻(1條, 99.71%)、其他浮游植物(4條)、其他海洋生物(5條)。紅色赤潮藻和多紋膝溝藻的檢出和高占比, 證明了這兩個物種的確作為赤潮原因種引起了榮成海域的赤潮暴發。除此之外, 對赤潮海域環境樣本針對18S rDNA分子標記進行克隆測序也檢出了紡錘環溝藻, 表明分子分析的準確性和可靠性。
2.2 赤潮原因種的系統發育分析
以三角異帽藻為外類群, 分別針對紅色赤潮藻(圖2a)和多紋膝溝藻(圖2b)重建18S rDNA全長序列系統發育樹。發現所有紅色赤潮藻株系主要形成3個分支: 首先, 亞洲海域的2個株系, 韓國GSW0207株系(Kim, 2004)和中國潿洲島S2-2019-Ak株系聚為一支; 其次, 來自美國不同海域的6個株系以97的較高自展支持值聚為一支; 最后, 本次榮成的克隆測序和單細胞分離株系得到的紅色赤潮藻序列皆與絕大部分的亞洲海域株系, 包括中國、日本、韓國株系, 和歐洲海域的2個株系, 法國和挪威株系, 聚為一個大支。所有多紋膝溝藻株系, 除了CNT00007序列之外, 以67的自展支持值與韓國海域的6個株系聚為一支。

圖2 基于18S rDNA全長序列的赤潮優勢種系統發育樹(以三角異帽藻為外類群)
注: a: 紅色赤潮藻; b: 多紋膝溝藻; 加粗字體表示株系來源地區, 紅字表示本研究紅色赤潮藻測序結果序列, 藍字表示本研究多紋膝溝藻測序結果序列, *表示單細胞擴增測序結果
2.3 赤潮物種組成的宏條形碼分析
為了評估宏條形碼分析方法在鑒定致災赤潮物種中的應用價值, 我們對赤潮水體開展了宏條形碼分析。對水體中浮游植物DNA的18S rDNA V4區擴增和高通量測序結果進行了DADA2分析, 共獲得了1 016個ASVs, 經過過濾獲得的666個ASVs, 包括405個浮游植物ASVs (圖3a)。在405個浮游植物ASVs中, 超過一半(268個)注釋為甲藻門, 相對豐度為94.6% (圖3b)。這些浮游植物中相對豐度最高的十種物種依次為紅色赤潮藻、多紋膝溝藻、紡錘環溝藻、灰白下溝藻、球形異帽藻()、劇毒卡羅藻()、日本下睫蟲()、夜光藻、相關亞歷山大藻()和。其中紅色赤潮藻在浮游植物中的相對豐度最高, 多紋膝溝藻(ASV2)在浮游植物中的相對豐度第二(包括兩個高度相似但不同的ASV, 即ASV2和ASV5)(圖3c)。該方法鑒定出的致災赤潮物種與兼用基于形態學和分子標記的鑒定結果基本相符, 且宏條形碼分析揭示出更多的物種, 包括紡錘環溝藻, 即該次赤潮是一次以紅色赤潮藻、多紋膝溝藻、紡錘環溝藻和灰白下溝藻為主導的多相赤潮事件。

圖3 宏條形碼分析流程及赤潮浮游植物組成
3 討論
隨著生態環境的復雜化, 混合多相赤潮呈現愈來愈頻繁發生的趨勢。紅色赤潮藻近幾年更易形成多相赤潮, 2011年在廈門同安灣海域發生了范圍105 km2的紅色赤潮藻、中肋骨條藻和角毛藻的三相赤潮(俞秀霞, 2012), 2016年惠州市大亞灣海域發生了范圍74 km2的紅色赤潮藻、中肋骨條藻和夜光藻的三相赤潮(2016 年廣東省海洋災害公報), 另在2021年在山東東營以北渤海海域發生了范圍高達3 800 km2的紅色赤潮藻和多紋膝溝藻的雙相赤潮(自然資源部北海局, 2022)。這種由非單一物種引發的赤潮, 反映出水體內物種結構和物種多樣性的高度復雜化, 這也為鑒定致災赤潮物種, 探究物種之間互相作用、赤潮暴發機制帶來一定的難度。
本研究以此次赤潮暴發區域的表層水體樣本為例, 對常規基于形態特征和分子標記的鑒定方法與宏條形碼分析方法兩者進行評價比較, 為后續的赤潮鑒定提供了更多的可行思路。首先借助形態學初步判斷海水中浮游生物的種類和密度, 依據其具備的形態特征對赤潮優勢種進行鑒定, 這也是傳統上公認的赤潮致災物種鑒定方式, 在直觀性和定量化的操作上被認同并一直發揮著不可替代的作用(黃長江等, 2000a; 李雪梅等, 2011)。然而, 形態特征的差別細微、具有較強形態可塑性或固定過程中細胞不穩定性則要求鑒定者需要更豐富的經驗和更精細的觀察工具例如掃描電鏡或透射電鏡(齊雨藻等, 1977; 賴紅艷等, 2007; 李雪梅等, 2011), 為監測應用帶來偏差和復雜。更有甚者, 當物種沒有明確的分類形態特征時, 基于形態學的鑒定方式則很難開展下去(甄毓等, 2006)。本研究通過對赤潮樣本中的活細胞進行形態鑒定, 發現該赤潮事件是一個多相赤潮事件, 優勢致災赤潮物種包括紅色赤潮藻、多紋膝溝藻和灰白下溝藻, 比最近報道的基于對固定樣本觀察的鑒定結果(李曉東等, 2023)多了一個物種灰白下溝藻。灰白下溝藻沒有被鑒定出, 是由于該藻具有固定后細胞不穩定的特點(黃長江等, 2000b)。本研究利用宏條形碼分析除了鑒定出上面三種致災赤潮物種外, 還鑒定出紡錘環溝藻細胞, 表明宏條形碼分析更加準確可靠。基于形態和單細胞測序分析均未鑒定到紡錘環溝藻細胞, 可能是由于該藻細胞較小, 且無色素體(顧海峰等, 2014)而容易被錯過。
分子生物學技術在微生物的分類鑒定上被廣泛、有效地應用, 18S rDNA基因具有穩定的保守區和可變區結構, 因此使得作為分子標記具備通用性和高分辨率(Lavrinienko, 2021), 且針對浮游植物已建立了相對豐富的18S rDNA序列數據庫, 已被推薦作為物種鑒定和系統發育分析的分子標記(Sorhannus, 2004; Luddington, 2012)。本研究中采用了3類分子生物學技術, 包括單細胞DNA擴增、克隆文庫測序和宏條形碼分析技術對赤潮生物樣品進行解析。單細胞DNA擴增可以短時間內獲得目標微藻細胞的全長18S rDNA基因序列, 進而確定其物種信息。然而該方法在目標微藻的選擇和分離上具有局限性, 不能展現群落的物種組成結構和物種多樣性。
基于18S rDNA的克隆文庫測序則可以同時獲得環境DNA中多個物種的分子標記序列, 進行系統發育分析和生物進化分析, 開始對群落的物種多樣性甚至遺傳多樣性進行解讀(Medlin, 1988; Giovannoni, 1990; Lin, 2020), 然而由于測序通量低和挑取陽性克隆的隨機性等弊端(張玉等, 2018), 系統性取樣難以接近飽和, 不能做到準確地表征環境樣品中的生物多樣性(Edgcomb, 2002; Stoeck, 2007)。本研究利用此方法鑒定出了紅色赤潮藻、多紋膝溝藻和紡錘環溝藻這三種致災赤潮物種, 灰白下溝藻沒有得到鑒定, 其隨機性導致低估甚至忽略了致災赤潮物種, 不能全面準確地對本次赤潮進行解析。基于高通量測序的宏條形碼分析技術, 則提供了前所未有的數據獲得量(Margulies, 2005), 這意味著不僅可以更深度全面并準確地分析環境樣品中物種組成, 還可以依據各序列豐度所占比例相對定量的判斷, 便于跟蹤各物種的豐度變化趨勢。此外, 宏條形碼分析技術更易實現鑒定流程的標準化、規范化, 具有較高的可操作性和可重復性(陳楠生, 2020)。本研究通過比較宏條形碼分析方法與兼用基于形態特征和分子標記的鑒定方法, 獲得了一致的鑒定結果, 甚至在具有特殊性質的藻細胞鑒定上有更佳表現, 如難以固定或固定后細胞立即破碎、藻細胞難以分離觀察等。本研究中紡錘環溝藻和灰白下溝藻細胞經過固定后立即破碎(黃長江等, 2000b), 并且分離單細胞較困難, 然而通過宏條形碼分析方法表明二者作為優勢物種, 是赤潮暴發時的重要組成, 由此表明宏條形碼分析方法可以用于準確系統鑒定包括組成較為復雜的多相赤潮事件在內的致災赤潮物種。
4 結論
2021年冬季出現在山東省榮成海域的赤潮物種鑒定研究通過對基于形態特征和分子標記的鑒定方法與宏條形碼分析方法兩者進行評價比較, 獲得了一致的赤潮鑒定結果, 甚至后者在具有特殊性質的藻細胞鑒定上有更佳表現, 即一次以紅色赤潮藻、多紋膝溝藻、紡錘環溝藻和灰白下溝藻為主導的多相赤潮事件, 由此表明宏條形碼分析方法可以用于準確系統鑒定包括組成較為復雜的多相赤潮事件在內的致災赤潮物種。
劉瑞玉, 2008. 中國海洋生物名錄[M]. 北京: 科學出版社.
齊雨藻, 張子安, 1977. 應用掃描電子顯微鏡的硅藻分類研究[J]. 中山大學學報(自然科學版)(4): 14-29.
自然資源部北海局, 2022, 《2021年北海區海洋災害公報》[R/OL]. 19-21(2022-05). http://ncs.mnr.gov.cn/n1/n128/ n298/220609161508806020.html.
李曉東, 蘇麗, 李曉捷, 等, 2023. 2021—2022年山東榮成海帶產區大規模潰爛災害綜合調查分析[J]. 中國農業科技導報, 25(1): 206-222.
李雪梅, 宮春光, 安鑫龍, 2011. 赤潮微藻的分類鑒定方法[J]. 河北漁業(12): 58-59, 63.
宋建杰, 2011. 山東近海生物資源可持續利用對策研究[D]. 青島: 中國海洋大學.
張玉, 米鐵柱, 甄毓, 等, 2018. 海洋沉積物中硫酸鹽還原菌和硫氧化菌群落分析方法的比較[J]. 環境科學, 39(1): 438-449.
陳楠生, 2020. 有害藻華的宏條形碼分析: 機會與挑戰[J]. 海洋科學, 44(7): 116-134.
陳楠生, 丁翔翔, 崔宗梅, 2023. 山東近海赤潮物種多樣性研究進展[J]. 海洋與湖沼, 54(5): 1258-1273.
周名江, 朱明遠, 張經, 2001. 中國赤潮的發生趨勢和研究進展[J]. 生命科學, 13(2): 54-59, 53.
周健, 王瑋, 吳志宏, 等, 2020. 山東沿海赤潮災害基本特征及防控對策建議[J]. 海洋環境科學, 39(4): 537-543.
周斌, 馬龍, 周雅卓, 等, 2013. 山東近海潮流能電場建設環境影響分析[J]. 海洋開發與管理, 30(4): 72-76.
俞志明, 陳楠生, 2019. 國內外赤潮的發展趨勢與研究熱點[J]. 海洋與湖沼, 50(3): 474-486.
俞秀霞, 2012. 廈門同安灣海域一次三相型赤潮及其成因分析[J]. 福建水產, 34(3): 203-207.
顧海峰, 羅肇河, 劉麗麗, 等, 2014. 中國近海甲藻環溝藻屬2個新記錄種: 紡錘環溝藻和莫氏環溝藻[J]. 生物多樣性, 22(3): 401-406.
黃長江, 董巧香, 2000a. 1998年春季珠江口海域大規模赤潮原因生物的形態分類和生物學特征I[J]. 海洋與湖沼, 31(2): 197-204.
黃長江, 董巧香, 2000b. 1998年春季珠江口海域大規模赤潮原因生物的形態分類和生物學特征Ⅱ[J]. 海洋與湖沼, 31(3): 233-238.
賴紅艷, 侯建軍, 王振河, 2007. 用掃描電鏡觀察裸甲藻的方法研究[J]. 湖北民族學院學報(自然科學版), 25(3): 338-342.
甄毓, 于志剛, 米鐵柱, 2006. 分子生物學在微藻分類研究中的應用[J]. 中國海洋大學學報, 36(6): 875-878.
ANDERSON D M, BURKHOLDER J M, COCHLAN W P,, 2008. Harmful algal blooms and eutrophication: Examining linkages from selected coastal regions of the United States [J]. Harmful Algae, 8(1): 39-53.
ANDERSON D M, CEMBELLA A D, HALLEGRAEFF G M, 2012. Progress in understanding harmful algal blooms: paradigm shifts and new technologies for research, monitoring, and management [J]. Annual Review of Marine Science, 4: 143-176.
CALLAHAN B J, MCMURDIE P J, ROSEN M J,, 2016. DADA2: High-resolution sample inference from Illumina amplicon data [J]. Nature Methods, 13(7): 581-583.
CHEN T T, LIU Y, SONG S Q,, 2015. The effects of major environmental factors and nutrient limitation on growth and encystment of planktonic dinoflagellate[J]. Harmful Algae, 46: 62-70.
CHEN T T, LIU Y, SONG S Q,, 2018. Characterization of the parasitic dinoflagellatesp. infectingin coastal waters of China [J]. Journal of Eukaryotic Microbiology, 65(4): 448-457.
DAUGBJERG N, HANSEN G, LARSEN J,, 2000. Phylogeny of some of the major genera of dinoflagellates based on ultrastructure and partial LSU rDNA sequence data, including the erection of three new genera of unarmoured dinoflagellates [J]. Phycologia, 39(4): 302-317.
EDGCOMB V P, KYSELA D T, TESKE A,, 2002. Benthic eukaryotic diversity in the Guaymas Basin hydrothermal vent environment [J]. Proceedings of the National Academy of Sciences of the United States of America, 99(11): 7658-7662.
GIOVANNONI S J, BRITSCHGI T B, MOYER C L,, 1990. Genetic diversity in Sargasso Sea bacterioplankton [J]. Nature, 345(6270): 60-63.
GóMEZ F, TAKAYAMA H, MOREIRA D,, 2016. Unarmoured dinoflagellates with a small hyposome:andgen. nov. for(Gymnodiniales, Dinophyceae) [J]. European Journal of Phycology, 51(2): 226-241.
GUILLOU L, BACHAR D, AUDIC S,, 2013. The Protist Ribosomal Reference database (PR2): a catalog of unicellular eukaryote Small Sub-Unit rRNA sequences with curated taxonomy [J]. Nucleic Acids Research, 41(D1): D597-D604.
GUNDERSON J H, GOSS S H, COATS D W, 2001. FISH probes for the detection of the parasitic dinoflagellatesp. Infecting the dinoflagellatein chesapeake bay [J]. Journal of Eukaryotic Microbiology, 48(6): 670-675.
HALLEGRAEFF G M, 2010. Ocean climate change, phytoplankton community responses, and harmful algal blooms: a formidable predictive challenge [J]. Journal of Phycology, 46(2): 220-235.
HEE K S, KIM K Y, KIM C H,, 2004. Phylogenetic Analysis of Harmful Algal Bloom (HAB)-Causing Dinoflagellates Along the Korean Coasts, Based on SSU rRNA Gene [J]. Journal of Microbiology and Biotechnology, 14(5): 959-966.
JEONG H J, YOO Y D, SEONG K A,, 2005. Feeding by the mixotrophic red-tide dinoflagellate: mechanisms, prey species, effects of prey concentration, and grazing impact [J]. Aquatic Microbial Ecology, 38(3): 249-257.
KI J S, HAN M S, 2007. Cryptic long internal repeat sequences in the ribosomal DNA ITS1 gene of the dinoflagellate(Dinophyceae): a 101 nucleotide six-repeat track with a palindrome-like structure [J]. Genes & Genetic Systems, 82(2): 161-166.
KIM K Y, KIM Y S, HWANG C H,, 2006. Phylogenetic analysis of dinoflagellatestein responsible for harmful algal blooms based on the partial LSU rDNA sequence data [J]. Algae, 21(3): 283-286.
KIM S H, KIM K Y, LEE W S,, 2004. Phylogenetic analysis of harmful algal bloom (HAB)-causing dinoflagellates along the Korean Coasts, based on sSU rRNA gene [J]. Journal of Microbiology and Biotechnology, 14(5): 959-966.
KIM H J, LI Z, GU H F,, 2023.sp.. and two allied species (Gonyaulacales, Dinophyceae) from Korean coastal waters and East China Sea: morphology, phylogeny and growth response to changes in temperature and salinity [J]. Phycologia, 62(1): 48-67.
LAVRINIENKO A, JERNFORS T, KOSKIM?KI J J,, 2021. Does intraspecific variation in rDNA copy number affect analysis of microbial communities? [J]. Trends in Microbiology, 29(1): 19-27.
LEIGH J W, BRYANT D, 2015. POPART: full‐feature software for haplotype network construction [J]. Methods in Ecology and Evolution, 6(9): 1110-1116.
LEóN-MU?OZ J, URBINA M A, GARREAUD R,, 2018. Hydroclimatic conditions trigger record harmful algal bloom in western Patagonia (summer 2016) [J]. Scientific Reports, 8(1): 1330.
LIN S H, HU Z X, DENG Y Y,, 2020. An assessment on the intrapopulational and intraindividual genetic diversity in LSU rDNA in the harmful algal blooms-forming dinoflagellate(=)based on clonal cultures and bloom samples from Jiaozhou Bay, China [J]. Harmful Algae, 96: 101821.
LIU S Y, GIBSON K, CUI Z M,, 2020. Metabarcoding analysis of harmful algal species in Jiaozhou Bay [J]. Harmful Algae, 92: 101772.
LIU S Y, ZHANG M J, ZHAO Y F,, 2021. Biodiversity and spatial-temporal dynamics ofspecies in Jiaozhou Bay, China [J]. International Journal of Environmental Research and Public Health, 18(21): 11637.
LUDDINGTON I A, KACZMARSKA I, LOVEJOY C, 2012. Distance and character-based evaluation of the V4 region of the 18S rRNA gene for the identification of diatoms (Bacillariophyceae) [J]. PLoS One, 7(9): e45664.
MARGULIES M, EGHOLM M, ALTMAN W E,, 2005. Genome sequencing in microfabricated high-density picolitre reactors [J]. Nature, 437(7057): 376-380.
MCCABE R M, HICKEY B M, KUDELA R M,, 2016. An unprecedented coastwide toxic algal bloom linked to anomalous ocean conditions [J]. Geophysical Research Letters, 43(19): 10366-10376.
MEDLIN L, ELWOOD H J, STICKEL S,, 1988. The characterization of enzymatically amplified eukaryotic 16S-like rRNA-coding regions [J]. Gene, 71(2): 491-499.
NGUYEN L T, SCHMIDT H A, VON HAESELER A,, 2015. IQ-TREE: a fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies [J]. Molecular Biology and Evolution, 32(1): 268-274.
RE?é A, CAMP J, GARCéS E, 2015. Diversity and phylogeny of gymnodiniales (Dinophyceae) from the NW Mediterranean Sea revealed by a morphological and molecular approach [J]. Protist, 166(2): 234-263.
SALDARRIAGA J F, MCEWAN M L, FAST N M,, 2003. Multiple protein phylogenies show thatandare early branches of the dinoflagellate lineage [J]. International Journal of Systematic and Evolutionary Microbiology, 53(Pt 1): 355-365.
SAUNDERS G W, HILL D R A, SEXTON J P,, 1997. Small-subunit ribosomal RNA sequences from selected dinoflagellates: testing classical evolutionary hypotheses with molecular systematic methods [M] // BHATTACHARYA D. Origins of Algae and their Plastids. Vienna: Springer: 237-259.
SORHANNUS U, 2004. Diatom phylogenetics inferred based on direct optimization of nuclear-encoded SSU rRNA sequences [J]. Cladistics, 20(5): 487-497.
STOECK T, BASS D, NEBEL M,, 2010. Multiple marker parallel tag environmental DNA sequencing reveals a highly complex eukaryotic community in marine anoxic water [J]. Molecular Ecology, 19(S1): 21-31.
STOECK T, KASPER J, BUNGE J,, 2007. Protistan diversity in the Arctic: a case of paleoclimate shaping modern biodiversity? [J]. PLoS One, 2(8): e728.
TAKANO Y, HORIGUCHI T, 2006. Acquiring scanning electron microscopical, light microscopical and multiple gene sequence data from a single dinoflagellate cell [J]. Journal of Phycology, 42(1): 251-256.
WICKHAM H, 2009. Ggplot2: Elegant Graphics for Data Analysis [M]. New York: Springer.
YU Z M, SONG X X, CAO X H,, 2017. Mitigation of harmful algal blooms using modified clays: Theory, mechanisms, and applications [J]. Harmful Algae, 69: 48-64.
ZHANG Q C, QIU L M, YU R C,, 2012. Emergence of brown tides caused byHargraves et Sieburth in China [J]. Harmful Algae, 19: 117-124.
ZHANG Q C, WANG Y F, SONG M J,, 2022. First record of abloom in Haizhou Bay in response to dissolved organic nitrogen and phosphorus [J]. Marine Pollution Bulletin, 178: 113572.
附表 株系克隆測序注釋比對結果
Supplementary Table The annotations for clone sequencing strains
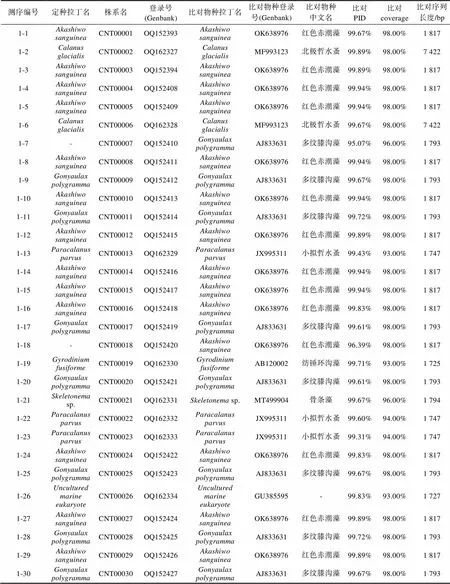
測序編號定種拉丁名株系名登錄號(Genbank)比對物種拉丁名比對物種登錄號(Genbank)比對物種中文名比對PID比對coverage比對序列長度/bp 1-1Akashiwo sanguineaCNT00001OQ152393Akashiwo sanguineaOK638976紅色赤潮藻99.67%98.00%1 817 1-2Calanus glacialisCNT00002OQ162327Calanus glacialisMF993123北極哲水蚤99.89%98.00%7 422 1-3Akashiwo sanguineaCNT00003OQ152394Akashiwo sanguineaOK638976紅色赤潮藻99.89%98.00%1 817 1-4Akashiwo sanguineaCNT00004OQ152408Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 1-5Akashiwo sanguineaCNT00005OQ152409Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 1-6Calanus glacialisCNT00006OQ162328Calanus glacialisMF993123北極哲水蚤99.67%98.00%7 422 1-7-CNT00007OQ152410Gonyaulax polygrammaAJ833631多紋膝溝藻95.07%96.00%1 793 1-8Akashiwo sanguineaCNT00008OQ152411Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 1-9Gonyaulax polygrammaCNT00009OQ152412Gonyaulax polygrammaAJ833631多紋膝溝藻99.67%98.00%1 793 1-10Akashiwo sanguineaCNT00010OQ152413Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 1-11Gonyaulax polygrammaCNT00011OQ152414Gonyaulax polygrammaAJ833631多紋膝溝藻99.72%98.00%1 793 1-12Akashiwo sanguineaCNT00012OQ152415Akashiwo sanguineaOK638976紅色赤潮藻99.89%98.00%1 817 1-13Paracalanus parvusCNT00013OQ162329Paracalanus parvusJX995311小擬哲水蚤99.43%93.00%1 747 1-14Akashiwo sanguineaCNT00014OQ152416Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 1-15Akashiwo sanguineaCNT00015OQ152417Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 1-16Akashiwo sanguineaCNT00016OQ152418Akashiwo sanguineaOK638976紅色赤潮藻99.83%98.00%1 817 1-17Gonyaulax polygrammaCNT00017OQ152419Gonyaulax polygrammaAJ833631多紋膝溝藻99.61%98.00%1 793 1-18-CNT00018OQ152420Akashiwo sanguineaOK638976紅色赤潮藻96.39%98.00%1 817 1-19Gyrodinium fusiformeCNT00019OQ162330Gyrodinium fusiformeAB120002紡錘環溝藻99.71%93.00%1 725 1-20Gonyaulax polygrammaCNT00020OQ152421Gonyaulax polygrammaAJ833631多紋膝溝藻99.61%98.00%1 793 1-21Skeletonema sp.CNT00021OQ162331Skeletonema sp.MT499904骨條藻99.67%96.00%1 794 1-22Paracalanus parvusCNT00022OQ162332Paracalanus parvusJX995311小擬哲水蚤99.60%94.00%1 747 1-23Paracalanus parvusCNT00023OQ162333Paracalanus parvusJX995311小擬哲水蚤99.31%94.00%1 747 1-24Akashiwo sanguineaCNT00024OQ152422Akashiwo sanguineaOK638976紅色赤潮藻99.83%98.00%1 817 1-25Gonyaulax polygrammaCNT00025OQ152423Gonyaulax polygrammaAJ833631多紋膝溝藻99.67%98.00%1 793 1-26Uncultured marine eukaryoteCNT00026OQ162334Uncultured marine eukaryoteGU385595-99.83%93.00%1 727 1-27Akashiwo sanguineaCNT00027OQ152424Akashiwo sanguineaOK638976紅色赤潮藻99.89%98.00%1 817 1-28Gonyaulax polygrammaCNT00028OQ152425Gonyaulax polygrammaAJ833631多紋膝溝藻99.72%98.00%1 793 1-29Akashiwo sanguineaCNT00029OQ152426Akashiwo sanguineaOK638976紅色赤潮藻99.89%98.00%1 817 1-30Gonyaulax polygrammaCNT00030OQ152427Gonyaulax polygrammaAJ833631多紋膝溝藻99.67%98.00%1 793
續表

測序編號定種拉丁名株系名登錄號(Genbank)比對物種拉丁名比對物種登錄號(Genbank)比對物種中文名比對PID比對coverage比對序列長度/bp Single-cell_PCR_1-1Akashiwo sanguineaCNT00031OQ152428Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 Single-cell_PCR_1-2Akashiwo sanguineaCNT00032OQ152429Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 Single-cell_PCR_1-3Akashiwo sanguineaCNT00033OQ152430Akashiwo sanguineaOK638976紅色赤潮藻99.94%98.00%1 817 Single-cell_PCR_2-1Gonyaulax polygrammaCNT00034OQ152431Gonyaulax polygrammaAJ833631多紋膝溝藻99.83%98.00%1 793 Single-cell_PCR_2-2Gonyaulax polygrammaCNT00035OQ152432Gonyaulax polygrammaAJ833631多紋膝溝藻99.72%98.00%1 793 Single-cell_PCR_3-1Katodinium glaucumCNT00036OQ162335Katodinium glaucum KP790161灰白下溝藻99.93%73.00%1 342
Molecular analysis of a polyphasic red tide in Rongcheng OFFSHORE, Shandong PENINSULA IN 2021~2022
LIU Kui-Yan1, 2, 3, 4, WANG Hong-Shu1, 2, 3, LIU Feng1, 2, 3, CHEN Nan-Sheng1, 2, 3, 4
(1. CAS Key Laboratory of Marine Ecology and Environmental science, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laoshan Laboratory, Qingdao 266237, China; 3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China; 4. University of Chinese Academy of Sciences, Beijing 100049, China)
Shandong Peninsula is surrounded by the Bohai Sea and Yellow Sea, features complex coastal zoning and long coastline, and suffers from frequent red tide outbreaks in the recent decade. Some red tide species are small in cell size or have inconspicuous morphological characteristics, and are often fragile and unstable during fixation, making it a challenge work for experts to identify the causative red tide species based only on morphological features. Therefore, causative species of many red tides have not been accurately identified, especially for those polyphasic red tide events. From November 2021 to April 2022, a devastating red tide event of 1 440 km2occurred in Rongcheng offshore in a kelpaquaculture region, resulting in the bleaching or rotting of the kelp and serious economic losses. Considering both morphological features of live algal cells in water samples and molecular marker sequences amplified from single cells, three dominant causative red tide species were identified, including,, and, which was different from a recent report in which only the former two were identified in this region.is easily missed out as it is fragile and unstable during fixation. Metabarcoding analysis of water samples identified another causative species,, being also fragile and unstable during fixation. This study showed that the metabarcoding analysis is standardized and more accurate in species identification, and can accurately and systematically identify red tide causative species especially for complex polyphasic red tide events.
harmful algal bloom (HAB); Dinoflagellata; metabarcoding analysis;;
Q948
10.11693/hyhz20230300062
* 嶗山實驗室科技創新項目, LSKJ202203700號; 國家自然科學基金項目, 42176162號; 國家重點研發計劃, 2022YFC3105200號; 中國科學院戰略性先導科技專項(B類), XDB42000000號; 榮成市海洋與漁業監測減災中心委托項目, 2022-2023。劉奎艷, 博士研究生, E-mail: liukuiyan@qdio.ac.cn
陳楠生, 博士生導師, 研究員, E-mail: chenn@qdio.ac.cn
2023-03-16,
2023-04-17

