抗雜交鱧(Channa argus×C.maculate)彈狀病毒卵黃抗體制備及ELISA檢測方法的建立*
劉 田 李 碩 汪銘書 趙立寧 黃錦爐 吳藝琳 賈愛卿
抗雜交鱧()彈狀病毒卵黃抗體制備及ELISA檢測方法的建立*
劉 田1, 2, 3, 4李 碩2汪銘書4趙立寧2黃錦爐2吳藝琳2賈愛卿2①
(1. 農業農村部微生態資源養殖利用企業重點實驗室 廣東廣州 511400; 2. 廣東海大集團股份有限公司畜牧水產研究中心 廣東廣州 511400; 3. 廣東海大畜牧獸醫研究院 廣東廣州 511400; 4. 四川農業大學預防獸醫研究所 四川成都 611100)
為確定雜交鱧()彈狀病毒卵黃抗體效價水平消減規律并驗證抗體對病毒的中和能力, 采用雜交鱧彈狀病毒滅活疫苗免疫蛋雞, 使用醋酸-醋酸鈉-辛酸法制備卵黃抗體, 建立間接ELISA檢測方法以監測卵黃抗體產生過程抗體水平消減情況, 以中和試驗評估卵黃抗體中和雜交鱧彈狀病毒效果。結果顯示, ELISA檢測方法最佳條件為抗原包被濃度0.5×105.8TCID50/0.1 mL, 37 °C包被2 h, 37 °C封閉2 h。與大口黑鱸蛙虹彩病毒卵黃抗體、SPF蛋黃提取物、免疫前蛋黃提取物以及MBC空細胞均無交叉反應。以S/N(sample/negative)>2.1且敏感性最高為標準確定陽性、陰性樣品。卵黃抗體于首免后28 d產生效價, 四免后達到最高水平, 效價為1︰25 600, 平臺期可持續40~60 d, 通過中和抗體檢測結果證明平臺期內抗體中和效價在免疫周期內最高, 約為46.3。通過ELISA檢測方法對卵黃抗體產生規律進行監測, 通過中和檢測方法評估卵黃抗體中和病毒效果。高滴度卵黃抗體具有被開發為新型抗雜交鱧彈狀病毒生物制品的潛力, 雜交鱧彈狀病毒卵黃抗體的制備及快速檢測方法的構建為該病的防治提供了理論基礎和技術手段。
雜交鱧彈狀病毒; 卵黃抗體; 間接ELISA; 中和抗體
雜交鱧由烏鱧()和斑鱧()人工雜交而成, 屬于鱸形目(Perciformes), 鱧科(Channidae)魚類。該魚分布廣、繁殖力強, 因其魚骨刺少、魚肉含量高且蛋白質滋補價值突出而具有極高的食用營養和藥用保健價值(鐘小慶等, 2021; 李元躍等, 2022)。目前雜交鱧作為優特新品種已實現全人工高密度養殖, 隨著養殖密度的不斷增加, 細菌和病毒性傳染疾病成為制約該品種魚健康養殖的關鍵。2012年7月在廣東省廣州、佛山、中山、清遠等多地發現一種可引起雜交鱧暴發性大規模死亡的疾病, 給雜交鱧養殖業帶來了嚴重的經濟損失。曾偉偉等(2013)經病原學分析確定造成雜交鱧死亡的病原為彈狀病毒, 并將其定義為雜交鱧彈狀病毒(Hybrid snakehead rhabdovirus, HSHRV)。
魚類彈狀病毒毒株種類多、毒力強, 是一類可使多種魚出現高發病率和致死率的病毒病原體。已報道感染魚類彈狀病毒20多種, 分布于諾拉彈狀病毒屬()和水泡性病毒屬()。HSHRV屬于水泡性病毒屬, 為單股負鏈線性RNA病毒。該病毒呈典型子彈狀, 病毒粒子大小為60 nm× 160 nm, 具有L、G、N、P、M共5種主要結構蛋白(Einer-Jensen, 2004; Teng, 2007)。回歸感染試驗表明, 發病魚肝、脾、腎腫大且表面有出血點, 魚鰾表面血管腫脹、出血嚴重, 死亡率達90%以上(曾偉偉等, 2013)。HSHRV易自然感染苗期雜交鱧, 死亡高峰為感染后第3天, 死亡持續時間為7~15 d, 高峰期日死亡量可過千尾, 死亡率高達80%以上, 日經濟損耗達數萬元。中成魚感染后日死亡量較苗期降低, 約百尾, 死亡率約5%, 日經濟損耗也可達萬元, 目前尚無預防和治療該病的特效藥物(Hoffmann, 2005)。因此急需開發一款可預防、緊急治療雜交鱧彈狀病毒的生物制品, 提高雜交鱧存活率、降低飼養經濟損耗。
卵黃抗體(Immunoglobulin of egg yolk, IgY)是一類經抗原免疫蛋雞后于蛋黃中提取的可用于預防和緊急治療特定疾病的抗體。與IgG等血清抗體相比, IgY具有提取方法簡單、產量高、成本低、化學性質穩定等特點(張小鶯等, 2004, 2006; Schade, 2004; 張桂枝等, 2009)。因其具有良好的被動免疫療效, 常作為母源抗體的替代品, 用于治療和預防幼齡動物疾病, 在動物免疫力較弱的時期為其提供持續免疫保護。目前卵黃抗體在畜禽疾病的預防和緊急治療上的應用已得到市場的充分認可和廣泛驗證, 同時卵黃抗體在水產疾病的應用也屢見文獻報道。特異性卵黃抗體可針對魚、蝦、海參和鮑等細菌和病毒性疾病產生較好的保護效果(Lu, 2008; Qin, 2018; 閆茂倉等, 2019; Hu, 2019; Xu, 2020)。由于HSHRV主要危害0.2~50 g雜交鱧苗種, 這一階段魚苗免疫系統不成熟, 依靠魚苗主動免疫系統預防該疾病較為困難, 加之發病急且死亡率高、發病病程短, 經卵黃抗體為魚苗提供被動免疫保護更具有生產和實踐意義。本研究將雜交鱧彈狀病毒經BEI滅活劑滅活處理后, 在固定的抗原劑量下免疫蛋雞, 經三次常規免疫和一次加強免疫后收集高免蛋, 制備HSHRV卵黃抗體。同時建立HSHRV卵黃抗體ELISA檢測方法, 用以檢測特異性抗體效價產生規律。通過中和效價檢測試驗, 明確HSHRV卵黃抗體中和病毒的效果, 為雜交鱧彈狀病毒的防治提供理論基礎。
1 材料與方法
1.1 毒株、細胞及實驗動物
雜交鱧彈狀病毒江門I株(HSHRV-JMI)、鱖魚腦細胞(Mandarin fish brain cell, MBC)由海大研究院保存。200日齡海藍灰蛋雞300只, 由豐牧公司和海大研究院提供。
1.2 主要試劑
L-15培養基(biosharp, BL313A)、胎牛血清(Excell, FSP500)、雙抗(新賽美, C100C5)、BEI (Aladdin, P104878-25ml)、五水合硫代硫酸鈉(西隴科學, B220708)、吐溫-80 (Diamond, A100442-0500)、Marcol52白油(埃克森美孚化工商務(上海)有限公司, 70133758)、牛血清白蛋白V (廣州瑞舒生物科技有限公司, J0121B)、包被液(Biopanda, CB-003)、羊抗雞酶標二抗(Abcam, ab6877)、TMB顯色液(湖州英創生物科技有效公司, TMB-S-004)、終止液(Biopanda, STP-001)。
1.3 試驗方法
1.3.1 病毒培養及滴度測定 凍存MBC細胞經37 °C恒溫水浴充分融解、離心后, 以含10% FBS的L-15培養基28 °C無CO2培養24 h, 待細胞密度長至90%時, 接種 1000 TCID50HSHRV-JMI, 28 °C無CO2培養72 h, 至90%以上病變時收集病毒。病毒–80 °C反復凍融2次、離心、過濾除菌后分裝, –80 °C保存備用。制備MBC細胞并接種96孔細胞板, 28 °C無CO2培養24 h備用。10倍倍比稀釋收集的病毒后接種細胞, 稀釋度為10–1至10–9, 每個稀釋度接種8孔。28 °C孵育2 h后棄上清, 加入含2% FBS的L-15培養基, 28 °C無CO2培養7 d, 觀察并記錄細胞病變孔數, 經Reed-Mench法計算病毒滴度。
1.3.2 滅活疫苗制備 HSHRV-JMI融解后加入BEI至終濃度為0.5%, 充分吹打混勻后, 37 °C, 120 r/min, 滅活24 h。加入五水合硫代硫酸鈉至終濃度為10%終止滅活。取96份滅活HSHRV-JMI加入4份吐溫-80, 7 000 r/min乳化5 min。取3份乳化后樣品加入7份Marcol52白油, 12 000 r/min乳化15 min。乳化后樣品3 500 r/min離心10 min后不分層, 4 °C保存備用。
1.3.3 蛋雞免疫 滅活疫苗組200只、對照組100只。蛋雞免疫共計四次, 每次每只蛋雞胸肌多點注射1 mL滅活疫苗。首次免疫病毒劑量為1×107TCID50/mL。14 d后開展二次免疫, 免疫劑量為1×108TCID50/mL。二次免疫后14 d開展第三次免疫, 免疫劑量為1×108TCID50/mL。第三次免疫后每隔20 d采集30枚雞蛋并于中和效價小于1︰43時進行第四次加強免疫, 免疫劑量為1×107TCID50/mL。其中對照組均注射1 mL L-15培養基。
1.3.4 卵黃抗體制備 收集免疫前雞蛋及各收蛋期包括對照組和免疫組高免蛋, 蛋殼表面進行清洗、消毒。無菌條件下使用蛋清蛋黃分離器收集蛋黃。加入蛋黃總重3倍體積的醋酸-醋酸鈉(pH=4.8)的緩沖液后, 48 °C條件下充分攪拌1 h。加入3%辛酸48 °C條件下充分攪拌1 h。無菌過濾布過濾除雜, 獲得純化后抗體。
1.3.5 抗HSHRV卵黃抗體ELISA檢測方法建立 雜交鱧彈狀病毒按一定滴度包被酶標板, 對包被條件、封閉條件進行系統優化, 以制備的卵黃抗體為一抗1︰100倍起進行倍比稀釋, HRP標記羊抗雞IgY為二抗按說明書1︰50 000稀釋, 450 nm波長下測定吸光度值, 判定標準OD450>0.1且檢測樣品/陰性對照比值S/N (sample/negative)>2.1的最高稀釋度為此次檢測樣品的效價。
陽性陰性對照篩選 將彈狀病毒作為包被抗原, 使用包被液對其分別進行1︰10、1︰50、1︰100、1︰200、1︰400倍稀釋后100 μL/孔包被酶標板, 4 °C孵育18 h, 洗滌3次, 每次5 min, 拍干。使用封閉液, 200 μL/孔加入酶標板中, 37 °C封閉2 h, 洗滌3次, 每次5 min, 拍干。取二免、三免、三免后10 d、三免后20 d純化后卵黃抗體, 使用封閉液1︰100倍稀釋后, 100 μL/孔加入酶標板, 37 °C孵育1 h, 洗滌3次, 每次5 min, 拍干。使用PBS按說明書1︰50 000稀釋羊抗雞酶標二抗, 100 μL/孔加入酶標板, 37 °C孵育50 min, 洗滌3次, 每次5 min, 拍干。100 μL/孔加入TMB底物顯色液, 37 °C條件避光下孵育10 min。50 μL/孔加入終止液, 終止顯色反應, 使用酶標儀OD450讀取數據。
抗原條件優化 使用棋盤法在96孔酶標板中, 橫向將彈狀病毒以1︰100倍起進行2倍倍比稀釋12個梯度, 縱向將陽性對照、陰性對照以1︰100倍起進行2倍倍比稀釋8個梯度。
包被條件優化 4 °C孵育18 h、37 °C孵育1 h、37 °C孵育2 h、室溫孵育1 h、室溫孵育2 h。
封閉條件優化 4 °C孵育18 h、37 °C孵育1 h、37 °C孵育2 h、室溫孵育1 h、室溫孵育2 h。
特異性驗證 按1.3.4分別制備SPF雞蛋蛋黃提取液、免疫前雞蛋蛋黃提取液、大口黑鱸蛙虹彩病毒(largemouth bass virus, LMBV)高免蛋卵黃抗體。以優化后的條件進行包被、封閉, 抗原設立MBC空細胞對照組、PBS空白對照組、細胞毒抗原組。抗體設立SPF雞蛋蛋黃提取液、免疫前雞蛋蛋黃提取液、大口黑鱸蛙虹彩病毒卵黃抗體組。以1.3.5確定的樣品為陽性、陰性對照進行特異性驗證。
敏感性驗證 將陽性樣品1︰100倍起進行2倍倍比稀釋12個梯度, 驗證檢測方法敏感性。
重復性驗證及方法應用 對各收蛋期共計8個批次的卵黃抗體進行效價監測。每組卵黃抗體樣品及陽性、陰性對照設立三組平行組, 分別1︰100倍起進行倍比稀釋12個梯度, 并由3個不同的檢測員于3個不同時間完成重復檢測, 驗證檢測方法重復性。
1.3.6 卵黃抗體中和效果評估 將MBC細胞經1︰3傳代后接種96孔細胞板, 28 °C、無CO2孵育培養過夜。10倍比稀釋病毒滴度為107.8TCID50/0.1 mL雜交鱧彈狀病毒至200 TCID50。取500 μL 2倍稀釋蛋黃液于56 °C水浴中補體滅活40 min后4倍倍比稀釋。取100 μL滅活補體的蛋黃稀釋液和100 μL病毒稀釋液充分混勻后28 °C、85 r/min充分中和3 h。取中和后混合液加入96孔細胞板中, 28 °C、無CO2孵育3 h。PBS清洗細胞1次, 加入10% FBS L-15完全培養基28 °C、無CO2孵育培養7 d后觀察細胞病變情況。
2 結果
2.1 HSHRV-JMI擴繁和滴度確定
HSHRV-JMI接種MBC細胞后, 24 h內開始出現細胞病變, 24 h后20%~30%細胞出現收縮變圓、內部空洞、聚集成團的現象, 并形成明顯的空斑。48 h后40%~60%的細胞出現病變, 72 h后90%以上的細胞出現病變(圖1)。72 h后收集病毒, 測定滴度為107.8TCID50/0.1 mL。
2.2 ELISA檢測方法建立及優化
2.2.1 陽性陰性對照篩選 結果可知(表1), 抗原稀釋倍數小于1︰100時, 不同免疫時間點對應的對照組OD450值基本無變化, 判斷為非特異性反應。抗原在1︰100~1︰400倍稀釋條件下, 優先選取OD450值>1、同一抗原稀釋度下相鄰倍比稀釋樣品OD450值有較大變化的樣品, 三免后20 d樣品S/N=3.8, 即三免20 d免疫組卵黃抗體為陽性對照樣品, 同期對照組卵黃抗體為陰性對照樣品。
2.2.2 抗原條件 最適條件應選在可檢測稀釋度范圍內S/N最大且對應的陰性對照OD450值較小的樣品, 采用該樣品對應的抗原稀釋度為最佳抗原工作濃度。結果可知(表2), 抗原稀釋倍數為1︰200, 病毒滴度為0.5×105.8TCID50/0.1 mL時, S/N=3.94, 同時陰性對照OD450值較小。
2.2.3 包被條件 最適條件應選在可檢測稀釋度范圍內S/N>2.1且對應的陰性對照OD450值較小的樣品, 結果可知(表3, 表4, 表5), 陽性抗體在1︰100至1︰1 600倍的條件下稀釋時, 37 °C孵育2 h, 對應的S/N值為各包被條件中最大。確定包被條件為37 °C孵育2 h。

圖1 HSHRV-JMI在鱖魚腦細胞(MBC)的病變情況
注: a. 接毒前細胞; b. 接毒后24 h細胞; c. 接毒后48 h細胞; d. 接毒后72 h細胞
表1 卵黃抗體陰性對照和陽性對照確定

Tab.1 Negative control and positive control of anti-HSHRV-JMI IgY
表2 抗原最佳包被濃度確定

Tab.2 Determination of the optimal antigen coating concentration
表3 陽性對照OD450均值
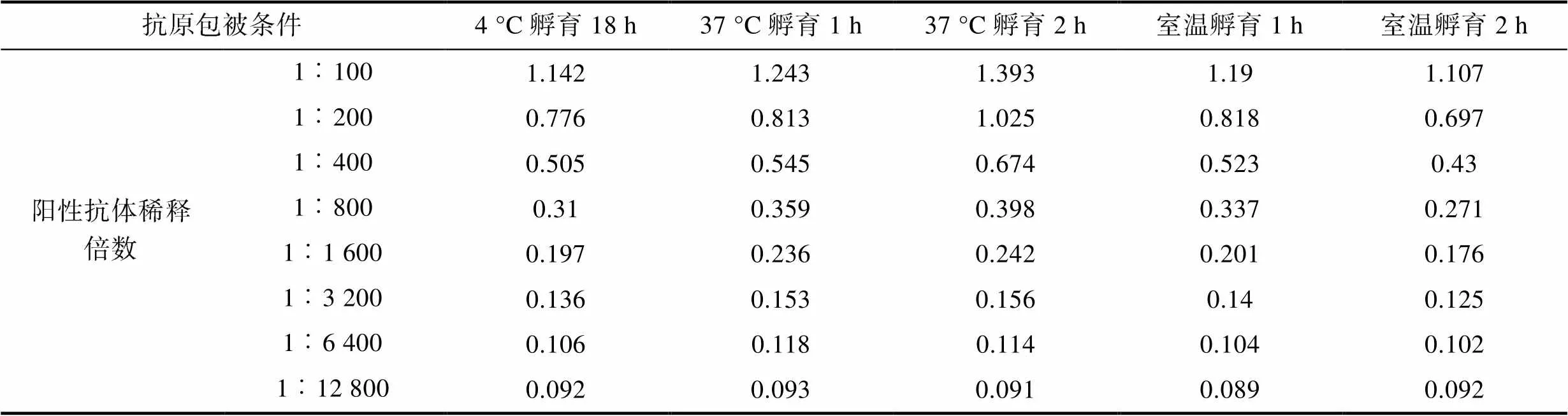
Tab.3 Mean OD450 for positive control
表4 陰性對照OD450均值
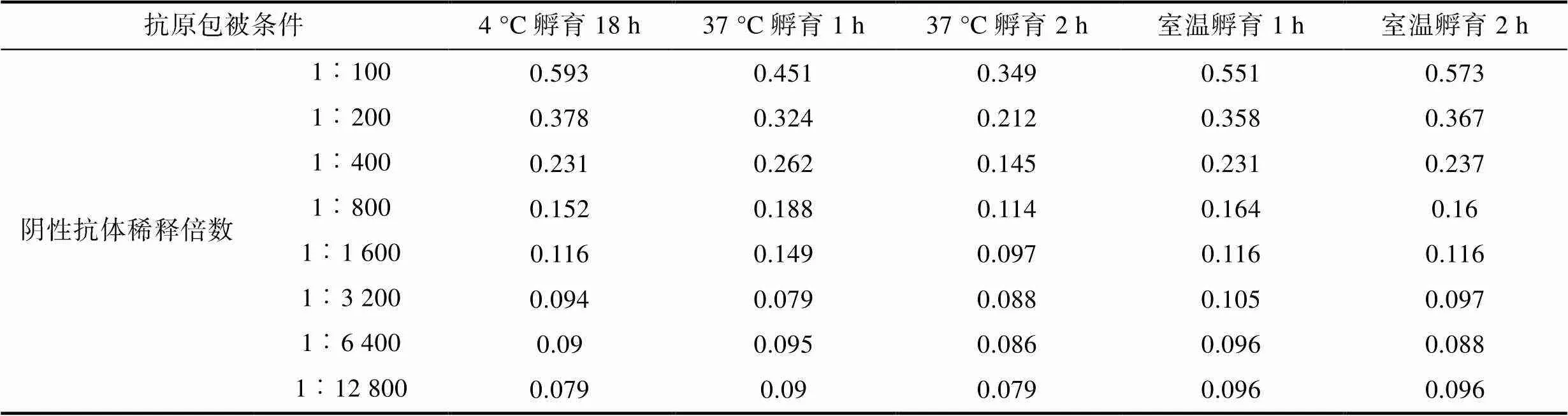
Tab.4 Mean OD450 for negative control
表5 S/N值確定抗原最佳包被條件
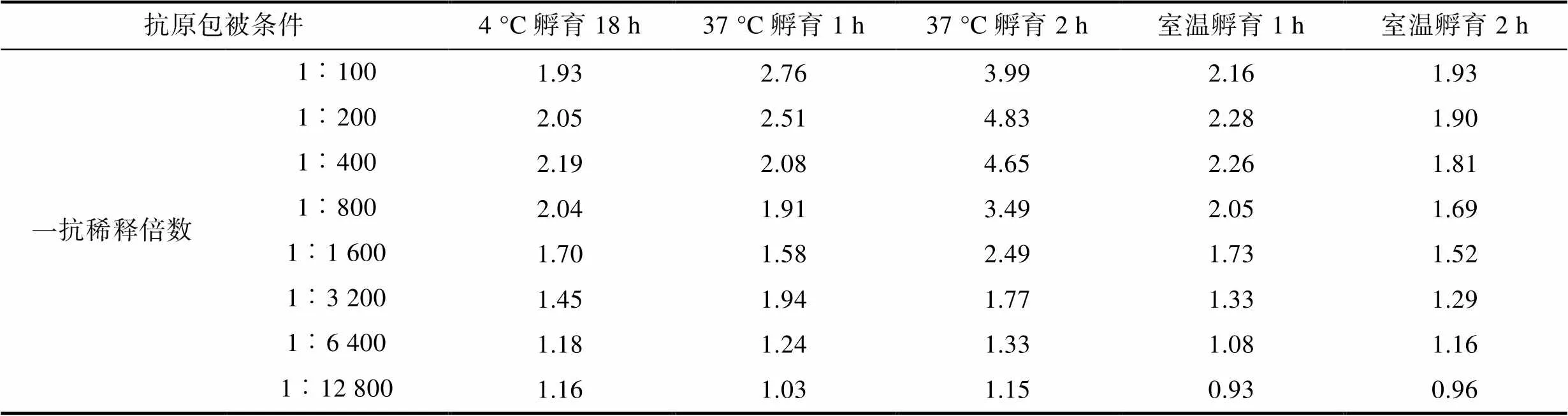
Tab.5 The optimal antigen coating conditions determined by S/N value
2.2.4 封閉條件 最適條件應選在可檢測稀釋度范圍內陰性對照OD450值較小的樣品, 結果可知(表6, 表7, 表8)在1︰100至1︰1 600倍的條件下稀釋時, 陰性對照OD450值最小的封閉條件為抗原37 °C孵育2 h。確定封閉條件為37 °C孵育2 h。
2.2.5 特異性驗證 經ELISA特異性驗證結果分析(表9), 以OD450>1且S/N (sample/negative)>2.1為特異性反應評判標準。相同條件下當抗原為MBC空細胞或PBS時, 抗HSHRV卵黃抗體均無信號產生, 結果為陰性; 當抗原為HSHRV-JMI時, HSHRV卵黃抗體產生特異性信號結果為陽性, 其余卵黃抗體組信號均與陰性對照組相同, 即無特異性反應信號產生。
2.2.6 重復性驗證及方法應用 對滅活疫苗組各收蛋期共計8個批次的卵黃抗體進行效價監測。在第三次免疫后20 d檢測到抗體效價, 在第四次免疫后抗體效價大幅度上升, 最高效價可達1︰25 600 (圖2)。
2.3 卵黃抗體中和效果評估
分別測定不同時間點蛋黃IgY中和抗體水平, 蛋黃液稀釋2倍后進行中和效價評估。結果顯示, 首免后14 d即可檢測到中和抗體, 三免后20 d抗體效價達到44.7左右, 隨后逐漸下降。第四次免疫后, 中和抗體效價水平迅速達到峰值, 最高中和抗體效價上升至46.3左右, 并隨著時間延長而逐步降低。四免后80 d時, 中和抗體效價低于43(圖3)。蛋黃IgY中和效價可以直接反映抗體在體外中和病毒的能力。滅活疫苗可誘導蛋雞產生較高水平的中和抗體以中和病毒。
表6 陽性對照OD450均值

Tab.6 Mean OD450 for positive control
表7 陰性對照OD450均值

Tab.7 Mean OD450 for negative control
表8 S/N值確定最佳封閉條件

Tab.8 The optimal blocking conditions determined by S/N value
表9 特異性驗證
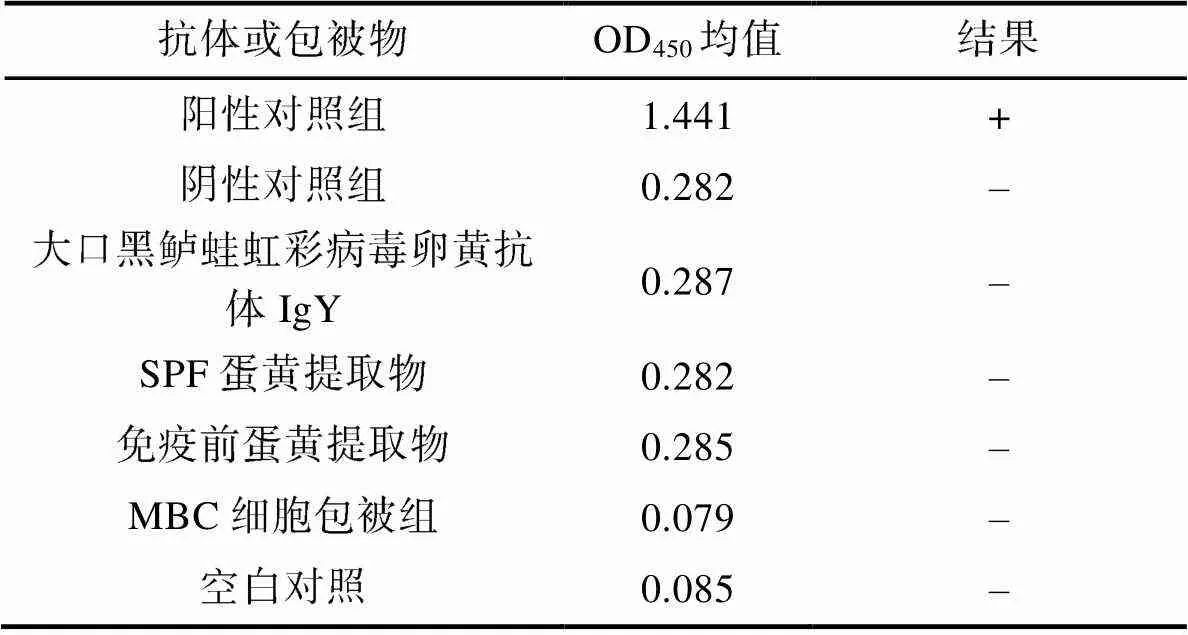
Tab.9 Specificity validation
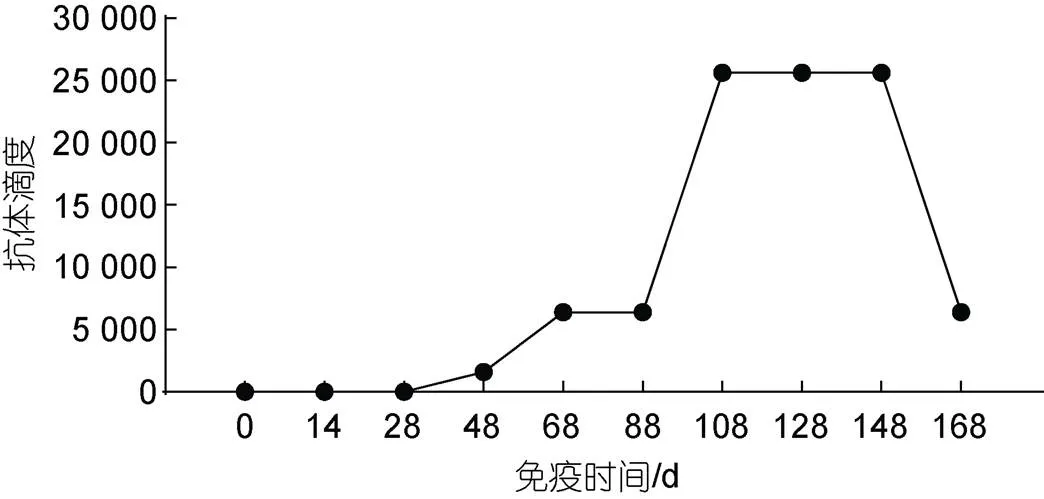
圖2 特異性抗體產生規律

圖3 中和效果評估
3 討論
雜交鱧彈狀病毒病是一種暴發性、高致死性和高傳染性的病毒性疾病, 可經親魚垂直傳播給苗種, 苗期易感, 高峰期死亡率達80%以上。常通過養殖過程中池塘和人員嚴格消毒、降低放養密度、定期調水改底、優質飼料投喂的方式預防該疾病的發生, 該病治療效果不佳(雷燕, 2015)。針對鱖魚源彈狀病毒病、大口黑鱸源彈狀病毒病的預防和治療方法已有文獻報道(Chen, 2012; Zhang, 2018; 袁雪梅等, 2020; 杭小英等, 2021; 羅霞等, 2022), 目前尚無預防雜交鱧彈狀病毒病疫苗和治療雜交鱧彈狀病毒病藥物的研究。鑒于雜交鱧彈狀病毒對雜交鱧養殖的危害, 急需開發一款針對雜交鱧彈狀病毒病的生物制品以驗證預防和治療該病的可能性。
本研究結合苗期雜交鱧極易暴發彈狀病毒的特點和卵黃抗體被動免疫的功效, 制備雜交鱧彈狀病毒卵黃抗體、構建間接ELISA檢測方法以檢測IgY的免疫反應活性, 同時通過中和效價檢測手段明確卵黃抗體中和雜交鱧彈狀病毒的效果。
3.1 卵黃抗體的制備
卵黃抗體制備過程中免疫原的選擇與對蛋雞免疫過程的參數控制是保證免疫效果的關鍵。實驗動物的免疫效果受諸多變量因素影響, 通常包括免疫原類型、免疫原劑量、佐劑、免疫間隔與次數、實驗動物自身情況。研究表明在一定劑量范圍內, 免疫效果會隨著抗原濃度的增加而加強, 同時劑量過高會導致免疫耐受情況的發生(Hendriksen, 2001; Schade, 2005)。張小鶯等(2010)用7.2×108pfu/mL抗原免疫蛋雞, 免疫熒光試驗表明抗體在1︰100 000倍稀釋下仍可穩定表達, 當免疫抗原滴度降低至7.0×106pfu/mL時, 僅能在1︰10倍稀釋下檢測到抗體。因此為確保最終抗體收獲較高的滴度并規避可能發生的免疫耐受情況, 我們將首免和四免的病毒滴度設置為1×107TCID50/mL, 二免和三免病毒滴度設置為1×108TCID50/mL。本次免疫中免疫間隔為14 d, 為避免免疫耐受情況發生, 本研究待中和抗體效價降低至1︰64以下時進行第四次免疫。有研究表明免疫間隔大于4周甚至數月, 均取得了較好的免疫效果(Tini, 2002)。
在佐劑的選擇中, 弗氏佐劑價格相對昂貴不適合規模化蛋雞免疫, 我們選擇相對價格低廉可適宜大規模免疫的白油佐劑, 同時也得到良好的免疫效果。蛋雞免疫方式優選肌肉注射, 有研究表明皮下注射效果優于肌肉注射, 靜脈注射效果最佳, 但存在安全隱患(Schade, 2005)。
在疫苗的類型選擇中, 多肽亞單位疫苗可根據病毒或細菌的結構蛋白進行分析, 通過篩選并提取具有優勢抗原表位的片段, 其特異性會遠遠大于滅活疫苗, 但其不足之處卻是免疫原性較低, 需與相對價格較高的佐劑配合使用才能產生更好的免疫效果(Snippe, 1979)。本研究選擇免疫原性較強且價格相對低廉可大規模免疫生產的滅活疫苗進行蛋雞免疫。
卵黃抗體純化方式的選擇中, 傳統的有機試劑沉淀法在粗分離的卵黃抗體中殘留的有機溶劑較多, 不易去除, 且大量生產會對環境造成嚴重污染。鹽析與凝膠過濾及色譜純化等方法均存在制備步驟多、獲得批量小、產品安全性不高及回收率低等普遍問題, 適用于高純度、高濃度的實驗室早期開發階段。本研究使用醋酸-醋酸鹽-辛酸法進行純化、制備, 其回收率高, 成本低, 制備過程中使用的化學試劑很少, 合大規模生產的同時也遵從綠色提取理念(王洪新等, 2003; 胡瑞鴻, 2020)。
3.2 卵黃抗體ELISA檢測方法
卵黃抗體效價檢測常用方法如瓊脂擴散、血凝抑制、中和試驗及ELISA檢測等。與其他檢測方法相比, ELISA檢測方法的優勢在于其特異性好、靈敏度高(Lee, 2009; Li, 2014)。
為配合后期中和試驗驗證卵黃抗體中和病毒的效果, 本研究使用HSHRV作為免疫原及檢測方法的包被抗原, 其免疫原性要高于多肽亞單位疫苗,但相對檢測方法的特異性來說會較低。從結果來看, 在檢測過程中隨著抗體稀釋度越高, 檢測方法特異性越好。結合建立此方法的初衷為檢測卵黃抗體效價水平消減規律, 即每一批次卵黃抗體最高效價為當批次卵黃抗體效價水平。在ELISA反應中, 為避免卵黃抗體低稀釋度時非特異性反應對檢測結果的影響, 本研究通過棋盤法確定抗原最適工作濃度為0.5×105.8TCID50/0.1 mL, 通過對包被、封閉條件的篩選確定最適條件為37 °C包被2 h及37 °C封閉2 h,通過優化以上檢測條件, 來降低非特異性信號造成的假陰性結果。以MBC空細胞包被組及PBS空白包被組為抗原對照組, 以實驗室保存的大口黑鱸蛙虹彩病毒卵黃抗體, 免疫前蛋黃提取物及SPF蛋黃提取物為抗體對照組, 驗證檢測方法的抗原抗體結合的特異性, 以OD450>1且S/N (sample/negative)>2.1為特異性反應評判標準, 結果顯示此檢測方法具有良好的特異性。對各收蛋期共計8個批次的卵黃抗體進行效價監測, 選取其中效價最高的實驗組別作為陽性對照組, 以其為標準驗證檢測方法敏感性可達1︰25 600。同時確定在免疫周期內, 卵黃抗體效價平臺期可持續40~60 d。
此方法最終可應用于蛋雞免疫試驗過程中, 可對任意收蛋期內收集高免蛋卵黃抗體效價進行檢測。
3.3 卵黃抗體中和病毒效果評估
為驗證卵黃抗體對病毒的中和效果, 中和效價可反映抗體中和病毒的能力, 研究發現通過中和試驗檢測滅活疫苗組免疫后高免蛋表現出高水平的中和病毒能力, 同時發現在ELISA檢測卵黃抗體效價于四免后達到最高峰1︰25 600并進入平臺期持續40~60 d, 卵黃抗體中和效價也于四免后達到高峰46.3平臺期持續60 d, 中和效果可保護50%的細胞不發生病變, 這說明了高效價的卵黃抗體具有良好的中和病毒的能力。在平臺期60 d左右可持續產出高效價的卵黃抗體, 這為高效價的卵黃抗體生產提供了充足的抗體源。
3.4 卵黃抗體在水產疾病中的應用
卵黃抗體相關產品制備工藝簡單, 生產成本相對較低, 在臨床使用中會相對便利, 其生產也不受南北地域、季節或時間的限制, 在疾病治療方面, 具有高效、無公害、安全等優勢, 是一種接近理想的疾病預防、治療的藥物。
本研究以HSHRV滅活疫苗作為免疫原對蛋雞進行免疫, 其免疫原性良好, 通過建立ELISA檢測方法對免疫期內高免蛋所產卵黃抗體進行實時效價監測, 確定平臺期以便在平臺期內可大量收集高免蛋。通過中和試驗驗證卵黃抗體中和病毒效果。高滴度抗雜交鱧彈狀病毒卵黃抗體具有被開發為被動免疫的新型抗雜交鱧彈狀病毒生物制品的潛力, 為雜交鱧彈狀病毒病的防治提供了理論基礎, 亦為其他水產疾病的預防與治療提供了研究方向。
4 結論
本研究用滅活雜交鱧彈狀病毒制備特異性卵黃抗體, 特異性抗體效價消長規律經構建的間接ELISA檢測方法實時監測。通過細胞中和試驗明確抗雜交鱧彈狀病毒卵黃抗體具有良好的中和病毒效果, 表明滅活雜交鱧彈狀病毒可以有效刺激具有中和能力的卵黃抗體的產生。該研究表明, 高中和滴度的抗雜交鱧彈狀病毒卵黃抗體具有開發為新型抗雜交鱧彈狀病毒生物制品的潛力, 為該病的防治奠定了理論基礎。
王洪新, 劉學賢, 穆海波, 等, 2003. 雞新城疫卵黃抗體IgY的分離提純研究[J]. 中國家禽, 25(19): 11-14.
閆茂倉, 王瑤華, 胡利華, 等, 2019. 副溶血弧菌特異性卵黃抗體(AHPND-VpIgY)對凡納濱對蝦幼體被動免疫和育苗成活率的影響[J]. 海洋與湖沼, 50(2): 443-448.
李元躍, 李容偉, 陳融斌, 等, 2022. 紅樹林下人工籠養中華烏塘鱧()肌肉營養成分的分析與評價[J]. 海洋與湖沼, 53(5): 1170-1179.
張小鶯, 陳琛, 趙建樂, 等, 2010. 卵黃抗體技術中不同因素對免疫效果的影響[J]. 中國家禽, 32(1): 23-26.
張小鶯, 鄭禮, SCHADE R, 2006. 卵黃抗體技術的醫藥應用與研究動態[C] //中國藥理學會制藥工業專業委員會第十二屆學術會議、中國藥學會應用藥理專業委員會第二屆學術會議、2006年國際生物醫藥及生物技術論壇(香港)會議論文集. 天津:《中草藥》雜志編輯部.
張小鶯, 鄭禮, SCHADE R, 等, 2004. 免疫雞產生IgY抗體的技術[J]. 中國藥理學通報, 20(10): 1102-1106.
張桂枝, 靳雙星, 2009. 抗雞新城疫和傳染性法氏囊病二聯卵黃抗體的研制及應用[J]. 中國畜牧獸醫, 36(8): 136-138.
杭小英, 袁雪梅, 呂孫建, 等, 2021. 抗大口黑鱸彈狀病毒中草藥的篩選及抗病毒效果[J]. 江蘇農業科學, 49(14): 155-159.
羅霞, 付小哲, 林強, 等, 2022. 鱖魚傳染性脾腎壞死病和彈狀病毒病二聯滅活疫苗毒種及種子批的研究[J]. 西北農林科技大學學報(自然科學版), 50(1): 1-9.
胡瑞鴻, 2020. 抗H株小鵝瘟病毒卵黃抗體的研制與質量評估[D]. 哈爾濱: 東北農業大學.
鐘小慶, 楊菁, 2021. 全國生魚看廣東, 廣東生魚看三角! 這個漁業重鎮游出的烏斑雜交鱧, 能否引領產業發展新高峰?[J]. 當代水產, 46(10): 72-74.
目前,高職教師到企業掛職鍛煉的時間一般為2-6個月(一個學期),最長也僅為1年(一個學年),掛職的時間相對較短。在短時間內,教師很難做到與企業崗位、企業團隊和企業管理等相融合,與企業的融合度不夠。因時間相對較短,企業也存在著不愿意將關鍵核心的崗位安排給掛職教師,通常會安排相對清閑的崗位,僅安排一些協作性、臨時性的工作。
袁雪梅, 呂孫建, 施偉達, 等, 2020. 大口黑鱸彈狀病毒的分離培養及其卵黃抗體的制備[J]. 漁業科學進展, 41(3): 151-157.
曾偉偉, 王慶, 王英英, 等, 2013. 一株鱧科魚源彈狀病毒的分離及鑒定[J]. 水產學報, 37(9): 1416-1424.
雷燕, 2015. 雜交鱧彈狀病毒病綜合防控技術[J]. 海洋與漁業·水產前沿, (4): 87-88.
SCHADE R, 張小鶯, 鄭禮, 2004. IgY技術及其醫藥應用: 理論基礎[J]. 中國藥理學通報, 20(5): 491-495.
CHEN Z Y, LEI X Y, ZHANG Q Y, 2012. The antiviral defense mechanisms in mandarin fish induced by DNA vaccination against a rhabdovirus [J]. Veterinary Microbiology, 157(3/4): 264-275.
EINER-JENSEN K, AHRENS P, FORSBERG R,, 2004. Evolution of the fish rhabdovirus viral haemorrhagic septicaemia virus [J]. Journal of General Virology, 85(5): 1167-1179.
HENDRIKSEN C, 2001. Book Review: Chicken egg yolk antibodies, production and application, IgY-technology [J]. Alternatives to Laboratory Animals, 29(3): 373-374.
HOFFMANN B, BEER M, SCHüTZE H,, 2005. Fish rhabdoviruses: molecular epidemiology and evolution [M] // FU Z F. The World of Rhabdoviruses. Berlin, Heidelberg: Springer: 81-117.
HU B C, YANG XC D, GUO E P,, 2019. The preparation and antibacterial effect of egg yolk immunoglobulin (IgY) against the outer membrane proteins of[J]. Journal of the Science of Food and Agriculture, 99(5): 2565-2571.
LEE S H, LILLEHOJ H S, PARK D W,, 2009. Induction of passive immunity in broiler chickens againstby hyperimmune egg yolk immunoglobulin Y [J]. Poultry Science, 88(3): 562-566.
LI C H, LU X J, LI D F,, 2014. Passive protective effect of chicken egg yolk immunoglobulins against experimental Vibrio anguillarum infection in ayu () [J]. Fish & Shellfish Immunology, 37(1): 108-114.
LU Y N, LIU J J, JIN L J,, 2008. Passive protection of shrimp against white spot syndrome virus (WSSV) using specific antibody from egg yolk of chickens immunized with inactivated virus or a WSSV-DNA vaccine [J]. Fish & Shellfish Immunology, 25(5): 604-610.
QIN Z D, BABU S V, LI N Q,, 2018. Protective effects of chicken egg yolk immunoglobulins (IgY) against experimentalinfection in blunt snout bream () [J]. Fish & Shellfish Immunology, 78: 26-34.
SCHADE R, CALZADO E G, SARMIENTO R,, 2005. Chicken egg yolk antibodies (IgY-technology): a review of progress in production and use in research and human and veterinary medicine [J]. Alternatives to Laboratory Animals, 33(2): 129-154.
SNIPPE H, WILLERS J M N, 1979. Cell co-operation in antibody formation on hapten-carrier complexes: some regulatory aspects [J]. Developmental & Comparative Immunology, 3: 509-522.
TENG Y, LIU H, LV J Q,, 2007. Characterization of complete genome sequence of the spring viremia of carp virus isolated from common carp () in China [J]. Archives of Virology, 152(8): 1457-1465.
TINI M, JEWELL U R, CAMENISCH G,, 2002. Generation and application of chicken egg-yolk antibodies [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 131(3): 569-574.
XU L, CHE J, XU Y P,, 2020. Oral administration of microencapsulated egg yolk immunoglobulin (IgY) in turbot () to combat against2CDM001 infections [J]. Fish & Shellfish Immunology, 106: 609-620.
ZHANG L J, LI N Q, LIU Q,, 2018. An avirulentrhabdovirus vaccine candidate protects Chinese perch against rhabdovirus infection [J]. Fish & Shellfish Immunology, 77: 474-480.
PREPARATION OF ANTI-HYBRID SNAKEHEAD RHABDOVIRUS IgY AND DEVELOPMENT OF INDIRECT ELISA
LIU Tian1, 2, 3, 4, LI Shuo2, WANG Ming-Shu4, ZHAO Li-Ning2, HUANG Jin-Lu2, WU Yi-Lin2, JIA Ai-Qing2
(1. Key Laboratory of Microecological Resources and Utilization in Breeding Industry, Ministry of Agriculture and Rural Affairs, Guangzhou 511400, China; 2. Animal Husbandry and Fisheries Research Center of Guangdong Haid Group Co., Ltd., Guangzhou 511400, China; 3. Guangdong Haid Institute of Animal Husbandry and Veterinary, Guangzhou 511400, China; 4. Institute of Preventive Veterinary Medicine, Sichuan Agricultural University, Chengdu 611100, China)
To analyze the production regularity of anti-Hybrid snakehead rhabdovirus IgY and the effectiveness of neutralization antibody, laying hens were immunized with inactivated vaccine and then the indirect ELISA method was established for monitoring the production regularity of egg yolk antibody. Neutralization assay was also conducted to evaluate antibody neutralization. The optimal antigen coating concentration of ELISA assay was 0.5×105.8TCID50/0.1 mL with coating at 37 °C for 2 h, and blocking at 37 °C for 2 h. No cross reaction was found with anti-IgY, SPF egg yolk extract, pre-immunized egg yolk extract and MBC cells. The positive and negative samples were determined by S/N (sample/negative)>2.1 with the highest sensitivity. Anti-Hybrid snakehead rhabdovirusIgY was produced at 28 d after the first immunization, and reached the highest level after the fourth immunization with 1 : 25 600. And also the plateau phase was lasting for 40~60 d, during the plateau phase, the antibody neutralization titer reached to highest with 46.3. In this study, the production regularity of anti-Hybrid snakehead rhabdovirus IgY was monitored by indirect ELISA, and the effectiveness of neutralization antibody was valued by neutralization assay. The high titer IgY has the potential to be developed as a new type of biologic product against hybrid snakehead rhabdovirus. The preparation of anti-Hybrid snakehead rhabdovirus IgY and the construction of indirect ELISA method will provide theoretical basis and a technical mean for the prevention and treatment of this disease.
hybrid snakehead rhabdovirus; immunoglobulin of egg yolk (IgY); indirect ELISA; neutralizing antibody
* 2023年鄉村振興戰略專項-農業科技發展及資源環境保護管理項目, 2023KJ115號。劉 田, 博士, E-mail: lt9208101223@ 163.com; 同等貢獻第一作者: 李 碩, 碩士, E-mail: 980942564@qq.com
賈愛卿, E-mail: 59492815@qq.com
2023-05-18,
2023-09-24
S942; Q955; S965
10.11693/hyhz20230500108

