Lancet|KEYNOTE-966 Ⅲ期臨床研究:晚期膽道惡性腫瘤治療
——帕博利珠單抗聯合吉西他濱+順鉑vs單用吉西他濱+順鉑
李斌 摘譯, 姜小清, 趙海濤 審校
1 海軍軍醫大學第三附屬醫院膽道一科, 上海 200438; 2 北京協和醫院肝臟外科, 北京 100730
據目前報道,KEYNOTE-966 是首個程序性死亡受體1抑制劑的安慰劑對照研究,也是有關程序性死亡受體1 或其配體檢查點抑制劑顯著改善晚期膽道惡性腫瘤患者總生存期且安全性可控的第2 個研究。KEYNOTE-966研究提供了TOPAZ-1研究之外的重要發現,得益于更大的樣本量、更高非亞裔患者的比例、持續使用吉西他濱直至疾病進展、更全面地評估重要的臨床生物標志物(如乙型肝炎和丙型肝炎病毒狀態),上述因素均可能影響研究結果對于全球患者的普適性。
1 背景
膽道惡性腫瘤(biliary tract cancers,BTC)是一組起源于肝內外膽管和膽囊的復雜上皮惡性腫瘤,預后較差[1]。雖然BTC 占全球總新發腫瘤患者數低于1%[2],但發病率在持續攀升[1,3-4]。研究[5]發現,BTC腫瘤微環境廣泛呈現免疫抑制或免疫豁免特征,因此對程序性死亡受體1及其配體(PD-1/PD-L1)抑制劑單藥治療的反應性較低[6-8]。已知包括吉西他濱和順鉑在內的幾種化療藥物可以通過直接免疫刺激機制、下調免疫抑制微環境和增強免疫原性來調節免疫系統[9-10],上述免疫調節機制為免疫聯合化療治療腫瘤特別是呈現免疫抑制微環境特征腫瘤提供了強有力的理論依據。針對晚期BTC 患者的隨機雙盲Ⅲ期TOPAZ-1 研究[11]表明,與單用吉西他濱和順鉑相比,聯用PD-L1 抑制劑度伐利尤單抗顯著提高了患者的總生存期(OS)。本研究旨在評估在吉西他濱和順鉑的基礎上聯用抗PD-1 單克隆抗體帕博利珠單抗能否提高晚期BTC患者一線治療療效。
2 方法
2.1 研究設計及患者 KEYNOTE-966 研究是在亞太、歐洲、北美和南美的175個研究中心開展的一項隨機、雙盲、安慰劑對照的Ⅲ期研究。納入標準:年齡≥18歲;經組織學證實不可切除的局部晚期或轉移性肝外膽管癌、膽囊癌或肝內膽管癌(包括混合型肝細胞癌-膽管癌);由研究者根據實體腫瘤療效評價標準(RECIST)1.1 版確定為可測量病灶;ECOG 體能狀態評分0 或1;可提供腫瘤組織用于生物標志物檢測;臟器功能良好;患者預期壽命超過3 個月。在診斷為不可切除或轉移性腫瘤前≥6 個月完成新輔助或輔助治療的患者也可納入研究。既往或目前存在HCV 感染的患者符合納入標準。乙型肝炎活動期但可控的患者可納入研究,包括HBsAg 陽性或可檢測到HBV DNA,在治療開始前至少4 周接受抗病毒治療且病毒載量<100 IU/mL。排除壺腹癌或在既往2年內合并有需要系統治療的活動性自身免疫疾病者。
2.2 隨機化與盲法 研究人員使用中央交互式語音應答系統(美國Almac Clinical Technologies 公司)和研究資助者生成的隨機列表,將患者按1∶1 隨機分配至帕博利珠單抗聯合化療組或安慰劑(生理鹽水)聯合化療組。按地理區域(亞洲 vs 非亞洲)、疾病分期(局部晚期 vs 轉移性)和腫瘤原發部位(肝外膽管 vs 膽囊 vs 肝內膽管)進行分層隨機化。
2.3 研究流程 每3 周靜脈注射1 次帕博利珠單抗200 mg或安慰劑(生理鹽水)。每3周的第1天和第8天靜脈注射吉西他濱1 000 mg/m2和順鉑25 mg/m2。持續上述所有治療,直至出現疾病進展、不可耐受的毒性反應、研究者決定停止治療、患者撤回同意或其他原因(以先發生者為準)。帕博利珠單抗和安慰劑至多應用35 個周期,順鉑至多應用8 個周期,吉西他濱無周期限制。因不可耐受的毒性反應而停用吉西他濱和/或順鉑的患者可以繼續使用帕博利珠單抗或安慰劑,反之亦然。不允許接受交叉治療。
2.4 研究結局 主要終點OS定義為從隨機分組至全因死亡的時間,次要終點包括無進展生存期(PFS)、客觀緩解率(ORR)、緩解持續時間(DoR)以及安全性,其中PFS、ORR 和DoR 由盲態獨立中心評審根據RECIST 1.1 版評估。PFS 定義為從隨機分組至首次記錄出現疾病進展或全因死亡的時間,以先發生者為截點。ORR 定義為最佳總體反應為完全或部分緩解的患者比例。DoR定義為從首次出現完全或部分緩解到出現疾病進展或全因死亡的時間,以先發生者為截點。
2.5 統計學處理 使用Maurer & Bretz圖解法,將所有OS、PFS 和ORR 假設的第一類總錯誤率嚴格控制在單側α=0.025。判斷帕博利珠單抗聯合化療較安慰劑聯合化療療效更優的單側P值邊界,對于OS 為0.020 0,PFS為0.012 5,ORR為0.012 5。使用R 3.6.1軟件計算樣本量和統計效力。使用SAS 9.4 軟件進行統計學分析。
3 結果
2019年10 月4 日—2021 年6 月8 日 對1 564 例BTC患者進行篩選,其中1 069例被隨機分配至帕博利珠單抗聯合化療組(n=533)或安慰劑聯合化療組(n=536),并納入意向性治療人群(圖1)。基線時,治療組間的人口統計學數據和患者特征基本平衡(表1)。

表1 意向性治療人群基線時的人口統計學資料和臨床特征

圖1 研究流程圖
最終分析時中位隨訪時間(定義為從隨機分配到2022 年12 月15 日數據截止)為25.6(21.7~30.4)個月。帕博利珠單抗聯合化療組中位治療持續時間為6.37(2.79~10.84)個月,安慰劑聯合化療組為5.54(2.53~9.69)個月。帕博利珠單抗聯合化療組中位治療周期為9(4~16)周期,安慰劑聯合化療組為8(4~14)周期。在意向性治療人群中,帕博利珠單抗聯合化療組533 例患者中有253 例(47%)和安慰劑聯合化療組536 例患者中有261 例(49%)接受1 種或多種后續抗腫瘤治療。
最終分析顯示,帕博利珠單抗聯合化療組中位OS為12.7個月(95%CI:11.5~13.6),安慰劑聯合化療組10.9個月(95%CI:9.9~11.6)。帕博利珠單抗聯合化療組估算12 個月OS 率為52%(95%CI:47~56),安慰劑聯合化療組為44%(95%CI:40~48);帕博利珠單抗聯合化療組估算24 個月OS 率為25%(95%CI:21~29),安慰劑聯合化療組為18%(95%CI:15~22)(圖2a)。帕博利珠單抗聯合化療組達到具有統計學意義的OS獲益療效邊界(HR=0.83,95%CI:0.72~0.95,P=0.003 4)。描述性亞組分析顯示,在大多數預設的亞組中,帕博利珠單抗聯合化療組均有獲益,包括PD-L1聯合陽性評分<1分和≥1分亞組(圖2b)。

圖2 最終分析中意向性治療人群的OS
首次中期分析[截至2021 年12 月15 日、中位隨訪時間為13.6(9.7~18.4)個月]時,帕博利珠單抗聯合化療組中位PFS 為6.5 個月(95%CI:5.7~6.9),安慰劑聯合化療組為5.6 個月(95%CI:5.1~6.6)(圖3)。帕博利珠單抗聯合化療組未達到具有統計學意義的PFS 獲益的療效邊界(HR=0.86,95%CI:0.75~1.00,P=0.023)。

圖3 首次中期分析時,根據盲態獨立中央評審評估使用Kaplan-Meier法估算意向性治療人群的PFS
在首次中期分析時,帕博利珠單抗聯合化療組533例患者中153例(29%,95%CI:25~33)和安慰劑聯合化療組536例患者中153例(29%,95%CI:25~33)出現完全或部分緩解(表2)。帕博利珠單抗聯合化療組未達到具有統計學意義的ORR獲益的療效邊界(治療差異0.2%,95%CI:-5.2~5.6,P=0.47)。帕博利珠單抗聯合化療組的中位DoR 為9.7 個月(95%CI:6.9~12.2),安慰劑聯合化療組為6.9 個月(95%CI:5.7~8.2)。帕博利珠單抗聯合化療組估算的24 個月的持續緩解率為18%(95%CI:11~26),安慰劑聯合化療組為6%(2~13)。
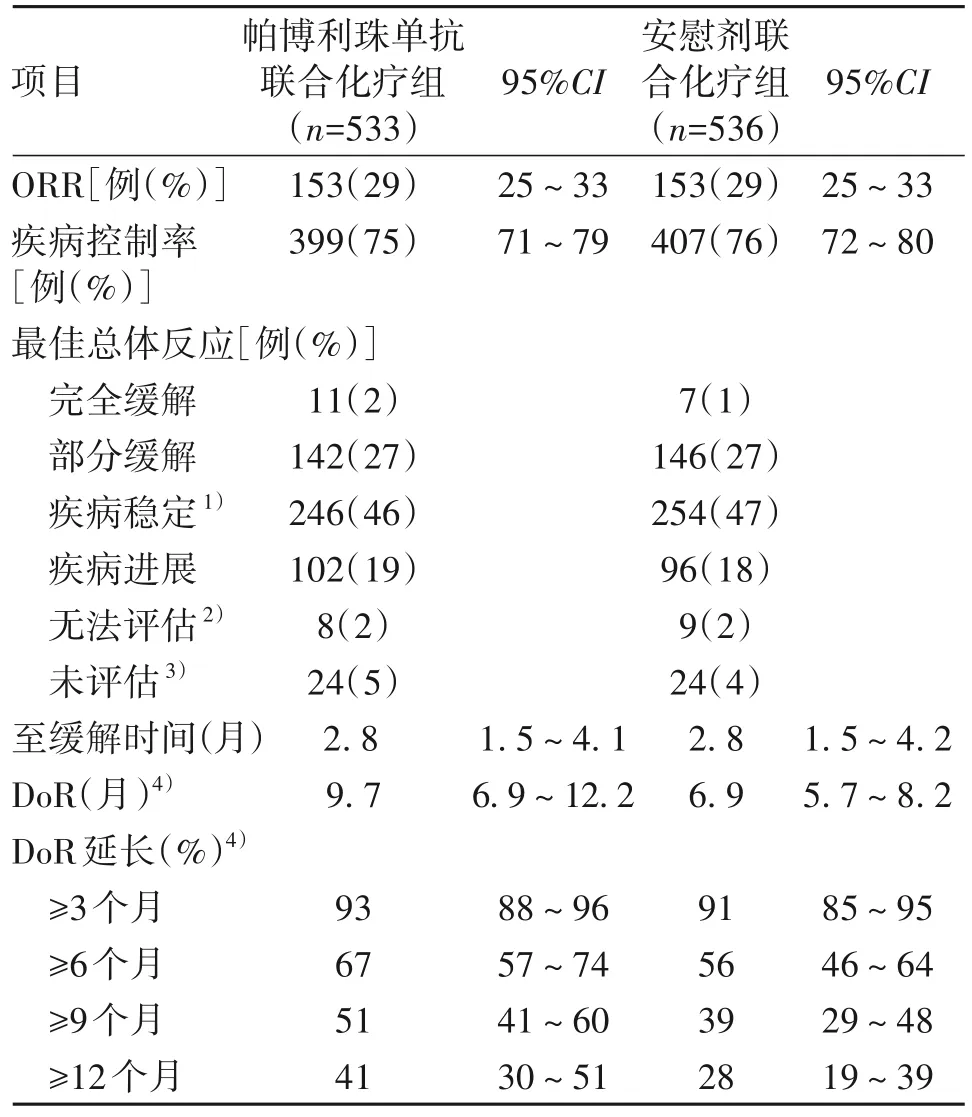
表2 首次中期分析時意向性治療人群的療效反應總結
最終分析顯示,在實際治療人群中,帕博利珠單抗聯合化療組529例患者中524例(99%)和安慰劑聯合化療組534例患者中532例(<100%)患者發生全因不良事件(AE)。帕博利珠單抗聯合化療組420例(79%)患者和安慰劑聯合化療組400 例(75%)患者發生3~4 級AE。表3 中總結2 組超過15%患者發生的AE。未觀察到美國肝病學會定義的HBV 再激活伴肝炎爆發病例[12]。
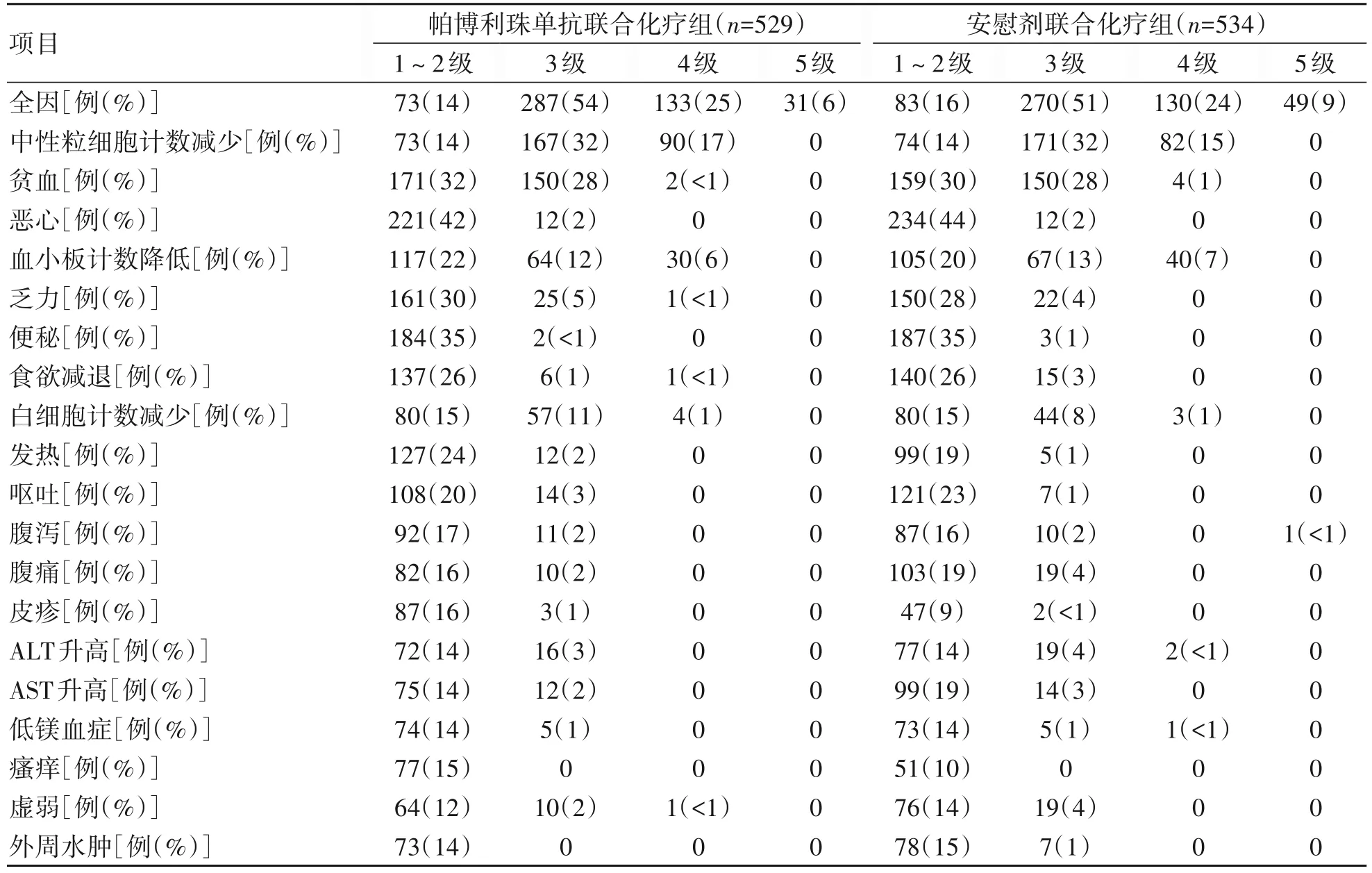
表3 最終分析時實際治療人群中,各組患者中發生率≥15%的全因AE
最終分析顯示,帕博利珠單抗聯合化療組529 例患者中493 例(93%)發生治療相關AE,其中369 例(70%)患者為3~4 級AE,102 例(19%)停用≥1 種研究藥物,18例(3%)停用所有研究藥物。安慰劑聯合化療組534 例患者中500 例(94%)發生治療相關AE,其中367例(69%)為3~4級AE。81例(15%)停用≥1種研究藥物,14例(3%)停用所有研究藥物。帕博利珠單抗聯合化療組8例(2%)和安慰劑聯合化療組3例(1%)患者因治療相關AE死亡。帕博利珠單抗聯合化療組529例患者中117 例(22%)和安慰劑聯合化療組534 例患者中69例(13%)發生潛在免疫介導相關AE和輸液反應,其中帕博利珠單抗聯合化療組有7%(37例)和安慰劑聯合化療組有4%(21例)發生3~4級AE。肺炎是唯一導致死亡的免疫介導相關AE,發生于帕博利珠單抗聯合化療組1例(<1%)。帕博利珠單抗聯合化療組和安慰劑聯合化療組中分別有48例(9%)和26例(5%)因免疫介導相關AE和輸液反應接受皮質類固醇治療。
4 討論
在隨機、安慰劑對照的Ⅲ期KEYNOTE-966臨床研究中,對比單用吉西他濱和順鉑化療方案,帕博利珠單抗聯合吉西他濱和順鉑作為不可切除的局部晚期或轉移性BTC 患者一線治療方案顯著提高了患者的OS。總體生存曲線未交叉、早期即分離,并在整個隨訪過程中呈持續分離狀態,帕博利珠單抗組估算24個月OS率為25%,安慰劑組僅為18%。帕博利珠單抗組的中位DoR 也較安慰劑組更長(首次中期分析,9.7 個月 vs 6.9 個月)。吉西他濱和順鉑聯用帕博利珠單抗的OS獲益在大多數預設的亞組(包括基于地區和病因分層的亞組)中基本一致。
雖然KEYNOTE-966和TOPAZ-1研究設計相似,但仍有不同之處。首先,吉西他濱治療持續時間不同。在TOPAZ-1 研究中,吉西他濱至多維持8 個治療周期[11],而在KEYNOTE-966研究中吉西他濱無用藥最大周期限制,可以持續給藥直至出現疾病進展或無法耐受的毒性反應。總體而言,帕博利珠單抗聯合化療組43%和安慰劑聯合化療組39%的患者接受≥9 個周期的吉西他濱治療,其中帕博利珠單抗聯合化療組32%和安慰劑聯合化療組27%的患者接受≥12個周期的吉西他濱治療。KEYNOTE-966 和TOPAZ-1 研究中吉西他濱治療持續時間的不同反映了臨床實踐的異質性,為全球不同的標準治療方案補充了理論依據。其次,KEYNOTE-966 研究按地理區域進行分層隨機化,而TOPAZ-1研究沒有這一設計。此外,KEYNOTE-966研究較TOPAZ-1研究招募更多患者(1 069例 vs 685例),且非亞洲地區患者的比例更高(583例 vs 311例,55% vs 45%)。在KEYNOTE-966 研究中,帕博利珠單抗聯合吉西他濱和順鉑在大量非亞洲人群中的相對獲益與在意向性治療人群中觀察到的相似。再者,KEYNOTE-966 研究對生物標志物的評估較TOPAZ-1研究更全面,包括PD-L1 表達和病毒性肝炎狀態,為在不同患者亞組中聯合帕博利珠單抗治療提供了更多依據。最后,兩項研究的總體生存曲線的形狀和分離時間不同。在KEYNOTE-966 研究中,隨機分組后約第2 個月,曲線分離且有利于帕博利珠單抗聯合化療組,并隨著治療時間推移保持相對一致的分離狀態。KEYNOTE-966 和TOPAZ-1 研究之間的一個顯著相似之處是,較高的PD-L1 表達水平與免疫聯合化療使患者獲益之間無顯著相關性,盡管在這兩項研究中使用不同的PD-L1 測定方法和評分方法,但研究結果相一致。
在KEYNOTE-966 研究的首次中期分析中,對PFS 預設的最終分析,盡管帕博利珠單抗聯合化療組較安慰劑聯合化療組的PFS 有差異,但未達統計學差異。評估BTC 患者的PFS 比較復雜,通常借助于膽道梗阻情況、肝功能和血清CA19-9 表達水平等非腫瘤直接評估方法。因此,根據RECIST 1.1 版評估的PFS可能并非衡量BTC 癥患者無進展生存的最佳指標。本研究兩組間ORR 也無顯著差異,安慰劑聯合化療組ORR 高于TOPAZ-1 研究中的ORR,但與近期其他研究[13-14]中的吉西他濱和順鉑組ORR 相似。帕博利珠單抗聯合化療組的療效比安慰劑組更持久,最終分析顯示,估算帕博利珠單抗聯合化療組和安慰劑聯合化療組分別有18%和6%的響應者,在24 個月時存活且無疾病進展。
帕博利珠單抗聯合化療(吉西他濱+順鉑)的AE譜與研究預期一致,符合每種研究藥物已知的AE 譜,并且各組間AE 發生率相似。最常見的AE 是血細胞計數異常、惡心和乏力,這些AE 已知與化療有關。與預期相符,帕博利珠單抗組潛在的免疫介導相關AE更多見,但通過適當的支持性治療后癥狀可控。用于治療免疫介導相關AE 的全身皮質類固醇使用率較低(實際治療人群中使用率<10%)。此外,接受帕博利珠單抗聯合化療的患者能夠維持可接受的健康相關生活質量。
本研究的局限性包括:首先,招募的肝內膽管癌比例過高,導致肝外膽管癌和膽囊癌樣本量相對較小,可能會影響亞組分析的結果。在包括TOPAZ-1研究在內的其他研究中也觀察到對肝內膽管癌的偏向性,可能也從側面反映了全球肝內膽管癌發病率的上升趨勢[1,4]。由于肝內膽管癌更易取樣,入組時對腫瘤組織取樣要求也可能導致了受試者選擇性偏倚。其次,由于伴有高度微衛星不穩定性(microsate instability-high,MSI-H)的BTC 發生率較低,在本研究中也僅有10 例MSI-H 病例,因此無法通過微衛星不穩定狀態來評估治療結局。
綜上所述,KEYNOTE-966 研究達到了研究設計的主要終點,即帕博利珠單抗聯合化療(吉西他濱和順鉑)較單用化療(吉西他濱和順鉑)可使初治轉移性或無法切除的BTC 患者OS 獲得統計學及臨床顯著意義的改善,同時未增加新的安全風險,帕博利珠單抗聯合吉西他濱和順鉑有望成為該人群新的治療策略。
致謝:感謝默沙東(中國)投資有限公司陳文挺為本文提供數據校對支持,感謝上海北翱醫藥科技有限公司為本文輔助重制圖表,感謝默沙東(中國)投資有限公司對本次二次發表工作的支持。
版權聲明:本文原文“Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966):a randomised, double-blind,placebo-controlled, phase 3 trial”,首次發表在Lancet,2023, 401(10391):1853-1865。本次二次發表已取得版權所有者?2023 Elsevier 出版社的同意,對原文進行翻譯,不涉及一稿多投及侵犯版權等問題。
專家點評:BTC涵蓋膽囊癌(gallbladder cancer,GBC)及肝內、外膽管癌(intrahepatic/extrahepatic cholangiocarcinoma,ICC/ECC),具有侵襲性強、死亡率高、預后差的特點。BTC在全球范圍內的發病率呈現上升趨勢,在亞洲國家最為常見,我國BTC 的疾病負擔相較歐美更為嚴重。我國是乙型肝炎和原發性肝癌發病率高發國家,而ICC約占原發性肝癌的10%~15%。國家癌癥中心發布的2016年數據預計我國每年BTC新發人數約11萬。由于早期BTC患者無明顯臨床癥狀,70%以上的患者在確診時已處于進展期或晚期。
近年來,免疫檢查點抑制劑相關研究相繼在包括BTC在內的各個瘤種中取得陽性結果,顯示以免疫檢查點抑制劑為核心的治療方案能夠顯著延長患者的生存時間。而TOPAZ-1研究和KEYNOTE-966研究的成功,進一步證實了免疫治療晚期BTC 的有性效和安全性,標志著BTC 治療已進入了免疫治療時代。相較于TOPAZ-1 研究,KEYNOTE-966 研究具有入組樣本量更大、患者基線特征更為均衡(如入組更高比例的非亞裔患者)以及臨床生物標志物(如乙型肝炎和丙型肝炎病毒狀態)的檢測更為全面等特點。
在KEYNOTE-966研究中,帕博利珠單抗聯合化療組和安慰劑聯合化療組的OS為12.7個月和10.9個月,死亡風險降低17%(HR=0.83,95%CI:0.72~0.95,P=0.003 4),帕博利珠單抗聯合化療組2年生存率達25%,且具有可控的安全性。此外,值得注意的是,KEYNOTE-966研究中兩組的OS曲線在2個月時即呈分離狀態,并且隨著隨訪時間仍維持分離,提示多數BTC患者都可從帕博利珠單抗聯合吉西他濱+順鉑化療方案中生存獲益。藥物療效以及較大的樣本量,可能也是研究早期OS曲線即發生分離的原因。KEYNOTE-966研究中帕博利珠單抗聯合化療組較安慰劑聯合化療組的DoR也有明顯延長(9.7個月 vs 6.9個月),24個月持續緩解的患者比例為18%和6%,表明患者如果治療獲益即可獲得較長的獲益時間,這與既往免疫治療研究的認知一致。
2023年美國臨床腫瘤學會年會報道了KEYNOTE-966 研究健康相關生活質量(HRQoL)數據,結果顯示,在吉西他濱+順鉑化療基礎上聯用帕博利珠單抗一線治療晚期BTC患者,HRQoL可維持較好水平;兩組間疾病進展至惡化時間相似。連同之前報告的KEYNOTE-966研究的療效和安全性數據,進一步支持帕博利珠單抗聯合吉西他濱+順鉑化療可作為晚期BTC 患者新一線治療方案的選擇。
雖然晚期BTC 治療正式邁入了免疫治療時代,但依然存在著許多尚未解決的問題,例如不同亞型對免疫治療的獲益差異、療效標志物的探索以及如何進一步提高患者療效等亟待明確。
在TOPAZ-1 和KEYNOTE-966 研究的OS 亞組分析中,均觀察到不同疾病亞型對免疫治療獲益具有差異性。在KEYNOTE-966 研究中,相較于GBC 和ECC 人群,ICC人群治療獲益更大(HR=0.76),這體現出BTC生物學行為的強異質性,可能與不同BTC 亞型間病因和免疫微環境的差異有關,對化療和免疫治療的應答也不盡相同。ICC患者對于吉西他濱+順鉑化療的敏感性較差,可能因此凸顯了聯合免疫治療對提升此類患者OS 具有潛在優勢。而對于GBC 和ECC 患者的免疫治療獲益問題需要更多討論,在臨床實踐中不乏患者從免疫治療獲益的案例。未來需要進一步探尋有效的生物標志物,以確定BTC免疫治療優勢獲益人群。
目前,關于晚期BTC 中預測免疫治療應答的生物標志物主要包括PD-L1表達、腫瘤突變負荷、MSI-H、錯配修復缺陷(mismatch repair-deficient,dMMR),DNA損傷修復基因突變和腫瘤浸潤淋巴細胞等。但除MSI-H/dMMR外,其余生物標志物的證據等級較低,臨床應用尚未達成共識。KEYNOTE-158 研究隊列K 納入了不限腫瘤來源的晚期MSI-H/dMMR 實體瘤(除外結直腸癌),其中含BTC患者22例,經帕博利珠單抗治療中位OS 達到19.4 個月,3 年及以上OS 率達30.3%,表明帕博利珠單抗可使1/3 的BTC 患者生存期突破3 年。因此,《中國抗癌協會膽道惡性腫瘤靶向及免疫治療指南(2022)》中指出,對于不可切除和轉移性患者推薦增加分子檢測,包括MMR 檢測,并推薦帕博利珠單抗單藥可用于MSI-H/dMMR 的膽道惡性腫瘤一線治療(1A 類推薦)。
“三聯四藥”方案治療晚期BTC,即PD-1 單抗聯合貝伐珠單抗、侖伐替尼等抗血管生成藥物以及GEMOX(吉西他濱和奧沙利鉑)或吉西他濱+順鉑化療方案,已陸續開展多項相關研究,階段性報道ORR 達到37.5%~80%,但研究結果均基于較小的樣本量,治療有效性和安全性尚待大樣本量研究結果綜合評估。目前對“三聯四藥”方案疑慮的焦點,即在于肝膽腫瘤病患治療前往往存在肝功能異常的基線狀態,強大的給藥方案病患是否能夠耐受,以及是否會加劇患者的治療風險。此外,隨著BTC分子診斷研究的進展,未來或許還可根據患者分子特征探索免疫聯合明確靶點藥物治療方案的可行性,以期為患者帶來更優的療效。
點評專家:姜小清(海軍軍醫大學第三附屬醫院膽道一科),趙海濤(北京協和醫院肝臟外科)

