關于炎癥性腸病發病機制的研究進展
侯曉婷,孟 歡,薛佳辰,張華敏,王旭德*,王科斯*
(1.大連大學醫學院慢性病研究中心,遼寧 大連 116622;2.大連大學附屬中山醫院,遼寧 大連 116622;3.延邊大學藥學院,吉林 延吉 133002)
炎癥性腸病(inflammatory bowel disease, IBD)是一種長期反復發作的影響胃腸道各部位的炎癥性疾病,包括潰瘍性結腸炎(ulcerative colitis, UC)和克羅恩病(Crohn’s disease, CD)兩種類型。進入21 世紀后,IBD 已經成為一種全球性疾病,患病人數高達500 萬,在社會日益西方化的新興工業化國家發病率加快,負擔不斷提高[1-4]。
UC 和CD 在臨床表現、結腸鏡檢查和組織病理學特征上相似但有所區別。UC 是最主要的IBD 類型,它從直腸持續向大腸近端延伸,病變常局限于黏膜上皮。CD 在胃腸道的任何部位均可發生,但多發于末端回腸和右半結腸。除這些報道的主要表現外,IBD 患者常因腸外并發癥而痛苦,這些并發癥可能涉及皮膚病(結節性紅斑和壞疽性膿皮病)、眼部疾病(結膜炎和葡萄膜炎)、風濕病(強直性脊柱炎和周圍性關節炎)、肝膽疾病(原發性硬化性膽管炎)、泌尿系統疾病(腎結石),以及肛周并發癥(膿腫、瘺管和狹窄)[5-7]。
目前IBD 病因尚不清楚,但一系列的研究表明,個體的遺傳因素和外部環境、腸黏膜屏障功能、氧化應激、自噬功能異常和適應性免疫反應各方面都參與了IBD 的發病過程[8-11]。本文總結歸納了上述五個領域的最新研究進展,以明確了解IBD 的發病機制,為IBD 的治療提供更多思路。
1 遺傳和環境因素
迄今為止,在IBD 的遺傳框架研究方面已鑒定出163 個易感位點,大多數位點都有患IBD 的風險。Cleynen 等[12]應用蒙特利爾分類系統對34 819 例患者進行免疫芯片分型測試基因型表型關聯,結果顯示代表IBD 所有已知危險等位基因的遺傳風險評分與疾病亞表型有很強的相關性。越來越多的研究報告IBD 相關的表觀遺傳學改變,以及基因表達和細胞功能的相關改變。其中DNA 甲基化在IBD患者的黏膜活檢和外周血單個核細胞中的變化已被證實,與健康人相比,UC 患者的基因組甲基化程度相對較高[13-15]。
在工業化國家觀察發現環境空氣污染與IBD的發病率存在正相關關系。居民長期生活在高濃度二氧化氮和二氧化硫的環境中可增加患早發型IBD 的風險[16]。另外西方流行病學研究表示,吸煙能夠導致患CD 的風險增加[2]。
此外,發展中國家人群中IBD 發病率的上升原因之一在于飲食習慣的“西方化”,即以碳水化合物和紅肉攝入量高、膳食纖維攝入量低為特征[17]。首先,西方飲食對腸道微生物群組成的影響與較低的微生物多樣性、較高的類桿菌和腸桿菌科豐度以及較低的厚壁菌門水平有關,而傳統的東方飲食則與短鏈脂肪酸(short-chain fatty acids, SCFAs)和較低的腸桿菌科豐度(志賀氏菌和大腸桿菌)有關。其次,高脂肪、高糖的西方飲食降低了黏液層厚度,增加了腸道通透性,使易感小鼠腫瘤壞死因子(tumor necrosis factor, TNF)-α 分泌增加[18-19]。西方飲食中omega-6 (n-6)/omega-3 (n-3)多不飽和脂肪酸(polyunsaturated fatty acids, PUFAs)之間的不平衡,可能會增加IBD 的風險[17]。在小鼠模型中,高脂肪飲食特別是飽和動物脂肪會增加炎癥,補充omega-3長鏈脂肪酸則可以預防腸道炎癥[16,20-22]。
2 腸黏膜屏障
腸黏膜屏障在保護生物體免受來自外部環境的病原體和有害物質中發揮重要功能,由黏液和上皮層以及下面的固有層組成,包括機械屏障、化學屏障、免疫屏障和生物屏障。免疫細胞、腸道微生物群和抗微生物肽在維持腸道屏障功能中具有至關重要的作用。
2.1 機械屏障
機械屏障包括腸上皮細胞、上皮細胞緊密連接等。緊密連接(tight junction, TJ)在腸道屏障功能中起著重要的作用。腸上皮細胞中的TJ 蛋白由不同的連接分子組成,調節鄰近細胞中水、離子和大分子的細胞旁滲透性,而TJ 屏障的完整性缺失和結構受損導致免疫細胞的強制激活和不同組織中的慢性炎癥,最近的研究表明腸道TJ 屏障可以作為一個潛在的目標預防和減少不同的炎癥性疾病[23-24]。在自發性結腸炎的白介素(interleukin, IL)-10 基因敲除模型中,屏障通透性的增加先于疾病的發生,過度表達TJ 蛋白的小鼠模型導致屏障通透性增加[25]。其他整合性膜蛋白對泄漏途徑的調控和維持至關重要。例如, 閉鎖小帶蛋白( zonula occludens, ZO)-1 具有一個肌動蛋白結合域,部分通過肌動蛋白環調控泄漏途徑[26-27]。Ibrahim 等[28]發現磷脂酰肌醇-3-激酶(phosphatidylin-ositol-3-kinase, PI3K)家族成員之一,PIK3R3 的表達水平隨著結腸炎的發生而增加。體外研究顯示,上調的PIK3R3 降低ZO-1 的表達,而下調PIK3R3 能夠增加ZO-1 的表達。Sturgeon 等[29]報道了ZO-1 依賴性小腸屏障損傷是導致耐受破壞的早期步驟,隨后發展為慢性炎癥性疾病。
2.2 化學屏障
化學屏障由腸黏膜上皮分泌的黏液、消化液及腸腔內正常寄生菌產生的抑菌物質構成。黏液是由杯狀細胞產生和分泌的一種復雜的黏附液體,能夠保護上皮免受損傷并維持細胞水合作用。結腸隱窩是結腸中腸腺的結構,杯狀細胞位于結腸隱窩中。IBD 導致進行性腸隱窩破壞,使杯狀細胞減少并破壞腸黏液層。在腸道中,黏液的主要成分黏蛋白(mucin, MUC)以MUC2、MUC3 為主[30-34]。在活動期UC 期間結腸黏膜微生物的增加降低了負責產生MUC2 的杯狀細胞的分泌活性。除此之外,在UC中幾種不同的空間上不同的杯狀細胞表型發生了改變。MUC 翻譯后修飾異常,而MUC2 糖基化降低且結構改變并降解,這對黏蛋白表達水平有影響,并導致UC 患者結腸黏膜變薄。較薄的結腸黏膜導致腔內微生物成分與結腸上皮細胞的浸潤和接觸增加,從而驅動炎癥反應[35-38]。
2.3 生物屏障
腸黏膜生物屏障的實質是由腸道常駐菌群組成的一個相互依賴又相互作用的微生態系統。與健康人比較,IBD 患者腸道內具有抗炎能力的細菌減少,而炎癥性細菌增多[39]。此外,對患者和實驗動物的研究表明腸道細菌會促進與IBD 相關的慢性炎癥,其中雙歧桿菌與乳酸菌在維持腸道生物屏障功能中發揮著重要作用[40-42]。乳酸菌和雙歧桿菌屬能夠有效緩解IBD 的發生并降低疾病活動指數[43]。含有雙歧桿菌的益生菌能夠促進活動期UC患者的病情緩解,而不含雙歧桿菌的益生菌則沒有有益效果。與健康人群相比,IBD 患者腸道內的微生物多樣性較低且厚壁菌門豐度減少,雙歧桿菌水平降低[30,44-46]。共生細菌產生的SCFAs 可抑制組蛋白去乙酰化酶(histone deacetylase, HDAC)活性,在IBD 動物模型中均具有抗炎和維持上皮屏障功能的作用[47-49]。此外,微小核糖核酸(micro RNA,miRNA)也參與調節UC 的發病機制,包括調節免疫細胞、腸上皮屏障和腸道菌群與宿主之間的動態平衡。miR-18a*和miR-4802 可恢復具核梭桿菌對結直腸癌(colorectal cancer, CRC)化療誘導的凋亡基因表達、腫瘤凋亡和自噬體形成的抑制作用。Yu等[50]發現miR-18a*和miR-4802 通過阻斷具核梭桿菌誘導的自噬激活來調節具核梭桿菌介導的化療耐藥。具核梭桿菌通過激活Toll 樣受體(toll-like receptor, TLR ) 4/髓樣分化因子 ( myeloid differentiation factor 88, MyD88)通路抑制miR-18a*和miR-4802 的表達,降低miR-18a*和miR-4802 對其靶基因自噬相關蛋白7 重組蛋白(recombinant autophagy related protein 7, ATG7)和UNC-51 樣激酶1(UNC-51 like kinase 1, ULK1)ULK1 的抑制作用,導致自噬通路的激活和CRC 化療反應的改變。
2.4 免疫屏障
免疫屏障由腸黏膜淋巴組織(gut-associated lymphoid tissue, GALT)和腸道內分泌型免疫球蛋白A(secretory immunoglobulin A, SIgA)構成。GALT是IBD 發生的關鍵部位,患者的炎癥結腸富含與組織的淋巴樣結構相關的細胞和分子[51-55]。Perna等[56]研究發現谷氨酰胺能夠增加SIgA 的產生,SIgA 可以促進細菌在腸腔中的聚集,防止細菌在上皮表面的黏附從而避免細菌移位。當SIgA 進入腸道后能選擇性地包被革蘭氏陰性菌,形成抗原抗體復合物,阻礙細菌與上皮細胞受體相結合,同時刺激腸道黏液分泌并加速黏液層的流動,可有效阻止細菌對腸黏膜的黏附[56-57]。
單核吞噬細胞(巨噬細胞和樹突狀細胞)存在于腸道相關淋巴組織和腸道固有層,具有多種功能,包括吞噬抗原樣本和清除致病物質,以及產生細胞因子和維持上皮屏障功能。多項研究表明,腸道巨噬細胞釋放細胞因子和其他可溶性因子有助于維持組織穩態,向受損的結腸上皮傳遞再生信號,促進腸道再生反應[58-60]。IBD 患者炎癥部位有大量的樹突狀細胞,這些細胞激活CD4+和CD8+T淋巴細胞、自然殺傷(natural killer, NK)細胞等效應細胞,并抑制調節細胞的活化。樹突狀細胞在識別共生菌群后不會引發炎癥反應,而是通過主動誘導耐受性細胞因子和誘導調節性T 細胞(regulatory T cells, Tregs)分泌。因此,根據對抗原和細菌的識別,樹突狀細胞可以啟動促炎反應或者抗炎反應[21,53,61]。巨噬細胞通過識別病原體、吞噬微生物和調節腸道炎癥來控制腸道內環境平衡。機體發生IBD 時,巨噬細胞可以促進腸黏膜屏障愈合,并協調免疫反應的發展。根據激活狀態的不同,巨噬細胞分為代表促炎狀態的經典激活巨噬細胞(M1巨噬細胞)和代表抗炎狀態的交替激活巨噬細胞(M2 巨噬細胞)。M1 巨噬細胞的存在將局部巨噬細胞室的平衡轉變為促炎狀態。M1 巨噬細胞和上皮細胞共同培養后,上皮屏障的完整性將受到負面影響,破壞TJ 蛋白并誘導上皮細胞凋亡,從而推動IBD 的發展[62-65]。當組織發生炎癥時,體內的各種細胞,如巨噬細胞和間充質干細胞(mesenchymal stem cells, MSC)在炎性細胞因子的刺激下可以分泌腫瘤壞死因子誘導蛋白(tumor necrosis factor stimulated gene, TSG)-6,而TSG-6 能夠通過調節炎癥細胞因子和誘導M2 巨噬細胞標記物的表達來減輕腸道炎癥[66-71]。
3 氧化應激
哺乳動物細胞生存所必需的氧代謝產生活性氧(reactive oxygen species, ROS),在生理條件下對腸道穩態至關重要。然而,腸道炎癥通常伴隨ROS的過量產生。高水平的ROS 在細胞內產生氧化應激,體內氧化還原失衡,腸黏膜層損傷和上皮細胞凋亡,導致腸道中的細菌入侵,并刺激免疫反應和組織損傷[72-73]。
上皮細胞在宿主和各種生物之間的胃腸道內形成細胞屏障,這對于維持黏膜穩態是必不可少的。一旦腸道中產生過量的ROS,氧化應激可以通過改變蛋白質的功能、引起脂質過氧化來加速細胞損傷。ROS 含量超過一定閾值可以破壞細胞骨架蛋白,導致TJ 和上皮細胞通透性的改變,最終導致屏障破壞。通過這種方式,氧化應激使胃腸道發生炎癥反應,并引發IBD[74-76]。在小鼠結腸炎模型中,巨噬細胞或嗜中性粒細胞的缺失減少了ROS 和促炎細胞因子的產生,并減輕了腸道炎癥損傷。活躍的中性粒細胞和巨噬細胞以及胃腸道中的腸黏膜上皮細胞(intestinal epithelial cell, IEC)產生更多的ROS,這可以通過血液中氧化損傷的生物標志物8- 羥基脫氧鳥苷(8-hydroxy-deoxyguanosine, 8-OHdG)的水平來推斷。黏膜中炎癥細胞的浸潤進一步損害胃腸道組織,形成惡性循環[77-80]。
氧化應激可導致氧自由基代謝異常和細胞凋亡過度激活。此外,氧自由基會導致炎癥介質(如細胞因子和趨化因子)的釋放增加,這不僅會損傷上皮細胞,還會加劇氧化應激,導致腸道機械屏障的破壞。高水平的ROS 還會對脂質造成直接損害引起脂質過氧化,導致膜性能的損失。丙二醛(malondialdehyde, MDA)是脂質過氧化的標志[81]。Sengul Samanci 等[82]對IBD 患者眼部血管研究改變發現,與健康對照組相比,CD 組的MDA 水平最高,其次是 UC 組。抗氧化酶超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase, GPX) 和過氧化氫酶(catalase, CAT) 可以改善腸炎中的過氧化反應[27,73]。臨床數據已經證明IBD 患者三種SOD 亞型的不同黏膜表達:SOD2 表達顯著上調,而SOD1受影響較小,SOD3 表達降低。SOD 活性在UC 和CD 患者中也高于健康人群,當患者處于緩解期時,SOD 水平可以恢復正常。谷胱甘肽(glutathione,GSH)是一種可溶性抗氧化劑,高表達于細胞質、細胞核和線粒體中,能夠在腸黏膜中形成抗氧化屏障。GPX 可以維持GSH 水平,保護細胞免受過氧化損傷。對DSS 誘導的結腸炎小鼠給予藥物治療后可有效恢復小鼠結腸GSH、GPX 的表達,抑制促炎細胞因子的分泌并增強對結腸炎的抗氧化防御。此外,由IEC 分泌的GPX3 有助于提高腸黏膜中的細胞抗氧化活性。CD 患者的CAT 活性降低,在動物實驗中增強CAT 活性能夠降低結腸炎和結腸癌的發生率[83-84](圖1)。
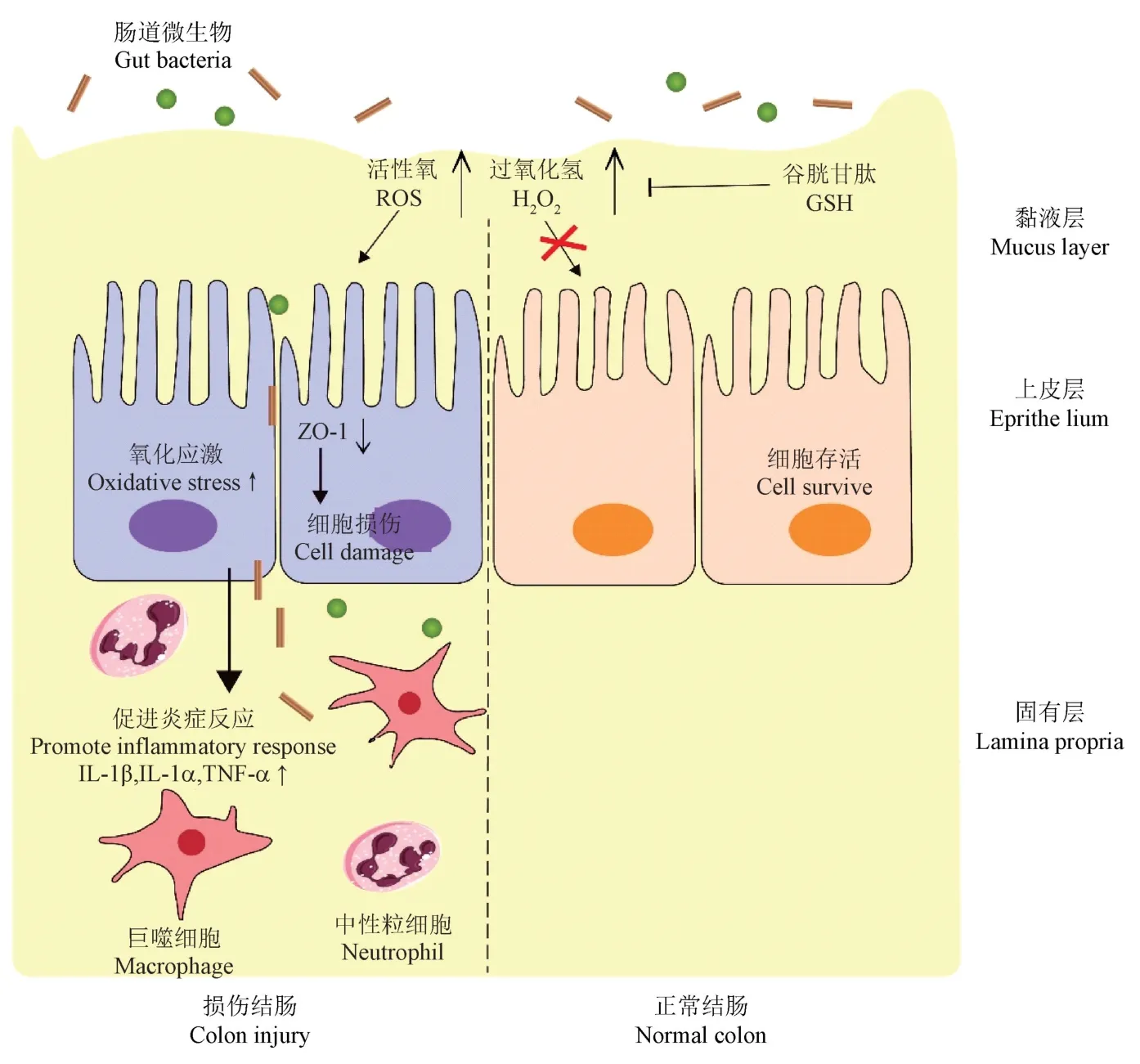
圖1 過量ROS 加劇腸道炎癥Figure 1 Excessive ROS aggravates intestinal inflammation
4 自噬
自噬是真核生物進化中的一個過程,細胞質物質可以在溶酶體內發生降解。自噬包括微自噬、分子伴侶介導的自噬和巨自噬三種類型。巨自噬簡稱為自噬,在維持腸道內環境穩定、調節腸道微生物群與先天免疫和適應性免疫之間的相互作用以及宿主防御腸道病原體方面起著關鍵作用。自噬功能障礙與包括IBD 在內的幾種人類疾病有關[85-90]。
在腸道上皮,自噬通過促進溶酶體介導的人封閉蛋白2(claudin-2) 降解調節上皮屏障功能。Claudin-2 是腸上皮中一種重要的水合小陽離子選擇性成孔緊密連接蛋白,失活后可減輕小鼠結腸炎癥狀,這表明claudin-2 是抗腸道炎癥的潛在靶點。功能失調性自噬可以導致claudin-2 水平升高,增加腸道通透性和宿主對管腔抗原的接觸,從而導致持續的炎癥反應發生[91-92]。自噬能夠通過促進線粒體穩態,抑制TNF 誘導的IEC 凋亡,維持腸黏膜屏障的完整性[93]。有大量文獻闡明了自噬缺陷與IBD 之間的牢固聯系。最常見的突變體自噬相關16 樣蛋白1 (autophagy related 16-like protein 1,ATG16L1)中的Thr 300-to-Ala(T300A)使該蛋白成為半胱氨酸-天冬氨酸蛋白酶(cystein-asparate protease, Caspase)-3 依賴裂解的靶點,增加了CD的發生風險[94-96]。T300A 突變中低表達或敲除ATG16L1 能夠增強小鼠對共感染病毒的敏感性,同時增強小鼠對DSS 誘導的腸損傷的炎癥反應。ATG蛋白能夠維持細胞器穩態,在小鼠和人體內促進腸道屏障對代謝和恢復免疫介導損傷的功能。潘氏細胞特異性缺失多個ATG 基因,與剪切型X-盒結合蛋白1(spliced X-box binding protein 1, Xbp1)一起缺失時,會導致腸道炎癥[95]。內質網應激期間缺陷性自噬使內質網核心信號 1 (endoplasmic reticulum to nucleus signalling 1, ERN-1)聚集物清除障礙,導致內質網應激增加和小鼠自發性CD 樣回腸炎[97-99]。
在樹突狀細胞中,自噬降解細胞內病原體,參與抗原向T 細胞提呈過程,誘導適應性免疫反應發生。缺陷性自噬導致細菌清除和抗原提呈受損,從而損害T 細胞活化。T 細胞代謝通過多種機制對效應細胞發揮強大的抑制作用,包括分泌抗炎細胞因子、溶解效應細胞和促進組織修復以防止腸道炎癥的發展[100]。自噬的改變會損害T 細胞的代謝轉變和增殖,導致CD4+和CD8+T 細胞數量減少,CD8+T細胞發育受損,Tregs 存活率下降,輔助性T 細胞(T helper cells, Th)2 和Th17 反應增加[101-103]。
研究發現在IBD 中,線粒體自噬對腸道微環境具有抗炎作用。CD 相關的ATG16L1T300A 變異能夠導致線粒體自噬缺陷、ROS 積累、增加IL-1β 的生成、促炎巨噬細胞的極化,從而減少細菌殺傷。自噬缺陷的巨噬細胞中細胞凋亡的易感性增加與細胞ROS 過度產生有關。在腸干細胞中,自噬能夠限制ROS 積累,抑制干細胞分化,促進上皮細胞再生。缺陷性自噬能夠導致ROS 積累和上皮再生受損,自噬相關蛋白的丟失通常與功能失調的線粒體和ROS 的積累增加有關,并導致細胞壞死。當自噬功能失常時,細胞的生物能量狀態達到絕對最小值,而膜通透性增加的線粒體不再被清除,迫使細胞發生凋亡[104]。對IBD 小鼠模型中巨噬細胞的評估發現,由于IL-10 或IL-10 受體的基因缺失導致線粒體自噬減少,炎癥小體激活和腸道炎癥發生,加重ROS 誘導的細胞凋亡。除了IL-1β 分泌增加,潘氏細胞異常還與免疫相關GTPase 家族M 蛋白(immunity-related GTPase family M protein, IRGM)-1缺失的小鼠腸道細胞線粒體自噬缺陷有關。線粒體自噬是選擇性清除老化、受損、功能失調或其他不必要線粒體的機制。在IBD 發展過程中,線粒體自噬被激活并清除受損線粒體,從而更有效地減輕炎癥過程中氧化應激反應[105-108]。
5 適應性免疫
適應性免疫系統包括T 淋巴細胞和B 淋巴細胞,并誘導對某些抗原的特異性記憶反應。白細胞介素參與防御腸道感染,調節適應性免疫,在淋巴組織的形成和體內平衡以及組織再生中發揮重要作用。
5.1 T 細胞及其細胞因子
5.1.1 輔助性T 細胞
目前,Th17 被認為是IBD 的主要致病因素。IBD 患者腸黏膜中存在大量Th17 細胞浸潤,炎癥組織中釋放IL-17 和Th17 相關細胞因子的細胞數量也較正常組織增加[105,109]。與Th17 細胞相比,Treg細胞不僅能抑制自身免疫性疾病的發生,還能控制腸道炎癥。UC 小鼠模型中小鼠外周血Treg 細胞降低,并通過增加IL-10 和轉化生長因子(transforming growth factor, TGF)-β 的分泌,顯著改善小鼠腹瀉癥狀。Treg 細胞表達叉頭狀家族轉錄因子(forkhead box, Fox)p3 并產生抗炎細胞因子IL-10 和TGF-β,從而發揮抗炎作用[61,110]。Th17 細胞促進腸道炎癥的發生,Treg 細胞抑制腸道炎癥。Th17/Treg 細胞失衡是影響IBD 發生發展的重要因素,這種平衡主要受到T 細胞受體信號、共刺激信號、細胞因子、膽汁酸代謝物、腸道微生物群等因素的影響[21,111]。
5.1.2 細胞因子
研究發現紊亂的細胞因子調節會破壞腸道穩態,而IBD 是細胞因子通路缺乏或激活增強的結果。在IBD 患者結腸黏膜中能夠檢測出高水平的IL-1β 和IL-18 活性[112-113]。IL-6 和TNF 也在炎癥反應中起主導作用。IL-6 是一種多效性細胞因子,能夠激活結腸上皮細胞中的信號轉導和轉錄激活因子(signal transduction and activator of transcription,STAT),并與其可溶性受體一起在IBD 發展過程中增加。TNF 能夠導致IL-1β、IL-6 和IL-23 的表達增加,加速IBD 病情惡化[55,114]。此外,IBD 患者中TNF 可溶性受體的血清濃度顯著增加[53]。與健康人群相比,IBD 患者血清中的IL-17 和IL-23 水平顯著升高,血清水平與疾病嚴重程度和持續時間相關,可以用作反映IBD 活動性的生物標志物[115-118](表1)。

表1 IBD 主要細胞因子作用靶點Table 1 Main cytokine targets of IBD
5.2 B 細胞及調節性B 細胞
B 細胞是骨髓來源的多能干細胞,機體發出的外源信號刺激B 細胞后,可使其產生促炎細胞因子或抗炎細胞因子,參與免疫調節和炎癥反應。調節性B 細胞(regulatory B cells, Bregs)是一類可以抑制免疫應答并分泌IL-10 的B 細胞亞群,IL-10 的保護功能已經在許多結腸炎模型中得到證實,Breg 細胞可通過直接接觸和間接接觸來發揮其免疫效應[124-126]。盡管T 細胞系統在有關IBD 發病機制和治療方法的研究中占主導地位,但新的數據表明B細胞譜系在IBD 中也發揮了作用。Breg 細胞通過分泌IL-10 促進T 細胞轉化為Treg 細胞,并促進Foxp3 的表達。此外,B 細胞通過產生上皮細胞特異性自身抗體加重UC 病情。最近研究表明,DSS誘導結腸炎小鼠結腸Breg 細胞持續減少,提示慢性腸道炎癥導致的黏膜B 細胞群體持續改變可能參與IBD 的發病[127-128]。在大腸桿菌刺激B 細胞后,多效調節細胞因子IL-6 的分泌上調,促進Breg 細胞分化和IL-10 的產生[129]。UC 患者外周血和腸組織中Breg 細胞明顯降低,同時伴有較低的血清IL-10水平[128,130-131]。Breg 細胞和Treg 細胞在體內的增加,建立了免疫同穩狀態。綜合上述,這兩個關鍵的調節細胞群體可能會形成強大的抗炎環境,能夠抑制各種自身免疫性疾病的炎癥[132]。
6 結語與展望
炎癥性腸病是慢性復發性腸道炎癥,已經成為一個世界性健康問題。盡管IBD 的病因學仍不清楚,但它涉及遺傳、環境、微生物群與免疫反應多因素的相互作用。目前常見臨床藥物有水楊酸類、糖皮質激素類、免疫抑制劑類等,但長期或過劑量使用時,引起的不良反應較多,耗費的時間與經濟壓力也較大,許多患者不能維持治療。為了找到新的治療策略來改善患者的治療,理解IBD 的發病機制是至關重要的。遺傳學相關的基因位點的數量和多樣性的增加給研究IBD 如何影響易感個體的免疫和炎癥帶來了重大突破。腸黏膜屏障在維持腸道穩態以及宿主免疫系統的發育和激活中也起著重要作用。最新研究進展揭示了腸黏膜屏障破壞和腸道菌群失調,與IBD 的發病機制密切相關。隨著研究的深入,自噬影響腸上皮細胞穩態和恢復的各種方式,自噬缺陷能夠通過破壞腸道穩態、影響腸道菌群組成、損害細胞內細菌清除和增強腸道炎癥反應等途徑對IBD 的病程產生強烈影響。此外,氧化應激被認為是IBD 發生發展和嚴重程度的潛在致病和關鍵因素,活性氧生成增加和抗氧化活性降低進一步促進IBD 的發展。越來越多的研究使我們對IBD 發病機制的理解取得了前所未有的進展,個體的遺傳因素和外部環境、腸黏膜屏障功能、氧化應激、自噬功能異常和適應性免疫反應各方面都參與了IBD 的發病過程,然而,不同IBD 患者亞群的發病機制、疾病特征和腸道炎癥驅動因素仍存在未知的問題,有待進一步探討。未來的研究希望能夠進一步闡明和整合微生物組和環境對免疫反應的影響,進一步對基因組、環境因素、腸道菌群以及免疫反應進行綜合分析,通過高基因組方法、環境變化調查、腸道菌群的分子分析以及對先天和適應性免疫反應之間的相互作用的更全面理解,并且有必要進一步了解腸道菌群如何調節先天和適應性免疫反應的機制和途徑。

