戊糖乳桿菌發酵對花生不同蛋白組分結構的影響
李玉蝶,李玟君,汪海燕,宋青云,龐子皓,肖一郎,汪 超,李 瑋
(湖北工業大學生物工程與食品學院,湖北省食品發酵工程技術研究中心,湖北 武漢 430060)
花生蛋白是優質的可食用植物蛋白源[1],其營養價值與動物蛋白相近。我國對食物蛋白研究相對滯后,尤其在花生蛋白產品制備工藝及其功能性研究方面起步較晚,大部分花生蛋白產品只能在低端市場徘徊,無法與國外產品形成競爭優勢。因此,有必要改善花生蛋白的功能特性,彌補花生蛋白功能性的欠缺,進一步拓寬花生蛋白在食品工業上的應用。
花生蛋白經過堿溶酸沉或超濾膜法等制得的高純度產品即為花生分離蛋白(peanut protein isolate,PPI),蛋白含量較高。花生蛋白由90%的鹽溶性蛋白和10%的水溶性蛋白組成,而鹽溶蛋白中則含有75%的花生球蛋白(14S)、25%的伴花生球蛋白(7.8S和2S)[2]。其中,花生球蛋白由3 個酸性亞基和3 個堿性亞基組成,具有緊密的球狀結構,活性基團包裹于分子內部,伴花生球蛋白僅有一個亞基[3]。花生蛋白的結構變化影響花生蛋白的功能特性,尤其是鹽溶性的球蛋白和伴球蛋白,二者的結構直接影響花生蛋白的熱聚集和凝膠特性。目前,花生蛋白組分改性研究主要集中在超聲波及酶處理等復合手段[4],與傳統方法相比,微生物發酵法更溫和、廉價、安全和環保,特別是功能型益生菌。戊糖乳桿菌(Lactiplantibacillus pentosus)作為優質乳酸菌,可發酵高產乳酸及更多的酶系來水解蛋白,改善發酵微環境,賦予花生蛋白更好的營養與風味[5-6],極具應用潛力。
本研究通過戊糖乳桿菌對提取出的PPI、花生球蛋白、伴花生球蛋白進行發酵處理,對比發酵處理前后花生不同組織蛋白分子結構、微觀結構及熱特性的變化規律,以期為研究乳酸菌改善花生蛋白聚集行為提高花生蛋白產品在蛋白基料中的應用提供參考。
1 材料與方法
1.1 材料與試劑
戊糖乳桿菌由實驗室從魚肉中自行分離,經16S rRNA鑒定為戊糖乳桿菌,于-80 ℃、含50%甘油凍存管中保存;低溫脫脂花生粕 青島長壽食品有限公司。
MRS液體培養基(蛋白胨1%、酵母粉0.5%、檸檬酸氫二銨0.2%、葡萄糖2%、乙酸鈉0.3%、磷酸氫二鉀0.2%、硫酸鎂0.058%、硫酸錳0.025%、牛肉膏1%、吐溫800.1%);其余試劑均購自國藥集團化學試劑有限公司。
1.2 儀器與設備
MLS-3781L-PC高壓蒸汽滅菌鍋 上海醫療核子儀器廠;CR21N高速冷凍離心機、F-7000熒光分光光譜儀日本日立公司;ZWYR-D2403恒溫培養振蕩器 上海智城分析儀器制造有限公司;ZLGJ-12真空冷凍干燥機鄭州科旺達生物儀器有限公司;Nano ZS+MPT-2納米粒徑及電位分析儀 英國Malvern公司;Vertex 70傅里葉變換紅外光譜(Fourier transform infrared spectrometer,FTIR)儀 德國Bruker公司;DSC1差示掃描量熱儀(differential scanning calorimeter,DSC)瑞士Mettler-Toledo公司;JSM-6390LV掃描電子顯微鏡 日本電子公司。
1.3 方法
1.3.1 原料制備
PPI的制備方法參考丁玲等[7]的方法,將低溫脫脂花生粕與0.02 mol/L pH 8.5的磷酸鹽緩沖液(phosphate buffered saline,PBS)按質量比1∶10混合。60 ℃攪拌2 h,4 000 r/min離心20 min,取上清液用1 mol/L HCl溶液調至pH 4.5,靜置30 min后再次離心(4 000 r/min、20 min),收集沉淀。加蒸餾水復溶后用1 mol/L NaOH溶液調節pH值到7.0,在4 ℃透析48 h,冷凍干燥后于4 ℃冰箱保存備用。花生球蛋白、伴球蛋白的制備參考封小龍[8]的方法略有改動,將制得的PPI溶于pH 7.10.4 mol/L磷酸緩沖溶液中(料液比為1∶10),常溫攪拌混勻1 h后,8 000 r/min離心30 min,取上清液置于4 ℃冰箱冷沉4 h,然后在4 ℃、8 000 r/min離心30 min。沉淀經冷凍干燥得花生球蛋白,上清液調節pH值至4.5,4 500 r/min離心20 min后取沉淀冷凍干燥得伴花生球蛋白,4 ℃保存備用。
向各組發酵原料(蛋白與無菌水質量比為1∶14,pH 6.3)中接入2.5%的戊糖乳桿菌,置于35 ℃搖床200 r/min密閉發酵48 h;分別取發酵后PPI發酵液、花生球蛋白發酵液、伴花生球蛋白發酵液8 000 r/min離心20 min后,收集上清液,真空冷凍干燥,得到發酵后的PPI(FPPI)、花生球蛋白、伴花生球蛋白,4 ℃保存備用。
1.3.2 蛋白質含量的測定
采用凱氏定氮法測定各蛋白組分的含量。根據發酵前后蛋白組分質量差的百分比計算蛋白損失率。
1.3.3 游離巰基含量測定
參照Beveridge等[9]的方法略有改進,分別稱取60 mg樣品溶于10 mL Tris-Gly標準緩沖溶液中(pH 8.0),渦旋混勻后在25 ℃水浴條件下反應1 h,室溫4 500 r/min離心15 min。取2 mL上清液于試管中,向其中加入50 μL Ellman試劑,渦旋混勻后室溫靜置反應5 min,通過紫外-可見分光光度計于412 nm波長處測定樣品溶液吸光度A412nm。用試劑緩沖液作空白對照,按下式計算游離巰基含量:
式中:C為樣品溶液質量濃度/(mg/mL)。
1.3.4 Zeta電位及平均粒徑測定
參考Pi Xiaowen等[10]方法,稱取0.01 mg樣品溶解于1 L 0.01 mol/L pH 7的PBS中,溶液過0.45 μm水性濾膜后,使用納米粒度及電位分析儀測定粒徑分布和Zeta電位,測定溫度25 ℃。
1.3.5 FTIR分析
參考耿軍鳳等[11]方法并略作修改,選用衰減全反射(attenuated total reflection,ATR)附件,取適量凍干樣品薄片置于ATR附件上掃描,設定參數為掃描次數32,掃描范圍4 000~500 cm-1,分辨率為4 cm-1。α-螺旋、β-折疊、β-轉角和無規卷曲對應譜帶的波數范圍分別為1 650~1 660、1 610~1 640、1 660~1 700 cm-1和1 640~1 650 cm-1。各二級結構相對含量通過相應峰的面積計算。
1.3.6 表面疏水性測定
根據賈潤紅[12]方法并稍作修改,分別用PBS(0.01 mol/L、pH 7.0)配制質量濃度為0.05、0.1、0.2、0.5、1 mg/mL的蛋白溶液4.0 mL,加入20 μL 8 mmol/L的1-苯胺基-8-萘磺酸溶液(pH 7.4)混勻后迅速使用熒光分光光度計進行測定。激發波長為390 nm,掃描發散光譜范圍為450~650 nm,加速電壓為600 V,狹縫寬度5 nm。以蛋白質量濃度對熒光強度作圖,直線的斜率即為蛋白質的表面疏水性。
1.3.7 熒光光譜測定
參考廖鈺等[13]方法并稍作修改,用pH 70.01 mol/L PBS配制質量濃度為1 mg/mL的蛋白溶液,在25 ℃使用熒光分光光度計對溶液進行光譜掃描,使用光程為1 cm的石英比色皿,測試條件:激發波長290 nm,掃描發散光譜范圍300~400 nm,狹縫寬度5 nm,掃描速率1 200 nm/min。
1.3.8 掃描電子顯微鏡觀察
將樣品粘貼到干凈的樣品臺上,對樣品進行真空噴金鍍膜處理后用掃描電子顯微鏡觀察,放大倍數為1 000 倍。
1.3.9 熱特性測定
參考嚴永紅等[14]方法并稍作修改,采用DSC測定。取4 mg樣品于樣品盤中密封,以空坩堝作為空白對照,設定升溫速率10 ℃/min,掃描間隔25~150 ℃。采用TA-60WS軟件讀取DSC譜圖中花生蛋白樣品的變性溫度(Td)和總變性焓(ΔH)。
1.4 數據處理與分析
每個處理組進行3 次平行實驗。采用Origin 9.6、Excel 2019和SPSS 25.0等軟件對實驗數據進行處理,P<0.05表示差異顯著。
2 結果與分析
2.1 花生粕蛋白質含量及戊糖乳桿菌發酵后蛋白損失率
如表1 所示,花生粕中PPI 得率為(88.57±5.16)%,其中花生球蛋白質量分數為(46.74±2.09)%,伴花生球蛋白質量分數為(40.29±3.22)%,與杜寅等[15]的研究結果一致,證明蛋白的分離效果較好。比較發酵處理后各蛋白的損失率發現,花生球蛋白的損失率低于PPI和伴花生球蛋白,可能是由于戊糖乳桿菌發酵過程分泌乳酸同時產生了多種蛋白酶系,利用蛋白產生了更多的氨基酸及小分子蛋白肽。花生球蛋白活性基團被球狀包埋減少了結合位點,表現出比伴花生球蛋白更強的穩定性[3]。

表1 花生粕中不同蛋白含量及發酵后蛋白含量的損失率Table 1 Contents of different protein components in peanut meal and their loss rates after fermentation
2.2 戊糖乳桿菌發酵對不同花生蛋白組分游離巰基含量的影響
如圖1所示,戊糖乳桿菌發酵后花生球蛋白游離巰基含量較發酵前增加了79.83%,而PPI和伴花生球蛋白較發酵前分別降低48.46%和55.15%,且發酵后伴花生球蛋白游離巰基含量的減少量比PPI多6.69%。戊糖乳桿菌發酵處理后球蛋白內部亞基結構充分展開,包埋在分子內部的巰基更多地暴露到分子表面,從而導致蛋白游離巰基含量增加[16]。隨著發酵微環境的改變,球蛋白內部基團更活躍,蛋白結構展開程度增大,而PPI、伴花生球蛋白發酵后游離巰基含量降低是由于在發酵過程中,新展開的蛋白界面不穩定,暴露出的巰基與氧氣結合形成了二硫鍵,從而使表面巰基含量降低[17-18]。結果表明,發酵處理可在一定程度上促使花生蛋白空間構象發生改變,生成聚集體,蛋白質分子質量增加,形成凝膠網絡。
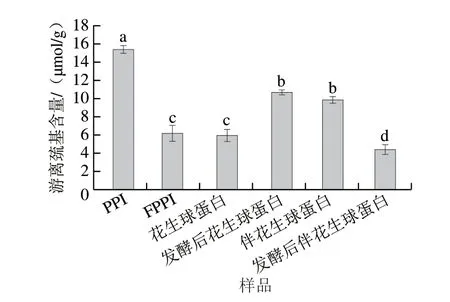
圖1 戊糖乳桿菌發酵對不同花生蛋白組分游離巰基含量的影響Fig.1 Effect of L.pentosus fermentation on free sulfhydryl contents of different peanut protein components
2.3 戊糖乳桿菌發酵對不同花生蛋白組分Zeta電位及平均粒徑的影響
如表2所示,各花生蛋白樣品的Zeta電位均為負值,是由于其pH值高于等電點,蛋白表面羧基發生解離[19]。與發酵前相比,發酵處理后PPI和伴花生球蛋白組分的Zeta電位絕對值分別下降了54.77%、51.75%。可能是由于發酵處理使蛋白質結構展開,部分去折疊后形成的聚集體阻礙了蛋白質羧基解離,促使更多內部帶正電荷的氨基酸殘基暴露,與蛋白質表面的負電荷中和[20],蛋白間靜電相互作用減弱,使花生蛋白組分的穩定性增加。
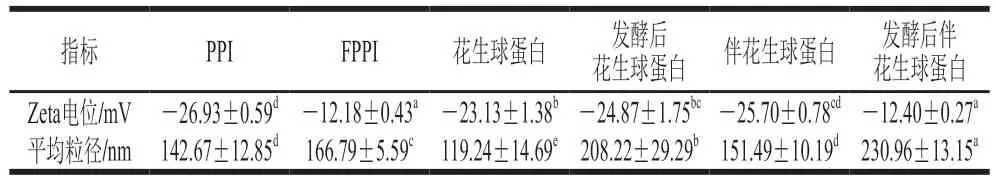
表2 戊糖乳桿菌發酵對不同花生蛋白組分Zeta電位及平均粒徑的影響Table 2 Effect of L.pentosus fermentation on zeta potential and average particle size of different peanut protein components
如表2和圖2所示,發酵處理后不同花生蛋白組分的粒徑峰值均向右移動,與發酵前相比,發酵后PPI、花生球蛋白、伴花生球蛋白平均粒徑分別增加了16.91%、74.62%、52.46%,這可能是由于發酵處理增強了蛋白質分子間的相互作用,使蛋白質分子發生聚集。已有研究表明,蛋白分子平均粒徑增大會增加分子表面積,在凝膠形成過程中可能有利于蛋白分子的聚集,從而提高凝膠的強度[21],故發酵處理產生的分子聚集現象對各花生蛋白組分的凝膠特性具有積極影響。
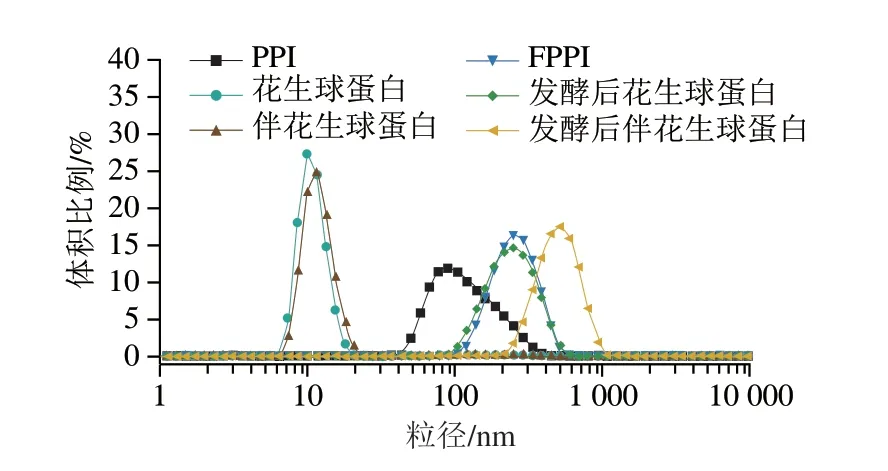
圖2 戊糖乳桿菌發酵對不同花生蛋白組分粒徑分布的影響Fig.2 Effect of L.pentosus fermentation on particle size distribution of different peanut protein components
2.4 戊糖乳桿菌發酵對不同花生蛋白組分二級結構的影響
如圖3所示,發酵處理后各花生蛋白組分FTIR光譜中特征峰位置均發生偏移,且峰強度也有所增加,說明發酵處理改變了各花生蛋白二級結構。如圖4所示,與發酵前相比,戊糖乳桿菌發酵后PPI、花生球蛋白、伴花生球蛋白β-折疊相對含量分別降低了15.42%、5.41%、5.31%;PPI、伴花生球蛋白α-螺旋相對含量分別增加了12.23%、8.15%,花生球蛋白α-螺旋相對含量降低了3.35%。PPI和花生球蛋白發酵后β-轉角和無規卷曲相對含量均增加,花生伴球蛋白無明顯變化;這表明發酵處理可能使各花生蛋白組分由β-折疊轉化為β-轉角、α-螺旋和無規卷曲,蛋白分子從有序逐漸變為無序,蛋白原始構象展開。這可能是由于戊糖乳桿菌發酵過程中維系二級結構的作用力氫鍵被破壞,導致蛋白變性以及隨后的聚集[22]。
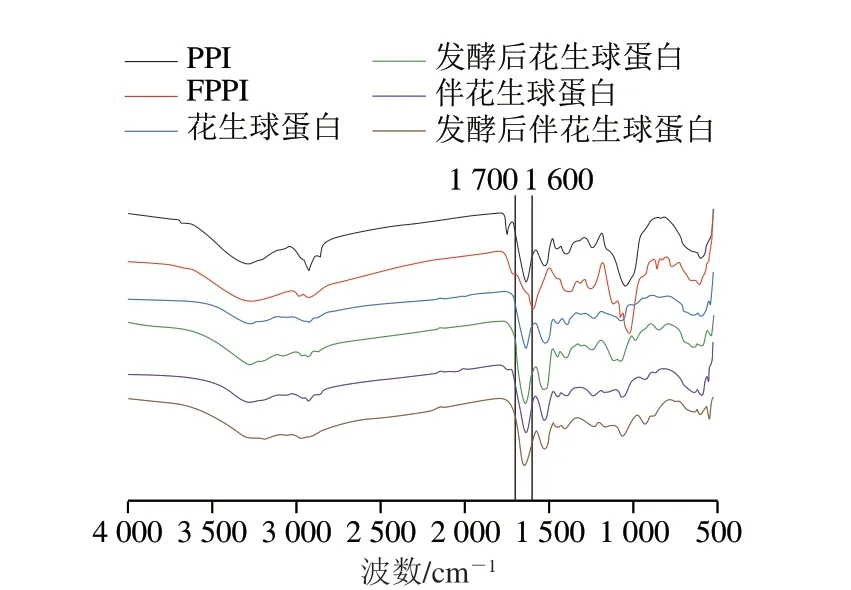
圖3 發酵前后不同花生蛋白組分FTIR光譜變化Fig.3 Changes in FTIR spectra of different peanut protein components before and after fermentation
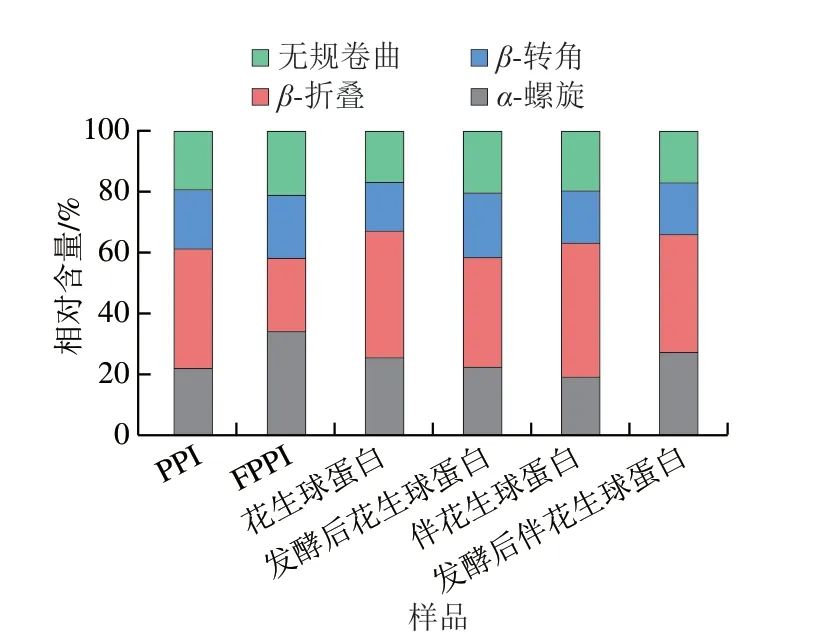
圖4 戊糖乳桿菌發酵對不同花生蛋白組分二級結構的影響Fig.4 Effect of L.pentosus fermentation on the secondary structures of different peanut protein components
2.5 戊糖乳桿菌發酵對不同花生蛋白組分表面疏水性的影響
蛋白質的表面疏水性主要取決于蛋白的去折疊程度及疏水基團的暴露程度[23]。如圖5所示,與發酵前相比,發酵處理后的花生球蛋白表面疏水性增加了63.19%,而PPI、伴花生球蛋白表面疏水性分別降低了83.30%、80.66%。花生球蛋白表面疏水性的增加可能是由于戊糖乳桿菌發酵使球蛋白分子在發酵過程中結構展開,內部更多疏水基團發生暴露;PPI及伴花生球蛋白表面疏水性降低是由于在發酵過程中,展開的蛋白質分子又在疏水相互作用和二硫鍵作用下通過共價交聯形成聚集體,掩埋了部分疏水基團,使蛋白表面疏水性降低[24-25]。與花生球蛋白及伴花生球蛋白相比,PPI表面疏水性降低幅度最大,可見PPI分子間重折疊發生了更多的交聯反應。綜上,戊糖乳桿菌發酵處理可以促進花生蛋白分子間親水相互作用,疏水性相互作用減弱,大量水分結合到蛋白表面。
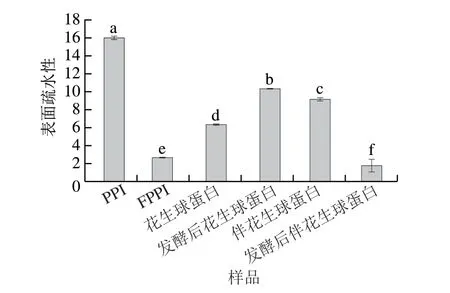
圖5 戊糖乳桿菌發酵對不同花生蛋白組分表面疏水性的影響Fig.5 Effect of L.pentosus fermentation on the surface hydrophobicity of different peanut protein components
2.6 戊糖乳桿菌發酵前后不同花生蛋白組分熒光光譜變化
如圖6所示,發酵前PPI、花生球蛋白、伴花生球蛋白最大發射波長(λmax)分別為(342.1±0.71)、(330.3±0.14)、(340.4±0.57)nm,戊糖乳桿菌發酵后三者λmax分別為(354.9±0.42)、(344.4±0.00)、(352.1±0.42)nm,結果表明,發酵處理后各花生蛋白組分λmax均發生紅移,蛋白結構展開,更多的Trp/Tyr殘基和疏水基團暴露在溶劑中,增加了微環境的非極性。與PPI及伴花生球蛋白相比,花生球蛋白紅移幅度分別增大1.3 nm和2.4 nm,說明花生球蛋白分子構象的變化程度最大[26];此外,發酵處理后各花生蛋白組分的熒光強度均顯著降低,可能是由于發酵過程中戊糖乳桿菌與花生蛋白分子間相互作用增強,誘導蛋白質肽鏈重新折疊卷曲,使發酵后各組分花生蛋白發生聚集導致熒光猝滅現象產生[27-28]。其中,發酵PPI的熒光強度最低,分子間碰撞產生更多交聯反應,引起更多的熒光猝滅,這與表面疏水性的結果一致。

圖6 發酵前后不同花生蛋白組分熒光光譜的變化Fig.6 Changes in fluorescence spectra of different peanut protein components before and after fermentation
2.7 戊糖乳桿菌發酵對不同花生蛋白組分微觀結構的影響
如圖7所示,發酵前花生蛋白大都呈球形顆粒狀[29];發酵后各花生蛋白組分結構形態明顯改變,球形結構被破壞,蛋白分子呈現扁平狀,可見多層蛋白質堆疊與聚集,樣品呈碎片化和斷裂,蛋白空間構象發生改變。這可能是由于發酵過程中,各組分花生蛋白受到戊糖乳桿菌發酵的影響,蛋白結構展開并發生分子間交聯所致。

圖7 戊糖乳桿菌發酵對不同花生蛋白組分微觀結構的影響Fig.7 Effect of L.pentosus fermentation on the microstructure of different peanut protein components
2.8 戊糖乳桿菌發酵對不同花生蛋白組分熱特性的影響
如圖8和表3所示,戊糖乳桿菌發酵處理對各花生蛋白熱穩定性的影響具有明顯差異。與發酵前相比,戊糖乳桿菌發酵處理后PPI的Td升高了4.36 ℃,花生球蛋白Td升高了17.83 ℃,伴花生球蛋白Td升高了7.31 ℃,結果表明發酵處理可增加各組分花生蛋白的熱穩定性,其中發酵后的花生球蛋白比PPI、伴花生球蛋白Td增幅大19.54%、14.75%,表明花生球蛋白Td增幅最大,熱穩定性受到的影響最為顯著。發酵前Td:PPI>花生球蛋白>伴花生球蛋白;發酵處理后Td:花生球蛋白>PPI>伴花生球蛋白,說明伴花生球蛋白對熱最敏感,花生球蛋白的熱穩定性比伴花生球蛋白好,此研究與杜寅[30]的研究結果一致。如表3所示,發酵后各花生蛋白ΔH為負值,呈降低趨勢,說明發酵處理后花生蛋白分子間作用力增加,聚集程度增加,與粒徑結果研究一致。
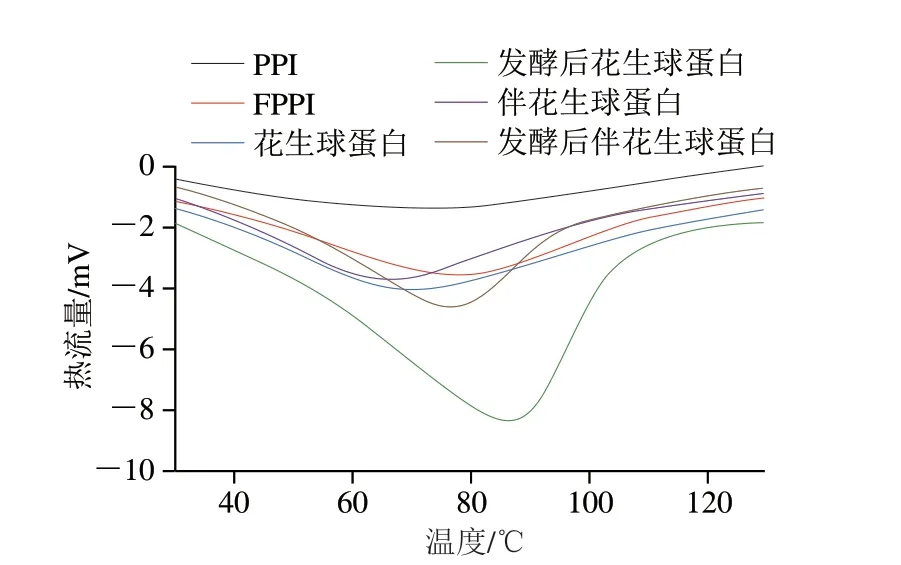
圖8 戊糖乳桿菌發酵對不同花生蛋白組分熱特性的影響Fig.8 Effect of L.pentosus fermentation on the thermal properties of different peanut protein components

表3 發酵前后不同花生蛋白組分的Td及ΔHTable 3 Td and ΔH of different peanut protein components before and after fermentation
3 結論
戊糖乳桿菌發酵可顯著提升花生球蛋白、降低PPI與伴花生球蛋白的游離巰基含量、表面疏水性。發酵后伴花生球蛋白游離巰基含量的減少量比PPI多6.69%,花生球蛋白游離巰基含量的提升有利于熱凝膠的形成,在花生蛋白替代動物蛋白形成凝膠產品的應用方面具有促進作用。發酵后各花生蛋白組分的粒徑和Zeta電位值顯著提升,蛋白熒光λmax紅移,表明花生蛋白的聚集發生改變,與PPI、伴花生球蛋白相比,花生球蛋白熒光掃描λmax紅移幅度超過1.3 nm和2.4 nm。證明花生球蛋白比PPI、伴花生球蛋白的鏈長更易發生延展效應,在蛋白修飾方面更具潛力。結合熱特性和掃描電子顯微鏡分析發現花生球蛋白在發酵后結構展開程度最大、熱穩定性更高,發酵后的花生球蛋白比PPI、伴花生球蛋白Td增幅大19.54%、14.75%,證明戊糖乳桿菌更易促進花生球蛋白的分子改性,并對花生蛋白的凝膠改性起到良好的促進作用。

