濃香型大曲貯存期微生物群落演替及代謝產物的變化機制
徐千惠,饒家權,鄒永芳,張 明,羅惠波,3,黃 丹,3,*
(1.四川輕化工大學生物工程學院,四川 自貢 643000;2.舍得酒業股份有限公司,四川 射洪 629000;3.釀酒生物技術及應用四川省重點實驗室,四川 自貢 643000)
大曲作為糖化發酵劑,為白酒釀造提供了重要且豐富的菌系、酶系和物系,即為后續窖內酒醅發酵提供微生物,將原料降解成小分子物質的水解酶或催化酯類物質合成的酯化酶,以及白酒風味物質或其前體物[1]。大曲生產過程通常包括1 個月左右的主發酵期和2~6 個月左右的貯存期[2]。在主發酵期,來自于制曲原料及環境的微生物生長代謝,通過開關門窗、揭蓋草簾進行工藝調控,其間,溫度、濕度等不斷變化,微生物菌群發生演替,同時積累了豐富的酶系以及風味物質[3]。而在貯存期,大曲大多是在自然條件下堆積存放[4],期間水分、酸度和淀粉的變化相對穩定[5],初級、次級代謝過程以及各種微生物和代謝物發生復雜變化[6]。目前對大曲質量的判斷主要依賴于長期積累的生產經驗和部分理化性質,這使得大曲的生產質量充滿不穩定性[2]。近年來,關于大曲主發酵期間微生物群落及功能變化機制的研究非常活躍[7-9],而貯存期大曲微生物群落結構、酶系以及風味物質變化也越來越受到關注。Fan Guangsen等[2]通過高通量測序技術發現大曲在通風良好、干燥的貯存環境中微生物會進一步相互作用,達到優化微生物群落的效果,同時發現清香型大曲經貯存后酯化力和發酵力增加,而液化力和糖化力變化不大。He Muwen等[10]采用頂空固相微萃取-氣相色譜-質譜(headspace-solid phase microextraction-gas chromatography mass spectrometry,HS-SPME-GC-MS)聯用技術測定貯存期大曲揮發性代謝產物,發現風味物質種類逐漸積累,在貯存3 個月含量達到最高,而Zhang Yuandi等[11]發現貯存使揮發性化合物的種類和含量有所下降。總之,現有研究顯示貯存過程對大曲質量具有重要影響,但關于貯存期大曲微生物群落結構及代謝產物變化機制的研究鮮有報道。
對于微生物群落的演替機制,人們廣泛認可隨機性過程和確定性過程同時影響菌群的組裝過程[12]。Tan Yuwei等[13]采用構建零模型的方法評估了白酒發酵過程中微生物群落的組裝模式,結果顯示微生物群落的演替既受確定性因素(溫度、有機酸和乙醇)的驅動,也受隨機性過程的驅動。Xu Min等[14]發現微生物的生態位差異也影響著群落的構建過程。大曲代謝物的變化被發現與微生物群落的演替緊密相關[6]。Gan Shuheng等[4]通過宏基因組測序獲得了糖化力、液化力與桿菌綱、曲霉屬、羅山松屬和散囊菌目間的正相關關系。He Muwen等[10]采用相關性網絡分析揮發性化合物與微生物之間的關聯,結果顯示,曲霉屬、根毛霉屬、芽孢桿菌屬、橫梗霉屬與酯類的形成呈正相關。
對于固態發酵基質而言,熱量、水和氧氣難以傳遞,Zhang Yuandi等[11]發現同一塊大曲不同部位的微生物群和揮發性物質具有不同的分布特征,因此大曲曲心和曲皮的微生物生長代謝存在差異。本研究旨在通過高通量測序解析濃香型大曲的曲心和曲皮在貯存期間發生的微生物群落結構變化,并分析糖化酶、液化酶活力的變化,利用HS-SPME-GC-MS研究揮發性代謝產物的差異,構建零模型解析微生物群落的組裝過程,運用相關性分析探究糖化力、液化力、風味物質與大曲微生物之間的聯系,揭示濃香型大曲貯存期菌系、酶系以及物系的變化機制,為優化大曲貯存工藝、提高大曲質量提供理論依據。
1 材料與方法
1.1 材料與試劑
大曲由遂寧市某濃香型白酒廠提供。
E.Z.N.A.?Soil DNA Kit 美國Omega BioTek公司;2-辛醇(色譜純)美國Sigma公司;其他試劑均為國產色譜純或分析純。
1.2 儀器與設備
離心機 德國Eppendorf股份公司;Nano Drop 2000紫外分光光度計 美國Thermo Fisher Scientific公司;50/30 μm DVB/CAR/PDMS固相微萃取頭 美國Supelco公司;7890A/5975B GC-MS聯用儀 美國Agilent公司。
1.3 方法
1.3.1 樣品采集
每塊大曲約4 kg,被分為兩個部分:1.5 cm厚的外層命名為曲皮(QP),其余的內層命名為曲心(QX)[15]。分別于不同貯存時期(0、9、43、108、161 d)在曲庫的對角線兩端及中點處各選取一塊大曲,將這3 塊大曲的曲皮、曲心迅速粉碎后分別混合,密封在無菌袋中,于-80 ℃冰箱中保存。
1.3.2 DNA提取和高通量測序
準確稱取7 g大曲,用E.Z.N.A.?Soil DNA Kit試劑盒提取大曲微生物DNA,用Nano Drop 2000紫外分光光度計測定其純度與濃度。使用引物338F/806R(5’-ACTCCTACGGGAGGCAGCAGAG-3’/5’-GGACTACHVGGTWTCTAAT-3’)擴增細菌16 SrRNA 基因的V3~V4 可變區,用引物ITS1f/2043R(5’-CTTGGTCATTAGGAAGA-3’/5’-GCTGCGTTCTTCATC GATGC-3’)擴增真菌rRNA基因的ITS1區[16],采用Illumina平臺進行雙端測序[15]。
1.3.3 酶活力的測定
糖化力和液化力根據Zhang Yuting等[17]的方法進行測定。糖化力為1 g大曲在1 h內將可溶性淀粉轉化為葡萄糖的毫克數;液化力為1 g大曲在1 h內液化淀粉的克數。
1.3.4 揮發性代謝產物的測定
稱取2 g樣品加到20 mL頂空瓶中,再加入2 g NaCl和50 μL質量濃度為10 mg/L的2-辛醇。將50/30 μm DVB/CAR/PDMS固相微萃取頭插入頂空瓶于50 ℃條件下萃取吸附30 vmin。取出萃取頭插入GC儀進樣口,在250 ℃條件下解吸5 min,采用陳瑩琪等[16]的方法進行GC-MS檢測分析。
1.4 統計分析
測序原始序列通過DADA2進行質控操作,基于100%的序列相似性聚類得到特征序列。采用RStudio 4.1.3進行主坐標分析(principal co-ordinates analysis,PCoA)、α多樣性分析、Venn圖繪制、群落的平均最近分類單元指數(beta-nearest taxon index,βNTI)計算、修正Raup-Crick指數(RCbray)計算、生態位寬度計算、冗余分析(redundancy analysis,RDA)、Spearman相關性熱圖繪制。
2 結果與分析
2.1 濃香型大曲貯存過程中微生物群落結構變化
2.1.1 濃香型大曲貯存過程中優勢微生物群落演替特征大曲微生物在持續進行的貯存過程中此消彼長,采用高通量測序技術對其演替情況進行解析。在大曲貯存期間共注釋到16 個細菌門和4 個真菌門,212 個細菌屬和30 個真菌屬,其中將平均相對豐度前10的優勢微生物屬變化情況繪制成柱形圖展示。由圖1a可知,曲皮在入庫貯存第0天的主要優勢細菌是芽孢桿菌屬(Bacillus)(23.69%)、假單胞菌屬(Pseudomonas)(26.58%)、魏斯氏菌屬(Weissella)(20.94%)等,這種優勢地位到了貯存第43天被鏈球菌屬(Streptococcus)(33.31%)、放線菌屬(Actinomyces)(18.83%)取代。貯存第43~108天,魏斯氏菌屬迅速生長成為絕對優勢細菌(1.41%~63.08%)。貯存第108天和第161天的曲皮細菌組成較為相似,這與唐賢華等[18]得出的貯存期導致大曲微生物種類趨于平穩的研究結論一致。并且有研究結果可以解釋這一現象:貯存過程中溫度、水分、酸度等環境條件的變化會導致大曲微生物之間進一步相互作用,使群落結構趨于相似,最終形成一種穩定體系[19]。而在曲心,貯存前43 d的細菌組成較為一致,由芽孢桿菌屬、克羅彭斯特菌屬(Kroppenstedtia)、高溫放線菌屬(Thermoactinomyces)、假單胞菌屬、葡萄球菌屬(Staphylococcus)等組成。假單胞菌屬的相對豐度最高,呈明顯的上升趨勢(15.84%~76.70%),而芽孢桿菌屬在持續下降(43.24%~9.23%)。葡萄球菌屬在貯存前9 d的含量較為豐富(12.73%~10.74%),隨后立即讓位給其他細菌,在貯存第108~161天的相對豐度保持在0.42%~1.67%。隨著貯存時間的延長,除了芽孢桿菌屬的相對豐度在10%左右波動外,其余在貯存開始時呈明顯優勢的細菌都在衰減,而乳桿菌屬(Lactobacillus)、放線菌屬、鏈球菌屬、腸球菌屬(Enterococcus)等相對豐度增加,這種變化與Jin Yao等[20]的發現一致。由圖1b可知,曲皮和曲心在貯存過程中的真菌皆以嗜熱子囊菌屬(Thermoascus)為主,其相對豐度在曲皮和曲心中的變化規律大體一致,均從一個極高的相對豐度(96.89%、93.29%)波動下降。其次是曲霉屬(Aspergillus),在貯存第0天幾乎沒有,而后大量生長,但不同的是從貯存第9天開始,曲霉在曲心中總體呈波動上升趨勢(22.17%~30.35%),而在曲皮中呈快速下降趨勢(60.82%~2.41%)。畢赤酵母屬(Pichia)在曲心中的相對豐度很低(0%~0.96%),但在曲皮中卻大量生長,是曲皮在貯存第108天的絕對優勢真菌(68.89%)。
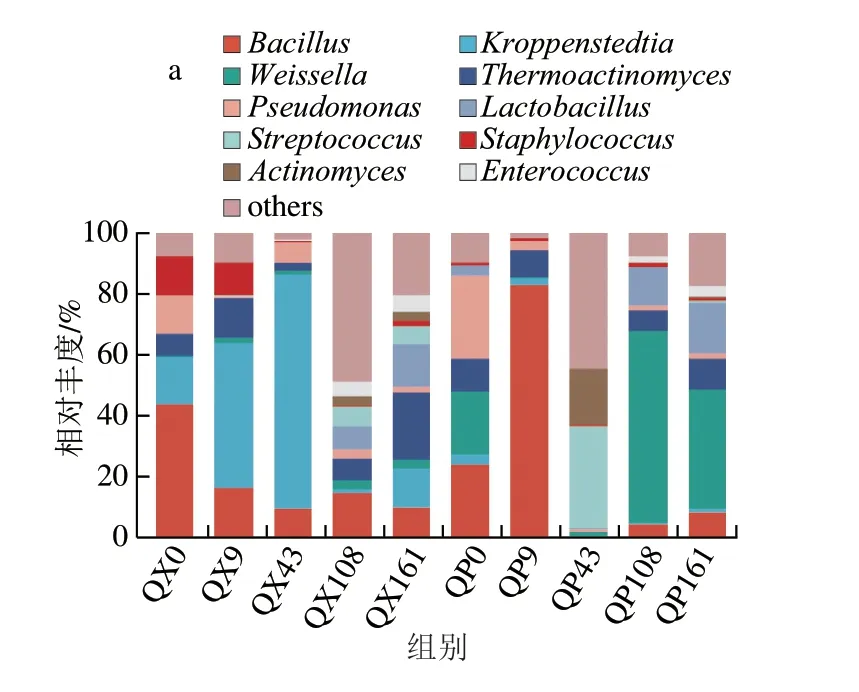
圖1 大曲貯存過程中優勢細菌(a)和真菌(b)在屬水平的相對豐度Fig.1 Relative abundance of dominant bacteria (a) and fungi (b) at genus level during Daqu storage
總體看來,大曲貯存過程使曲皮中的魏斯氏菌屬、乳桿菌屬、畢赤酵母屬和曲心中的高溫放線菌屬、魏斯氏菌屬、乳桿菌屬、鏈球菌屬、曲霉屬的相對豐度得到了極大提高,同時使曲皮和曲心中的芽孢桿菌屬、假單胞菌屬、嗜熱子囊菌屬等的相對豐度下降。此外,曲皮中others的變化情況顯示了大曲中一些原本的極低豐度微生物可能由于適應曲庫的環境條件以及微生物之間友好的相互關系而大量生長,同時一些微生物因為適應性差而走向衰竭[10,19]。這些結果都表明貯存使大曲微生物間相互作用重新平衡[6],改變了微生物群落組成。
2.1.2 濃香型大曲貯存過程中菌群結構特征的變化
不同貯存時間的大曲微生物α多樣性指數如圖2所示。Chao1指數反映物種的豐富度,大曲貯存前43 d的微生物豐富度相差不大,隨著貯存時間的延長,曲心中細菌的Chao1指數在貯存第108天增長至最大,而真菌的Chao1指數在第43天達到最高值后減小。總體看來,貯存過程使大曲微生物的豐富度略有降低。Pielou’s evenness指數表征均勻度,在大曲貯存期間,微生物群落的均勻度呈現先增加再減少的趨勢。貯存第161天的細菌群落均表現出稍稍低于貯存第0天的均勻度,而真菌群落的均勻度總體增加,表明貯存過程塑造了更為均勻的真菌群落[21]。Shannon指數反映物種多樣性,大曲的物種多樣性與均勻度的變化趨勢較為相似,總體上貯存過程增加了大曲的微生物多樣性。
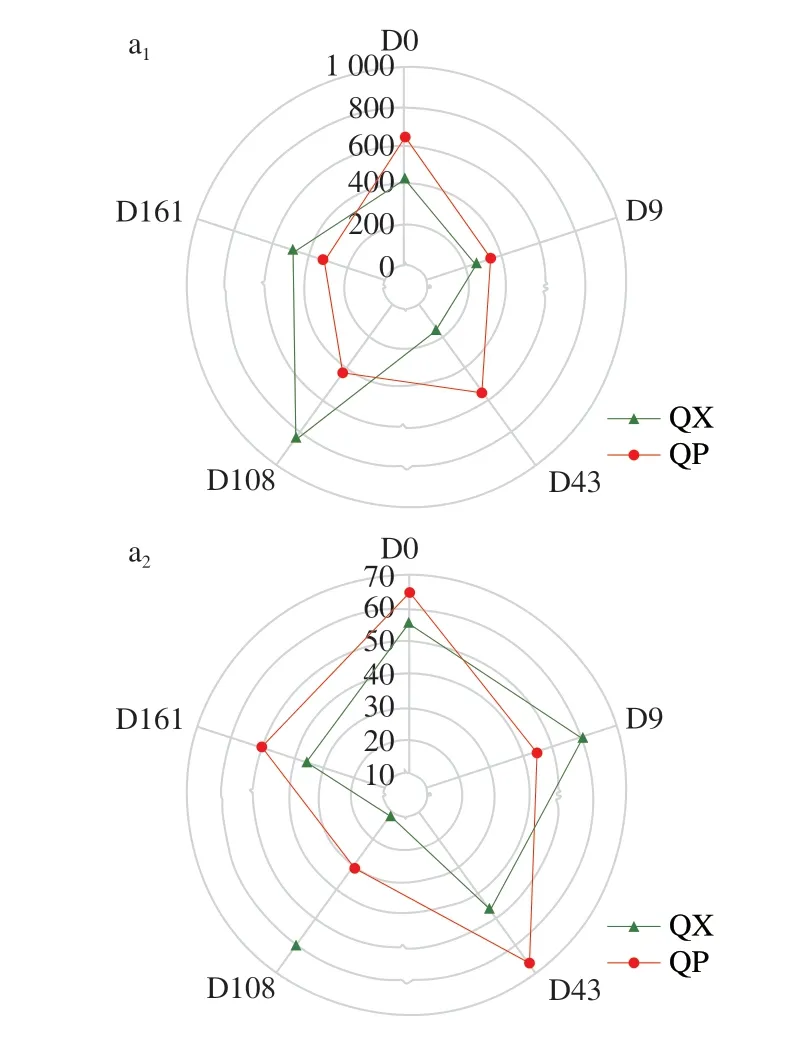
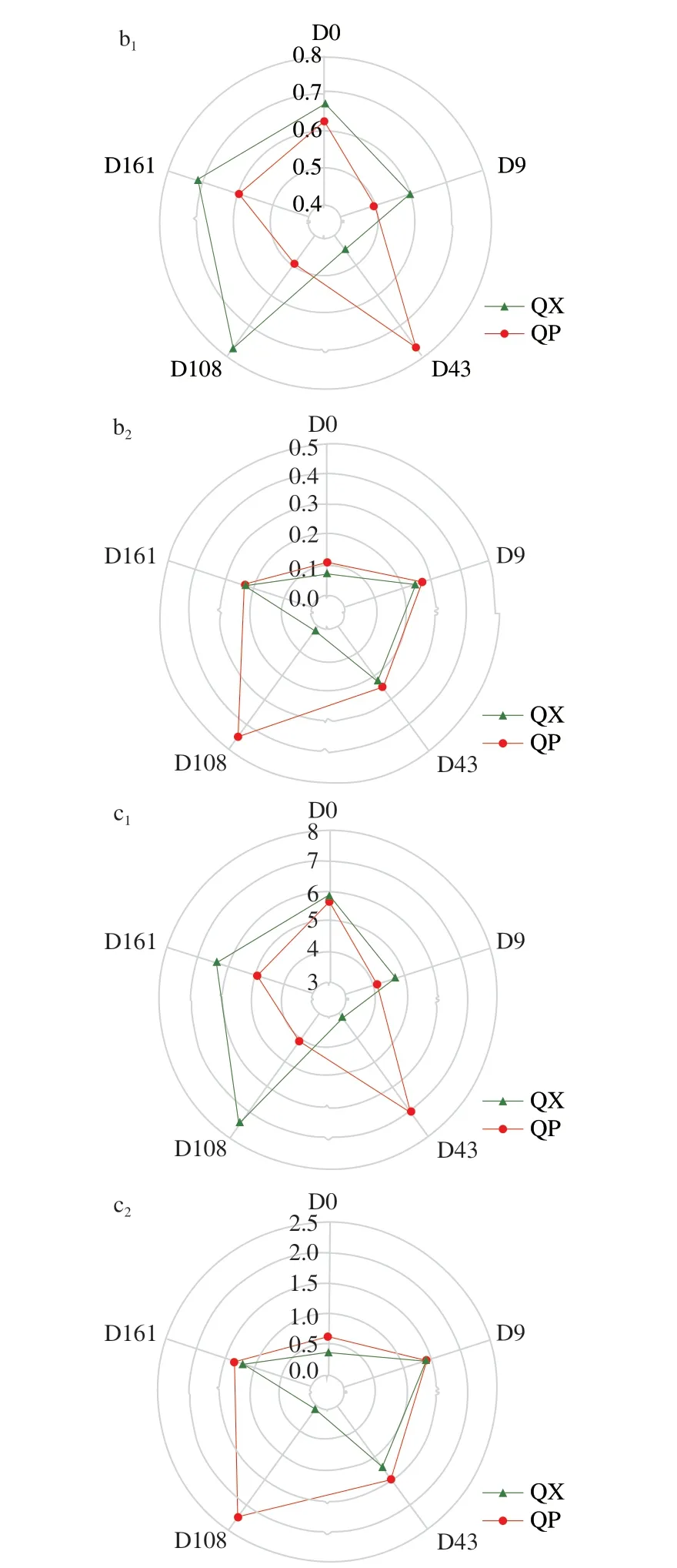
圖2 大曲貯存過程中微生物的α多樣性指數Fig.2 Microbial α-diversity indexes during Daqu storage
為探究大曲貯存過程中微生物群落結構的變化,對大曲樣品進行PCoA。由圖3a可知,PC1和PC2對細菌群落組成差異的解釋度分別為29.63%和22.15%,共計51.78%。貯存前43 d的曲心細菌結構相近,但曲皮細菌樣本相互分離較遠,說明貯存前43 d內曲皮細菌結構發生了明顯變化。貯存第108、161天曲心和曲皮的細菌樣本各自聚在一起,表明大曲貯存3 個月后,細菌結構已經趨于穩定,這與以往的研究一致[4,19]。如圖3b所示,PC1和PC2對真菌群落組成差異的解釋度分別為53.02%和41.79%,總解釋度高達94.81%。曲心的真菌結構總體距離相近,說明曲心真菌結構在貯存過程中變化不大,并且與貯存第0、43、161天的曲皮真菌結構相似性較高,但分別與曲皮在第9、108天的真菌結構相差甚遠。為進一步了解大曲貯存期間微生物群落結構,Venn圖展示了不同貯存時期間的共有微生物及特有微生物數量。如圖4所示,在屬水平上,曲皮、曲心在5 個貯存時期分別有13、14 個共有物種,其中絕大部分如曲霉屬、芽孢桿菌屬、乳桿菌屬、畢赤酵母屬、魏斯氏菌屬等都屬于圖1中的優勢菌屬,但它們在貯存不同時期的相對豐度各不相同。曲皮和曲心在每個貯存時期的特有物種數量總和分別占53%和50%,表明大曲貯存過程中的微生物差異由一半的共有物種的豐度差異和一半的特有物種的物種差異組成[4]。這些結果同樣表明一些原本的極低豐度微生物可能會隨著貯存的進行大量生長,同時一些微生物豐度降至極低,也有研究顯示部分特有低豐度微生物來自貯存環境[4]。

圖3 大曲貯存過程中細菌(a)和真菌(b)樣本的PCoAFig.3 PCoA plots of bacterial (a) and fungal (b) samples during storage of Daqu
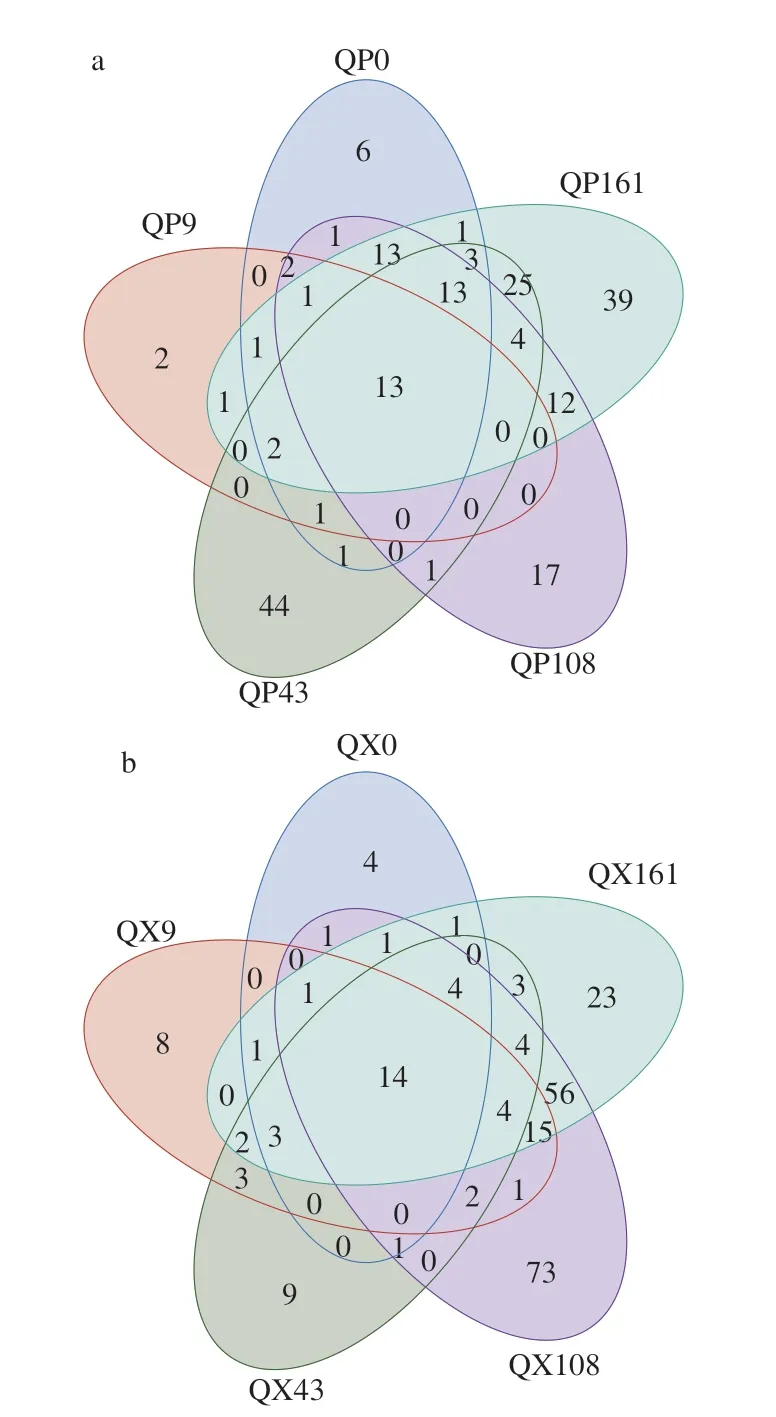
圖4 大曲貯存過程中曲皮(a)和曲心(b)的物種個數Venn圖Fig.4 Venn diagram for the number of microbial species on (a) and in (b)Daqu during storage
2.2 濃香型大曲貯存過程中糖化力和液化力的變化
糖化酶是微生物代謝產生的重要酶類,能將釀酒原料中的淀粉、纖維素等多糖降解為還原糖,再由酵母等微生物進一步轉化為乙醇[10,22],因此糖化力是大曲重要的生化指標。由圖5a可知,曲皮糖化力在貯存前108 d先上升后下降(272、398、107 mg/(g·h)),在貯存第108~161天內大幅回升(107~256 mg/(g·h))。而曲心糖化力在48~187 mg/(g·h)之間呈現比較規律的波動。液化酶能斷裂淀粉分子的α-1,4-糖苷鍵生成糊精等中間產物[23]。圖5b所示的曲皮液化力在貯存第0~43天內略有降低(0.37~0.12 g/(g·h)),從貯存第43天開始持續增加至貯存結束(0.12~0.30 g/(g·h))。曲心液化力在貯存前43 d內維持在0.08 g/(g·h),之后快速上升并穩定在0.27~0.21 g/(g·h)。總體看來,與以往的研究一致[10,23],糖化力和液化力在貯存約43 d內呈下降趨勢,隨后整體回升。曲皮的糖化力和液化力均在貯存后略微降低,而曲心中的二者在貯存后升高。有研究表明,大曲在貯存初期具有較高的液化和糖化活性,且二者往往呈正相關,后來酶活性降低,轉變為較高的酯化活性[2],這與貯存后期酯類物質含量快速增加有關。

圖5 大曲貯存過程中糖化力(a)和液化力(b)的變化Fig.5 Changes in saccharification power (a) and liquefaction power (b) of Daqu during storage
2.3 濃香型大曲貯存過程中揮發性代謝產物的變化
大曲中的風味物質可以作為酒體中香氣物質的直接來源,也可作為酒中香氣物質的重要前驅物來源[20]。采用HS-SPME-GC-MS分別在貯存過程的曲心和曲皮位置檢測到67、70 種揮發性化合物,可分為醇類、酯類、酚類、酸類、醛酮類、烷烯類、吡嗪類和其他物質。由圖6可知,曲皮中風味物質的總含量隨著貯存時間呈現先下降后上升再下降的變化趨勢,其中在貯存約3 個月時總含量達到最高,這在其他報道中也有同樣的發現[10],相比之下,曲心中的風味物質含量總體較為穩定,僅在貯存結束時發生了較大的下降。酯類物質是中國白酒中令人愉悅的水果、花香、蜂蜜香氣的主要貢獻者[6],是貯存期間占比最大的揮發性風味物質,令人注意的是其在曲皮貯存第108天時發生了激增,與前述微生物群落演替結果相結合,推測這種變化可能與魏斯氏菌和畢赤酵母的劇烈增加有關。據報道,魏斯氏菌發酵產生乳酸,為乳酸乙酯的合成提供前體物質,畢赤酵母能利用蔗糖和葡萄糖制造乙酸乙酯等芳香化合物,二者均在酯化過程中發揮重要作用[24]。醇作為酸和酯的重要前體物質,其含量僅次于酯類,在貯存期間變化幅度不大。酸類、烷烯類、醛酮類物質的變化比較一致,表現為貯存初期有較高的含量,之后迅速下降,并在之后的貯存期間保持非常低的含量。總體上,貯存過程使風味物質總含量減少,這與Zhang Yuandi等[11]的研究結果一致。其中醇類物質、酯類物質略微降低,酸類物質、烷烯類物質、醛酮類物質大量減少。結果表明隨著貯存時間的推移,一些重要的風味化合物被豐富,一些異雜味被減少或去除[23],同時伴隨著部分風味物質的揮發[6,11],說明貯存過程有助于“凈化”風味[25]、形成獨特濃郁的“大曲味”[2]。
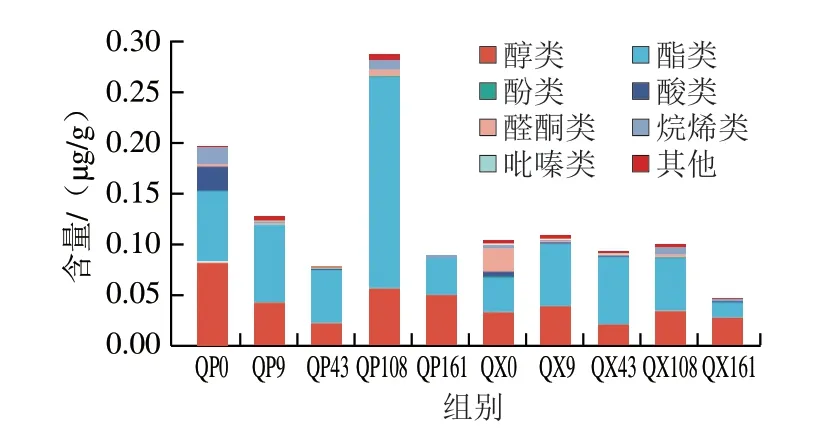
圖6 大曲貯存過程中各類揮發性代謝產物的變化Fig.6 Changes of volatile metabolites in Daqu during storage
2.4 濃香型大曲貯存過程中微生物群落的演替機制
為探究大曲貯存過程中微生物群落結構的變化原因,采用系統發育零模型計算大曲微生物群落的βNTI來判斷群落的構建過程[14]。如圖7a所示,曲皮細菌群落的βNTI值在-1.12~5.05之間變化,曲心細菌在-1.28~5.55之間變化,二者的|βNTI|>2的占比均為40%,說明細菌群落的組裝過程主要受60%的隨機性過程影響,同時受40%的確定性過程影響。曲皮真菌群落的βNTI值在-0.64~3.61之間波動,其|βNTI|>2的比例為20%,說明曲皮真菌群落受隨機性過程主導(80%)。而曲心真菌僅在-1.52~1.76之間波動,說明其完全受隨機性過程影響(100%)。總體上,大曲貯存期間微生物群落的組裝主要由隨機性過程主導。相較于真菌來說,細菌受確定性過程的影響更大;相較于曲心微生物來說,曲皮微生物受確定性過程的影響更大。

圖7 大曲貯存過程中微生物群落的構建過程(a)和各個生態過程對群落構建的貢獻程度(b)Fig.7 Development of microbial community during Daqu storage (a),and contribution of each ecological process to microbial community development (b)
為了進一步量化隨機性和確定性過程在貯存期大曲微生物群落構建中的貢獻程度,圖7b顯示了群落的修正RCbray[14]。結果表明無論是曲皮還是曲心,對細菌群落構建的影響因素包括40%的變量選擇(環境因子、微生物相互作用等)、40%的擴散限制以及20%的未定義過程(生態漂變等)。而真菌群落則大部分受未定義過程的影響(曲皮70%、曲心90%),說明主要由生態漂變等導致真菌結構發生隨機變化。變量選擇對曲皮真菌群落構建的貢獻為30%,但對曲心真菌的貢獻為0。勻質擴散只在曲心真菌群落構建過程中發揮了一定作用(10%),這種生態過程會導致群落結構的相似性[26]。而對于細菌群落來說,相對穩定的貯存環境可能導致擴散限制較大地影響了細菌在曲庫中的擴散。有研究表明,真菌群落在曲心中傾向于隨機分散,而細菌群落則偏好聚集狀態[20]。結果表明,變量選擇對微生物菌群(尤其是曲皮中)發揮較大的作用,說明貯存條件的改變及微生物間的相互作用對群落演替十分重要[26]。而目前的生產中,貯存期間幾乎都未采取人工調控溫濕度等措施,使氣候條件成了重要因素[4],可見在大曲貯存期實施工藝調控對穩定大曲質量具有重要意義。
大曲貯存過程中微生物的生態位寬度如圖8所示。曲心細菌和曲皮真菌在貯存第108天和曲皮細菌在貯存第43天時的生態位寬度發生激增,說明這時候微生物對環境資源的利用程度大大增加,這一時期的變化與圖1中優勢菌群結構發生劇烈演替相符合。對比貯存前后的生態位寬度,結果顯示除了曲皮細菌外,其余菌群的生態位寬度經貯存后都增加,說明貯存使大曲微生物對環境資源的利用增加,對微生物間相互作用的適應狀況更好[27]。貯存過程中不同時期的大曲微生物占據著不同的生態位,顯示了對環境擾動的不同響應[28],這種響應是由其生理耐受性、擴散能力、分類多樣性和功能多樣性等共同介導[29-30],因此貯存期大曲微生物群落不同的組裝過程可能是受到微生物群對環境干擾的不同響應和生態位寬度的差異所影響[14]。此結果與零模型的分析結果一致反映了貯存環境對大曲微生物生長代謝的重要性。
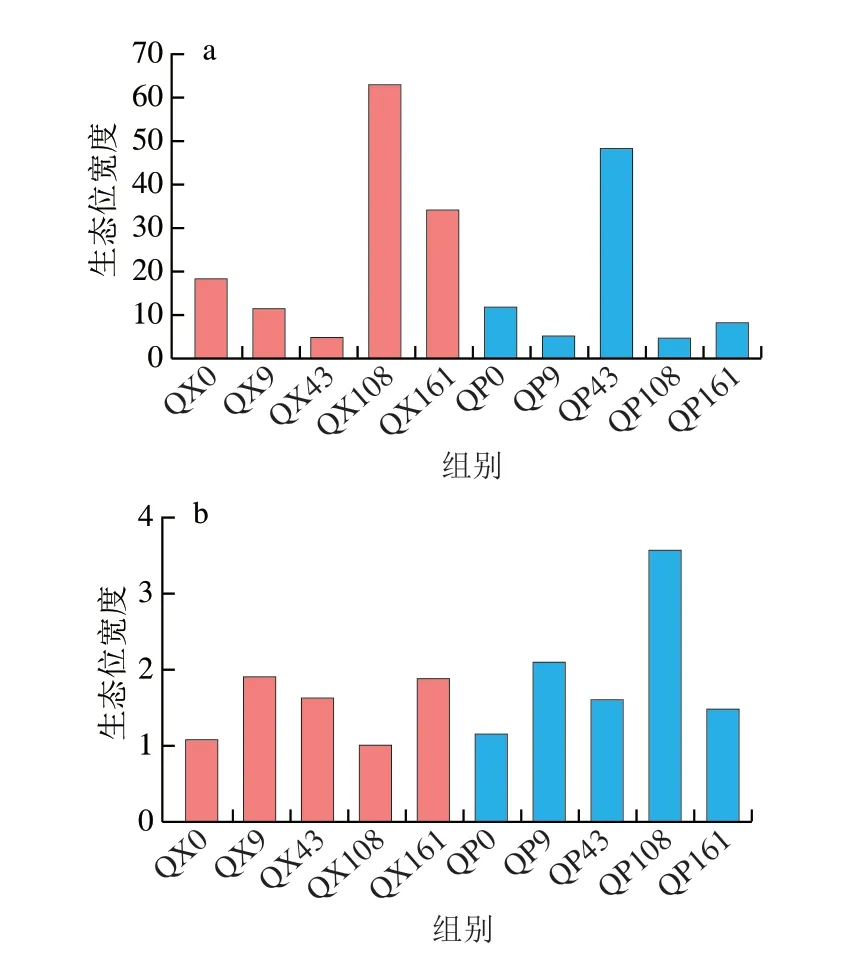
圖8 大曲貯存過程中細菌(a)和真菌(b)的生態位寬度變化Fig.8 Variations in niche width of bacteria (a) and fungi (b) during Daqu storage
2.5 濃香型大曲貯存過程中重要酶活力與微生物群落演替的相關性
貯存期間大曲微生物群落不斷變化,并通過代謝活動引起酶活力的變化[6]。通過RDA探究兩種重要酶活力與大曲微生物間的關聯,其中RDA1和RDA2(加權)標準正交物種得分大于0.09的菌屬見圖9[4]。如圖9a所示,曲皮中,糖化力與嗜熱子囊菌屬呈負相關,與畢赤酵母屬、魏斯氏菌屬、乳桿菌屬、芽孢桿菌屬和曲霉屬呈正相關。貯存第108天和第161天的曲皮樣本與液化力極為相關,其中屬畢赤酵母屬、魏斯氏菌屬、乳桿菌屬貢獻最大。由圖9b可知,曲心中的糖化力和液化力均與科薩克氏菌屬(Kosakonia)呈負相關,與嗜熱子囊菌屬、曲霉屬呈強正相關,相比之下,與嗜熱真菌屬(Thermomyces)、高溫放線菌屬的正相關性較弱。結果顯示,畢赤酵母屬、魏斯氏菌屬、乳桿菌屬、嗜熱子囊菌屬、曲霉屬等微生物通過代謝作用有助于提高糖化酶、液化酶活力。一些研究報道了嗜熱子囊菌屬、曲霉、根毛霉屬及芽孢桿菌屬等大曲核心微生物具有強大的水解能力,有助于淀粉的液化和糖化,為后續風味化合物的形成打下基礎[31-32]。
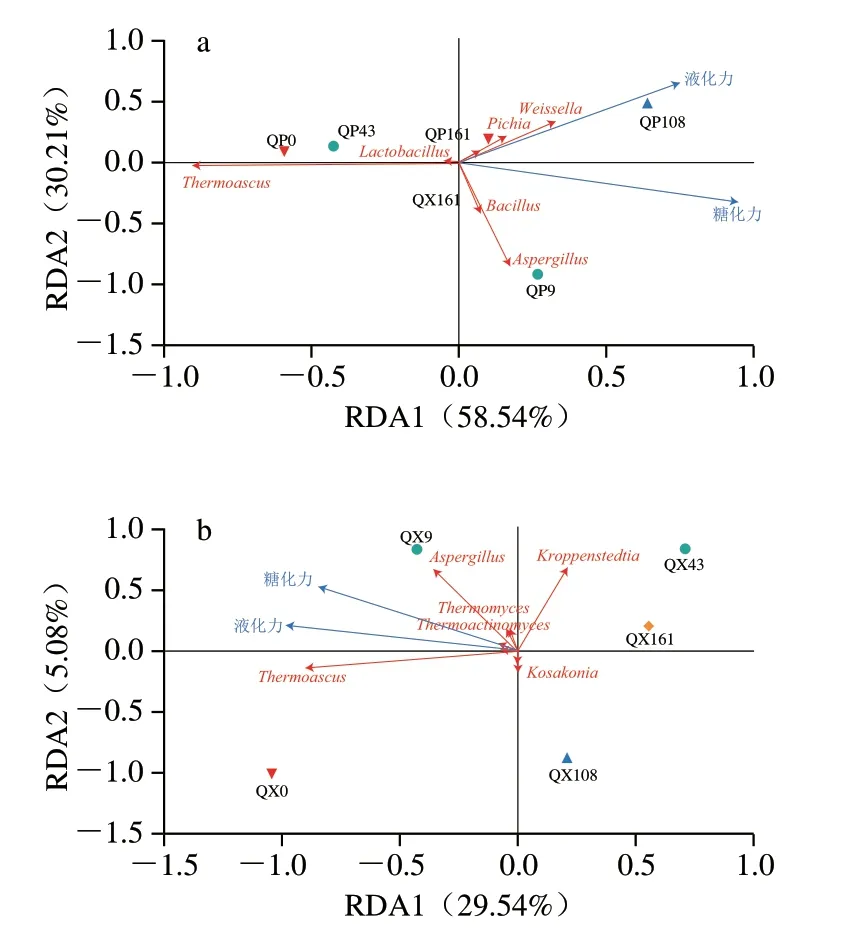
圖9 大曲貯存過程中糖化力、液化力與曲皮(a)和曲心(b)微生物的RDAFig.9 RDA of saccharification power,liquefaction power and microorganisms on (a) and in (b) Daqu during storage
2.6 濃香型大曲貯存過程中揮發性風味物質與微生物群落演替的相關性
為探究大曲貯存期間揮發性風味物質的變化機制,利用Spearman相關性分析評估揮發性化合物與微生物的關聯[6]。如圖10a所示,曲皮中一些酯類物質如9-十六碳烯酸乙酯、肉豆蔻酸乙酯、十六酸乙酯、十八烯酸乙酯與根霉屬(Rhizopus)、威克漢姆酵母屬(Wickerhamomyces)等呈顯著負相關。乙酸乙酯與黃桿菌屬(Flavobacterium)、假單胞菌屬呈顯著正相關,與放線菌屬、鏈格孢屬(Alternaria)、棒狀桿菌屬(Corynebacterium)、梭桿菌屬(Fusobacterium)等呈顯著負相關。并且苯乙醇也和這些菌屬呈顯著負相關,而與假單胞菌屬、克羅彭斯特菌屬呈顯著正相關。乙醇、正戊醇、2,3-丁二醇聚為一類,與醋桿菌屬(Acetobacter)、鏈霉菌屬(Streptomyces)呈極顯著正相關。有研究顯示,大曲中的苯乙醇、戊醇等高級醇可能是通過Ehrlich代謝途徑的氨基酸分解代謝形成,也可能是由一些微生物菌株的脂質氧化形成[33-34]。在曲皮中僅檢測到2,5-二甲基吡嗪、2,3,5-三甲基吡嗪兩種吡嗪物質,均與假單胞菌屬、克羅彭斯特菌屬呈顯著正相關。如圖10b所示,在曲心中檢測到了更多吡嗪種類,其中2,5-二甲基吡嗪、2,3,5-三甲基吡嗪與魏斯氏菌屬、乳桿菌屬、腸球菌屬呈顯著負相關,與芽孢桿菌屬、嗜熱子囊菌屬呈顯著正相關;而2,6-二甲基吡嗪、2,3,5,6-四甲基吡嗪則與微小桿菌屬(Exiguobacterium)、短狀桿菌屬(Brachybacterium)、熱桿菌屬(Thermobacillus)呈極顯著正相關,這與以往的研究一致[20],因此通過調節這些微生物的豐度和活性有助于白酒中作為健康因子的吡嗪含量的提升。據報道,芽孢桿菌通過分泌淀粉酶、蛋白酶、纖維素酶等將淀粉和蛋白質轉化為葡萄糖和氨基酸,從而產生揮發性化合物及其前體物質,如吡嗪、芳香族化合物、酚類化合物和有機酸[15],可見芽孢桿菌對大曲的風味和質量有著重要貢獻。曲心中辛酸乙酯、癸酸乙酯、十七酸乙酯等與根霉屬、克雷伯菌屬(Klebsiella)呈顯著正相關,與威克漢姆酵母屬呈顯著負相關。正己酸乙酯與魏斯氏菌屬、腸球菌屬、乳桿菌屬以及一些非優勢菌如棲熱菌屬(Thermus)、克洛氏菌屬(Crossiella)等呈顯著正相關。總之,大曲貯存過程中揮發性風味物質在很大程度上受到微生物結構及其代謝活性復雜變化的影響,是風味物質揮發[11]和微生物轉化共同作用的結果[6],此結果為后續考慮通過物種強化提高大曲風味質量提供一定的理論基礎。

圖10 大曲貯存過程中揮發性代謝產物與曲皮(a)、曲心(b)中微生物的相關性聚類熱圖Fig.10 Cluster heatmaps for the correlation between volatile metabolites and microorganisms on (a) and in (b) Daqu during storage
3 結論
本研究利用高通量測序探究濃香型大曲貯存過程中的微生物群落組成及結構特征。結果顯示大曲的貯存過程是微生物進一步相互作用并重新平衡群落結構的過程,長時間的貯存改變了功能微生物比例[2],最終導致微生物多樣性增加、群落結構趨于穩定、均勻。貯存結束后,成熟大曲的曲心微生物群落主要由芽孢桿菌屬、魏斯氏菌屬、高溫放線菌屬、克羅彭斯特菌屬、乳桿菌屬、嗜熱子囊菌屬、曲霉屬等組成;曲皮微生物主要包括魏斯氏菌屬、乳桿菌、高溫放線菌屬、嗜熱子囊菌屬、畢赤酵母屬等優勢微生物。此外研究了糖化力、液化力以及揮發性風味物質的變化規律,發現貯存過程使曲皮中糖化力、液化力有所下降,但在曲心中有所增加,同時有助于風味物質的豐富和轉化,這些變化使曲香更加濃郁[10]。通過構建零模型探索微生物群落的組裝機制,發現隨機性過程主導了群落結構的變化,同時確定性過程也有重要影響,其中變量選擇發揮了較大的作用,生態位差異也有一定影響,這一結論還需更多的研究驗證。多元統計分析顯示微生物區系與大曲糖化力、液化力及揮發性代謝產物之間有顯著相關性,說明貯存有助于通過改變微生物群落生產出高質量大曲。
總之,貯存過程對大曲微生物群落結構的重新平衡、酶活力及揮發性代謝產物的積累與轉化具有重要意義,這與Fan Guangsen等[6]的研究結果一致。引起這些變化的確定性過程是變量選擇,說明大曲貯存期實施工藝調控對穩定大曲質量非常重要。此外,還應對微生物的代謝通路進行分析,進一步完善貯存期間大曲品質的變化機制。本研究對優化大曲的貯存工藝、提高大曲品質具有重要意義。

