枸杞深色有隔內生真菌定殖規律及其與土壤因子的相關性
王若彤 陳思杰 鞠明岫 閆思遠 李金 顧沛雯


摘 要 利用采自寧夏銀川市金鳳區和西夏區兩個枸杞栽培區0~20、20~40和40~60 cm共3個土層深度的枸杞根系和根圍土樣,研究枸杞 (Lycium barbarum)根系深色有隔內生真菌 (dark septate endophytes,DSE)的定殖規律及其與土壤因子的相關性,以期為充分利用DSE資源和基于生物技術促進荒漠植被恢復和生態改良提供依據。結果表明,DSE可定殖于枸杞根系形成深色、有隔菌絲,微菌核多呈聚合型和離散型。兩樣地DSE定殖率差異顯著,金鳳區樣地DSE平均總定殖率(73.27%)顯著高于西夏區樣地 ?(23.54%);不同土層DSE定殖率有差異,兩樣地DSE總定殖率、菌絲定殖率和微菌核定殖率最大值均出現在20~40 cm土層。兩樣地不同土層深度間土壤因子的分布差異顯著,主成分分析顯示pH、堿解氮、速效磷、有機質、堿性磷酸酶和蔗糖酶能綜合反映銀川市兩枸杞樣地根際土壤養分狀況。方差分解分析結果表明,DSE定殖受到樣地和土壤因子的共同影響。相關性分析表明,DSE定殖在兩樣地間存在較大差異,金鳳區樣地DSE總定殖率與有機質顯著正相關,與速效鉀極顯著負相關;DSE菌絲定殖率與有機質、速效磷和堿解氮顯著正相關,與速效鉀和pH顯著負相關。西夏區樣地DSE總定殖率和微菌核定殖率與pH極顯著正相關;DSE菌絲定殖率與有機質、速效磷和脲酶顯著負相關。上述結果說明,枸杞根系能被DSE侵染,DSE定殖具有明顯的垂直空間異質性,并與土壤因子密切相關。
關鍵詞 深色有隔內生真菌;枸杞;定殖狀況;土壤因子
枸杞(Lycium barbarum)屬茄科(Solanaceae)多年生落葉灌木,是中國傳統的藥食同源植物,主要生長在中國西北干旱地區[1-2]。枸杞作為中藥材和重要的保健食品在中國已有上千年的歷史,其果、葉、根、花皆具有較高的藥用價值和保健效果,現代藥理研究表明枸杞具有調節免疫、抗氧化、抗癌抗腫瘤等功效[3]。枸杞具有生態適應性強、抗寒、抗旱、耐貧瘠、耐鹽堿等特點,是理想的生態和經濟兼用的樹種[4]。
深色有隔內生真菌(dark septate endophytes, DSE)是指定殖于植物根內的土壤真菌,其特點是寄居在健康植物根表皮、皮層乃至維管組織細胞內或細胞間隙,形成深色有隔菌絲、微菌核或泡囊結構,促進植物生長但不會引起典型的病理學特征[5]。研究發現,DSE宿主范圍非常廣泛,其宿主植物超過110科320屬600余種[6],如絕大多數農作物、牧草、莎草科、十字花科、藜科等植物根系均有定殖[5]。DSE可能在生態學功能方面與菌根真菌相似,并對不同生態系統至關重要[5]。He等[7]發現接種DSE可以促進根系及植株對氮和磷的吸收,增加植株的根長、表面積、生物量。Jin等[8]研究表明DSE顯著降低煙草葉片中鎘和鉛含量,提高煙草的生物量和重金屬耐受性。DSE還可作為植物病害的生物防治劑,Harsonowati等[9]得出DSE Cladophialophora chaetospira SK51在草莓根系定殖,與草莓枯萎病病原Fusarium oxysporum f.sp.fragariae競爭占據植物根系的生態位,對草莓枯萎病的防效達90.48%,并促進增長。胡麗杰等[10]已證明DSE在枸杞中具有豐富的生物多樣性,可在枸杞根部皮層細胞內定殖并形成菌絲和形態各異的微菌核,能夠促進枸杞生長,提高枸杞對炭疽病的抗性,具有良好的促生防病作用[11],但目前鮮見有關枸杞根部DSE定殖狀況與土壤環境因子相關的報道。
本研究通過對寧夏銀川市金鳳區和西夏區兩個不同枸杞栽培區枸杞根系樣品和根際土壤樣品的采集,系統調查兩個不同栽培區枸杞根系內DSE的定殖情況,同時測定各栽培區樣地的土壤理化性質及酶活;分析DSE各結構定殖規律與土壤因子之間的相關性,旨在闡明影響枸杞根系DSE定殖和分布的主要土壤因子,為DSE資源的充分利用和進一步產業化應用提供依據。
1 材料與方法
1.1 材 料
于2020年8月采集枸杞根系樣品和根圍土土壤樣品。選取寧夏銀川市金鳳區森淼枸杞園和西夏區紅瑪瑙枸杞園為兩個典型采樣地,兩地面積均為3.33 hm2。金鳳區森淼枸杞園(海拔 ?1 117 m,38°25′10″N,106°10′25″E),土壤類型為風沙土,該樣地地勢平坦,周邊綠化植被較多,田間管理如灌水、施肥等良好;西夏區紅瑪瑙枸杞園(海拔1 127 m,38°31′31″N,106°4′20″E),土壤類型為礫質灰鈣土,該樣地地勢較陡,植被類型單一,田間管理如灌水、施肥等頻次較少。枸杞品種為‘寧杞5號,樹齡8 a,其根系垂直分布在地下 ?0~60 cm的土層深度。本試驗在每個采樣地設置3個小樣方(100 m×100 m),小樣方間隔大于1 000 m,呈棋盤式。在每個小樣方采用對角線采樣法,隨機選擇5株長勢良好的健康枸杞植株,株距大于100 m。在距枸杞植株主干東西南北4個方位水平方向0~30 cm范圍內,除去其枯枝落葉層挖土壤剖面,按0~20 cm、20~40 cm和40~60 cm 3個土層采集土樣和根樣,每土層各1 kg,將其裝于隔熱性能良好的塑封袋中,記錄采樣時間、地點等信息,及時帶回實驗室進行處理。將每個小樣方中同一土層的土樣和根樣均勻混合,過2? mm篩,隨機挑選50~60個根段(長度為5~ ?6 cm,直徑小于2 mm),保存于FAA固定液(甲醛、冰醋酸及75%酒精體積比為1∶1∶18)中,用于DSE結構和定殖狀況觀測。篩下的土樣經自然風干后,過1 mm篩,用于土壤因子測定。兩個樣地共計18份根樣和18個土樣。
1.2 試驗方法
1.2.1 DSE定殖觀察 參考Phillips等[12]的染色方法,從FAA固定液中取出根段,無菌水淋洗,將根段剪成1? cm后移入10% KOH中,90 ℃水浴1 h,乳酸酸化5~10 min。將根段酸化后經0.05%臺盼藍酸性甘油溶液(乳酸、甘油和水的體積比為3∶1∶1)染色5? min,乳酸甘油(乳酸和甘油的體積比為1∶1)脫色。隨機選取50個根段,在Olympus BX53(奧林巴斯株式會社,日本)顯微鏡下觀察DSE的侵染狀況和定殖結構,并統計定殖率[13]。
DSE定殖率=(微菌核視野數+菌絲視野數)/總視野數×100%
1.2.2 土壤因子測定 土壤理化性質測定[14]:配制質量比為1∶5的土壤∶水懸浮液,采用PHS-25精密酸度計測量pH;重鉻酸鉀-硫酸氧化法測定土壤有機質;堿解擴散法測定堿解氮; ?0.5 mol/L NaHCO3浸提-鉬銻抗比色法測定速效磷;火焰光度法測定速效鉀。土壤酶活測定[15]:采用靛酚藍比色法測定土壤脲酶,用24 h后1 g土中NH3-N的毫克數表示其活性;采用3,5-二硝基水楊酸比色法測定蔗糖酶,用24 h后1 g土生成葡萄糖毫克數表示其活性;采用高錳酸鉀滴定法測定過氧化氫酶;采用磷酸苯二鈉比色法測定堿性磷酸酶,用24 h后1? g土中釋放出的酚的毫克數表示其活性。
1.3 數據處理
將獲得的數據使用 Microsoft Excel 2007軟件整理;采用SPSS 25.0 進行單因素方差(OneWay ANOVA);采用Origin 2021通過主成分分析對土壤因子進行降維處理,確定影響兩樣地的主要土壤因素;采用美吉云平臺生信工具VPA(Variance partitioning analysis)進行方差分解分析,分析樣地、土層深度、土壤因子對DSE定殖的影響;采用Pearson對DSE定殖情況與土壤因子進行相關性分析。
2 結果與分析
2.1 DSE定殖結構
兩樣地健康枸杞根系DSE的定殖結構無明顯差別。由圖1觀察結果表明,DSE可侵染并定殖于枸杞根系,菌絲有橫隔,多呈深色,可侵入根系表皮和維管組織(圖1-A~E),菌絲能夠延伸至皮層細胞在胞內形成菌絲(圖1-C),能夠在皮層細胞間延伸形成菌絲網(圖1-D和圖1-E)。微菌核由細胞壁加厚的膨大細胞密集積聚形成,形狀不一(圖1-F~1-P)。根據其形態可分為聚合型和離散型。聚合型常見有葉狀(圖1-F~H)、腦狀(圖1-I)、錘狀(圖1-J);離散型可見帶狀(圖1-K和圖1-L)、鏈狀(圖1-M和圖1-N)、串珠狀(圖1-O)和星點狀(圖1-P)。
2.2 DSE空間分布
由表1可知,同一樣地不同土層,金鳳區樣地總定殖率在20~40 cm土層顯著高于其他土層,菌絲定殖率在0~20? cm和20~40 cm土層顯著高于40~60 cm土層,微菌核定殖率在20~40 cm土層高于其他土層;西夏區樣地20~40 cm土層總定殖率和微菌核定殖率高于0~20 cm和 ?40~60 cm土層,20~40 cm土層菌絲定殖率顯著高于0~20 cm土層。兩個樣地DSE總定殖率、菌絲定殖率和微菌核定殖率最大值出現在 ?20~40 cm土層。
同一土層不同樣地,金鳳區樣地DSE平均總定殖率(73.27%)、菌絲定殖率(56.80%)和微菌核定殖率(32.36%)均顯著高于西夏區樣地的平均總定殖率(23.54%)、菌絲定殖率(20.1%)和微菌核定殖率(12.09%)。說明銀川市兩枸杞樣地DSE的分布具有明顯的垂直空間特異性,這可能與宿主植物根系分布有關。
2.3 土壤因子空間分布
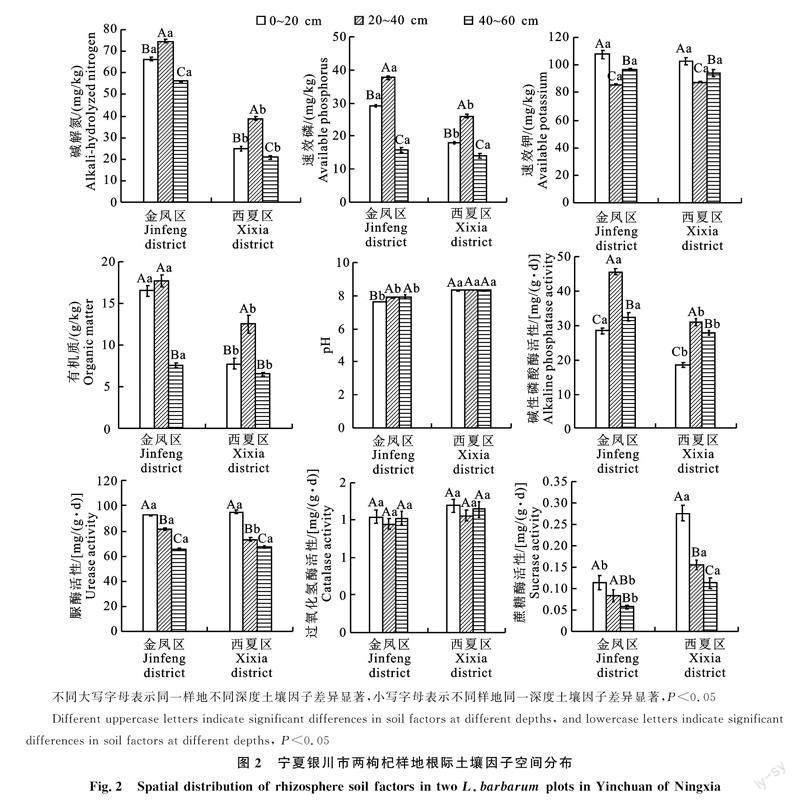
由圖2可知,銀川市金鳳區和西夏區兩枸杞樣地不同土層深度之間土壤因子差異顯著。同一樣地不同土層,堿解氮、速效磷、有機質和堿性磷酸酶的最大值均出現在20~40 cm,速效鉀、脲酶、過氧化氫酶和蔗糖酶的最大值均出現在0~20 cm。堿性磷酸酶最小值均出現在0~20 cm,速效鉀、過氧化氫酶最小值均出現在20~40 cm,堿解氮、速效磷、有機質、脲酶、蔗糖酶最小值均出[CM(21]現在40~60[KG*2]cm。堿解氮、速效磷、有機質、堿性磷酸酶隨土層加深先升后降,速效鉀、過氧化氫酶隨土層加深先降后升,脲酶、蔗糖酶隨土層加深呈下降趨勢。堿解氮、速效鉀、速效磷、堿性磷酸酶、脲酶在3個土層之間有顯著差異,過氧化氫酶在3個土層之間無顯著差異;金鳳區樣地有機質在 ?0~20、20~40 cm土層顯著高于40~60 cm,西夏區樣地有機質在20~60cm土層顯著高于0~20、40~60 cm土層;金鳳區樣地蔗糖酶在0~20 cm土層顯著高于40~60 cm土層,西夏區樣地三個土層之間蔗糖酶有顯著差異。金鳳區pH的最大值出現在40~60 cm,最小值出現在0~20 cm,隨土層加深呈上升趨勢,且pH在20~40、40~60 cm土層顯著高于0~20 cm;西夏區pH的最大值出現在40~60 cm,最小值出現在0~20 cm,隨土層加深無明顯變化規律。
同一土層不同樣地,金鳳區樣地堿解氮、有機質、堿性磷酸酶均顯著高于西夏區樣地,金鳳區樣地pH和蔗糖酶均顯著低于西夏區樣地。金鳳區速效磷在0~20 cm、20~40 cm土層均顯著高于西夏區樣地,在40~60 cm兩樣地無顯著差異;金鳳區脲酶在20~40 cm土層顯著高于西夏區樣地,在0~20 cm、40~60 cm土層兩樣地無顯著差異。速效鉀和過氧化氫酶在兩個樣地之間無顯著差異。說明銀川市兩枸杞樣地土壤因子的分布表現出明顯的空間異質性。
2.4 土壤因子主成分分析
對pH、堿解氮、速效磷、速效鉀、有機質、堿性磷酸酶、過氧化氫酶、脲酶、蔗糖酶9個土壤因子進行主成分分析,按照相關矩陣特征值大于1,方差累計貢獻率大于75%的原則,選出3個主成分。分析結果如表2,提取的3個主成分方差累計貢獻率達85.56%,能基本反映全部土壤因子的指標信息。第一主成分中,pH、堿解氮、速效磷、有機質、堿性磷酸酶載荷較大(權重>0.800);第二主成分中,蔗糖酶載荷較大(權重為0.943);第三主成分中,速效鉀載荷較大(權重為0.907)。第一主成分(PC1)所占信息量達48.494%,第二主成分(PC2)所占信息量為21.841%,兩者的方差貢獻率均較大,且由圖3可知,第一主成分(PC1)和第二主成分(PC2)中的方差貢獻率最大,分別可以解釋總方差的48.494%和21.841%,累計解釋總方差的70.335%。所以pH、堿解氮、速效磷、有機質、堿性磷酸酶和蔗糖酶能綜合反映銀川市兩枸杞樣地根際土壤養分狀況。
2.5 不同因子對DSE真菌定殖影響的方差分解分析
將不同樣地、土層深度、土壤因子對枸杞根系DSE的定殖率進行方差分解分析,定量評估不同因子對枸杞根系DSE定殖率的貢獻率[16]。由圖4可知,不同樣地、土層深度和土壤因子對DSE定殖的總解釋量為76.9%,其中土壤因子與樣地對DSE定殖的共同解釋量為75.3%,說明寧夏銀川市枸杞樣地DSE定殖主要受到樣地和土壤因子的共同影響。
2.6 DSE定殖與土壤因子相關性分析
由表3 Pearson相關性分析表明,DSE定殖在兩樣地間存在較大差異。金鳳區樣地枸杞根系[CM(21]DSE總定殖率與有機質顯著正相關,與速效鉀極顯著負相關;DSE菌絲定殖率與有機質、速效磷和堿解氮顯著正相關,與速效鉀和pH顯著負相關。西夏區樣地枸杞根系DSE總定殖率和微菌核定殖率與pH極顯著正相關;DSE菌絲定殖率與有機質、速效磷和脲酶顯著負相關。對比不同樣地可知,堿解氮、速效磷、有機質等土壤因子可以影響兩樣地DSE的定殖。
3 討? 論
3.1 DSE定殖與空間分布
DSE宿主范圍和生態分布極廣,定殖于植物根組織后不會引起明顯的病理學特征,它寄生于植物根系或與其共生,作用于宿主植物并對生態系統的穩定和生產力造成一定影響[17]。研究結果表明,寧夏銀川市兩樣地的枸杞根系可被DSE侵染,并形成深色、有隔菌絲和典型的微菌核結構。菌絲可通過變窄穿過植物細胞壁供DSE與植物進行營養物質交換[17];微菌核由菌絲膨大加厚堆積而成,可作為DSE的繁殖結構[18]。本研究得出枸杞根系DSE總定殖率在23.54%~ ?73.27%,平均定殖率為48.41%,說明DSE真菌可與其宿主枸杞根系形成良好的共生關系。李雪夢[19]研究得到DSE在枸杞根系內所形成的不同定殖結構的定殖率間有差異,表現為菌絲定殖率高于微菌核定殖率,本研究得到了相同的結論。
DSE定殖率在不同土層深度間具有明顯的垂直空間特異性[20]。蔚杰等[21]發現構樹根系在0~20 cm土層的DSE總定殖率顯著高于20~40 cm土層。王少杰等[18]發現蒙古沙冬青DSE的定殖率在0~20 cm土層最大。孫茜等[22]發現白刺、檸條錦雞兒、無葉沙拐棗、紅花錦雞兒等蒙古沙冬青的伴生植物DSE定殖率最大值在0~20 cm土層,且定殖率均表現為淺土層高于深土層。本研究同樣發現DSE定殖率在不同土層間有差異,但其中20~40 cm土層DSE定殖率高于0~20 cm和40~60 cm土層,這可能是與宿主植物根系分布有關。構樹、蒙古沙冬青、沙蒿及白刺等植物根系入土淺,主要分布在0~20 cm土層,可能是淺土層土壤表面落葉及腐殖質積累較多,土壤通氣性佳,微生物資源多樣,對DSE生長有利。而枸杞根系側、須根分布的高密度區是在距地表20~40 cm的較深土層內,生物量最大[23],可為DSE提供更多的寄居環境。因此,根系的空間分布可能導致植物DSE定殖不同。DSE較高定殖可使根系生物量顯著提高,對根系生長范圍擴大有益[24]。
DSE廣泛分布于各類生境,特別是在脅迫環境及受干擾嚴重區域,其組成在不同生境中有明顯差別[5]。余鑫[25]分析認為在重金屬礦區中蘆竹的DSE定殖率和生態環境密切相關,相比于水生環境,陸生環境下DSE定殖率顯著較大,且能達到水生環境蘆竹根內定殖率的3倍多。Casanova-Katny等[26]通過分析智利中部安第斯山脈不同海拔中23 種植物共生真菌的定殖情況,得到DSE侵染程度隨海拔升高而增大。李寶庫等[27]也得到了一致的結論。本研究發現金鳳區樣地DSE總定殖率、菌絲定殖率與微菌核定殖率均顯著高于西夏區樣地,可能是因為金鳳區的風沙土表層營養物質流動性大,根系較淺的植株只能在淺土層獲取有限的營養物質,根系較深的植物能夠利用更深土層養分,而在西夏區高肥力土壤中DSE的礦化作用[28]下降,植物可以直接從土壤吸收所需營養物質,使DSE與植物之間的互動聯系降低,可能造成西夏區樣地DSE的定殖率下降。由此可見,DSE的定殖可能受到生境和宿主根部結構的雙重影響。
3.2 DSE與土壤因子的關系
土壤理化性質對微生物的群落結構有重要影響[29]。土壤pH可影響植物對土壤元素的有效利用,大多數植物的最大養分利用率pH 為 ?6.0~7.5,土壤pH升高反而會限制土壤養分的吸收[30]。本研究中,金鳳區DSE定殖與土壤pH在7.5~8.2顯著負相關,當pH較高時,可能會通過促進土壤養分的礦化而在某種程度抑制DSE的定殖。土壤有機質作為土壤中各種營養元素尤其是氮、磷的重要來源,其含量高低直接影響了土壤肥力和土壤質量[31]。Li等[32]發現土壤有機質與菌絲、微菌核定殖呈顯著正相關。Hou等[20]也得出微菌核定殖與土壤有機碳(SOC)呈顯著正相關。本研究發現金鳳區樣地枸杞根系的DSE總定殖率、菌絲定殖率與土壤有機質呈顯著正相關,與前人結論一致。而西夏區DSE菌絲定殖率與有機質呈顯著負相關可能也與pH過高,抑制了DSE的定殖相關。張娟等[33]發現沙鞭群落空地DSE總定殖率、菌絲定殖率和微菌核定殖率與堿解氮、速效磷呈極顯著正相關,與本試驗金鳳區所得結果一致。氮和磷是植物生長的必要營養元素,作為植物生長最重要的限制資源之一,兩者影響植物從代謝到生物量生產和生長的各個層面,DSE真菌則可在宿主根部定殖促進宿主對氮素和磷的吸收[34]。
土壤酶作為土壤評價體系中一項重要的生物學指標,是具有催化能力的“特殊有機體”,能夠參與土壤新陳代謝并表示土壤養分轉化能力的強弱[35]。土壤磷酸酶、脲酶、蔗糖酶等水解酶活性能夠表征土壤碳氮磷等營養物質的循環情況,與土壤養分密切相關[36]。王少杰等[18]研究得出烏海、阿拉善左旗和民勤樣地DSE菌絲定殖的主要土壤影響因子均有堿性磷酸酶。石經新[37]認為西北荒漠黑枸杞的菌絲定殖率、總定殖率和定殖強度與堿性磷酸酶、脲酶顯著負相關。賀學禮等[38]通過揭示DSE在荒漠沙蒿根圍的空間分布及其與土壤因子的相關程度,指出DSE定殖與脲酶呈負相關。葛佳麗等[17]認為不同根系來源樣品DSE定殖率與脲酶存在極顯著負相關性,與本研究西夏區枸杞根系DSE菌絲定殖率與脲酶顯著負相關的結果一致。Xie等[39]認為DSE能夠促進土壤氮和磷的循環利用是經過脲酶和磷酸酶活性升高間接作用實現的。脲酶參與的酶促反應可產生一種氮源氨,能被植物有效利用,其活性也體現出土壤將有機態氮轉化為有效態氮及土壤供應無機氮的能力[40]。方差分解分析表明,土壤因子會影響寧夏銀川市枸杞DSE的侵入和定殖。同時,DSE定殖與樣地、土層深度、土壤因子(土壤理化性質和土壤酶活)的方差分解有23.1%的總方差未被解釋,說明還有其他因子可能影響DSE定殖,有待進一步探索。
4 結? 論
寧夏銀川市金鳳區和西夏區兩枸杞樣地根系均能被DSE定殖,可形成深色有隔菌絲、聚合型或離散型微菌核,具有明顯的空間異質性。pH、堿解氮、速效磷、有機質、堿性磷酸酶和蔗糖酶能綜合反映兩枸杞樣地根際土壤養分狀況。DSE定殖受到樣地和土壤因子的共同影響,并與土壤因子密切相關。說明DSE能與枸杞根系形成良好的共生關系,為充分利用DSE資源和生物技術促進荒漠植被恢復和生態改良提供依據。
參考文獻 Reference:
[1]胥生榮,張恩和,馬瑞麗,等.干旱脅迫及復水對耐旱枸杞水力學特性的影響[J].中國生態農業學報,2017,25(8):1190-1197.
XU SH R,ZHANG E H,MA R L,et al.Hydraulic characteristics of Lycium barbarum L.seedlings under drought stress and re-watering conditions[J].Chinese Journal of Eco-Agriculture,2017,25(8):1190-1197.
[2]朱娟娟,馬海軍,張 琇,等.鹽脅迫下解鉀菌對枸杞幼苗的促生效應[J].應用生態學報,2021,32(4):1289-1297.
ZHU J J,MA H J,ZHANG X,et al.Effects of potassium-solubilizing bacteria promoting the growth of Lycium barbarum seedlings under salt stress[J].Chinese Journal of Applied Ecology,2021,32(4):1289-1297.
[3]如克亞·加帕爾,孫玉敬,鐘烈州,等.枸杞植物化學成分及其生物活性的研究進展[J].中國食品學報,2013,13(8):161-172.
RUKEYA·JIAPAER,SUN Y J,ZHONG L ZH,et al.A review of phytochemical composition and bio-active of Lycium barbarumfruit (Goji)[J].Journal of Chinese Institute of Food Science and Technology,2013,13(8):161-172.
[4]趙 琴,潘 靜,曹 兵,等.氣溫升高與干旱脅迫對寧夏枸杞光合作用的影響[J].生態學報,2015,35(18):6016-6022.
ZHAO Q,PAN J,CAO B,et al.Effects of elevated temperature and drought stress on photosynthesis of Lycium barbarum[J].Acta Ecologica Sinica,2015,35(18):6016-6022.
[5]劉茂軍,張興濤,趙之偉.深色有隔內生真菌(DSE)研究進展[J].菌物學報,2009,28(6):888-894.
LIU M J,ZHANG X T,ZHAO ZH W.Advances in the research of dark septate endophytes[J].Mycosystema,2009,28(6):888-894.
[6]ARI J,JAMES M T.Dark septate endophytes:a review of facultative biotrophic root-colonizing fungi[J].New Phytologist,1998,140(2):295-310.
[7]HE C,WANG W Q,HOU J L.Characterization of dark septate endophytic fungi and improve the performance of liquorice under organic residue treatment[J].Frontiers in Microbiology,2019,10:1364.
[8]JIN H Q,LIU H B,XIE Y Y,et al.Effect of the dark septate endophytic fungus Acrocalymma vagum on heavy metal content in tobacco leaves[J].Symbiosis,2018,74(2):89-95.
[9]HARSONOWATI W,MARIAN M,SURONO,et al.The effectiveness of a dark septate endophytic fungus,Cladophialophora chaetospira SK51,to mitigate strawberry Fusarium wilt disease and with growth promotion activities[J].Frontiers in Microbiology,2020,11:585.
[10]胡麗杰,閆思遠,孫牧笛,等.寧夏枸杞深色有隔內生真菌的侵染特征及多樣性[J].微生物學通報,2019,46(11):2973-2984.
HU L J,YAN S Y,SUN M D,et al.Infection characteristics and diversity of dark septate endophytic fungi isolated from? Lycium barbarum in Ningxia[J].Microbiology China,2019,46(11):2973-2984.
[11]胡麗杰,閆思遠,李嘉泓,等.枸杞內生真菌對膠孢炭疽菌Colletotrichum? gloeosporioides的拮抗作用及生防潛力[J].植物保護,2020,46(1):125-133.
HU L J,YAN S Y,LI J H,et al.Antagonism and control potential of endophytic fungi from Lycium barbarum? ?against Colletotrichum gloeosporioides[J].Plant Protection,2020,46(1):125-133.
[12]PHILLIPS J M,HAYMAN D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society,1970, ?55(1):158-161.
[13]曹冠華,張 雪,顧 雯,等.不同產地滇黃精叢枝菌根真菌、深色有隔內生真菌定殖調查及與主要功效成分含量相關性分析[J].中草藥,2019,50(16):3930-3936.
CAO G H,ZHANG X,GU W,et al.Colonization investigation of arbuscular mycorrhizal fungi (AMF) and dark septate endophytes (DSE) in roots of Polygonatum kingianum and their correlations with content of main functional components in rhizomes[J].Chinese Traditional and Herbal Drugs,2019,50(16):3930-3936.
[14]鮑士旦.土壤農化分析[M].第3版.北京:中國農業出版社,2008.
BAO SH D.Agrochemical Analysis of Soil [M].3rd ed Beijing:Chinese Agriculture Press,2008.
[15]關松蔭.土壤酶及其研究法[M].北京:農業出版社,1986.
GUAN S Y.Soil Enzyme and Its Research Method[M].Beijing:Agriculture Press,1986.
[16]趙 昕,高慧利,龍俊萌,等.西北沙區梭梭根系深色有隔內生真菌等微生物時空分布及對根際土壤環境的響應[J].菌物學報,2021,40(10):2716-2734.
ZHAO X,GAO H L,LONG J M.Spatial and temporal distribution and the response to rhizosphere soil environment of dark septate endophyte and other microorganisms in roots of Haloxylon ammodendron in sand area of Northwest China[J].Mycosystema,2021,40(10):2716-2734.
[17]葛佳麗,張琳琳,李欣玫,等.極旱荒漠植物深色有隔內生真菌定殖及其與土壤因子的相關性[J].河北大學學報(自然科學版),2018,38(1):73-82.
GE J L,ZHANG L L,LI X M,et al.Colonization of dark septate endophytes in roots of different plants and its correlation with soil factors in extreme arid desert environment[J].Journal of Hebei University (Natural Science Edition),2018,38(1):73-82.
[18]王少杰,侯力峰,解琳琳,等.蒙古沙冬青根系DSE定殖與土壤因子典范對應分析[J].河北大學學報(自然科學版),2017,37(5):497-507.
WANG SH J,HOU L F,XIE L L,et al.CCA analysis of colonization of DSE in the rhizosphere of Ammopiptanthus mongolicus in relation to soil factors[J].Journal of Hebei University (Natural Science Edition),2017,37(5):497-507.
[19]李雪夢.四子王旗荒漠草原植物深色有隔內生真菌(DSE)研究[D].呼和浩特:內蒙古農業大學,2019.
LI X M.Study on dark septate endophytes of defferent? plants in the desert steppe of Siziwang banner[D].Hohhot:Inner Mongolia Agricultural University,2019.
[20]HOU L F,HE X L,LI X,et al.Species composition and colonization of dark septate endophytes are affected by host plant species and soil depth in the Mu Us sandland,northwest China[J].Fungal Ecology,2019,39:276-284.
[21]蔚 杰,賀學禮,趙麗莉,等.河北峰峰礦區深色有隔內生真菌定殖及群落組成[J].菌物研究,2018,16(4):228-238.
YU J,HE X L,ZHAO L L,et al.Colonization and community composition of dark endophytic fungi in Fengfeng mining area of Hebei[J].Journal of Fungal Research,2018,16(4):228-238.
[22]孫 茜,賀 超,賀學禮,等.沙冬青與伴生植物深色有隔內生真菌定殖規律及其與土壤因子的相關性[J].植物生態學報,2015,39(9):878-889.
SUN Q,HE CH,HE X L,et al.Colonization of dark septate endophytes in roots of Ammopiptanthus mongolicusand its associated plants as influenced by soil properties [J].Chinese Journal of Plant Ecology,2015,39(9):878-889.
[23]占玉芳,魯延芳,甄偉玲,等.河西灌區枸杞根系空間分布特征研究[J].水土保持研究,2016,23(4):133-137
ZHAN Y F,LU Y F,ZHEN W L,et al.Spatial distribution characteristics of root system of Lycium barbarum L.in Hexi? irrigation area[J].Research of Soil and Water Conservation,2016,23(4):133-137.
[24]NEWSHAM K K.A meta-analysis of plant responses to dark septate root endophytes[J].New Phytol,2011, ?190(3):783-793.
[25]余 鑫.云南募乃鉛鋅礦區陸生和水生蘆竹DSE多樣性及其功能初探[D].昆明:云南大學,2016.
YU X.Diversity and functions of dark septate endophytes (DSE) colonizing the aquatic and terrestrial Arundo donax in Munai Pb/Zn slag heap,Yunnan,SW China[D].Kunming:Yunnan University,2016.
[26]CASANOVA-KATNY M A,TORRES-MELLADO G A,PALFNER G,et al.The best for the guest:high Andean nurse cushions of Azorella madreporica enhance arbuscular mycorrhizal status in associated plant species[J].Mycorrhiza,2011, ?21(7):613-622.
[27]李寶庫,賀學禮,吳偉家.不同海拔蒙古沙冬青根系深色有隔內生真菌(DSE)定殖的空間變化[J].江蘇農業科學,2016,44(5):502-505.
LI B K,HE X L,WU W J.Spatial changes of dark septate endophytic fungi (DSE) colonization in roots of Ammopiptanthus mongolicus at different altitudes[J].Jiangsu Agricultural Sciences,2016,44(5):502-505.
[28]HOEKSEMA J D,CHAUDHARY V B,GEHRING C A,et al.A meta-analysis of context-dependency in plant response to inoculation with mycorrhizal fungi[J].Ecology Letters,2010,13(3):394-407.
[29]王鎣燕,王子芳,黃 容,等.縉云山不同森林植被下土壤微生物群落結構特征研究[J].土壤學報,2019,56(5):1210-1220.
WANG Y Y,WANG Z F,HUANG R,et al.Characterization of soil microbial community structure as affected by vegetation in Jinyun mountain[J].Acta Pedologica Sinica,2019,56(5):1210-1220.
[30]ZHAO J,DONG Y,XIE B B,et al.Effect of annual variation in soil pH on available soil nutrients in pear orchards[J].Acta Ecologica Sinica,2011,31(4):212-216.
[31]吳海燕,金榮德,范作偉,等.基于主成分和聚類分析的黑土肥力質量評價[J].植物營養與肥料學報,2018,24(2):325-334.
WU H Y,JIN R D,FAN Z W,et al.Assessment of fertility quality of black soil based on principal component and cluster analysis[J].Journal of Plant Nutrition and Fertilizers,2018,24(2):325-334.
[32]LI B K,HE X L,HE C,et al.Spatial dynamics of dark septate endophytes and soil factors in the rhizosphere of Ammopiptanthus mongolicus in Inner Mongolia,China[J].Symbiosis,2015,65(2):75-84.
[33]張 娟,賀學禮,趙麗莉,等.荒漠土壤因子和DSE定殖對克隆植物入侵的響應[J].生態學報,2015,35(4):1095-1103.
ZHANG J,HE X L,ZHAO L L,et al.Responses of desert soil factors and dark septate endophytes colonization to clonal plants invasion[J].Acta Ecologica Sinica,2015, ?35(4):1095-1103.
[34]VERGARA C,ARAUJO K E C,ALVES L S,et al.Contribution of dark septate fungi to the nutrient uptake and growth of rice plants[J].Brazilian Journal of Microbiology,2018,49(1):67-78.
[35]王 銳,閆鵬科,馬婷慧,等.行內生草對土壤微環境和釀酒葡萄品質的影響[J].干旱地區農業研究,2020,38(3):195-203.
WANG R,YAN P K,MA T H,et al.Effects of intra-row planted grass on soil microenvironment and wine grape quality[J].Agricultural Research in the Arid Areas,2020,38(3):195-203.
[36]劉紅梅,周廣帆,李 潔,等.氮沉降對貝加爾針茅草原土壤酶活性的影響[J].生態環境學報,2018,27(8):1387-1394.
LIU H M,ZHOU G F,LI? J,et al.Effects of nitrogen deposition on soil enzyme activities of stipa baicalensis steppe[J].Ecology and Environmental Sciences,2018,27(8):1387-1394.
[37]石經新.西北荒漠黑枸杞深色有隔內生真菌時空分布和促生抗旱研究[D].河北保定:河北大學,2021.
SHI J X.Spatiotemporal distribution and drought? promotion of dark septate endophytes fungi in Lycium ruthenicum in Northwest China [D].Baoding Hebei:Hebei University,2021.
[38]賀學禮,王銀銀,趙麗莉,等.荒漠沙蒿根圍AM真菌和DSE的空間分布[J].生態學報,2011,31(3):812-818.
HE X L,WANG Y Y,ZHAO L L,et al.Spatial distribution of arbuscular mycorrhizal fungi and dark septate endophytes in the rhizosphere of Artemisia sphaerocephala from Inner Mongolia desert[J].Acta Ecologica Sinica,2011,31(3):812-818.
[39]XIE L L,HE X L,WANG K,et al.Spatial dynamics of dark septate endophytes in the roots and rhizospheres of Hedysarum scoparium in northwest China and the influence of edaphic variables[J].Fungal Ecology,2017,26:135-143.
[40]徐浩博,賀學禮,許 偉,等.蒙古沙冬青根圍叢枝菌根和深色有隔內生真菌的空間分布[J].貴州農業科學,2013,41(12):105-109.
XU H B,HE X L,XU W,et al.Spatial distribution of arbuscular? mycorrhizal fungi and dark septate endophytes in the rhizosphere of Ammopiptanthus mongolicus[J].Guizhou Agricultural Sciences,2013,41(12):105-109.
Colonization of Dark Septate? Endophytes Fungi in Lycium barbarum and? Its Correlation with Soil Factors
WANG Ruotong, CHEN Sijie, JU Mingxiu, YAN Siyuan, LI Jin and GU Peiwen
Abstract In the present study, we investigated the colonization of dark septate endophytes (DSE) in the roots of Lycium barbarum and its correlation with soil factors, and collected the root and inter-root soil samples at three soil depths of 0-20 cm, 20-40 cm and 40-60 cm from? cultivation area of L.barbarum? in Jinfeng district and Xixia district of Yinchuan in Ningxia, so as? to provide a basis for the full utilization of DSE resources and biotechnology-based promotion of desert vegetation restoration and ecological improvement.The results showed that DSE could colonize the root system of ??L.barbarum, form dark and septate hyphae, and? generate polymeric and discrete microsclerotia.The rate of DSE colonization was significantly different between the two sample plots.The mean total colonization rate of DSE in Jinfeng (73.27%) was significantly higher than that in Xixia (23.54%).The DSE colonization rates varied among different soil layers.The maximum values of total DSE colonization rate, hyphae colonization rate and microsclerotia colonization rate were all found at the 20-40 cm soil layers? of both sample plots.The distribution of soil factors differed significantly among different soil depths in the two samples.The principal component analysis showed that the rhizosphere soil nutrient status was affected comprehensively by pH, alkali hydrolyzable nitrogen, available phosphorus, organic matter, alkalin phosphatase and sucrase in two sample plots of Yinchuan.Variation partitioning revealed that the colonization of DSE fungi was affected by a combination of sample site and soil factors.The correlation analysis showed that DSE colonization differed significantly between the two samples.In the sample plot of Jinfeng district, the total DSE colonization rate had significantly positive correlation with organic matter, and significantly negative correlation with available potassium.The DSE hyphae colonization rate had significantly positive correlation with organic matter, available phosphorus and alkaline nitrogen, and significantly negative correlation with available potassium and pH.In the sampling site of Xixia, the total DSE colonization rate and the microsclerotia colonization rate had significantly positive correlation with pH, while the DSE hyphae colonization rate had significantly negative correlation with organic matter, available phosphorus and urease.The findings in this study indicated that the root system of L.barbarum can be infested by DSE, the colonization exhibits? obvious vertical spatial heterogeneity and is closely related to soil factors.
Key words Dark septate endophytes; Lycium barbarum;Colonization status;Soil factors
Received2022-07-29Returned 2022-08-01
Foundation item National Natural Science Foundation of China(No.31460484);Key Research and Development Plan of China(No.2019YFD10025002).
First author WANG Ruotong, female,master student.Research area:biological control and mycological resources utilization.E-mail:wangruotong0729@163.com
Corresponding?? author GU Peiwen, female,Ph.D,professor.Research area:biological control and mycological resources utilization.E-mail:gupeiwen2013@126.com
(責任編輯:史亞歌 Responsible editor:SHI Yage)
收稿日期:2022-07-29修回日期:2022-08-01
基金項目:國家自然科學基金(31460484);國家重點研發計劃(2019YFD10025002)。
第一作者:王若彤,女,碩士研究生,研究方向為生物防治與菌物資源利用。E-mail:wangruotong0729@163.com
通信作者:顧沛雯,女,博士,教授,研究方向為生物防治與菌物資源利用。E-mail:gupeiwen2013@126.com

