黃芩苷通過抑制TLR2/MyD88/NF-κB信號通路減輕帶狀皰疹后遺神經痛大鼠神經炎癥
胡焓 馮丹 田佳玉 童勝雄 張書力 (武漢市第一醫院疼痛科,湖北 武漢 430022)
帶狀皰疹后遺神經痛(PHN)是水痘-帶狀皰疹病毒感染損傷脊髓后根神經節引起的一種頑固性神經疼痛疾病,自發痛、誘發痛和熱敏感性受損是其主要臨床癥狀,給患者生活和身心健康造成極大困擾〔1,2〕。水痘-帶狀皰疹作為一種嗜神經性病毒,激活膠質細胞,促進促炎因子表達,引發脊髓組織神經炎癥,造成神經細胞損傷凋亡是PHN的主要發病機制,減輕神經炎癥是PHN的有效治療策略〔3,4〕。Toll樣受體(TLR)是征募與誘導促炎細胞因子和趨化因子產生的信號,包括TLR2~TLR9蛋白分子,均可促進髓樣分化因子(MyD88)表達和核轉錄因子(NF)-κB磷酸化,促使促炎細胞因子和趨化因子在膠質細胞和神經元中表達,引發神經變性損傷〔5〕,研究顯示,TLR2參與神經病理性疼痛的發病機制,下調其表達可緩解糖尿病引發的神經炎癥損傷,減輕2型糖尿病患者神經病理性疼痛〔6〕,還可通過降低MyD88和促炎因子表達抑制三叉神經痛小鼠神經炎癥,進而發揮鎮痛作用〔7〕,由此可知TLR2/MyD88/NF-κB是治療PHN的潛在作用靶點。黃芩苷是黃芩根中的提取物,是具有很強抗炎、抗凋亡作用的黃酮類化合物,對腦缺血、帕金森病、癲癇等中樞神經系統疾病可起到神經保護作用〔8〕,能抑制TLR2/MyD88/NF-κB信號活化,進而減輕類風濕關節炎大鼠滑膜炎〔9〕,還可通過抑制炎癥反應來降低脊神經結扎模型大鼠疼痛敏感程度〔10〕。因此推測黃芩苷可能通過抑制TLR2/MyD88/NF-κB信號激活而減輕PHN大鼠神經炎癥,本研究以不同劑量黃芩苷處理PHN大鼠,對此推測做驗證研究。
1 材料與方法
1.1實驗動物 SD大鼠,SPF級,約6周齡,雄性,體質量210~240 g,購于簡陽達碩動物科技有限公司,生產許可證號SCXK(川)2021-036。在達到屏障環境級別的動物房中分籠適應飼養,每籠不超過5只,光照:12 h/12 h明暗交替循環,濕度:55%~65%,溫度:22.0~24.5 ℃。
1.2試劑與儀器 樹脂毒素(RTX,純度:95%~99%,貨號TC0309)、黃芩苷(純度:95%~99%,貨號TC0706)購自四川精萃天成藥物科技有限公司;大鼠環氧化酶(COX)-2酶聯免疫吸附試驗(ELISA)試劑盒(貨號SEKR-0075)、大鼠前列腺素(PG)E2 ELISA試劑盒(貨號SEKR-0053)、通用SP超敏免疫組化試劑盒(貨號SP0041)購自北京索萊寶科技有限公司;TUNEL檢測試劑盒(貨號ab206386)、大鼠白細胞介素(IL)-18 ELISA(貨號ab213909)、兔源抗大鼠Anti-TLR2一抗(貨號ab209217)、兔源抗大鼠Anti-MyD88一抗(貨號ab219413)、辣根過氧化物酶(HRP)耦聯羊抗兔二抗(貨號ab205718)、兔源抗大鼠Anti-p-NF-κB p65一抗(ab239882)、兔源抗大鼠Anti-β-actin一抗(貨號ab8227)、兔源抗大鼠Anti-淋巴細胞功能相關抗原(LFA)-1一抗(貨號ab186873)、兔源抗大鼠Anti-NF-κB p65一抗(貨號ab16502)購自美國Abcam公司。Von Frey纖維絲測痛儀(型號37450)、足底紅外熱刺激儀(型號55370,意大利Ugo Basile公司);石蠟切片機(型號6062,德國SLEE公司);光學顯微鏡(VHX-7000,日本基恩士公司);基礎電泳儀電源(型號1645050)、全段酶標儀(型號1681135)、凝膠成像分析系統(型號SYSTEM GelDoc XR+)、小型垂直電泳轉印系統(型號1658033,美國Bio-Rad公司)。
1.3制備PHN大鼠模型并分組處理 采用RTX誘導制備PHN大鼠模型,具體方法參照文獻〔11〕:以含10%Tween 80和10%乙醇的生理鹽水溶解RTX,得到質量濃度100 μg/ml的RTX溶液備用,取SD大鼠檢測其機械和熱痛覺敏感性后腹腔注射200 μg/kg劑量的RTX溶液(100 μg/ml的RTX溶液2 ml/kg),3 d后再次對大鼠機械和熱痛覺敏感性進行檢測,若大鼠縮爪閾值相比造模前顯著降低,同時熱敏潛伏期顯著升高,即表明PHN造模成功。隨機分為模型組、黃芩苷低劑量組、黃芩苷高劑量組、黃芩苷高劑量+空載質粒組、黃芩苷高劑量+TLR2過表達組,每組10只,另外隨機選出10只SD大鼠,以2 ml/kg劑量的含10%Tween 80和10%乙醇生理鹽水進行腹腔注射,作為對照組。
以生理鹽水溶解黃芩苷制作3、6 mg/ml的黃芩苷藥液,黃芩苷低劑量組、黃芩苷高劑量組大鼠分別灌胃10 ml/kg的3、6 mg/ml的黃芩苷藥液(1次/d,黃芩苷劑量分別達到30、60 mg/kg)〔10〕,同時尾靜脈注射與黃芩苷高劑量+TLR2過表達組等劑量的生理鹽水(2次/w);黃芩苷高劑量+空載質粒組、黃芩苷高劑量+TLR2過表達組灌胃10 ml/kg的6 mg/ml的黃芩苷藥液(1次/d,黃芩苷劑量分別達到60 mg/kg),同時分別尾靜脈注射空載質粒、TLR2過表達質粒溶液(2次/w,劑量參照說明書);模型組、對照組灌胃10 ml/kg的生理鹽水(1次/d),同時尾靜脈注射與黃芩苷高劑量+TLR2過表達組等劑量的生理鹽水(2次/w),各組均處理2 w。
1.4檢測大鼠長時程自發痛、機械和熱痛覺敏感性 于2 w給藥結束后24 h檢測各組大鼠長時程自發痛、機械和熱痛覺敏感性。以Von Frey纖維絲測痛儀檢測機械痛覺敏感性:取出各組大鼠,等其進入平靜狀態時,以纖維絲刺激針刺激大鼠后側右肢足底,壓力值從小到大的纖維絲依次刺激,每個壓力值刺激10次(每次間隔15 s),大鼠出現5次以上縮足反應的纖維絲壓力值即為大鼠縮爪閾值,每只大鼠測3次后取平均值。以足底紅外熱刺激儀檢測熱痛覺敏感性:取出各組大鼠放入透明有機玻璃箱(底部厚2 mm)中,并將玻璃箱放在高出實驗臺30 cm的架子上,等大鼠進入平靜狀態時,打開紅外熱刺激儀,并調節燈源與玻璃箱底部距離,使照射大鼠足底的光圈直徑為5 mm,記錄自開始照射到大鼠出現縮足反應所用時間,即為熱敏潛伏期,每只大鼠測3次后取平均值。采用攝像機記錄3 h內置于有機玻璃箱(30 cm×30 cm×30 cm)中的大鼠自發縮足反射總次數,計算單位時間(h)內大鼠自發縮足反射次數,作為大鼠長時程自發痛癥狀評測標準。
1.5采集標本并檢測大鼠脊髓神經細胞凋亡、脊髓組織炎性細胞浸潤 長時程自發痛、機械和熱痛覺敏感性檢測結束后以乙醚麻醉各組大鼠,采集其頸動脈血后離心,收集上清存于-80 ℃作為血清標本備用;斷頭處死大鼠后解剖剝離出脊髓組織,采用手術剪取下約0.8 g研磨勻漿后離心,收集上清采用二喹啉甲酸(BCA)法測出其中總蛋白濃度,存于-80 ℃作為脊髓組織樣品液備用;剩余脊髓組織沖洗、常規固定、逐級脫水、透明后,置于熱石蠟中包埋后切為5 μm厚的脊髓組織切片,脫蠟后逐級水化。
每只大鼠各選出6張無刀痕及破損的切片,其中3張以TUNEL檢測試劑盒做TUNEL凋亡細胞染色,另3張孵育3%過氧氮、封閉、稀釋250倍兔源抗大鼠Anti-LFA-1一抗、洗片后采用通用SP超敏免疫組化試劑盒孵育二抗并做免疫組織化學染色,將染色后的所有切片洗滌后封片觀察,采用光學顯微鏡隨機攝取每張切片任意5個視野圖像,并計數各細胞,算出脊髓神經細胞凋亡率和LFA-1陽性細胞比例,計算公式分別為:脊髓神經細胞凋亡率=脊髓神經細胞凋亡數/脊髓神經細胞總數×100%;LFA-1陽性細胞比例=LFA-1陽性細胞數/細胞總數×100%。
1.6檢測大鼠脊髓組織及血清PGE2、COX-2、IL-18水平 取出1.5中的脊髓組織樣品液和血清放入冰水浴中解凍,各取出350 μl采用ELISA試劑盒檢測其中PGE2、IL-18、COX-2水平,均遵照各自試劑盒說明書中步驟進行。
1.7檢測大鼠脊髓組織TLR2/MyD88/NF-κB通路相關蛋白表達1.6中剩余的脊髓組織樣品液中剩余的脊髓組織樣品液,根據測量的蛋白濃度結果,每組取15 μg總蛋白上樣、變性、跑電泳、轉膜,脫脂牛奶封閉蛋白非特異位點后裁下TLR2、MyD88、p-NF-κB p65、NF-κB p65、β-actin蛋白,孵育相對應兔源抗大鼠Anti-TLR2、MyD88、p-NF-κB p65、NF-κB p65、β-actin一抗后孵育HRP耦聯羊抗兔二抗,攝取蛋白條帶圖像后以ImageJ軟件分析量化其相對表達水平。
1.8統計學分析 采用SPSS26.0軟件進行t檢驗、單因素方差分析、SNK-q檢驗。
2 結 果
2.1黃芩苷對大鼠疼痛癥狀的影響 與對照組比較,模型組縮爪閾值顯著降低(P<0.05),熱敏潛伏期、自發縮足反射次數顯著升高(P<0.05)。與模型組比較,黃芩苷低劑量組、黃芩苷高劑量組、黃芩苷高劑量+空載質粒組縮爪閾值均顯著升高(P<0.05),熱敏潛伏期、自發縮足反射次數均顯著降低(P<0.05);黃芩苷高劑量組和黃芩苷高劑量+空載質粒組縮爪閾值顯著高于黃芩苷低劑量組(P<0.05),熱敏潛伏期、自發縮足反射次數顯著降低(P<0.05)。與黃芩苷高劑量組比較,黃芩苷高劑量+空載質粒組縮爪閾值、熱敏潛伏期、自發縮足反射次數無明顯變化(P>0.05);黃芩苷高劑量+TLR2過表達組縮爪閾值顯著降低(P<0.05),熱敏潛伏期、自發縮足反射次數顯著升高(P<0.05)。見表1。
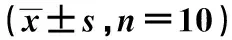
表1 各組自發縮足反射次數、縮爪閾值、熱敏潛伏期、脊髓組織PGE2、IL-18、COX-2水平及脊髓神經細胞凋亡率比較
2.2黃芩苷對脊髓神經細胞凋亡的影響 與對照組比較,模型組脊髓神經細胞凋亡率顯著升高(P<0.05)。與模型組比較,黃芩苷低劑量組、黃芩苷高劑量組、黃芩苷高劑量+空載質粒組脊髓神經細胞凋亡率均顯著降低(P<0.05);黃芩苷高劑量組和黃芩苷高劑量+空載質粒組脊髓神經細胞凋亡率相比黃芩苷低劑量組顯著降低(P<0.05)。與黃芩苷高劑量組比較,黃芩苷高劑量+空載質粒組脊髓神經細胞凋亡率無明顯變化(P>0.05);黃芩苷高劑量+TLR2過表達組脊髓神經細胞凋亡率顯著升高(P<0.05)。見表1、圖1。

圖1 TUNEL法檢測脊髓神經細胞凋亡(×200)
2.3黃芩苷對脊髓組織炎癥因子PGE2、IL-18、COX-2水平的影響 與對照組比較,模型組脊髓組織PGE2、IL-18、COX-2水平顯著升高(P<0.05)。與模型組比較,黃芩苷低劑量組、黃芩苷高劑量組、黃芩苷高劑量+空載質粒組脊髓組織PGE2、IL-18、COX-2水平均顯著降低(P<0.05);黃芩苷高劑量組脊髓組織PGE2、IL-18、COX-2水平相比黃芩苷低劑量組顯著降低(P<0.05)。與黃芩苷高劑量組比較,黃芩苷高劑量+空載質粒組脊髓組織PGE2、IL-18、COX-2水平無明顯變化(P>0.05);黃芩苷高劑量+TLR2過表達組脊髓組織PGE2、IL-18、COX-2水平顯著升高(P<0.05)。見表1。
2.4黃芩苷對脊髓組織炎性細胞浸潤的影響 與對照組比較,模型組脊髓組織LFA-1陽性細胞比例顯著升高(P<0.05)。與模型組比較,黃芩苷低劑量組、黃芩苷高劑量組、黃芩苷高劑量+空載質粒組脊髓組織LFA-1陽性細胞比例均顯著降低(P<0.05);黃芩苷高劑量組、黃芩苷高劑量+空載質粒組脊髓組織LFA-1陽性細胞比例相比黃芩苷低劑量組顯著降低(P<0.05)。與黃芩苷高劑量組比較,黃芩苷高劑量+空載質粒組脊髓組織LFA-1陽性細胞比例無明顯變化(P>0.05);黃芩苷高劑量+TLR2過表達組脊髓組織LFA-1陽性細胞比例顯著升高(P<0.05)。見圖2、表2。

圖2 免疫組織化學染色檢測各組脊髓組織炎性細胞浸潤(×200)
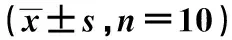
表2 各組血清PGE2、IL-18、COX-2水平、脊髓組織TLR2/MyD88/NF-κB通路相關蛋白相對表達水平及脊髓組織LFA-1陽性細胞比例比較
2.5黃芩苷對血清炎癥因子PGE2、IL-18、COX-2水平的影響 與對照組比較,模型組血清PGE2、IL-18、COX-2水平顯著升高(P<0.05)。與模型組比較,黃芩苷低劑量組、黃芩苷高劑量組、黃芩苷高劑量+空載質粒組血清PGE2、IL-18、COX-2水平顯著降低(P<0.05);黃芩苷高劑量組血清PGE2、IL-18、COX-2水平較黃芩苷低劑量組顯著降低(P<0.05)。與黃芩苷高劑量組比較,黃芩苷高劑量+空載質粒組血清PGE2、IL-18、COX-2水平無明顯變化(P>0.05);黃芩苷高劑量+TLR2過表達組血清PGE2、IL-18、COX-2水平顯著升高(P<0.05)。見表2。
2.6黃芩苷對脊髓組織TLR2/MyD88/NF-κB通路相關蛋白表達的影響 與對照組比較,模型組脊髓組織TLR2、MyD88蛋白表達及p-NF-κB p65/NF-κB p65顯著升高(P<0.05)。與模型組比較,黃芩苷低劑量組、黃芩苷高劑量組、黃芩苷高劑量+空載質粒組脊髓組織TLR2、MyD88蛋白表達及p-NF-κB p65/NF-κB p65均顯著降低(P<0.05);黃芩苷高劑量組脊髓組織TLR2、MyD88蛋白表達及p-NF-κB p65/NF-κB p65相比黃芩苷低劑量組顯著降低(P<0.05)。與黃芩苷高劑量組比較,黃芩苷高劑量+空載質粒組脊髓組織TLR2、MyD88蛋白表達及p-NF-κB p65/NF-κB p65無明顯變化(P>0.05);黃芩苷高劑量+TLR2過表達組脊髓組織TLR2、MyD88蛋白表達及p-NF-κB p65/NF-κB p65顯著升高(P<0.05)。見表2、圖3。

1~6:對照組、模型組、黃芩苷低劑量組、黃芩苷高劑量組、黃芩高劑量+空載質粒組、黃芩苷高劑量+TLR2過表達組圖3 Western印跡檢測各組脊髓組織TLR2/MyD88/NF-κB通路相關蛋白表達
3 討 論
我國PHN發病率呈上升趨勢,但目前還沒有特別有效的治療手段,臨床中主要是選擇鎮痛藥進行對癥治療,但很多患者疼痛癥狀沒有得到很好的緩解,并且還存在很多不良反應,因此還需尋找開發新型治療藥物〔12,13〕。RTX處理大鼠可使其產生PHN類似的如機械痛覺敏感性降低及熱痛覺敏感性升高的臨床癥狀,因此本研究以腹腔注射RTX的方法制備PHN模型,結果表明腹腔注射RTX可引發強烈神經炎癥及脊髓組織大量炎性細胞浸潤,造成大鼠自發疼痛、熱痛閾升高、機械痛閾降低及脊髓神經損傷癥狀,提示PHN模型制備成功。
PHN被認為是一個慢性亞臨床炎癥過程,許多炎性因子參與了其發生發展過程,大量炎性因子釋放觸發的神經炎癥是導致PHN患者自發痛及機械痛覺過敏的重要機制之一,阻止炎癥發生可顯著降低PHN患者機械性異常疼痛程度〔14,15〕。黃芩苷提取自中藥黃芩中的天然黃酮類化合物,作為一種天然抗炎、抗凋亡、抗氧化劑,其還具有神經保護作用,可減輕各種中樞神經系統疾病引發的神經損傷〔8〕,能通過抑制炎癥和氧化應激而減輕氧糖剝奪誘導的神經元和人腦微血管內皮細胞損傷,改善腦缺血/再灌注損傷所致的記憶功能障礙〔16,17〕,并可抑制脊神經結扎模型大鼠炎癥,從而減輕其神經疼痛癥狀〔10〕,本研究結果表明黃芩苷可降低炎癥因子表達,抑制神經炎癥反應,減輕脊髓組織炎性細胞浸潤及神經細胞凋亡,減輕自發疼痛和機械性疼痛,改善熱痛閾升高癥狀,提示黃芩苷可用于治療PHN。
研究顯示病原體感染可通過激活先天免疫系統觸發疼痛,TLR2作為先天免疫的主要組成部分,介導各種炎癥疼痛的發生發展〔18〕,TLR2可激活下游MyD88/NF-κB信號通路,促使坐骨神經慢性壓迫性損傷(CCI)誘導的大鼠機械性痛覺和熱痛覺過敏,阻止TLR2/MyD88/NF-κB信號傳導可抑制CCI導致的脊髓組織神經炎癥,有效減輕大鼠神經病理性疼痛,最終對CCI模型大鼠發揮神經保護和持續鎮痛作用〔19〕,白琳等〔9〕研究發現黃芩苷可通過抑制TLR2/MyD88/NF-κB途徑介導的炎癥激活而減輕類風濕關節炎大鼠滑膜炎癥狀,因此推測黃芩苷減輕PHN大鼠神經炎癥的藥理機制可能是抑制TLR2/MyD88/NF-κB信號激活。本研究結果表明,TLR2/MyD88/NF-κB信號參與介導黃芩苷對PHN大鼠神經炎癥的抑制過程,過表達TLR2可減弱黃芩苷對神經炎癥和脊髓神經元凋亡的抑制作用,拮抗其對PHN大鼠自發疼痛和機械性痛閾降低、熱痛閾升高癥狀的緩解作用,最終逆轉黃芩苷對PHN大鼠的鎮痛治療作用,揭示黃芩苷抑制PHN大鼠神經炎癥是通過下調TLR2通路實現的。
綜上所述,黃芩苷可減弱TLR2、MyD88表達和NF-κB磷酸化,從而降低炎癥因子PGE2、IL-18、COX-2表達,抑制神經炎癥反應,減少脊髓神經細胞凋亡,緩解PHN大鼠機械性痛閾降低、熱痛閾升高癥狀,并最終減輕大鼠長時程自發疼痛,具有顯著鎮痛作用,抑制TLR2/MyD88/NF-κB信號同路可能是其藥理機制之一。本文為PHN的臨床治療找到了新的藥物選擇,并提供了理論依據,有利于黃芩苷在PHN臨床治療中的開發應用,但關于其藥理機制的研究還存在一定不足,后續會進行更深入探討。

