長鏈非編碼RNA XIST調控miR-124/STAT3軸參與糖尿病腎病纖維化的機制
趙積海 張喜俊 董效珍 牛讓花 楊紅
(嘉峪關市第一人民醫院 1內分泌科,甘肅 嘉峪關 735100;2檢驗科)
糖尿病腎病(DKD)是糖尿病的主要并發癥〔1〕。越來越多的研究證實,長鏈非編碼RNA(lncRNA)在DKD腎小球疾病、腎小管上皮細胞、腎足細胞損傷凋亡及腎纖維化進程中發揮重要調控作用,并有望成為未來治療DKD的新策略〔2〕。lncRNA中的鏈鎖X染色體特異性失活轉錄本(lncRNA-XIST)可調控細胞增殖、凋亡、炎癥、自噬等多種生理過程〔3〕,且有研究報道,lncRNA-XIST影響DKD腎衰竭及纖維化進程〔4〕,但其參與疾病過程的靶向調控機制還不明確。信號轉導和轉錄激活因子(STAT)3是一類兼有信號轉導和轉錄因子作用的蛋白,磷酸化的STAT3可以二聚體的形式進入細胞核,調控基因轉錄〔5〕,且大量文獻證實STAT3是DKD腎纖維化過程的重要通路〔6〕。微小(mi)RNA也是靶向抗DKD腎纖維化的重要治療策略〔7〕,研究證實miR-124可影響腎臟纖維化進程〔8〕,且miR-124與STAT3之存在靶向調控關系。但lncRNA-XIST是否能靶向調控miR-124/STAT3軸來緩解DKD腎纖維化進程還未見報道。本研究通過體內外實驗探討lncRNA-XIST影響DKD腎纖維化的靶向調控機制。
1 材料和方法
1.1動物及細胞來源 SPF級C57小鼠60只,體質量18~20 g,8~10周齡,購自廣東藥康生物科技有限公司,生產許可證號:SCXK(粵)2020-0054,使用許可證號:SYXK(粵)2020-0238。本實驗符合3R原則,經醫院倫理委員會批準。小鼠永生化足細胞由南京大學贈送。
1.2主要試劑及儀器 鏈脲佐菌素(貨號:sf1446)上海士鋒生物科技有限公司;24 h尿蛋白檢測用試劑盒-考馬斯亮藍試劑盒(貨號:C0054)購自上海寶曼生物科技有限公司;空腹血糖(FBG)、血清肌酐(SCr)和尿素氮(BUN)等酶聯免疫吸附試驗(ELISA)試劑盒(貨號:YS-E93554、JS15547、MM-20555R1)分別購自上海研生實業有限公司、青島捷世康生物科技有限公司及廣州市超博科技有限公司;Masson染色液(貨號:hz-44222-1)購自上海滬震實業有限公司;Hoechst33258染色液(貨號:SY1170)購自北京伊塔生物科技有限公司;STAT3(貨號:ab109085)、纖連蛋白(FN,貨號:ab254706)、轉化生長因子(TGF)-β1(貨號:ab254706)、Ⅳ型膠原蛋白(Collagen Ⅳ,貨號:ab182744)、纖維細胞特異蛋白(FSP)-1(貨號:ab213693)等抗體均購自美國Abcam公司。實時熒光定量聚合酶鏈反應儀(RT-qPCR)試劑盒(貨號:AB4106A)、Trizol試劑盒(貨號:12183555)均購自美國賽默飛公司;STELLARIS型共聚焦顯微鏡購自德國徠卡;JEM-ARM300F透射電鏡購自深圳市研盟科技有限公司等。
1.3DKD活檢腎組織標本及正常腎組織標本獲取及lncRNA-XIST、miR-124表達檢測 收集2015年3月至2020年3月在嘉峪關市第一人民醫院糖尿病腎病科就診的DKD腎組織標本6例。正常腎組織標本來自因交通意外事故死亡、法醫鑒定健康無其他疾病、遺體捐贈的死亡人群6例。納入標準:18~60歲,經腎穿刺活檢確診為糖尿病腎病;排除原發性急慢性腎小球腎炎、合并其他繼發性腎小球腎炎或腎病、嚴重營養不良、急性心腦血管疾病、自身免疫性、傳染病、腫瘤、惡性血液系統疾病等患者。以上所有組織標本的使用,患者本人或家屬均知情并簽署知情同意書。本課題研究內容經醫院倫理委員會批準。組織標本均于液氮中速凍后于-80 ℃保存。將各組織標本,4 ℃解凍后冰上勻漿、離心、用Trizol提取試劑盒提取總RNA,用逆轉錄試劑盒逆轉錄cDNA。以cDNA為模板,按照qRT-PCR試劑盒說明書進行PCR,檢測lncRNA-XIST、miR-124表達水平。lncRNA-XIST以三磷酸甘油醛脫氫酶(GAPDH)為內參,miR-124以U6為內參基因,采用2-ΔΔCt算法進行計算。引物由生工生物工程(上海)股份有限公司合成,引物序列(5′-3′)為:lncRNA-XIST:正向:AGCTCCTCGGACAGCTCTAA,反向:CTCCAGATAGCTGGCAACC;GAPDH正向:GGCA-AGTGTGGCTGGCTGGAAGTG,反向:GTCTTGTAGTAGGGACGTAG;miR-124正向:ACACTCCAGCTGGGTAAGGCACGCGGTG,反向:CTCACAGTACGTTGGTATCCTTGTGATGTTC;U6正向:CTCGCTTCGGCAGCACATA,反向:CGAATTTGCGTGTCATCCT。
1.4小鼠DKD模型建立及分組給藥 取C57小鼠參照文獻〔9,10〕用高脂飼料(含12%蛋白、38%脂肪、50%碳水化合物)喂養5 w后,于小鼠腹腔注射60 mg/kg STZ溶液3 d,1次/d,建立DKD模型,取小鼠尾動脈血測FBG,以FBG ≥ 16.7 mmol/L為模型成功。共造模成功50只,按隨機數字表法分為模型組、lncRNA-XIST低表達腺病毒(Si-lncRNA-XIST)組、Si-lncRNA-XIST陰性對照(Si-lncRNA-NC)組、miR-124激動劑組(agomiR-124)組、agomiR-124陰性對照(agomiR-NC)組,每組10只。另取10只小鼠正常飼養,視為正常對照組。各組小鼠均于造模成功后開始給藥,lncRNA-XIST及agomiR-124重組腺病毒及相關陰性對照試劑,分別參照文獻〔4,11〕設置劑量,并分別用生理鹽水稀釋成終濃度為1 nmol/50 μl混懸液,按200 μl/kg的體積經尾靜脈注射給藥;正常對照組及模型組尾靜脈注射等量生理鹽水。各組連續給藥4 w,2次/w。
1.5小鼠FBG及腎功能檢測 小鼠末次給藥結束后,收集24 h尿液,用考馬斯亮藍試劑盒說明書方法檢測24 h尿蛋白含量。禁食禁水后12 h斷頭處死小鼠,取血液6 ml,離心分離后取上清液,用ELISA試劑盒說明書方法檢測FBG、血清Scr、BUN水平。
1.6電鏡及Masson染色檢測小鼠腎組織結構病變及纖維化程度 迅速解剖分離完整左右兩腎,右腎分為兩部分,一部分置于-80 ℃冰箱保存備用,另一部分于4%戊二醇中固定并迅速送于醫院電鏡室處理后進行電鏡觀察,并拍照。左腎迅速置于4%多聚甲醛中固定24 h后,常規透明、浸蠟、包埋后,切成5 μm厚的切片,取部分石蠟切片,按Masson試劑盒說明書方法進行染色、封片后置于顯微鏡下觀察腎纖維化染色情況。
1.7免疫組化染色法檢測腎組織STAT3、FN陽性表達 取1.6中剩余左腎石蠟切片,脫蠟、水化、抗原修復后,加入一抗(STAT3、FN,均為1∶500)4 ℃孵育過夜后,加入羊抗兔二抗(1∶800),室溫孵育3 h,二氨基聯苯胺(DAB)顯色、蘇木素復染后,封片,并于400倍光鏡下拍照,用Image Pro Plus5.0圖像分析系統計算陽性反應物質的平均光密度值,結果以5個視野陽性表達的平均光密度值表示。
1.8qRT-PCR檢測腎組織lncRNA-XIST、miR-124表達 取1.6中-80 ℃保存的腎組織,4 ℃解凍后,用Trizol抽提取總RNA,以總RNA為模板,反轉錄cDNA。取cDNA,按RT-qPCR試劑盒(SYBR Green)說明書和PCR儀進行擴增。lncRNA-XIST以GAPDH為內參,miR-124以U6為內參基因,采用2-ΔΔCt法計算lncRNA-XIST、miR-124表達水平。引物由上海生工生物工程股份有限公司合成,引物序列(5′-3′)為:lncRNA-XIST正向:CCGATTTACAGGAACTTCTCTGGGC,反向:GGGAGGTAAGGAGAC-ATAACCACG;GAPDH正向:CTTTAGGGTAGTGGTAGAAG,反向:TGAGGCTGGAAGTGGAAG;miR-124正向:AAGTGGCGCACGGAATAAGACCGC,反向:GTGCAGGGTCCGAGGTATTCGGC;U6正向:GCTTCGGCAGCACATATACTAAAAT,反向:CGCTTCACGAATTTGCGTGTCAT 。
1.9高糖培養的腎足細胞損傷并轉染lncRNA-XIST及miR-124低表達腺病毒 常規復蘇小鼠腎足細胞系,于含10%胎牛血清+10 U/ml重組小鼠γ-干擾素的RPMI1640培養基中常規培養細胞,當融合度達80%時,用不含γ-干擾素的培養基常規培養14 d待足細胞分化成熟(胞核胞體增大、胞漿呈分枝狀不規則突起)后,分為空白組、高糖組、Si-lncRNA-XIST+si-miR-124組、Si-lncRNA-XIST+Si-NC組、Si-lncRNA-NC+si-miR-124組、Si-lncRNA-NC+Si-NC組;空白組不做任何處理,于正常條件下培養48 h;高糖組用含葡萄糖濃度為30 mmol/L的完全培養基中培養48 h復制DKD足細胞損傷模型;Si-lncRNA-XIST+si-miR-124組在用lncRNA-XIST及miR-124低表達腺病毒轉染;Si-lncRNA-XIST+Si-NC組轉染Si-lncRNA-XIST及不含miR-124的空載體腺病毒(Si-NC);Si-lncRNA-NC+si-miR-124組轉染不含lncRNA-XIST的空載體腺病毒(Si-lncRNA-NC)及si-miR-124;Si-lncRNA-NC+Si-NC組轉染Si-lncRNA-NC及Si-NC;各組轉染組均于轉染后3 h,于高糖條件下培養48 h后,用1.8方法,提取細胞RNA,檢測lncRNA-XIST、miR-124表達水平,以評估轉染效果。
1.10腎足細胞損傷及纖維化相關指標檢測 取1.9中處理后的各組細胞,用4%多聚甲醛固定、0.5%Triton X-100室溫透化后用Hoechst33258染液說明書方法染色、DAPI染核、甘油封片后,于共聚焦顯微鏡下觀察損傷足細胞染色狀況。取1.9中處理后的各組細胞,用上述方法固定、透化后,加山羊血清封閉,并加入一抗(STAT3、FN,均為1∶200稀釋倍數),4 ℃孵育過夜,加入FITC標記的二抗(1∶200),室溫孵育3 h,DAPI核染后置于熒光顯微鏡下觀察。
取1.9中處理后的各組細胞,用裂解液裂解后,提取蛋白,二喹啉甲酸(BCA)法檢測蛋白濃度后,取50 μg蛋白,進行電泳及轉膜反應,加入一抗(TGF-β1、Collagen Ⅳ、FSP-1,1∶800,內參β-actin,1∶1 000),4 ℃孵育過夜,加入辣根過氧化物酶(HRP)羊抗兔二抗(1∶1 500)室溫孵育4 h后,用電化學發光(ECL)法顯色曝光,用化學發光成像儀觀察條帶,拍照后,以ImageJ軟件分析蛋白相對表達水平。
1.11雙熒光素酶報告試驗檢測 構建并合成含有miR-124結合位點的lncRNA-XIST及突變結合位點的識別序列,得到lncRNA-XIST-WT及lncRNA-XIST-MUT,待足細胞生長至80%融合度時,將miR-124高表達腺病毒agomiR-124及空載體agomiR-NC分別與lncRNA-XIST-WT及lncRNA-XIST-MUT共轉染,得到lncRNA-XIST-WT+agomiR-124組、lncRNA-XIST-WT+agomiR-NC組、lncRNA-XIST-MUT+agomiR-124組、lncRNA-XIST-MUT+agomiR-NC組,各組均于轉染后24 h添加螢火蟲和海參熒光素酶試劑,檢測螢火蟲熒光活性/海參熒光活性。
1.12統計學分析 采用SPSS22.0軟件進行單因素方差分析、t檢驗、SNK-q檢驗。
2 結 果
2.1人正常腎組織及DKD腎組織中lncRNA-XIST、miR-124表達變化 與正常腎組織(1.08±0.05)相比,DKD腎組織lncRNA-XIST表達(2.39±0.22)明顯升高(t=14.223,P=0.000),正常腎組織miR-124表達(1.01±0.06)明顯高于DKD腎組織(0.42±0.02,t=22.851,P=0.000)。
2.2沉默lncRNA-XIST及上調miR-124表達后對小鼠lncRNA-XIST、miR-124表達的影響 與正常對照組相比,模型組lncRNA-XIST表達明顯升高,miR-124表達明顯降低(P<0.05)。與模型組相比,si-lncRNA-XIST組lncRNA-XIST表達明顯降低,miR-124表達明顯升高(P<0.05);agomiR-124組miR-124表達升高(P<0.05),lncRNA-XIST表達差異無統計學意義(P<0.05)。Si-lncRNA-NC組及agomiR-NC組與模型組相比差異無統計學意義(P>0.05)。見表1。
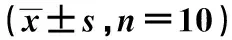
表1 各組腎組織lncRNA-XIST、miR-124表達、FBG、24 h尿蛋白、Scr、BUN水平、STAT3、FN陽性表達比較
2.3沉默lncRNA-XIST及上調miR-124表達后對腎組織結構病變、纖維化及腎功能相關指標的影響 正常對照組腎組織結構正常,膠原纖維染色較淡。模型組電鏡下可見腎小球基底膜增厚及電子致密物沉積、足細胞排列紊亂及足突融合等結構損傷嚴重,Masson染色可膠原纖維染色加重,腎纖維化嚴重,小鼠FBG、24 h尿蛋白、血清SCr、BUN水平均顯著高于正常對照組(P<0.05)。與模型組相比,si-lncRNA-XIST組及agomiR-124組腎小球基底膜增厚及足細胞損傷、腎纖維化沉積均減輕,小鼠FBG、24 h尿蛋白、血清SCr、BUN水平均明顯降低(P<0.05)。Si-lncRNA-NC組及agomiR-NC組腎結構損傷及纖維化沉積與模型組相近,FBG、24 h尿蛋白、血清SCr、BUN水平變化差異無統計學意義(P>0.05),見表1、圖1。
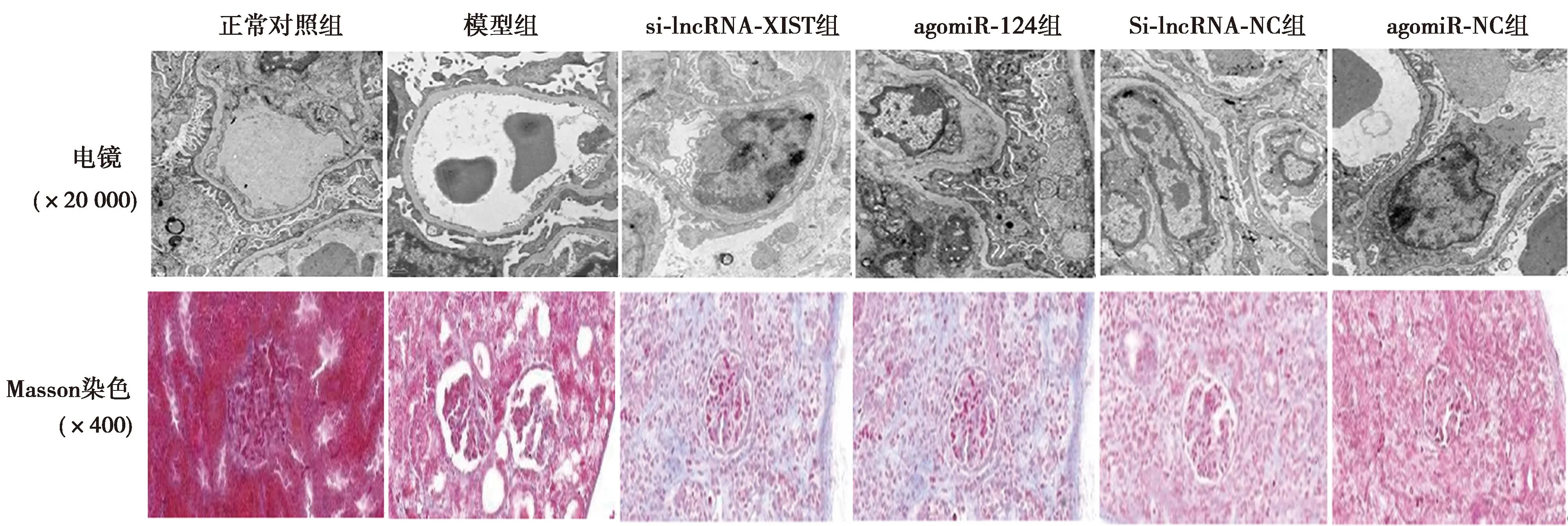
圖1 各組腎組織
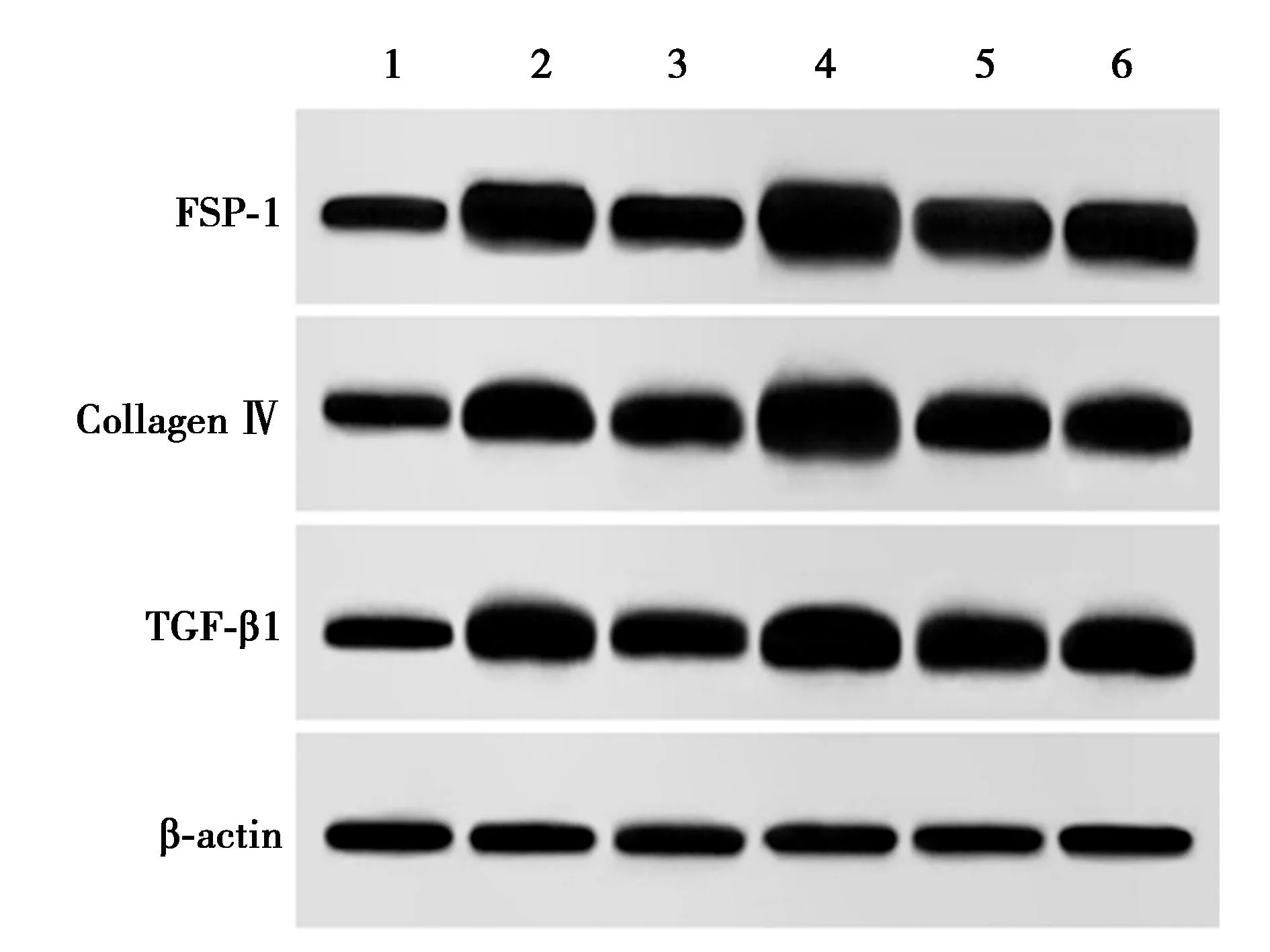
2.4沉默lncRNA-XIST及上調miR-124表達后對腎組織STAT3、FN陽性表達的影響 與正常對照組相比,模型組腎STAT3、FN陽性表達明顯升高(P<0.05)。與模型組相比,si-lncRNA-XIST組及agomiR-124組STAT3、FN陽性表達明顯降低(P<0.05);Si-lncRNA-NC組及agomiR-NC組上述指標變化與模型組相比差異無統計學意義(P>0.05)。見表1、圖2。
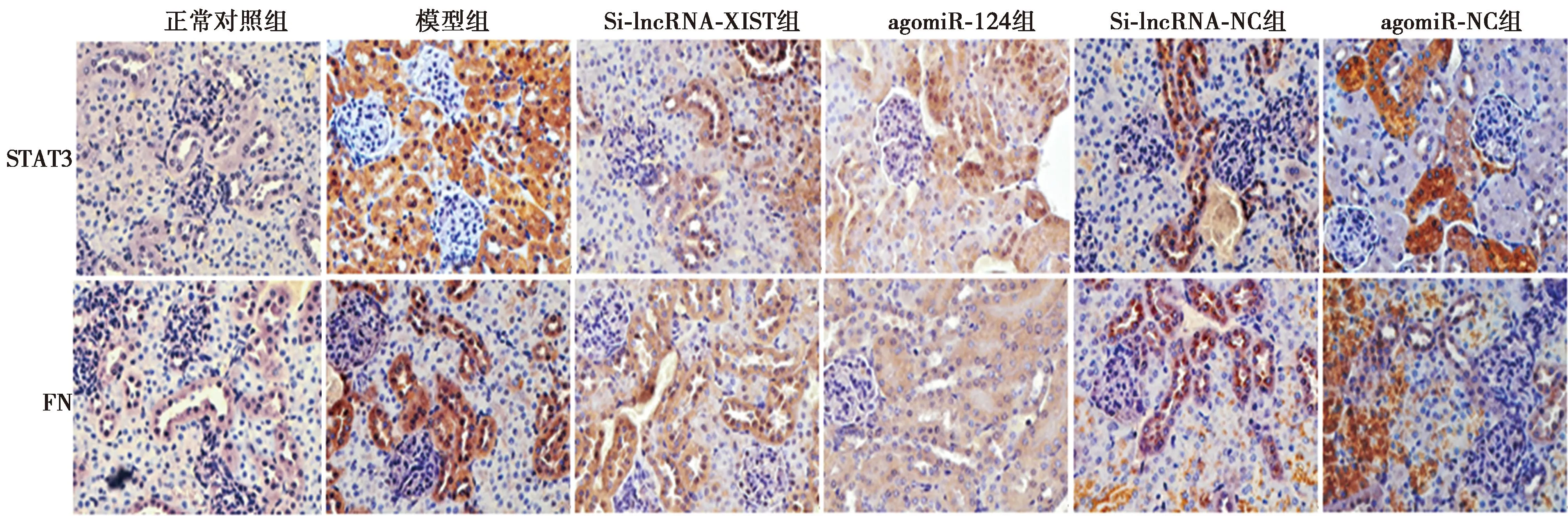
圖2 各組腎組織STAT3、FN表達(免疫組化,×400)
2.5共轉染lncRNA-XIST及miR-124低表達腺病毒后對足細胞損傷及lncRNA-XIST、miR-124表達的影響 與空白組相比,高糖組細胞核呈碎塊樣致密濃染,細胞凋亡率、lncRNA-XIST表達明顯升高,miR-124表達明顯降低(P<0.05)。與高糖組相比,Si-lncRNA-XIST+Si-NC組細胞核碎塊樣致密濃染減淡,細胞凋亡率、lncRNA-XIST表達明顯降低,miR-124表達明顯升高(P<0.05);Si-lncRNA-NC+si-miR-124組胞核碎塊樣致密濃染進一步加重,細胞凋亡率明顯增加,miR-124表達明顯降低(P<0.05),lncRNA-XIST表達與模型組相比無明顯差異(P>0.05)。與Si-lncRNA-XIST+Si-NC組相比,Si-lncRNA-XIST+si-miR-124組細胞核碎塊樣致密濃染加重,細胞凋亡率表達明顯升高,miR-124表達明顯降低(P<0.05),lncRNA-XIST表達明顯升高(P<0.05)。Si-lncRNA-NC+Si-NC組各指標變化與高糖組相比無統計學差異(P>0.05),見圖3、表2。
圖3 各組足細胞(Hoechst33258染色,×400)
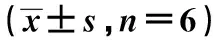
表2 各組細胞凋亡率、lncRNA-XIST、miR-124、STAT3、FN、TGF-β1、Collagen Ⅳ、FSP-1表達比較
2.6共轉染lncRNA-XIST及miR-124低表達腺病毒后對足細胞STAT3、FN陽性表達及TGF-β1、Collagen Ⅳ、FSP-1蛋白表達的影響 與空白組相比,高糖組細胞STAT3、FN陽性表達及TGF-β1、Collagen Ⅳ、FSP-1蛋白表達明顯升高,差異有統計學意義(P<0.05)。與高糖組相比,Si-lncRNA-XIST+Si-NC組細胞STAT3、FN陽性表達及TGF-β1、Collagen Ⅳ、FSP-1蛋白表達明顯降低(P<0.05);Si-lncRNA-NC+si-miR-124組STAT3、FN陽性表達及TGF-β1、Collagen Ⅳ、FSP-1蛋白表達進一步增加(P<0.05)。與Si-lncRNA-XIST+Si-NC組相比,Si-lncRNA-XIST+si-miR-124組細胞上述蛋白表達明顯升高(P<0.05)。Si-lncRNA-NC+Si-NC組各指標變化與高糖組相比差異無統計學意義(P>0.05),見表2、圖4、圖5、圖6。
1~6:空白組、高糖組、Si-lncRNA-XIST+Si-NC組、Si-lncRNA-NC+si-miR-124組、Si-lncRNA-XIST+si-miR-124組、Si-lncRNA-NC+Si-NC組圖4 各組細胞TGF-β1、Collagen Ⅳ、FSP-1蛋白表達
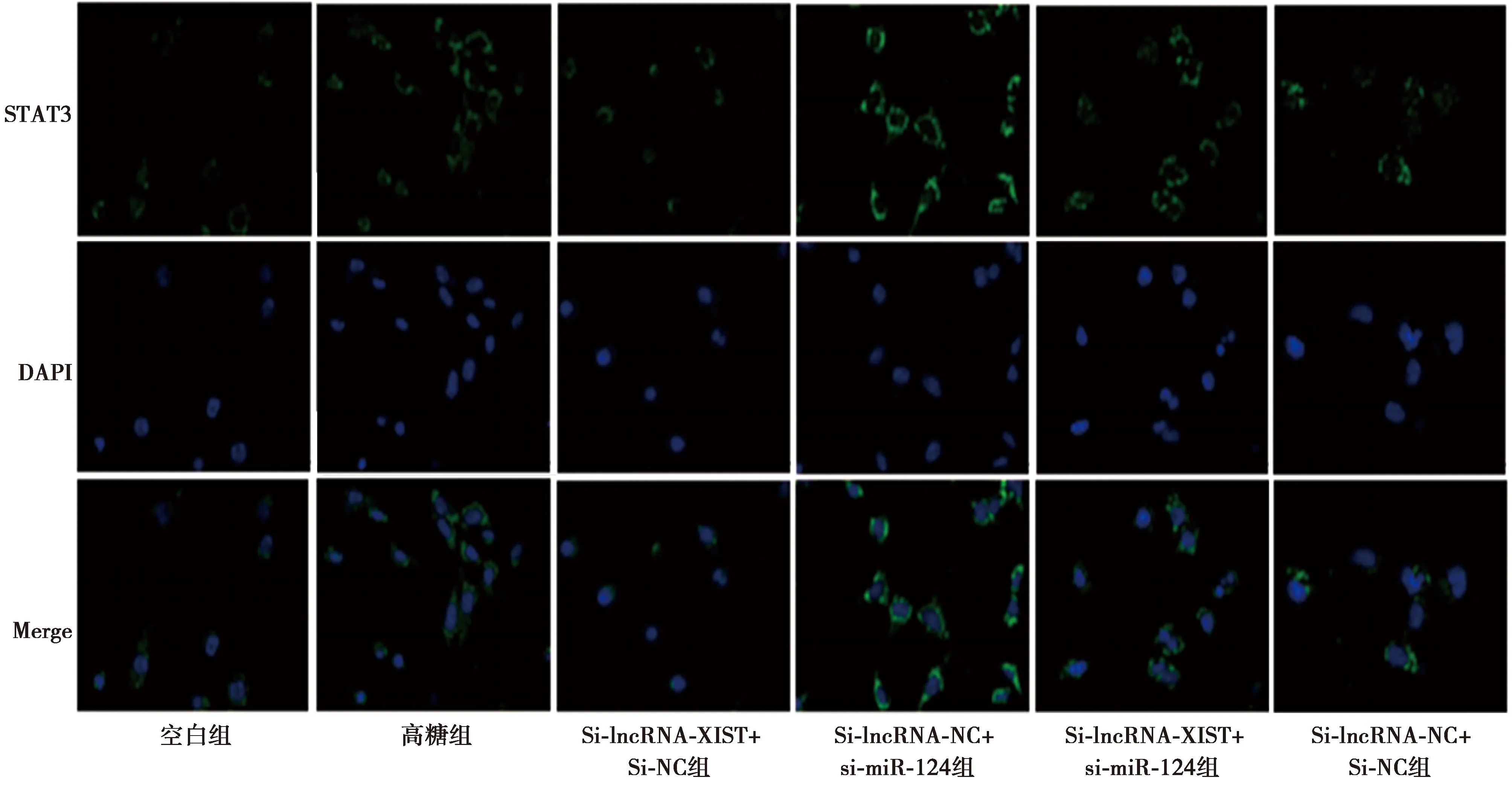
圖5 各組細胞STAT3表達(免疫熒光染色,×400)
圖6 各組細胞FN表達(免疫熒光染色,×400)
2.7lncRNA-XIST對miR-124的靶向作用 生物信息學軟件檢測發現,lncRNA-XIST與miR-124之間有相似的結合位點。雙熒光素酶報告實驗發現,轉染lncRNA-XIST-WT與agomiR-124后,雙熒光素酶活性(0.62±0.06)較lncRNA-XIST-WT共轉染agomiR-NC(1.09±0.11)明顯降低(t=9.188,P<0.05)。lncRNA-XIST-MUT與agomiR-124共轉染熒光素酶活性(1.06±0.11)與lncRNA-XIST-MUT共轉染agomiR-NC(1.02±0.10)無明顯差異(t=0.659;P>0.05),見圖7。
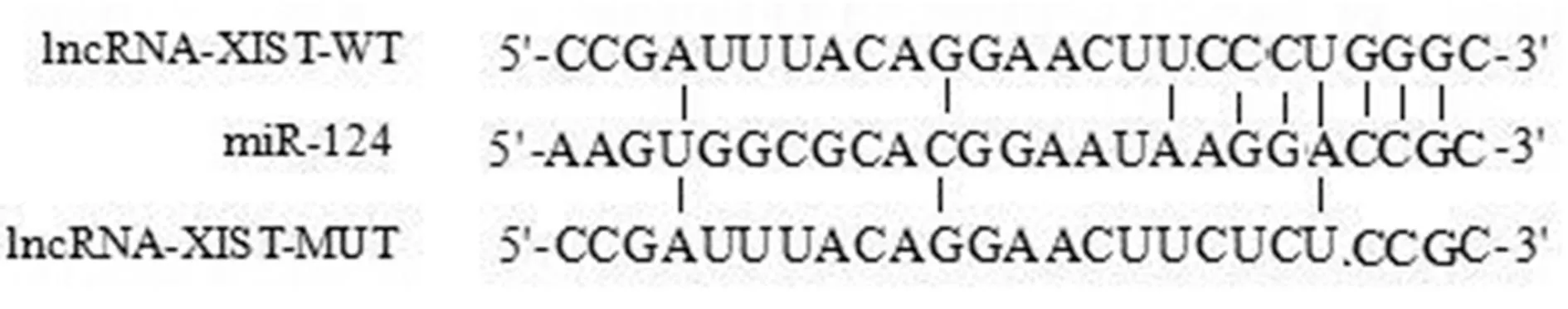
圖7 miRtarbase預測圖
3 討 論
DKD是導致糖尿病及終末期腎病患者死亡的重要原因,目前臨床上尚無能治療DKD的特效藥物〔12〕。基因靶點治療在抑制DKD腎損傷及腎纖維化進程中有潛在應用價值〔13〕,而lncRNA能調控miRNA表達,越來越多的研究發現,多種lncRNA能通過多種信號通路來誘導細胞質基質沉積、纖維化、足細胞損傷等來調控DKD腎病理表型的改變〔2〕。LncRNA XIST通過介導X染色體沉默來發揮功能,Yao等〔14〕發現lncRNA XIST在腎細胞癌患者組織中表達高于正常組織,且能沉默miR-193a-5p基因來加速腎臟病變進程;Yang等〔4〕發現下調LncRNA XIST表達,可抑制糖尿病小鼠腎間質纖維化進程,預示LncRNA XIST可能在DKD腎纖維化過程中發揮重要調控作用。本研究證實了下調LncRNA XIST表達可能為治療DKD的潛在治療策略。
miRNAs也在DKD腎損傷及纖維化進程中發揮重要作用。Sakuma等〔15〕在DKD患者中檢測到miR-124、miR-21、miR-199a等多個miRNAs表達的異常,并推測DKD腎纖維化發生的重要原因,可能與miRNAs及其調控的TGF-β1、EMT等纖維化相關信號通路的改變有關。Zhou等〔8〕發現,miR-124異常表達可受LncRNA-HOTAIR調控,且沉默lncRNA HOTAIR可上調miR-124表達,來抑制TGF-β1表達及EMT進程,緩解輸卵管阻塞性大鼠腎間質纖維化進程,預示miR-124異常表達可能為腎纖維化發生的危險因素。Németh等〔16〕發現,STAT3能夠誘導TGF-β1、FN等多種信號基因蛋白表達來介導腎纖維化的發生發展,證實STAT3是腎纖維化改變的重要轉導分子。Cheng等〔17〕發現,STAT3與miR-124的非編碼翻譯區(3'-UTR)區有互補關系,且用雙熒光素酶報告試驗證實miR-124與STAT3之間存在靶向調控關系,預示miR-124可能通過靶向調控STAT3表達,來參與疾病發展過程。本研究結果提示,miR-124發揮抗腎纖維化作用,可能與靶向抑制STAT3激活有關。
miRNA分子可通過靶向抑制或斷裂信使RNA分子來調節蛋白質的翻譯水平,LncRNA可通過競爭性結合miRNA而影響miRNA對蛋白質翻譯的調控作用〔18〕。本研究結果提示,LncRNA XIST與miR-124之間可能存靶向調控作用。本研究用雙熒光素酶報告基因檢測證實了上述推測。足細胞是腎組織結構的重要單位細胞,足細胞EMT損傷引起的腎結構和功能的破壞,是導致DKD蛋白尿形成及腎損傷、纖維化甚至衰竭的重要原因〔19〕。Jin等〔20〕用熒光原位雜交定位實驗證實lncRNA-XIST定位表達于小鼠永生化足細胞內。本研究結果提示,miR-124低表達可逆轉lncRNA-XIST沉默發揮的抗纖維化作用。
綜上,沉默lncRNA-XIST可能通過上調miR-124表達,抑制STAT3表達,降低足細胞損傷及EMT進程,來發揮抗DKD腎損傷及纖維化作用。但lncRNA-XIST調控網絡復雜,lncRNA-XIST調控DKD腎損傷及纖維化的其他機制,還有待后續繼續研究。

