斜帶髭鯛內臟白點病病原的分離鑒定及耐藥性分析
李慧耀,楊求華,葛 輝,何麗斌,吳麗云,吳建紹*
(1.福建省水產研究所,福建 廈門 361013; 2.福建省海洋生物增養殖與高值化利用重點實驗室,福建 廈門 361013)
斜帶髭鯛(Hapalogenysnitens)是一種重要的海水養殖經濟魚類,隸屬于鱸形目(Perciformes) ,石鱸科(Haemulidae) ,髭鯛屬(Hapalogenys),主要分布在西北太平洋地區,是東亞特有海洋魚類[1]。斜帶髭鯛在我國東海、南海均有野生資源分布,主要生活在近海中下層水體,攝食底棲的魚類或者貝類[2]。斜帶髭鯛具有長速快、肉質鮮美等優良養殖性狀,1995年成功進行人工育苗,隨著養殖規模迅速擴大,已發展成為我國沿海重要的養殖經濟魚類之一[3]。然而,近年來隨著養殖規模的發展和養殖密度擴大,斜帶髭鯛患內臟白點病發病越來越頻繁,制約了該養殖業的可持續發展。
內臟白點病是魚類中常見的一種細菌性疾病,主要臨床表現為病魚活力下降、食欲減退,體表無明顯癥狀,但解剖后可觀察到脾臟、肝臟、腎臟等內臟有許多白色結節小點,可能伴有嚴重的腹水、脹氣等癥狀,發病初期不易察覺,后期死亡率極高,易造成較大的經濟損失[4]。魚類內臟白點病的病原呈現多樣化特點,有鰤魚諾卡氏菌(Nocardiaseriolea)[5]、變形假單胞菌(Pseudomonasplecoglossicida)[6]、巴氏桿菌(Pasteurellapiscicida)[7]、嗜水氣單胞菌(Aeromonashydrophila)[8]、美人魚發光桿菌(Photobacteriumdamselae)[9]和立克次氏體[10]等。由于不同病原菌感染魚類所引起的內臟白點病外觀癥狀相似,因此有必要對發生內臟白點病的病原進行分離鑒定。
目前,關于斜帶髭鯛內臟白點病的研究未見報道。本研究從患內臟白點病的斜帶髭鯛的內臟中分離得到一株優勢菌株,結合形態學、生理生化特征和分子生物學技術對其進行種類鑒定,并對分離得到的菌株進行了藥物敏感性試驗,本研究可為斜帶髭鯛內臟白點病的防治提供理論依據。
1 材料與方法
1.1 細菌分離培養與形態學觀察
患病和健康的斜帶髭鯛均采集自福建省漳州市龍海區斗美海域魚排網箱,重量為(395±23) g,采集樣本時海區水溫為15 ℃,鹽度為25,溶解氧濃度為8.13 mg/L。病魚臨床表現為腹部脹大、食欲不振、游泳無力。使用無菌采樣袋將病魚轉移至實驗室進行解剖觀察,無菌操作條件下,從病魚的脾臟和頭腎等器官病灶處取樣,使用2216E液體培養基(青島海博生物技術有限公司)對病原菌進行分離培養,在28 ℃、220 r/min條件下培養過夜。然后用無菌接種環挑取單菌落在2216E瓊脂平板上劃線純化,重復3次。純化后的菌種用體積分數為20%甘油生理鹽水保存于-80℃超低溫冰箱中備用。使用透射電子顯微鏡(日立HT7800,日本)觀察分離菌的顯微形態。
1.2 回歸感染
將分離的菌株接種于5 mL的液體培養基,在220 r/min、28 ℃條件下培養細菌至對數生長期。用無菌生理鹽水(北京索萊寶科技有限公司)稀釋菌液至濃度約為106 CFU/mL,采用腹腔注射法進行回歸感染,每尾魚注射菌懸液100 μL,對照組注射等量無菌生理鹽水,每組設置3個平行,每個平行10尾魚,回歸感染用魚規格為(73±8) g,感染后取癥狀明顯的個體進行病原菌的分離。
1.3 系統發育分析
使用細菌基因組提取試劑盒(上海捷瑞生物工程有限公司)提取細菌基因組DNA,具體步驟按照說明書進行。使用引物擴增細菌的16S rRNA、dnaJ、gyrB基因[11],引物序列如表1所示。PCR反應條件如下:95 ℃預變性5 min,95 ℃變性30 s,45~57 ℃退火30 s,72 ℃延伸1 min,72 ℃延伸10 min,4 ℃保存,反應循環數為35次,反應體系為50 μL。反應產物交由廈門鉑尚生物技術有限公司進行測序。測序所得到的序列與NCBI(National Center for Biotechnology Information)下載的序列通過軟件MEGA 7.0基于Neighbour-joining方法構建其系統發育樹。
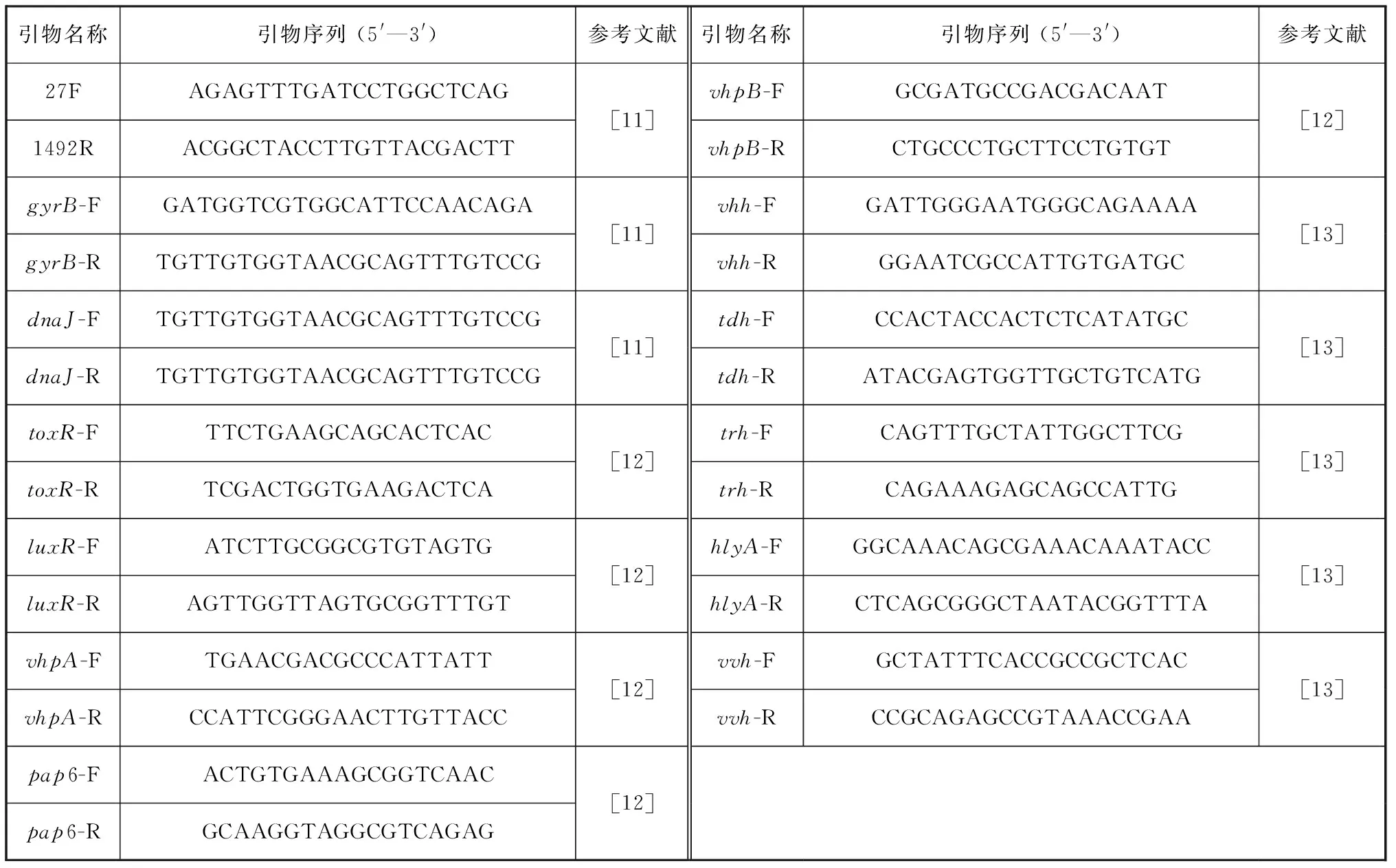
表1 PCR擴增所用引物序列Tab. 1 Primer sequences for PCR amplification
1.4 生理生化鑒定
參照Guo等[14]的方法,采用Biolog Gene III 半自動細菌鑒定系統鑒定細菌的生理生化表型。使用濁度計將含有10 mL IF-A的空白試管(Biolog目錄72401,濁度計的透射率調節到100%),從過夜培養的瓊脂平板上挑取單菌落添加到試管中,使懸浮液的透射率保持在95%~98%之間,然后將懸浮液添加到96孔板中(100 μL/孔,Gene III),并在28 ℃下培養18~24 h。使用MicroStationTMand OmniLog?軟件對細菌的生理生化表型進行鑒定。
1.5 組織病理學
從“1.1”中同時切取厚度小于5 mm的具有典型癥狀的患病斜帶髭鯛肝臟、脾臟、腎臟、鰓和心臟等組織器官,取健康斜帶髭鯛對應樣品作為對照組,使用Servicebio 通用型組織固定液在室溫下固定24 h。制備組織切片并用石蠟包埋。切片用蘇木精-伊紅(H&E)染色后在顯微鏡下觀察并拍照[15]。
1.6 毒力基因檢測
通過PCR法檢測分離菌的常見毒力基因攜帶情況,包括毒力調控基因toxR、群體效應調節基因luxR、金屬蛋白酶基因vhpA和vhpB、鋅金屬蛋白酶基因pap6、哈維氏弧菌(Vibrioharveyi)溶血素基因vhh、霍亂弧菌(Vibriocholerae)溶血素基因hlyA、創傷弧菌(Vibriovulnificus)溶血素基因vvh、副溶血弧菌(Vibrioparahaemolyticus)耐熱直接溶血素基因tdh和耐熱直接相關溶血素基因trh,其所需的引物序列見表1[12-13]。PCR 擴增體系及程序參照“1.3”。
1.7 抗微生物藥物敏感性試驗
使用藥敏紙片擴散法測定分離菌株對氨芐西林、阿米卡星、呋喃妥因和諾氟沙星等29種抗生素的敏感性。具體步驟為將過夜培養的分離菌菌液轉接至新鮮的2216E液體培養基中,在28 ℃、200 r/min條件下,培養至OD600為0.3~0.4,取100 μL菌液均勻涂布在MH平板上,并在超凈臺上晾干30 min,待平板上的水分被充分吸收后,將藥敏試紙(杭州濱和微生物試劑有限公司)平整的貼在涂有菌液的平板上。在28 ℃下倒置培養16~24 h,每種藥物設置3個重復試驗,使用游標卡尺測量抑菌圈大小,根據CLSI M100標準判定細菌對藥物的敏感程度。使用動物用藥敏檢測分析試劑盒(南京菲恩醫療科技有限公司)測定《水產養殖用藥明白紙 2022年 1、2 號》中批準使用8種常用漁藥對分離菌株的最小抑菌濃度(minimal inhibit concentration, MIC),包括恩諾沙星、硫酸新霉素、甲砜霉素、氟苯尼考、鹽酸多西環素、氟甲喹、磺胺間甲氧嘧啶、磺胺甲噁唑/甲氧芐啶,具體步驟按說明書要求進行。
2 結果
2.1 細菌分離培養及回歸感染結果
斜帶髭鯛發病時在網箱邊緩游或浮在水面,瀕死病魚體表外觀無潰瘍、缺損,但腹部鼓脹,鰓絲有白點且輕度潰爛[圖1(a)],鏡檢無其它寄生蟲附著,卵巢腫大、肝臟呈黃白色,肝臟、脾臟、頭腎和心臟上有明顯的白點結節癥狀,其中脾臟白點癥狀最嚴重[圖1(b)]。從脾臟、肝臟和頭腎病灶處均可分離到外觀單一的細菌菌落hn-1,菌株在2216E瓊脂培養基上呈圓形,邊緣整齊,菌落直徑約1~2 mm,在TCBS培養基上呈黃色圓形菌落。透射電鏡觀察結果顯示,分離菌株呈桿狀,具極生單鞭毛,長度約4.6 μm[圖1(c)]。經16S rRNA測序鑒定為哈維氏弧菌。回歸感染實驗結果顯示,第5天肝臟、脾臟已經出現白點癥狀[圖1(d)],被感染的斜帶髭鯛在第5天開始出現大量死亡,第12天死亡率達到91.4%(圖2),從回歸感染后出現白點病癥狀魚體中分離得到的菌株經鑒定與感染菌株一致。
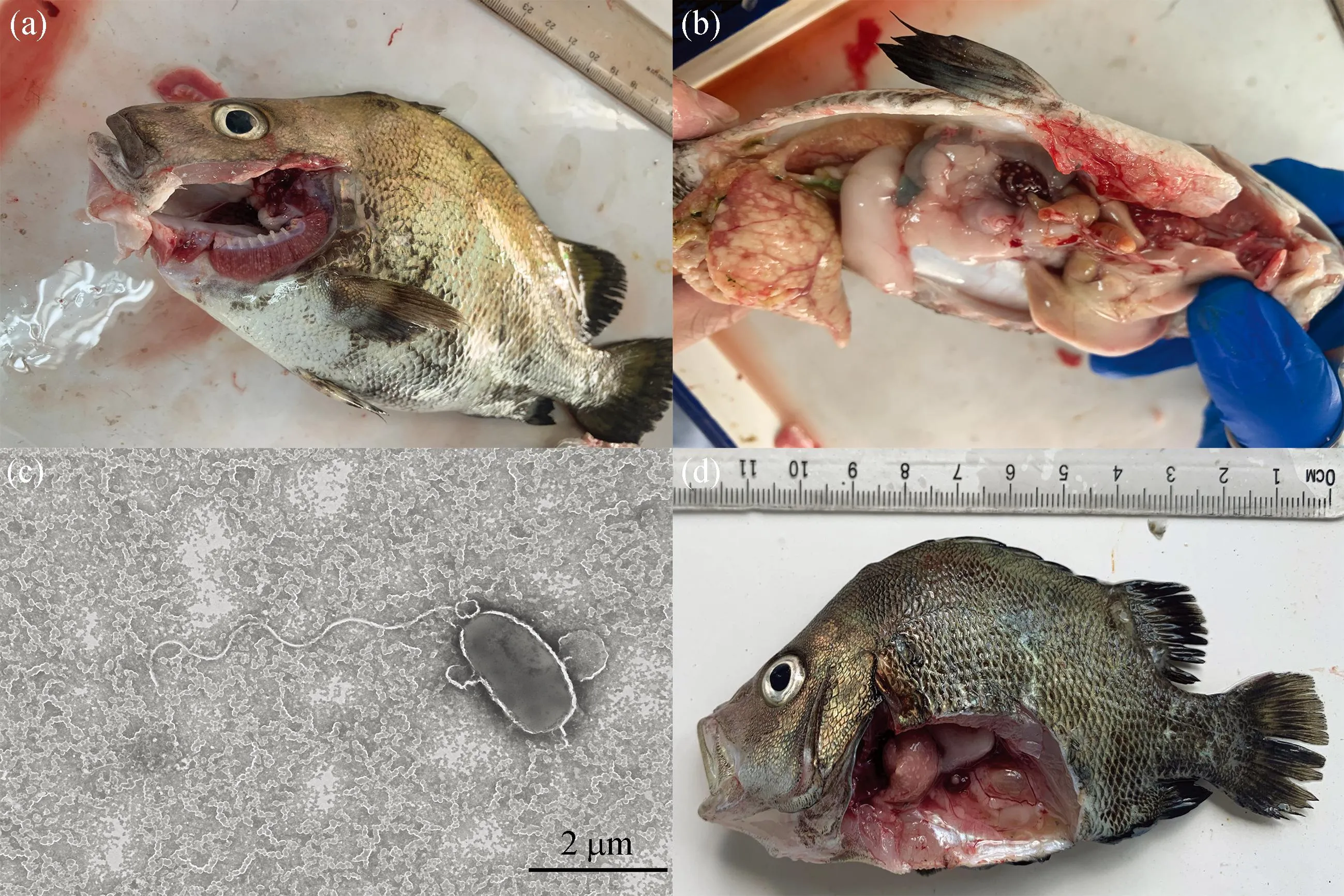
圖1 斜帶髭鯛白點病臨床癥狀及分離菌株透射電鏡圖Fig. 1 Clinical symptom of white spot disease in Hapalogenys nitens and the transmission electron microscopy of isolated strains(a)自然感染病魚鰓部白點,(b)自然感染病魚脾臟白點,(c)hn-1菌株透射電鏡圖,(d)回歸感染病魚。
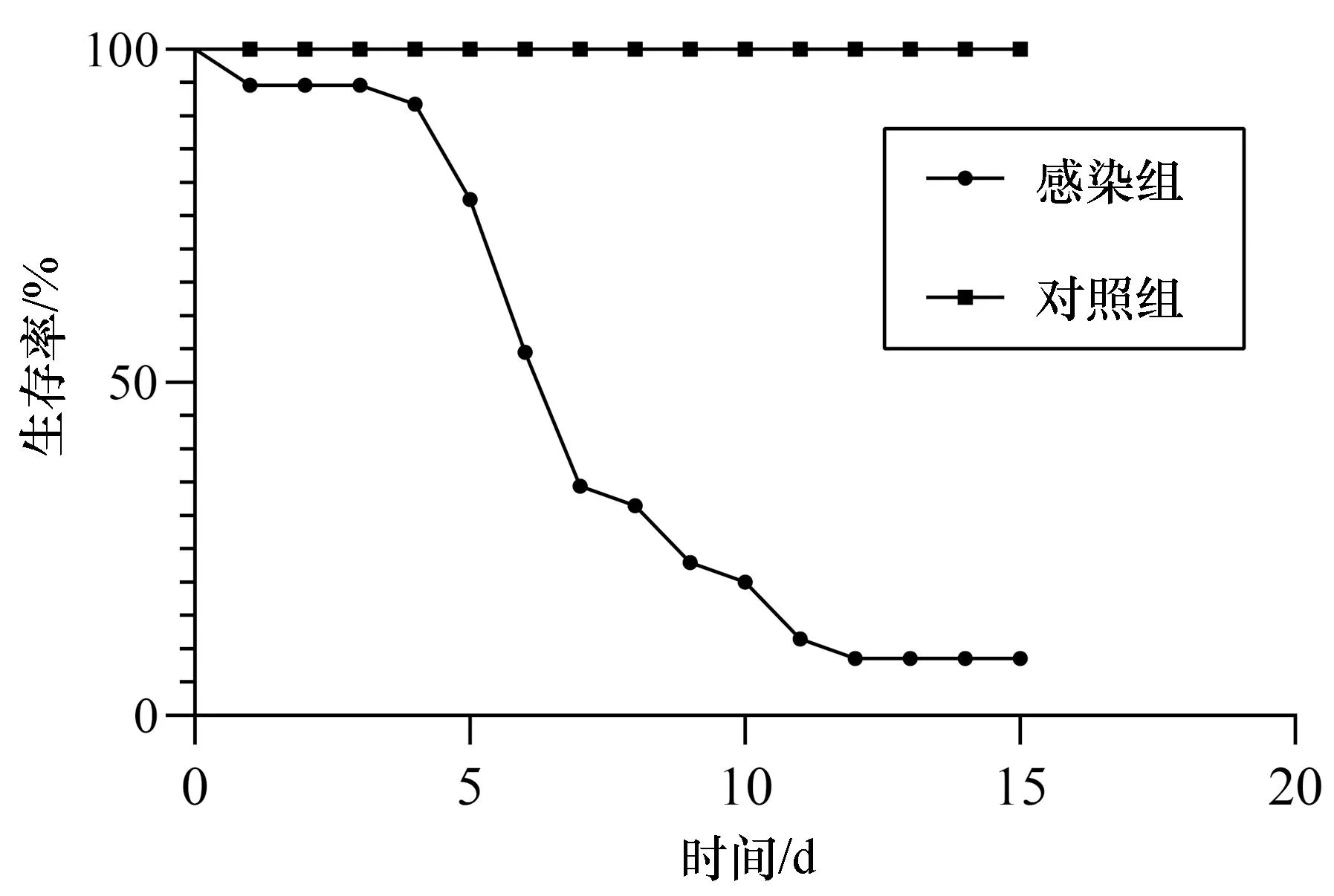
圖2 哈維氏弧菌對健康斜帶髭鯛回歸感染試驗結果Fig. 2 Results of the artificial infection test of Vibrio harveyi on healthy Hapalogenys nitens
2.2 系統發育分析
經測序獲得分離菌株的16S rRNA序列,通過與NCBI數據庫比對顯示分離菌均為哈維氏弧菌。分離菌株的16S rRNA、dnaJ、gyrB基因序列與NCBI下載的基因序列進行系統發育分析,結果顯示分離菌株與哈維氏弧菌聚為一類(圖3~5)。由此可進一步表明,分離得到的hn-1菌株為哈維氏弧菌。

圖3 哈維氏弧菌16S rRNA核苷酸序列的系統發育進化樹Fig. 3 Phylogenetic relationship between the nucleotide sequences of 16S rRNA of Vibrio harveyi

圖4 哈維氏弧菌dnaJ核苷酸序列的系統發育進化樹Fig. 4 Phylogenetic relationship between the nucleotide sequences of dnaJ of Vibrio harveyi

圖5 哈維氏弧菌gyrB核苷酸序列的系統發育進化樹Fig. 5 Phylogenetic relationship between the nucleotide sequences of gyrB of Vibrio harveyi
2.3 生理生化鑒定
通過Biolog Gene III鑒定分離菌株,鑒定結果顯示為哈維氏弧菌,菌株可分解多種糖和氨基酸,對葡萄糖、甘露糖、麥芽糖、絲氨酸、精氨酸和谷氨酸呈陽性,對肌醇呈弱陽性;耐受醋竹桃霉素、萬古霉素、利福霉素等抗生素(表2)。與Biolog Gene III數據庫標準菌株相比,分離株不可降解糊精和L-半乳糖醛酸內脂,對氨曲南敏感。
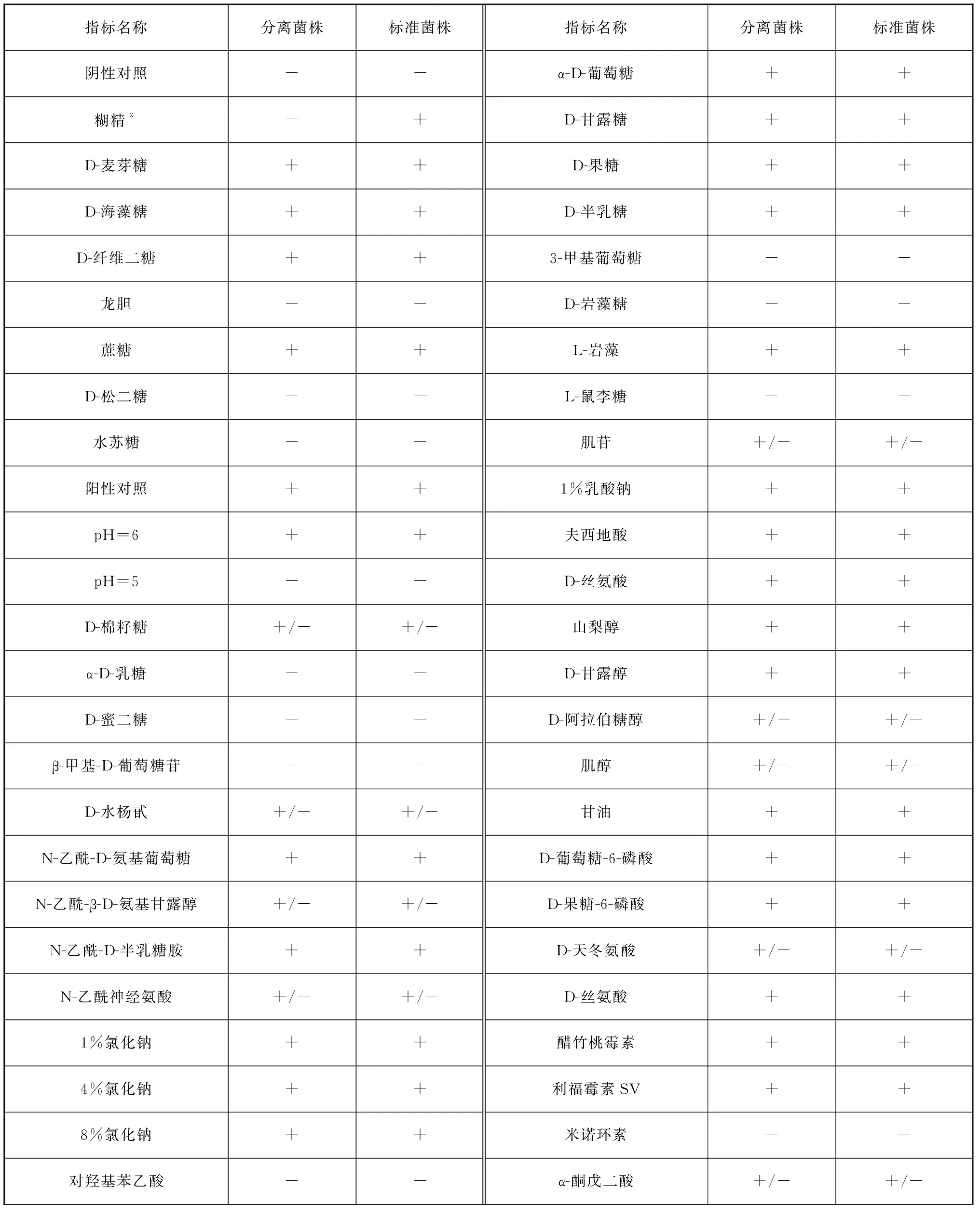
表2 分離菌株的生理生化特征Tab. 2 Physiological and biochemical characteristics of isolated strain
2.4 組織病理學變化
經組織切片觀察,患內臟白點病的斜帶髭鯛的肝臟、脾臟、鰓、頭腎、心臟均可觀察到明顯炎性肉芽腫病灶部位,呈深紫色,近圓形(圖6)。健康斜帶髭鯛肝組織細胞形狀較規則,肝細胞索清晰[圖6(a)],患病魚部分肝細胞嚴重壞死、萎縮成團,肝細胞界限模糊不清[圖6(b)];健康魚脾臟細胞密集相間,可見明顯的髓狀結構[圖6(c)],患病魚脾臟細胞結構疏松,病灶處形成致密細胞團,無髓狀結構[圖6(d)];健康魚鰓絲結構清晰、排列規則[圖6(e)],患病魚鰓絲萎縮、潰爛卷曲,鰓絲末端形成細胞團[圖6(f)];健康魚頭腎組織無結節,可見血管組織,血管中含紅細胞[圖6(g)],患病魚頭腎組織病灶處形成致密細胞團,無血管結構[圖6(h)];健康魚心臟組織結構清晰,分布規則[圖6(i)],患病魚病灶處心肌組織橫紋消失,細胞壞死形成了結節[圖6(j)]。
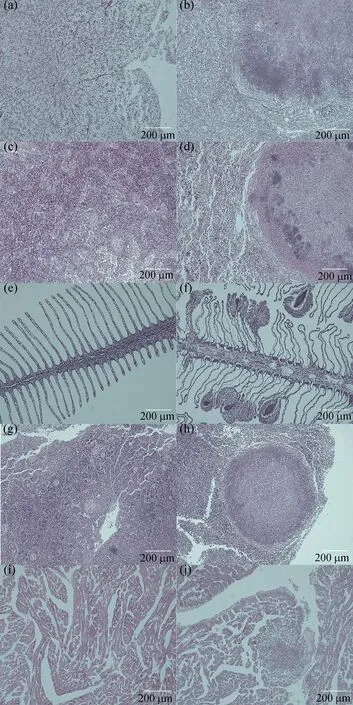
圖6 斜帶髭鯛組織器官病理切片圖Fig. 6 Histopathological examination of Hapalogenys nitens(a)、(c)、(e)、(g)和(i)分別為健康魚的肝、脾、鰓、頭腎和心臟組織切片圖,(b)、(d)、(f)、(h)和(j)分別為病魚的肝、脾、鰓、頭腎和心臟組織病理切片圖。
2.5 分離菌株毒力基因攜帶情況
毒力基因檢測結果如圖7所示,hn-1菌株攜帶哈維氏弧菌典型毒力調控基因toxR、群體效應調節基因luxR和溶血素基因vhh,以及創傷弧菌溶血素基因vvh和副溶血弧菌耐熱直接相關溶血素基因trh;不含金屬蛋白酶基因vhpA和vhpB、鋅金屬蛋白酶基因pap6、霍亂弧菌溶血素基因hlyA和副溶血弧菌耐熱直接溶血素基因tdh。
2.6 抗微生物藥物敏感性試驗結果
藥敏紙片法測定抗生素藥敏實驗結果如表3所示,分離菌株對氨芐西林、青霉素、萬古霉素、阿莫西林和多粘菌素B耐藥,對紅霉素中介,對四環素類(四環素、米諾環素、多西環素)、喹諾酮類(如諾氟沙星、恩諾沙星、左氧氟沙星等)、氨基糖苷類(如鏈霉素、新霉素等)等23種藥物敏感。常用漁藥MIC試驗結果顯示,鹽酸多西環素對分離菌株的MIC值最低,為0.06 μg/mL,其次是氟甲喹,MIC值為0.125 μg/mL(表4)。
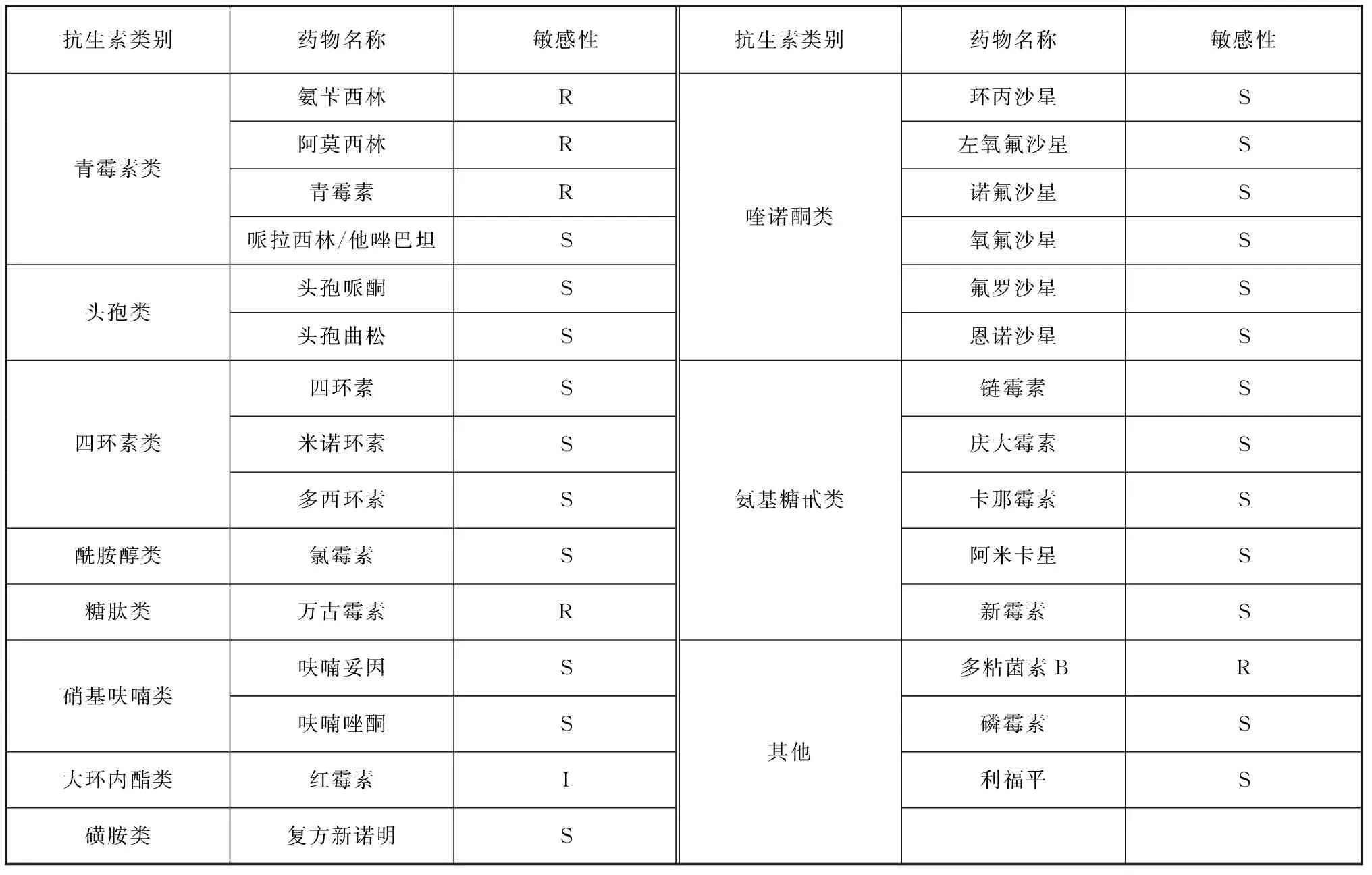
表3 紙片擴散法測定抗生素藥敏結果Tab. 3 Results of antibiotic susceptibility determination by K-B method
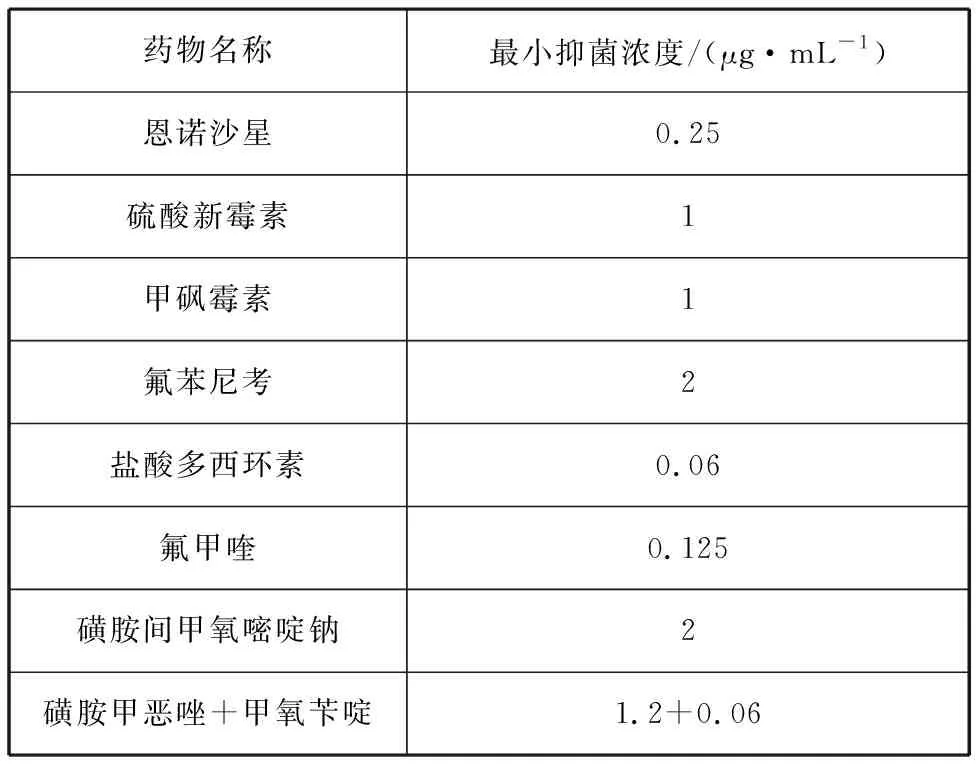
表4 常用漁藥最小抑菌濃度測定結果Tab. 4 Determination results of MIC of common fishery drugs
3 討論
哈維氏弧菌是一種常見的條件致病菌,廣泛分布于養殖水體中,適鹽范圍較廣,在淡水和海水中均可生存并感染宿主[16-17]。哈維氏弧菌的宿主范圍廣,可感染貝類[18]、甲殼類[17]和魚類[19]等,在海水養殖的魚類中,哈維氏弧菌感染可導致斜帶石斑魚(Epinepheluscoioides)、牙鲆(Paralichthysolivaceus)和軍曹魚(Rachycentroncanadum)等魚類患病,其主要癥狀為肛門紅腫、腹部鼓脹和腹腔積液[14]。也可感染引起雙斑東方鲀(Takifugubimaculatus)、大菱鲆(Scophthalmusmaximus)、半滑舌鰨(Cynoglossussemilaevis)、線紋海馬(Hippocampuserectus)、淺色黃姑魚(Nibeacoibor)、豹紋鰓棘鱸(Plectropomusleopardus)等魚類患病,其主要癥狀為皮膚潰爛[20-25]。哈維氏弧菌還可引起網箱養殖的鱸魚發生內臟白點病,且病魚的肝、脾和腎等多器官組織出現明顯的白色結節癥狀[19]。可感染鮸魚(Miichthysmiiuy)引起出血性潰瘍病和內臟白點病[26]。本研究報道了哈維氏弧菌可導致斜帶髭鯛患內臟白點病,擴大了哈維氏弧菌的天然宿主范圍。
內臟白點病典型癥狀為解剖可見大量肉芽腫聚集形成的白色結節,在顯微鏡下可觀察到病灶處有大量壞死細胞,肝、腎、脾為主要的病變組織[27]。魚類白點病病灶組織分布廣泛,本研究中患病的斜帶髭鯛的肝、脾、鰓、頭腎、心臟表面均有發現典型白色結節病灶,與鰤魚諾卡氏菌(Nocardiaseriolae)感染卵形鯧鲹(Trachinotusovatus)引起的白點病患病部位相同[28]。經組織切片觀察,病魚內臟病灶部位組織壞死崩解,壞死細胞聚集成團形成白色結節,鰓絲潰爛卷曲、鰓小片細胞脫落,末端與鄰近的鰓小片融合在一起呈棒狀,與大黃魚(Larimichthyscrocea)[29]、美國鰣魚(Alosasapidissima)[27]、卵形鯧鲹[28]等魚類白點病組織病理變化相似,是魚類內臟白點病典型病理特征。由于不同病原菌導致發生內臟白點病病魚發病癥狀和組織病理變化相似,需要進一步加強內臟白點病病原鑒定和監測。
細菌的毒力基因與其致病性密切相關,毒力基因可在不同菌株之間轉移導致菌株毒力存在差異[30]。本研究中哈維氏弧菌hn-1菌株檢測到3種典型毒力基因,分別為毒力調控基因toxR、群體效應調節基因luxR和溶血素基因vhh。toxR為表達調控類毒力因子,能調控多種毒力基因的表達[12];luxR是群體感應系統關鍵調節基因,可調節細菌的毒力因子表達、運動性和生物膜形成能力等毒力因子[31];溶血素基因可產生多種引起溶血作用的酶,是細菌的重要毒力因子之一[32]。吳立婷等對54株大黃魚源哈維氏弧菌的毒力基因攜帶情況進行檢測,結果顯示,toxR、luxR和vhh的攜帶率分別達到75.9%、74.4%和64.8%[12];泥蚶(Tegillarcagranosa)源哈維氏弧菌J14和J19菌株也均攜帶上述3種毒力基因[30]。除了攜帶哈維氏弧菌溶血素基因vhh,hn-1菌株同時攜帶創傷弧菌溶血素基因vvh和副溶血弧菌耐熱直接相關溶血素基因trh。hn-1菌株含有多種典型和外來毒力基因,其致病性可能由多種基因共同調控,毒力基因具體表達情況和調控機制有待進一步研究。
抗生素耐藥性是細菌的一種自我保護機制,在抗生素的環境選擇壓力下,細菌可通過突變或基因水平轉移等方式獲得新的耐藥性。抗生素的大量使用已經在全世界范圍加劇了細菌耐藥性的產生,積極開展細菌耐藥性試驗,有利于養殖過程中抗生素的合理使用,防止細菌耐藥性的產生和發展[33]。本研究中分離的哈維氏弧菌菌株主要對青霉素類藥物耐藥,如氨芐西林、青霉素和阿莫西林;對糖肽類的萬古霉素和多肽類的多粘菌素B也有耐藥性;對喹諾酮類、氨基糖苷類、四環素類等藥物具有較強的敏感性。分離菌株的耐藥性與從許氏平鲉(Sebastesschlegelii)中分離的哈維氏弧菌P5W菌株[34]和泥蚶中分離的J14菌株[30]較為一致,但與P5W菌株對比,分離株hn-1仍保持對氨基糖苷類藥物較高的敏感性。根據《水產養殖用藥明白紙 2022 年 1、2 號》中批準使用的8種水產常用抗生素的MIC值檢測結果,鹽酸多西環素、氟甲喹和恩諾沙星的MIC值較低,生產上可采用這3種抗生素用于該病的防治。
4 結論
本研究通過對分離自患內臟白點病的斜帶髭鯛的病原進行鑒定和分析,獲得了如下結論:
(1)確認了哈維氏弧菌可引起斜帶髭鯛內臟白點病,擴大了哈維氏弧菌的天然宿主范圍。
(2)哈維氏弧菌hn-1菌株攜帶toxR、luxR、vhh、vvh和trh毒力基因,對喹諾酮類、氨基糖苷類、四環素類等藥物具有較強的敏感性,該結果可為養殖斜帶髭鯛內臟白點病的病害防治提供新的參考依據。

