水禽細(xì)小病毒選擇壓力與基因重組分析
汪宏才 商雨 郭云清 曾哲 張蓉蓉 溫國元 羅青平

摘要:通過對臨床水禽細(xì)小病毒進(jìn)行PCR檢測、基因組測序和進(jìn)化分析,確定分離毒株的基因型。進(jìn)一步通過Paml、RDP軟件對分離株的基因組進(jìn)行選擇壓力和基因重組分析,確定分離株的演化趨勢。結(jié)果表明,分離的3株水禽細(xì)小病毒均屬于新型鵝細(xì)小病毒,分別命名為YiCH株、AnQ株和XiY株,基因組長度分別為5 056、5 056、5 068 bp。3個分離株與新型鵝細(xì)小病毒M15株親源關(guān)系最近,其中XiY株兩端ITR區(qū)域191~196位、4 878~4 883位均有6個堿基插入。對分離株進(jìn)行選擇壓力分析,分離株VP蛋白檢測出3個正選擇位點,分別為116Q、261A、485S。重組分析顯示,分離株YiCH株和AnQ株都存在重組現(xiàn)象,以XiY株為主要親本株、GPV 06-0329株為次要親本株重組而成。
關(guān)鍵詞:水禽細(xì)小病毒;新型鵝細(xì)小病毒;分離鑒定;選擇壓力;基因重組
中圖分類號:S855.3 ? ? ? ? 文獻(xiàn)標(biāo)識碼:A
文章編號:0439-8114(2023)11-0191-07
DOI:10.14088/j.cnki.issn0439-8114.2023.11.033 開放科學(xué)(資源服務(wù))標(biāo)識碼(OSID):
Selection pressure and gene recombination analysis of waterfowl parvovirus
WANG Hong-cai, SHANG Yu, GUO Yun-qing, ZENG Zhe, ZHANG Rong-rong, WEN Guo-yuan, LUO Qing-ping
(Institute of Animal Husbandry and Veterinary Sciences/Key Laboratory of Animal Bacterial Disease Prevention and Control Formulations of the Ministry of Agriculture and Rural Affairs/Hubei Key Laboratory of Animal Embryo and Molecular Breeding,Hubei Academy of Agricultural Sciences,Wuhan ?430064,China)
Abstract: By conducting PCR detection, genome sequencing, and evolutionary analysis on clinical waterfowl parvovirus, the genotype of the isolated strain was determined.Further selection pressure and gene recombination analysis were conducted on the genome of the isolated strains using Paml and RDP software to determine the evolutionary trend of the isolated strains. The results showed that the three strains of waterfowl parvovirus isolated belonged to the novel goose parvovirus, named YiCH strain, AnQ strain, and XiY strain, with genome lengths of 5 056, 5 056, and 5 068 bp, respectively. The three isolates had the closest phylogenetic relationship with the novel goose parvovirus M15 strain, with 6 base insertions at positions 191~196 and 4 878~4 883 in the ITR region at both ends of the XiY strain. Selection pressure analysis was conducted on the isolated strains, and three positive selection sites were detected for the VP protein of the isolated strains, namely 116Q, 261A, and 485S. Recombination analysis showed that both the YiCH and AnQ strains exhibited recombination phenomenon, with XiY strain as the main parent strain and GPV 06-0329 strain as the secondary parent strain.
Key words: waterfowl parvovirus; novel goose parvovirus; isolation and identification; select pressure; gene recombination
水禽細(xì)小病毒(Waterfowl parvovirus,WPV)主要包括鵝細(xì)小病毒(Goose parvovirus,GPV)、番鴨細(xì)小病毒(Mute duck parvovirus,MDPV)和鴨細(xì)小病毒(Duck parvovirus,DPV)。該病毒對鵝、番鴨、鴨等水禽影響較大,在中國、法國、匈牙利、德國、以色列、美國等都有發(fā)病報道。病毒呈球形或六角形,無囊膜,基因組為單鏈、線性DNA,長度約5 kb。病毒基因組編碼VP1、VP2和VP3 3種衣殼蛋白,其中VP3蛋白是主要結(jié)構(gòu)蛋白,能誘導(dǎo)機(jī)體產(chǎn)生中和抗體。該病毒不僅能感染雛鵝或雛番鴨,而且引起麻鴨等水禽發(fā)病,導(dǎo)致短喙和生長遲緩[1]。對雛鴨的危害嚴(yán)重,死亡率超過60%。湖北省農(nóng)業(yè)科學(xué)院畜牧獸醫(yī)研究所禽病實驗室從多地送檢的病死鴨組織中檢測出WPV。臨床發(fā)病日齡為1月齡左右,鴨喙發(fā)育不良,表現(xiàn)為上喙短、下喙長、舌頭異常突出。解剖可見肝臟輕微出血,其他組織無肉眼可見病變。
鵝細(xì)小病毒最早由中國專家方定一[2]于1962年使用鵝胚分離獲得,隨后世界各國相繼報道了該病[3,4]。近年來,水禽細(xì)小病毒不斷出現(xiàn)變異和重組,病原宿主譜逐漸擴(kuò)大,臨床癥狀也出現(xiàn)變化。由最初的下痢、肝臟出血、腸道栓塞等癥狀轉(zhuǎn)變?yōu)槎锑购蜕L遲緩[5]等癥狀,在生產(chǎn)上造成重大經(jīng)濟(jì)損失。早在1970年,法國騾鴨出現(xiàn)了大量短喙和侏儒綜合征(Short beak and dwarfism syndrome,SBDS)病例[6]。2015年以來,中國也出現(xiàn)了一種新型鵝細(xì)小病毒(NGPV),導(dǎo)致侏儒綜合征[7]。國內(nèi)有學(xué)者認(rèn)為,鵝源細(xì)小病毒的變種可能是引起鴨侏儒綜合征的主要病原[8-10]。侏儒綜合征的病原對多種櫻桃谷鴨和騾鴨具有高致病性,全基因組序列之間沒有顯著差異[11],但感染其他品種鴨后卻不一定出現(xiàn)侏儒綜合征癥狀[12]。鴨SBDS的病原體與GPV密切相關(guān),與目前已知的所有禽源細(xì)小病毒不同,應(yīng)該是一種新型鴨細(xì)小病毒(NDPV)[13]。國內(nèi)外學(xué)者對GPV的基因變異、基因重組等開展了相關(guān)研究,發(fā)現(xiàn)了SBDS是由GPV變異株引起,GPV通過基因重組等,由鵝向鴨進(jìn)行適應(yīng)性演化,造成鴨發(fā)病,生產(chǎn)性能下降。引起基因變異的主要原因包括選擇壓力和基因重組2個方面。本研究通過對湖北省、安徽省等地區(qū)鴨源細(xì)小病毒的分離鑒定,分析GPV的流行趨勢,病毒變異情況,并通過生物信息學(xué)方法對病毒進(jìn)行選擇壓力、基因重組等方面分析,旨為WPV的演化趨勢以及防控提供參考。
1 材料與方法
1.1 材料
1.1.1 樣品 疑似GPV感染的病料來自湖北省、安徽省3個發(fā)病鴨場,由湖北省農(nóng)業(yè)科學(xué)院畜牧獸醫(yī)研究所禽病實驗室保存。發(fā)病鴨群日齡在21~42 d,死亡率在5%~12%,使用氟苯尼考、多西環(huán)素等抗生素治療無明顯效果。臨床癥狀以拉稀、死亡和短喙為主。解剖病變主要為肝臟輕度出血、脾臟萎縮、腎臟出血。初步診斷為細(xì)小病毒感染。
1.1.2 試劑 DNA提取試劑盒為AxyPrep體液病毒DNA/RNA小量試劑盒;PCR試劑為Vazyme公司的2×Rapid Taq Master Mix;DL2000 DNA Marker、pMD18-T載體、DH5α感受態(tài)細(xì)胞購自寶日醫(yī)生物技術(shù)(北京)有限公司。Gel Extraction Kit瓊脂糖凝膠回收試劑盒、Plasmid Mini Kit I小量提取試劑盒購自奧美嘉生物技術(shù)公司。
1.1.3 引物設(shè)計 根據(jù)GenBank數(shù)據(jù)庫中公布的鴨、番鴨、鵝細(xì)小病毒全基因組序列,通過Lasergene軟件中 MegAlign程序進(jìn)行多重比對,使用Primer premier 6.0軟件在保守區(qū)域設(shè)計了1對檢測引物和2對測序引物,擴(kuò)增Rep基因和VP基因,反向末端重復(fù)序列(ITR)片段的擴(kuò)增參考文獻(xiàn)[14]的方法。引物由生工生物工程(上海)股份有限公司合成。引物序列信息見表1。
1.2 方法
1.2.1 病料的處理 將收集的病鴨肝、脾、腸道等疑似病變組織按照1∶5(V∶V)的比例加入pH 7.4磷酸鹽緩沖液(PBS)進(jìn)行組織勻漿,然后置于-20 ℃凍融3次,6 000 r/min離心15 min,經(jīng)0.22 μm過濾器過濾除菌后,置于-80 ℃冰箱備用。
1.2.2 核酸的提取和PCR擴(kuò)增 按照“1.2.1”項方法處理樣品,使用AxyPrep體液病毒DNA/RNA小量試劑盒,按照說明書的方法提取DNA,然后以PV-F/R引物對3個不同地區(qū)的鴨病料組織進(jìn)行PCR鑒定。PCR反應(yīng)體系:Master Mix 12.5 μL、ddH2O 8.5 μL、上下游引物各1.0 μL、DNA模板2.0 μL,合計25.0 μL。按以下條件進(jìn)行PCR反應(yīng):95 ℃預(yù)變性5 min;95 ℃變性15 s、52 ℃退火15 s、72 ℃延伸15 s,共35個循環(huán);72 ℃延伸5 min。PCR產(chǎn)物用1.0%瓊脂糖凝膠進(jìn)行電泳,觀察是否出現(xiàn)陽性條帶。
1.2.3 測序片段擴(kuò)增及序列測定 以“1.2.2”項中提取的DNA為模板,擴(kuò)增ITR區(qū)域、Rep基因、VP基因。PCR反應(yīng)體系:Master Mix 25.0 μL、ddH2O 17.0 μL、上下游引物各2.0 μL、DNA模板4.0 μL,合計50.0 μL。按以下條件進(jìn)行PCR反應(yīng):95 ℃預(yù)變性5 min;95 ℃變性20 s、52 ℃退火20 s、72 ℃延伸45 s,共35個循環(huán);72 ℃延伸10 min。由于ITR區(qū)域具有復(fù)雜的發(fā)卡結(jié)構(gòu),按以下條件進(jìn)行PCR反應(yīng):95 ℃預(yù)變性5 min;95 ℃變性20 s、55 ℃退火30 s、72 ℃延伸20 s,共35個循環(huán)。PCR產(chǎn)物用1.0%瓊脂糖凝膠進(jìn)行電泳,觀察是否出現(xiàn)陽性條帶。將PCR產(chǎn)物回收純化后,連接至pMD18-T載體,通過DH5α感受態(tài)細(xì)胞轉(zhuǎn)化,經(jīng)氨芐西林篩選和菌液PCR鑒定后,取陽性菌液送至生工生物工程(上海)股份有限公司測序。
1.2.4 測序結(jié)果的組裝與拼接 使用Lasergen軟件SeqMan程序進(jìn)行組裝拼接,以FM株為參考株,得到全基因組序列。根據(jù)病料來源,分別命名為YiCH株、AnQ株和XiY株。
1.2.5 進(jìn)化分析 登錄Genbank數(shù)據(jù)庫,選擇背景清晰、不同時空分布且具有代表性的GPV、MDPV和NGPV全基因組序列,合計31條。使用MEGA軟件,選擇最大似然法(Maximum likelihood,ML)建立進(jìn)化樹,自展值(Bootstrap method)設(shè)為500。參考毒株信息見表2。
1.2.6 選擇壓力分析 按文獻(xiàn)[15]的方法,使用Paml軟件中Codeml程序,分析Rep蛋白和VP蛋白所承受的正選擇壓力位點。結(jié)果通過Datamonkey網(wǎng)站(http://www.datamonkey.org/)在線驗證,選擇位點模式Episodic下MEME(Mixed
1.2.7 重組分析 使用ClustalX、MEGA等軟件,將參考序列和分離株核酸序列進(jìn)行多重比對后,使用RDP軟件[16],采用RDP、GENECONV、Chimaera、MaxChi、BootScan、SiScan和3Seq 7種檢測模式,對分離株的全基因組序列進(jìn)行重組分析,選擇7種檢測方法均支持的毒株為重組毒株。
2 結(jié)果與分析
2.1 檢測引物PCR擴(kuò)增結(jié)果
3個樣品使用檢測引物PV-F/R進(jìn)行PCR擴(kuò)增,1.0%瓊脂糖凝膠電泳檢測,均在800 bp處出現(xiàn)電泳條帶(圖1),條帶大小與預(yù)期相符,表明被檢測組織中含有細(xì)小病毒。
2.2 測序片段的擴(kuò)增
使用引物Rep-F/R擴(kuò)增Rep基因,產(chǎn)物大小為 2 000 bp;使用引物VP-F/R擴(kuò)增VP基因,產(chǎn)物大小為2 400 bp。PCR擴(kuò)增后,1.0%瓊脂糖凝膠電泳檢測,出現(xiàn)預(yù)期大小的條帶(圖2)。ITR區(qū)域分段擴(kuò)增后,分別得到188 bp短片段和476 bp 長片段2個條帶(圖3)。這些產(chǎn)物將用于后續(xù)的測序分析。
2.3 測序結(jié)果的組裝與拼接
將3株病毒的測序結(jié)果使用Lasergen軟件SeqMan組裝拼接后,得到全基因組序列。YiCH株、AnQ株和XiY株全基因組大小分別為5 056、5 056、5 068 bp。其中XiY株在ITR區(qū)域191~196位、 ? ? ? ? 4 878~4 883位均有6個堿基插入(圖4)。
2.4 進(jìn)化分析
參照文獻(xiàn)[17]對Rep基因、VP3基因進(jìn)行分子進(jìn)化和系統(tǒng)發(fā)育分析,堿基替代方法選用Maximum likelihood,系統(tǒng)發(fā)育檢驗采用Bootstrap方式,替代次數(shù)為500次。結(jié)果顯示,根據(jù)Rep基因繪制的系統(tǒng)發(fā)生樹如圖5所示,AnQ株、YiCH株和XiY株處于同一進(jìn)化分支,且與新型鵝細(xì)小病毒M15株親緣關(guān)系較近。基于VP3基因繪制的系統(tǒng)發(fā)生樹如圖6所示,3個分離株同樣處于同一分支,與sdlc01株、QH15株、SDLY1512株親緣關(guān)系較近。結(jié)果表明,AnQ株、YiCH株和XiY株屬于新型鵝細(xì)小病毒。
2.5 分離株選擇壓力分析
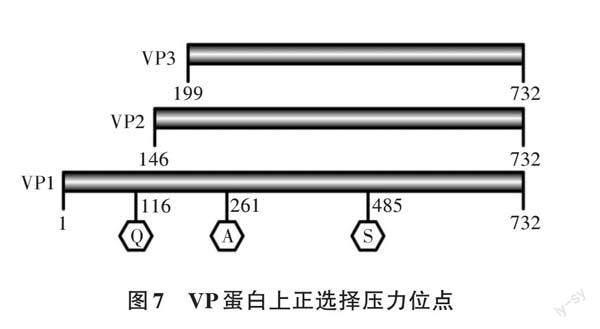
在Rep蛋白上未檢測出正選擇壓力位點,在VP蛋白上檢測出3個正選擇壓力位點(表3、圖7),分別位于VP1蛋白第116位Q氨基酸、261位A氨基酸和485位S氨基酸,其中261A、485S同時也位于VP2和VP3蛋白上。進(jìn)一步說明鵝細(xì)小病毒VP1、VP2和VP3 3個蛋白都受到正選擇壓力作用,更容易產(chǎn)生適應(yīng)性進(jìn)化,推測也是跨種傳播的主要原因。
2.6 分離株重組分析
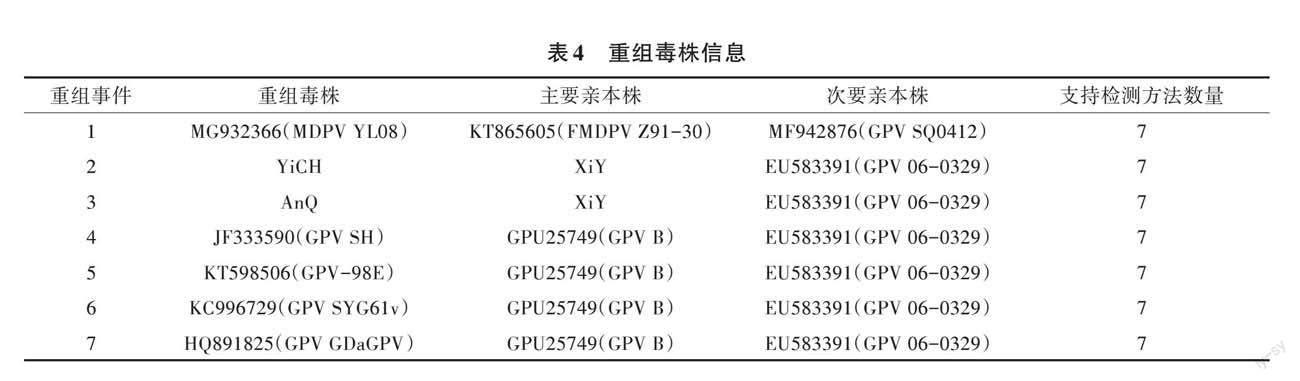
參照文獻(xiàn)[18]的方法,對Rep基因、VP基因以及ITR區(qū)域進(jìn)行重組分析,其中ITR區(qū)域、Rep基因無檢出,VP基因共檢測出14個重組事件。其中同時支持7種檢測方法的重組事件有7個(表4),由分離株參與的重組事件有2個,分別為重組事件2和重組事件3。對重組事件2和重組事件3采用RDP方法進(jìn)行驗證,YiCH株和AnQ株在VP區(qū)域111~541 bp處檢測到重組信息(圖8)。結(jié)果顯示,YiCH株、AnQ株都是重組毒株,以XiY株為主要親本株、GPV 06-0329株為次要親本株重組而成。
3 討論
經(jīng)典GPV感染主要引起腸道病變。近年來,隨著病毒的變異和重組,出現(xiàn)以鴨短喙、癱瘓、侏儒為主要癥狀的新型鵝細(xì)小病毒,給中國的水禽養(yǎng)殖造成嚴(yán)重的影響。MDPV和GPV在宿主譜、致病性方面也存在顯著差異。GPV既能感染鵝,也能感染番鴨,而MDPV只能感染番鴨,不能感染鵝,且早期MDPV和GPV在血清學(xué)方面無交叉反應(yīng)[19]。隨著NDPV的出現(xiàn),水禽細(xì)小病毒出現(xiàn)跳躍式進(jìn)化,衣殼蛋白上2個氨基酸發(fā)生變化,可能是引起NDPV宿主轉(zhuǎn)移的原因。自然選擇壓力驅(qū)動水禽細(xì)小病毒不斷產(chǎn)生適應(yīng)性改變;構(gòu)成NDPV的基因組中,陽性選擇位點主要位于結(jié)構(gòu)蛋白上[20]。疫苗加速病毒的變異頻率。
細(xì)小病毒重組現(xiàn)象比較普遍,經(jīng)典MDPV在演化過程中,強(qiáng)毒株和疫苗株在感染同一宿主時發(fā)生重組,導(dǎo)致新的毒株產(chǎn)生,MDPV ZW株就是由經(jīng)典的MDPV和GPV疫苗株重組產(chǎn)生的[21]。2種不同基因型的GPV在自然界中容易進(jìn)行重組,并產(chǎn)生新的變異毒株,如SDLY1602 被證明是一種重組毒株,是由GPV疫苗株82-0321v為主要親本和GPV野生毒株GDaGPV為次要親本重組而成,因此NGPV常被認(rèn)為是GPV的一個分支[22]。而在福建騾鴨中發(fā)現(xiàn)一株重組M15株,是由GPV和MDPV組成的天然重組體[23]。但番鴨細(xì)小病毒也可引起SBDS,2008年福建省騾鴨養(yǎng)殖場和臺灣省白鴨養(yǎng)殖場發(fā)現(xiàn)了由MDPV感染引起的SBDS臨床病例[24]。
不同物種之間細(xì)小病毒重組現(xiàn)象也常有發(fā)生[25-27],本研究中YiCH株就是以XiY株為主要親本,GPV 06-0329株為次要親本重組而成。重組區(qū)域主要位于結(jié)構(gòu)蛋白區(qū)域,而非結(jié)構(gòu)蛋白區(qū)域和兩端ITR區(qū)域未檢測出重組事件。GPV 06-0329株于2006年從臺灣省鵝中分離,接種1日齡番鴨能100%引起死亡[28],屬于強(qiáng)毒株。隨后,安徽省[29]、廣東省[30]等地相繼分離到臺灣省06-0329株。而主要親本株XiY株則是近年在湖北省分離得到,二者重組后得到Y(jié)iCH株和AnQ株,說明在同一地區(qū),細(xì)小病毒產(chǎn)生重組是普遍現(xiàn)象,且隨著引種和活禽交易,病毒易向周邊地區(qū)擴(kuò)散。
GPV通過自然選擇壓力和基因重組,產(chǎn)生適應(yīng)性進(jìn)化,可以在自然界中逐漸演變?yōu)镹GPV。陽性選擇壓力主要作用于VP結(jié)構(gòu)蛋白,通過改變蛋白質(zhì)結(jié)構(gòu)進(jìn)行宿主遷移。基因重組則是水禽細(xì)小病毒進(jìn)化的另一種方式,重組的主要區(qū)域位于VP蛋白區(qū)域,GPV、MDPV參與重組過程,并通過重組產(chǎn)生新的基因型,從而擴(kuò)大宿主范圍。
參考文獻(xiàn):
[1] SOLIMAN M A, ERFAN A M, SAMY M, et al. Detection of novel goose parvovirus disease associated with short beak and dwarfism syndrome in commercial ducks[J]. Animals, 2020,10(10): 1833.
[2] 方定一. “小鵝瘟”的介紹[J]. 中國畜牧獸醫(yī), 1962(8): 19-20.
[3] 傅宏慶, 姚志蘭, 王永娟, 等. 鴨短喙型小鵝瘟病毒SBDS-GPV JS01株的分離鑒定及其對雛鴨致病性的研究[J]. 中國獸醫(yī)科學(xué), 2020,50(10): 1286-1293.
[4] ISIDAN H, TURAN T, ATASOY M O, et al. Molecular analysis of goose parvovirus field strains from a Derzsys disease outbreak reveals local European-associated variants[J]. Archives of virology, 2021,166(7): 1931-1942.
[5] WAN C, LIU R, CHEN C, et al. Novel goose parvovirus in domestic Linwu sheldrakes with short beak and dwarfism syndrome, China[J]. Transboundary and emerging diseases, 2019,66(5): 1834-1839.
[6] PALYA V, ZOLNAI A, BENYEDA Z, et al. Short beak and dwarfism syndrome of mule duck is caused by a distinct lineage of ?goose parvovirus[J]. Avian pathology, 2009,38(2): 175-180.
[7] LI D L, ZHANG L D, CHEN S H, et al. Detection and molecular characterization of two genotypes of goose parvoviruses isolated from growing period geese and cherry valley ducks in China[J]. Avian diseases, 2019,63(3): 411-419.
[8] YU K X, MA X L, SHENG Z Z, et al. Identification of goose-origin parvovirus as a cause of newly emerging beak atrophy and dwarfism syndrome in ducklings[J]. Journal of clinical microbiology, 2016,54(8): 1999-2007.
[9] ZHAO G W, HUANG T T, WU D, et al. Diagnosis and characterization of duck beak atrophy and dwarfism syndrome in Chongqing of China[J]. Veterinary research forum, 2019,10(2): 169-172.
[10] CHEN S L, WANG S, CHENG X X, et al. Isolation and characterization of a distinct duck-origin goose parvovirus causing an outbreak of duckling short beak and dwarfism syndrome in China[J]. Archives of virology, 2016,161(9): 2407-2416.
[11] BIAN G Z, MA H B, LUO M P, et al. Identification and genomic analysis of two novel duck-origin GPV-related parvovirus in China[J]. BMC veterinary research, 2019,15(1): 1833-1839.
[12] XIAO S F, CHEN S L, CHENG X X, et al. The newly emerging duck-origin goose parvovirus in China exhibits a wide range of ?pathogenicity to main domesticated waterfowl[J]. Veterinary microbiology, 2017,203: 252-256.
[13] LI C F,LI Q,CHEN Z Y,et al. Novel duck parvovirus identified in cherry valley ducks (anas platyrhynchos domesticus), China[J]. Infection, genetics and evolution, 2016,44: 278-280.
[14] 賈婧宇,秘清靈,李勇霖,等. 3株櫻桃谷鴨源新型鵝細(xì)小病毒的分離及分子特征解析[J]. 中國動物傳染病學(xué)報,2022,30(2):7-13.
[15] 汪宏才, 溫國元, 張騰飛, 等. 新城疫病毒陽性選擇區(qū)域氨基酸與毒力相關(guān)性研究[J]. 中國家禽, 2018,40(21): 26-30.
[16] MARTIN D P, MURRELL B, GOLDEN M, et al. RDP4: Detection and analysis of recombination patterns in virus genomes[J]. Virus evolution, 2015,1(1): vev003.
[17] 傅秋玲,程龍飛, 萬春和, 等. 半番鴨胚中鵝細(xì)小病毒的分離鑒定及其基因組分子特征分析[J]. 畜牧獸醫(yī)學(xué)報,2017,48(11): 2148-2156.
[18] MARTIN D P, VARSANI A, ROUMAGNAC P, et al. RDP5:A computer program for analyzing recombination in, and removing signals of recombination from, nucleotide sequence datasets[J]. Virus evolution, 2021,7(1): 1-3.
[19] 程由銓, 胡奇林, 陳少鶯, 等. 番鴨細(xì)小病毒和鵝細(xì)小病毒生化及基因組特性的比較[J]. 中國獸醫(yī)學(xué)報, 2001(05): 429-433.
[20] FAN W, SUN Z, SHEN T, et al. Analysis of evolutionary processes of species jump in waterfowl parvovirus[J]. Frontiers in microbiology, 2017,8: 421.
[21] WANG J, LING J, WANG Z, et al. Molecular characterization of a novel Muscovy duck parvovirus isolate: Evidence of recombination between classical MDPV and goose parvovirus strains[J]. BMC veterinary research, 2017,13(1): 1238-1246.
[22] LI P, LIN S, ZHANG R, et al. Isolation and characterization of novel goose parvovirus-related virus reveal the evolution of waterfowl parvovirus[J]. Transboundary and emerging diseases, 2018,65(2): 284-295.
[23] WANG S, CHENG X X, CHEN S L, et al. Identification of a novel goose parvovirus (GPV) recombinant associated with short beak and dwarfism syndrome in Mainland China, 2015[J]. Infection, genetics and evolution, 2016,41: 289-291.
[24] FU Q L, HUANG Y, WAN C H, et al. Genomic and pathogenic analysis of a Muscovy duck parvovirus strain causing short beak and dwarfism syndrome without tongue protrusion[J]. Research in veterinary science, 2017,115: 393-400.
[25] WANG S, CHENG X X, CHEN S Y, et al. Genetic characterization of a potentially novel goose parvovirus circulating in Muscovy duck flocks in Fujian Province, China[J]. The Journal of veterinary medical science, 2013,75(8): 1127-1130.
[26] ZHU Y, ZHOU Z, HUANG Y, et al. Identification of a recombinant Muscovy duck parvovirus (MDPV) in Shanghai, China[J]. Veterinary microbiology, 2014,174(3-4): 560-564.
[27] SHEN H, ZHANG W, WANG H, et al. Identification of recombination between Muscovy duck parvovirus and goose parvovirus structural protein genes[J]. Archives of virology, 2015,160(10): 2617-2621.
[28] SHIEN J H, WANG Y S, CHEN C H, et al. Identification of sequence changes in live attenuated goose parvovirus vaccine strains developed in Asia and Europe[J]. Avian pathology, 2008,37(5): 499-505.
[29] 王 浩, 田先舉, 張 爍, 等. 2株鵝細(xì)小病毒全基因組特征分析[J]. 畜牧獸醫(yī)學(xué)報, 2013,44(4): 602-609.
[30] 黃冠雄. 2015-2016年廣東省小鵝瘟病毒分子流行病學(xué)調(diào)查[D]. 廣州:仲愷農(nóng)業(yè)工程學(xué)院, 2017.

