喹諾酮雜合體的抗耐甲氧西林金葡菌活性研究進展
王林碩 李曉 王寶君
摘要:耐甲氧西林金葡菌(MRSA)是引起院內和社區感染的重要病原菌,高發病率與致死率使得其位居感染病原菌之首。MRSA是多重耐藥致病菌,目前已對包括萬古霉素在內的幾乎所有抗生素產生了不同程度的耐藥性。因此,開發新型抗MRSA藥物刻不容緩。喹諾酮尤其是氟喹諾酮是臨床上廣泛使用的一類廣譜抗菌藥,對包括某些MRSA在內的多種致病菌引起的感染具有良好的療效。雜合體具有多個藥效團可同時作用于不同的藥物靶點,故雜合體策略是克服耐藥性的常用策略。喹諾酮與其它抗MRSA藥效團相結合所得的雜合體可發揮協同作用,尋找新型抗MRSA藥物的潛力分子。近年來,藥物化學家設計合成評價了多個系列喹諾酮雜合體的抗MRSA活性,發現了多個具有進一步研究價值的潛在化合物。本文將著重介紹2015—2022年間所發展的具有抗MRSA活性的喹諾酮雜合體的研究進展,并歸納構-效關系,為進一步合理設計此類雜合體提供一定的理論支持。
關鍵詞:喹諾酮;雜合體;抗菌;耐甲氧西林金葡菌;構-效關系
中圖分類號:R978.1? ? ? ? 文獻標志碼:A
Recent progress of quinolone hybrids with antibacterial potential against methicillin-resistant Staphylococcus aureus
Wang Linshuo1, Li Xiao2, and Wang Baojun1
(1 Shijiazhuang Medical College, Shijiazhuang 050599; 2 Handan Maternal and Child Health Care Hospital, Handan 056000)
Abstract Methicillin-resistant Staphylococcus aureus (MRSA) strains, the most common pathogens in hospital and community, remains a leading cause of bacterial infections worldwide due to the high mortality and morbidity. MRSA are multi-drug resistant pathogens and have already developed resistance to almost all antibiotics including vancomycin, necessitating the development of novel agents for combating these superbugs. Quinolones, especially fluoroquinolones, are broad-spectrum antibacterial agents widely applied in clinical practice and demonstrated excellent curative effect on infections caused by diverse pathogenic bacteria, including some MRSA. Hybrid molecules possess multiple pharmacophores that can act on different drug targets simultaneously, so hybridization is a promising strategy to overcome drug resistance. Combination of the quinolone moiety with other pharmacophores against MRSA has the potential to exert synergistic effect, and thus quinolone hybrids are useful templates for searching for new anti-MRSA drugs. In this review, the anti-MRSA potential and the structure-activity relationship of quinolone hybrids are discussed, which will provide a reference for further research.
Key words Quinolone; Hybrid; Antibacterial; MRSA; Structure-activity relationship
耐甲氧西林金葡菌(MRSA)是一種傳染性和致病性極強的共生菌,可導致肺炎、菌血癥、心內膜炎、皮膚和軟組織感染、骨和關節感染甚至死亡,是院內最常見的致病菌[1-2]。MRSA呈多重耐藥性,也稱“超級細菌”,對所有與甲氧西林相同結構的β-內酰胺類和頭孢類抗生素均耐藥,對其它抗菌藥如氨基糖苷類、大環內酯類、四環素類、氟喹喏酮類、磺胺類和利福平等具有不同程度的耐藥[3-4]。目前,MRSA感染幾乎遍及全球,并已超過乙肝和艾滋病,被列為世界3大最難解決感染性疾患的首位[5-6]。MRSA感染的治療是臨床最棘手的難題之一,最常用也是療效最肯定的抗菌藥有萬古霉素、去甲萬古霉素和替考拉寧、利奈唑胺、特地唑胺和康替唑胺等[7-8]。然而,新型耐藥MRSA如萬古霉素中介金葡菌(VISA)、異質性萬古霉素中介金葡菌(h-VISA)和萬古霉素耐藥金葡菌(VRSA)的出現,使得臨床醫師可能會在不久的將來面臨無藥可選的窘境[9-10]。因此,開發新型抗MRSA藥物刻不容緩。
喹諾酮尤其是氟喹諾酮具有抗菌譜廣、抗菌活性強、口服吸收好、組織濃度比較高和不良反應較低等諸多優點,廣泛應用于臨床治療各種致病菌引起的感染[11-12]。其中,某些第四代喹諾酮如莫西沙星、德拉沙星、西他沙星、加雷沙星、奈諾沙星和奧澤沙星等目前已在臨床上用于治療MRSA感染[13-14]。因此,喹諾酮骨架是開發新型抗MRSA藥物的潛在結構單元。將兩個或多個藥效團糅合到一個分子中所得的雜合體可同時作用于細菌的多個靶點,具有改善藥動學性質、降低毒副作用、提高藥效、拓展抗菌譜和克服耐藥性的潛力[15-16]。因此,將喹諾酮與其它抗MRSA藥效團相結合所得的雜合體可發揮協同作用,是尋找新型抗MRSA藥物的潛力分子[17-18]。
近年來,藥物化學家設計、合成了多個系列喹諾酮雜合體,并評價了它們的抗MRSA活性。其中的某些雜合體如氟喹諾酮-利福霉素雜合體Ro-23-9424 (Roche公司,可通過阻擾細菌合成細胞壁和干擾細菌核酸的功能發揮抗菌活性,已經進入Ⅱ期臨床試驗階段)和氟喹諾酮-β-內酰胺雜合體CBR-2092 (Cumber公司,可通過抑制RNA的合成和DNA促旋酶及拓撲異構酶IV發揮抗菌活性,已經進入Ⅱ期臨床試驗階段)顯示出良好的體內外抗MRSA活性,具有進一步研究價值。本文將著重介紹2015—2022年間所發展的具有抗MRSA活性的喹諾酮雜合體的研究進展,并歸納構-效關系,為進一步合理設計此類雜合體提供一定的理論支持.
1 喹諾酮雜合體的抗MRSA活性
氟喹諾酮-嘧啶雜合體1(圖1;最小抑菌濃度/MIC: 1.0~>256 μg/mL)的抗MRSA構-效關系研究表明:①氟喹諾酮N-1位取代基對活性有顯著影響,且乙基優于環丙基;②向嘧啶的C-4位引入供電子的氨基對活性有利,而吸電子的三氟甲基對活性不利[19]。其中,雜合體1a~c(MIC: 1.0 μg/mL)的抗MRSA活性是環丙沙星(MIC: 2.0 μg/mL)和諾氟沙星(MIC: 8.0 μg/mL)的2和8倍。值得一提的是,雜合體1a(MIC: 0.5~1.0 μg/mL)對所測3株藥敏型金葡菌也具有良好的活性,且活性與環丙沙星(MIC: 0.5~2.0 μg/mL)和諾氟沙星(MIC: 2.0~4.0 μg/mL)相當或更優。此外,雜合體1a(半數細胞毒性濃度/CC50: >
50 μg/mL)對正常HaCat細胞的毒性較低。作用機制研究表明,雜合體1a不僅可通過抑制生物膜的形成快速發揮抗菌活性,而且還可通過提高胞內活性氧濃度和形成DNA-1a復合物促使細菌凋亡。計算機模擬發現,雜合體1a具有良好的吸收、分布、代謝和消除(ADME)性質,且與諾氟沙星和環丙沙星相當。不僅如此,與諾氟沙星和環丙沙星相比,該雜合體產生耐藥性的幾率更低。
絕大多數喹諾酮-嘧啶雜合體2(MIC: 0.75~>50 μg/mL)和3(MIC: 0.38~12.5 μg/mL)顯示出潛在的抗MRSA活性,且構-效關系顯示:①向嘧啶C-4位的苯環對位引入小體積烷基尤其是甲基可增強活性;②嘧啶與苯環之間嵌入氧原子對活性有利;③喹諾酮N-1位為環丙基時活性優于相應的直鏈或支鏈烷烴衍生物[20]。其中,雜合體2a,b(MIC: 0.75 μg/mL)和3a,b(MIC: 0.38 μg/mL)是各系列中活性最高的化合物,且活性與環丙沙星(MIC: 0.50 μg/mL)相當,而優于萬古霉素(MIC: 1.5 μg/mL)。進一步評價發現,雜合體3b(MIC: <
0.17~0.69 μg/mL)對5株臨床分離MRSA也顯示出良好的活性,且活性高于萬古霉素(MIC: 0.78~3.13 μg/mL)。不僅如此,該雜合體(MIC: 0.125~1.0 μg/mL)對耐左氧氟沙星MRSA和耐萬古霉素中度耐藥金葡菌(VISA)的活性是左氧氟沙星(MIC: 16~>64 μg/mL)和萬古霉素(MIC: 2.0~>8.0 μg/mL)的≥8倍。特別值得一提的是,雜合體3b在MRSA傳代15次后MIC沒有任何增加,而對照藥萬古霉素則提升了4倍,提示該雜合體不易產生獲得耐藥性。對接試驗表明,該雜合體的氨基嘧啶結構片段可與DNA堿基形成2個氫鍵,這可能是該雜合體克服耐藥性的原因。
喹諾酮-嘧啶二酮雜合體4(MIC: 15.4 μg/mL)及其衍生物5(MIC: 24.2 μg/mL)的抗MRSA AUMC 261活性優于環丙沙星(MIC: 188.6 μg/mL)[21]。作用機制研究發現,雜合體4(IC50:1.72和4.36 μmol/L)和5(MIC: 5.72和7.77 μmol/L)對DNA促旋酶和拓撲異構酶IV具有雙重抑制作用。因此,二者可作為抗MRSA先導物進行進一步結構優化。
環丙沙星-喹唑啉酮雜合體6(MIC: 8.0~32 μg/mL)的抗MRSA活性普遍優于沙拉沙星-喹唑啉酮雜合體7(MIC: 16~32 μg/mL),提示氟喹諾酮母核對活性有一定影響[22]。進一步研究發現,向喹唑啉酮的C-6位引入供電子基如甲氧基對活性有利,而吸電子基則對活性不利;向C-7位引入鹵素也會降低活性。其中,雜合體6b(MIC: 8.0 μg/mL)的抗MRSA活性是環丙沙星(MIC: 16 μg/mL)的2倍。此外,雜合體6b(MIC: 8.0 μg/mL)的抗藥敏型金葡菌活性是環丙沙星(MIC: 32 μg/mL)的4倍,且耐藥指數(RI: MICMRSA/MICMSSA)為1.0,提示該雜合體無交叉耐藥性。
2-喹諾酮-喹唑啉酮雜合體8對所測5株甲氧西林敏感型金葡菌(MSSA)、3株MRSA和3株VISA的MIC分別為4.0~8.0 μg/mL、4.0~8.0 μg/mL和4.0~16 μg/mL [23]。進一步研究發現,該雜合體(半數抑制濃度/IC50:1.21 μmol/L)具有潛在的抑DNA促旋酶亞基B(gyrB)活性。代謝穩定性研究表明,該雜合體在血漿和肝微粒體的半衰期分別為>372.8 min和24.5 min。總之,雜合體8可作為gyrB抑制劑進行深入研究。
莫西沙星/磺酰胺雜合體9的抗MRSA構-效關系顯示:①向苯環的對位引入強吸電子基如硝基對活性不利,而鹵素和甲氧基對活性影響不大;②磺酰基并非這類雜合體具有高活性所必需的基團,用羰基或者次甲基取代活性并不會降低[24]。其中,雜合體9a~e(MIC: <2.64 μg/mL)的抗MRSA活性與環丙沙星(MIC: 1.31 μg/mL)處于同一水平,值得進一步研究。
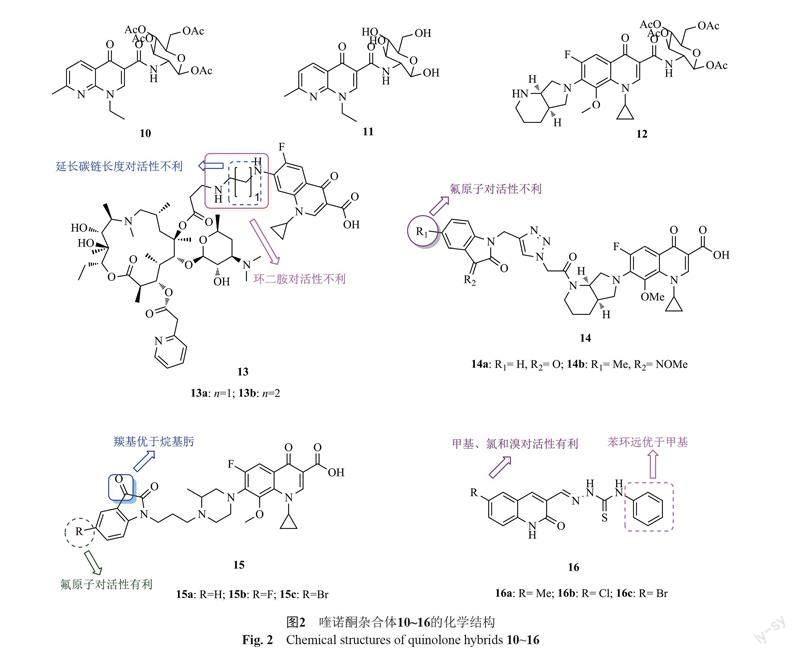
萘啶酮-葡萄糖雜合體10(圖2,MIC: 64 μg/mL)和11(MIC: 64 μg/mL)及莫西沙星-葡萄糖雜合體12(MIC: 128 μg/mL)的抗MRSA活性較弱,遠遜于對照藥莫西沙星(MIC: <0.2 μg/mL)[25-26]。這可能是由于氟喹諾酮的C-3位羧酸結構片段和C-4位羰基結構單元是DNA促旋酶的結合位點,對喹諾酮的抗菌活性至關重要,對該位點進行修飾往往會導致活性的降低甚至消失所致[11]。
氟喹諾酮-阿奇霉素雜合體的抗紅霉素核糖體甲基化酶基因(erm)編碼誘導耐藥的MRSA PU32構-效關系顯示:①氟喹諾酮與阿奇霉素母核之間用直鏈烷基二胺連接優于環二胺;②碳鏈長度與活性息息相關,且延長碳鏈長度對活性不利;③將喹諾酮C-7位的氨基連接子換成炔基連接子且移至C-6位將導致活性大幅下降[27]。作用機制研究顯示,這類雜合體可通過抑制蛋白質合成和抑制DNA復制雙重作用機制發揮抗菌活性。其中,雜合體13a,b(MIC: 8.0 μg/mL)抗MRSA PU32的活性是對照藥阿奇霉素(MIC: 32 μg/mL)和環丙沙星(MIC: 64 μg/mL)的4和8倍,值得進一步結構優化。
莫西沙星-1,2,3-三氮唑-靛紅雜合體14(MIC: 1.0~32 μg/mL)具有潛在的抗MRSA活性,且構-效關系顯示,向靛紅的C-5或C-7位引入氟原子或向C-3位引入乙肟對活性不利[28]。代表物14a,b(MIC: 1.0 μg/mL)
的抗MRSA活性可與萬古霉素(MIC: 1.0 μg/mL)相媲美,而是母藥莫西沙星(MIC: 8.0 μg/mL)的8倍。細胞毒性試驗表明,二者(CC50: 64和32 μg/mL)對正常CHO細胞的毒性較低。體內藥動學研究表明,雜合體14b(100 mg/kg, 皮下注射)的半衰期為3.1 h,達峰時間為29 min。
加替沙星-靛紅雜合體15(MIC: 0.125~0.5 μg/mL)具有優秀的抗MRSA活性,且活性不遜于加替沙星(MIC: 0.25 μg/mL)和環丙沙星(MIC: 0.5 μg/mL) [29]。構-效關系顯示,與羰基相比,向靛紅的C-3位引入烷基肟對活性不利;向C-5位引入氟原子對活性有利,但溴原子的引入不會增強活性;向加替沙星C-3位的羧酸引入第二個靛紅結構片段對活性不利。其中,代表物15b(MIC: 0.125 μg/mL)的抗MRSA活性是加替沙星(MIC: 0.25 μg/mL)和環丙沙星(MIC: 0.5 μg/mL)的2和4倍。
2-喹諾酮-氨基硫脲雜合體的抗MRSA構-效關系顯示:①氨基硫脲部分苯環對活性至關重要,將苯環用甲基替代將導致活性大幅降低;②向2-喹諾酮母核的C-6位引入甲基、氯和溴對活性有利,但氟對活性不利[30]。其中,雜合體16a~c(MIC: 312 μg/mL)的活性最高,但弱于環丙沙星(MIC: 62.5 μg/mL)。
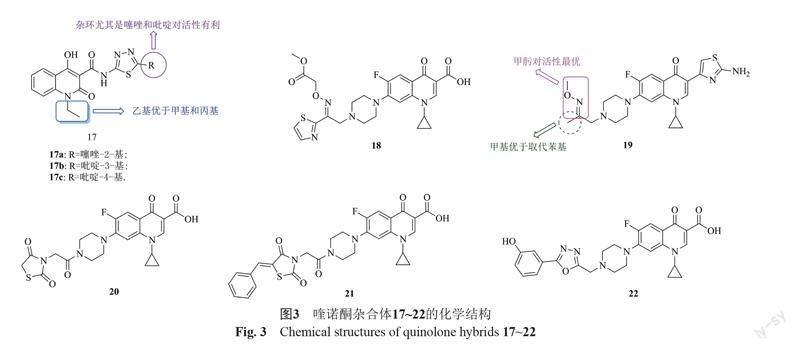
2-喹諾酮-噻二唑雜合體17(圖3,MIC: 0.25~4.0 μg/mL)對所測的9株臨床分離MRSA具有優秀的活性,且構-效關系顯示:①2-喹諾酮的N-1位為乙基時雜合體的活性優于相應的甲基和丙基衍生物;②向噻二唑的C-3位引入雜環尤其是噻唑和吡啶可提高活性[31]。
其中,雜合體17a~c(MIC: 0.25~1.0 μg/mL)對所測9株臨床分離MRSA的活性普遍優于萬古霉素(MIC: 1.0~8.0 μg/mL)。特別值得一提的是,雜合體17a(MIC: 0.25~1.0 μg/mL)對所測9株臨床分離MRSA、1株MSSA、2株甲氧西林敏感表皮葡萄球菌(MSSE)、3株耐甲氧西林表皮葡萄球菌(MRSE)和耐萬古霉素腸球菌(VRE)具有優秀的廣譜活性,且活性是萬古霉素(MIC: 1.0~64 μg/mL)的2~128倍。在MRSA感染小鼠模型中,雜合體17a組小鼠的存活率呈計量相關性,且在口服給藥9.0 mg/kg時小鼠的存活率為87.5%,而安慰劑組的存活率僅為12.5%。此外,雜合體17a的血漿結合率為99.9%。體內藥動學研究表明,雜合體17a(10 mg/kg, 口服給藥)的半衰期為2.3 h,達峰時間為1.0 h,藥時曲線下面積(AUCinf)為2620 ng·h/mL且最大血藥濃度(Cmax)為
827.1 ng/mL。特別值得一提的是,雜合體17a在MRSA傳代20次后MIC沒有任何增加,提示該雜合體不易產生獲得耐藥性。作用機制研究發現,DNA促旋酶B是該雜合體的作用靶點。總之,雜合體17a可作為候選物進行深入的臨床前研究。
含有肟基的環丙沙星/諾氟沙星-噻唑雜合體(MIC: 0.25~4.0 μg/mL)具有良好的抗MRSA活性,且活性是環丙沙星(MIC: 8.0 μg/mL)和諾氟沙星(MIC: 16 μg/mL)的2~64倍[32]。其中,雜合體18(MIC:
0.25 μg/mL)對所測的MRSA和3株金葡菌具有相同的活性,RI為1,提示該雜合體具有克服耐藥性的潛力。此外,當濃度為4.0 μg/mL時,雜合體18可在4 h清除MRSA,說明該雜合體具有快速殺菌作用。作用機制研究發現,該雜合體可通過破壞細胞膜、干擾DNA復制發揮抗MRSA活性。而諾氟沙星-噻唑雜合體19(MIC: 2.0 μg/mL)的抗MRSA活性是母藥諾氟沙星(MIC: 8.0 μg/mL)的4倍,且對正常BEAS-2B細胞未顯示出毒性(CC50: >132 μmol/L)[33]。構-效關系顯示,甲肟為高活性所必需且甲基對活性有利,將甲基用取代苯基替代將導致活性降低。作用機制研究發現,該雜合體不僅可通過干擾細胞的完整性發揮有效的膜通透性,通過氫鍵和π-π堆積與拓撲異構酶IV-DNA復合物結合,而且可通過插入DNA來形成穩定的生物大分子復合物,進而發揮高效抗菌活性。
環丙沙星-噻唑啉二酮雜合體20(MIC: 2.56 μg/mL)
及其衍生物21(MIC: 2.56 μg/mL)具有潛在的抗MRSA AUMC 261活性,但活性弱于母藥環丙沙星(MIC: 0.20 μg/mL)[34]。構-效關系顯示,向苯環無論引入供電子基還是吸電子基均不會提高抗MRSA活性。作用機制研究發現,這類雜合體可同時作用于DNA促旋酶和拓撲異構酶IV。
環丙沙星-噁二唑雜合體22(MIC: 32 μg/mL)具有中等強度的抗MRSA活性,且活性優于母藥環丙沙星(MIC: 128 μg/mL)[35]。不僅如此,該雜合體(MIC: ≤0.125 μg/mL)的抗金葡菌活性是環丙沙星(MIC: 0.5 μg/mL)的≥4倍,且殺菌活性也優于環丙沙星。作用機制研究顯示,該雜合體與拓撲異構酶IV具有較強的親和力,故可能通過抑制拓撲異構酶IV發揮抗菌活性。
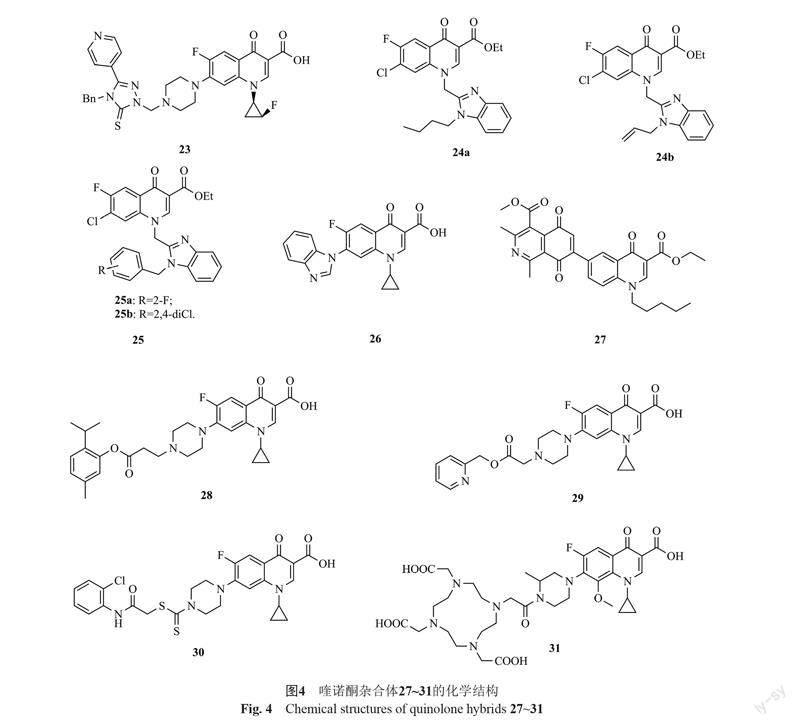
1-[(1R,2S)-2-氟環丙基]環丙沙星-1,2,4-三氮唑-5-硫酮雜合體23(圖4,MIC: 50 μg/mL)也具有潛在的抗MRSA活性,但活性弱于環丙沙星(MIC: 25 μg/mL)[36-37]。構-效關系顯示,1,2,4-三氮唑母核N-4位的芐基對活性有利,將其換為苯基或甲基將導致活性降低。
4-喹諾酮-苯并咪唑雜合體24a,b(MIC: 8.0 μg/mL)具有良好的抗MRSA活性,而克林沙星(MIC: >512 μg/mL)和諾氟沙星(MIC: >512 μg/mL)則未顯示出任何活性[38]。構-效關系顯示,苯并咪唑N-1位的烷基或烯基并非高活性所必需,向該位置引入含鹵素的芐基也可耐受。其中,雜合體25a,b(MIC: 8.0 μg/mL)的活性與雜合體24a,b相當。作用機制研究發現,雜合體25a可與拓撲異構酶IV-DNA復合物相結合,抑制DNA復制,進而發揮抗菌活性。氟喹諾酮-苯并咪唑雜合體26(MIC: 0.5 μg/mL)也顯示出優秀的抗MRSA活性,值得進一步研究[39]。
4-喹諾酮-異喹啉-5,8-二酮雜合體27(MIC: 8.0 μg/mL)具有潛在的抗MRSA活性,但活性弱于萬古霉素(MIC: 4.0 μg/mL)[40]。作用機制研究表明,該雜合體對位于GyrA和GyrB亞單位之間的一個特定疏水口袋具有親和力,但不與DNA分子相互作用。環丙沙星-麝香草酚雜合體28不僅對所測的4株金葡菌具有良好的活性(MIC: 0.8~1.6 μg/mL),而且對2株臨床分離MRSA也具有潛在的活性(MIC: 1.0和4.0 μg/mL)[41]。作用機制研究表明,雜合體28可與拓撲異構酶IV-DNA復合物相結合,進而發揮抗菌活性。
環丙沙星-吡啶雜合體29(MIC: 12.5 μg/mL)的抗MRSA活性略弱于環丙沙星(MIC: 6.25 μg/mL)[42],而環丙沙星-二硫代氨基甲酸雜合體30(MIC: 0.097和0.39 μg/mL)的抗MSSA和MRSA活性均優于母藥環丙沙星(MIC: 0.195和1.56 μg/mL)[43]。加替沙星-1,4,7,10-四氮雜環十二烷-1,4,7,10-四乙酸(DOTA)雜合體31(MIC: 1.56 μg/mL)具有潛在的抗MRSA活性,但活性遠遜于母藥加替沙星(MIC: 0.078 μg/mL) [44]。
2 結語
喹諾酮尤其是氟喹諾酮類化合物具有廣譜抗菌活性,對包括MRSA在內的多種致病菌具有良好的療效。然而,隨著這類藥物的廣泛使用甚至濫用,耐藥性問題日趨嚴重。因此,開發新型抗菌藥勢在必行。特別值得一提的是,喹諾酮雜合體可同時作用于細菌的多個靶點,具有克服耐藥性的潛力,引起了藥物化學家的極大關注。近年來,藥物化學家設計合成了多個系列喹諾酮雜合體,并評價了它們的體內外抗MRSA活性。此類研究豐富了構-效關系,為未來的進一步結構優化提供了一定的理論參考。
未來幾年的研究可集中在:①將喹諾酮藥效團與更多的抗MRSA藥效團雜合,以獲得更多的先導化合物,為后續研究提供量的保障;②對現有的具有潛在抗MRSA活性的喹諾酮雜合體進行深入的結構優化,進一步提升其活性,為進行體內活性評價提供更多優秀候選化合物;③對具有良好體內外抗MRSA活性的喹諾酮雜合體進行深入的臨床前評價,以期有更多的候選化合物能夠早日進入臨床為人類健康服務。
參 考 文 獻
Turner N A, Sharma-Kuinkel B K, Maskarinec S A, et al. Methicillin-resistant Staphylococcus aureus: An overview of basic and clinical research[J]. Nat Rev Microbiol, 2019, 17(4): 203-218.
Gajdács M. The continuing threat of methicillin-resistant Staphylococcus aureus[J]. Antibiotics, 2019, 8(2): e52.
Craft K M, Nguyen J M, Berg L J, et al. Methicillin-resistant Staphylococcus aureus (MRSA): Antibiotic-resistance and the biofilm phenotype[J]. MedChemComm, 2019, 10(8): 1231-1241.
Cheung G Y C, Bae J S, Otto M, et al. Pathogenicity and virulence of Staphylococcus aureus[J]. Virulence, 2021, 12(1): 547-569.
Lee A S, De Lencastre H, Garau J, et al. Methicillin-resistant Staphylococcus aureus[J]. Nat Rev Dis Primers, 2018, 4: e18033.
Tacconelli E, Carrara E, Savoldi A, et al. Discovery, research, and development of new antibiotics: The WHO priority list of antibiotic-resistant bacteria and tuberculosis[J]. Lancet Infect Dis, 2018, 18(3): 318-327.
Chalmers S J, Wylam M E. Methicillin-resistant Staphylococcus aureus infection and treatment options[J]. Methods Mol Biol, 2020, 2069: 229-251.
Nandhini P, Kumar P, Mickymaray S, et al. Recent developments in methicillin-resistant Staphylococcus aureus (MRSA) treatment: A review[J]. Antibiotics, 2022, 11(5): e606.
Cong Y G, Yang S J, Rao X C. Vancomycin-resistant Staphylococcus aureus infections: A review of case updating and clinical features[J]. J Adv Res, 2020, 21: 169-176.
Liu W T, Chen E Z, Yang L, et al. Emerging resistance mechanisms for 4 types of common anti-MRSA antibiotics in Staphylococcus aureus: A comprehensive review[J]. Microb Pathogen, 2021, 156: e104915.
汪阿鵬, 馮連順, 劉明亮, 等. 氟喹諾酮類抗菌藥的最新研究進展[J]. 國外醫藥抗生素分冊, 2019, 40(3): 171-179.
柴蕓, 馮連順, 劉明亮, 等. 喹諾酮衍生物及其抗耐甲氧西林金葡球菌活性[J]. 國外醫藥抗生素分冊, 2019, 40(3): 200-210.
Ezelarab H A A, Abbas S H, Hassan H A, et al. Recent updates of fluoroquinolones as antibacterial agents[J]. Arch Pharm, 2018, 351(9): e1800141.
Gatadi S, Madhavi S, Chopra S, et al. Promising antibacterial agents against multidrug resistant Staphylococcus aureus[J]. Bioorg Chem, 2019, 92: e103252.
Alkhzem A H, Woodman T J, Blagbrough I S. Design and synthesis of hybrid compounds as novel drugs and medicines[J]. RSC Adv, 2022, 12(30): 19470-19484.
Kumar S H M, Herrmann L, Tsogoeva S B, et al. Structural hybridization as a facile approach to new drug candidates[J]. Bioorg Med Chem Lett, 2020, 30(23): e127514.
Lungu I A, Moldovan O L, Biris V, et al. Fluoroquinolones hybrid molecules as promising antibacterial agents in the fight against antibacterial resistance[J]. Pharmaceutics, 2022, 14(8): e1749.
Jia Y S, Zhao L Y. The antibacterial activity of fluoroquinolone derivatives: An update (2018-2021)[J]. Eur J Med Chem, 2021, 224: e113741.
Tan Y M, Li D, Li F F, et al. Pyrimidine-conjugated fluoroquinolones as new potential broad-spectrum antibacterial agents[J]. Bioorg Med Chem Lett, 2022, 73: e128885.
Song R Z, Wang Y, Wang M H, et al. Design and synthesis of novel desfluoroquinolone-aminopyrimidine hybrids as potent anti-MRSA agents with low hERG activity[J]. Bioorg Chem, 2020, 103, e104176.
Samir M, Ramadan M, Abdelrahman M H, et al. New potent ciprofloxacin-uracil conjugates as DNA gyrase and topoisomerase IV inhibitors against methicillin-resistant Staphylococcus aureus[J]. Bioorg Med Chem, 2022, 73, e117004.
Norouzbahari M, Salarinejad S, Güran M, et al. Design, synthesis, molecular docking study, and antibacterial evaluation of some new fluoroquinolone analogues bearing a quinazolinone moiety[J]. DARU J Pharm Sci, 2020, 28(2): 661-672.
Han Z S, Kirchmair J, Li X Y, et al. Discovery of N-quinazolinone-4-hydroxy-2-quinolone-3-carboxamides as DNA gyrase B-targeted antibacterial agents[J]. J Enzyme Inhib Med Chem, 2022, 37(1): 1620-1631.
Türe A, Kulaba? N, Dingi? S ?, et al. Design, synthesis and molecular modeling studies on novel moxifloxacin derivatives as potential antibacterial and antituberculosis agents[J]. Bioorg Chem, 2019, 88, e102965.
Mohammed A A M, Suaifan G A R Y, Shehadeh M B, et al. Design, synthesis, and biological evaluation of 1,8-naphthyridine glucosamine conjugates as antimicrobial agents[J]. Drug Dev Res, 2019, 80(1): 179-186.
Mohammed A A M, Okechukwu P N, Shehadeh M B, et al. Design, synthesis and antimicrobial evaluation of novel glycosylated-fluoroquinolones derivatives[J]. Eur J Med Chem, 2020, 202: e112513.
Fang B Z, Hiasa H, Lv W, et al. Design, synthesis and structure-activity relationships of novel 15-membered macrolides: Quinolone/quinoline-containing sidechains tethered to the C-6 position of azithromycin acylides[J]. Eur J Med Chem, 2020, 193: e112222.
Gao F, Ye L, Kong F, et al. Design, synthesis and antibacterial activity evaluation of moxifloxacin-amide-1,2,3-triazole-isatin hybrids[J]. Bioorg Chem 2019, 91: e103162.
Guo H. Design, synthesis, and in vitro antibacterial activities of propylene-tethered gatifloxacin-isatin hybrids[J]. J Heterocyclic Chem, 2018, 55(8): 1899-1905.
Govender H, Mocktar C, Kumalo H M, et al. Synthesis, antibacterial activity and docking studies of substituted quinolone thiosemicarbazones[J]. Phosph, Sulf Silic Rel Elem, 2019, 194(11): 1074-1081.
Xue W J, Li X Y, Ma G X, et al. N-thiadiazole-4-hydroxy-2-quinolone-3-carboxamides bearing heteroaromatic rings as novel antibacterial agents: Design, synthesis, biological evaluation and target identification[J]. Eur J Med Chem, 2020, 188, e112022.
Chen J P, Battini N, Ansari M F, et al. Membrane active 7-thiazoxime quinolones as novel DNA binding agents to decrease the genes expression and exert potent anti-methicillin-resistant Staphylococcus aureus activity[J]. Eur J Med Chem, 2021, 217, e113340.
Wang L L, Battini N, Bheemanaboina R R Y, et al. A new exploration towards aminothiazolquinolone oximes as potentially multi-targeting antibacterial agents: Design, synthesis and evaluation acting on microbes, DNA, HSA and topoisomerase IV[J]. Eur J Med Chem, 2019, 179, 166-181.
Aziz H A, El-Saghier A M M, Badr M, et al. Thiazolidine?2,4?dione?linked ciprofloxacin derivatives with broad?spectrum antibacterial, MRSA and topoisomerase inhibitory activities[J]. Mol Divers, 2022, 26: 1743-1759.
Yang P, Luo J B, Zhang L L, et al. Design, synthesis and antibacterial studies of 1,3,4-oxadiazole-fluoroquinolone hybrids and their molecular docking studies[J]. Chemistry Select, 2021, 6(46): 13209-13214.
Gao Y, Na L X, Xu Z, et al. Design, synthesis and antibacterial evaluation of 1-[(1R,2S)-2-fluorocyclopropyl]ciprofloxacin-1,2,4-triazole-5(4H)-thione hybrids[J]. Chem Biodiversity, 2018, 15(10): E1800261.
Geng Y H, Wei Z Q, Xu Z, et al. Design, synthesis and antibacterial evaluation of 1-[(1R,2S)-2-fluorocyclopropyl]ciprofloxacin-(4-methyl-3-aryl)-1,2,4-triazole-5(4H)-thione hybrids[J]. Rev Roum Chim, 2019, 64(1): 101-107.
Wang Y N, Bheemanaboina R R Y, Gao W W, et al. Discovery of benzimidazole-quinolone hybrids as new cleaving agents toward drug-resistant Pseudomonas aeruginosa DNA[J]. Chem Med Chem, 2018, 13(10): 1004-1017.
Suay-garcía B, Bueso-bordils J I, Antón-fos G, et al. Synthesis of quinolones and Zwitterionic quinolonate derivatives with broad-spectrum antibiotic activity[J]. Pharmaceuticals, 2022, 15(7): e818.
Martins F J, Sagrillo F S, Medeiros R J V, et al. Evaluation of biological activities of quinone-4-oxoquinoline derivatives against pathogens of clinical importance[J]. Curr Top Med Chem, 2022, 22: 973-991
Chaniewicz K, Kmiecik S, Koliński M, et al. Design and synthesis of menthol and thymol derived ciprofloxacin: Influence of structural modifications on the antibacterial activity and anticancer properties[J]. Int J Mol Sci, 2022, 23(12): e6600.
Shahbazi A, Mostafavi H, Zarrini G, et al. Novel N-4-piperazinyl ciprofloxacin-ester hybrids: Synthesis, biological evaluation, and molecular docking studies[J]. Russ J Gen Chem, 2020, 90(8): 1558-1565.
Esfahani E N, Mohammadi-Khanaposhtani M, Rezaei Z, et al. Biology-oriented drug synthesis (BIODS) approach towards synthesis of ciprofloxacin-dithiocarbamate hybrids and their antibacterial potential both in vitro and in silico[J]. Chem Biodiversity, 2018, 15(10): E1800273.
Li W T, Hong G, Mao L, et al. Synthesis, antibacterial evaluation and in silico study of DOTA-fluoroquinolone derivatives[J]. Med Chem Res, 2022, 31(5): 705-719.
收稿日期:2022-11-09
基金項目:河北省衛健委課題(No. 20201430)
作者簡介:王林碩,女,生于1986年,工程師,主要從事新藥研究,E-mail: 396809463@qq.com
*通信作者,E-mail: ohogu@qq.com

