多輪次富營養模擬富集對窖泥富集液代謝產物的影響
李 棟,葉光斌,2*,宗緒巖,2,鄒 偉,2
(1.四川輕化工大學生物工程學院,四川宜賓 644000;2.四川輕化工大學釀酒生物技術及應用四川省重點實驗室,四川宜賓 644000)
我國的白酒文化可追溯到四五千年前的“龍山文化”時期,可謂歷史悠久[1]。濃香型白酒作為我國的第一大蒸餾酒,其酒體具有綿甜醇厚、窖香濃郁、舒適協調等特點,深受人們喜愛,且市場份額占比大[2]。窖泥作為濃香型白酒生產過程中主要微生物來源之一,其質量對白酒品質改善及特質香氣的形成具有重要的影響。泥窖池作為濃香型白酒特有的發酵容器,也是優良釀酒微生物棲息繁衍地,經過長期高酸度和密閉厭氧發酵等特殊釀酒環境的馴化,窖泥中逐漸富集了大量具有產香功能的微生物[3]。
在成熟的純培養技術下,窖泥中的產香功能微生物也逐漸被發掘出來。己酸乙酯是濃香型白酒的主要風味物質[4],己酸作為己酸乙酯合成的前體物質,其產生菌種類較多。主要有梭菌屬中的克氏梭菌(Clostridium kluyveri)、廣西梭菌(Clostridium guangxiense)[5-10];芽孢桿菌屬中的地衣芽孢桿菌(Bacillus licheniformis)、巨大芽孢桿菌(Bacillus megaterium)[11];顫桿菌科的Caproicibacterium菌屬[12];產己酸菌屬(Caproiciproducens)[13];瘤胃球菌科CPB6 菌株[14]等。有研究表明,多數梭菌可通過逆β 氧化途徑,以乙醇或乳酸為基礎,通過乙酰輔酶A,最終縮合成己酸,而其他菌屬產己酸的代謝途徑卻鮮有報道[15-16]。
除己酸外,丁酸、乙酸等酸也對白酒的風味影響頗深。對酪酸梭菌(Clostridium butyricum)[17-18]、毛螺旋菌科(Lachnospiraceae)JN500902T 菌株[19]的研究發現,其可產生多種脂肪酸,如丁酸、乙酸等;在白酒釀造中,丁酸被轉化為丁酸乙酯,乙酸被轉化為乙酸乙酯,兩者皆是白酒中重要的香味成分。也有研究發現丁酸可作為合成己酸的前體物質,同時對于新窖泥生成正丁醇起到至關重要的作用[20-21]。甲烷菌可實現“種間氫轉移關系”,與己酸菌能夠形成共棲作用,從而更加有利于己酸的生成[22]。
在窖泥環境體系中,微生物十分豐富,種間關系復雜,代謝產物多樣。加之實驗室條件下可培養的微生物種類有限,因此通過分離培養的方式必然會忽略窖泥中絕大部分具有產酸功能的微生物類型[23]。富集培養是目前有效分離環境樣品中難培養微生物的有效方法,例如Wu 等[24]從富集培養物中分離到了許多針對環境污染物的降解菌;Pernicova 等[25]將活性污泥加入到富集培養基(MSM)中培養,分離出了能產聚羥基鏈烷酸酯(PHA)的芽孢桿菌。對于微生物的分離而言,培養基選擇與設計無疑具有重要的作用。窖泥在不同富集處理下發酵產物的變化規律研究對于功能發酵菌液的開發與難培養微生物的分離等都具有重要的意義。如在培養基富集微生物時,進行熱激的前處理,就會使得大量非孢子形成的細菌減少,降低微生物的物種豐富度,從而使多數含有芽孢的梭菌、芽孢桿菌等得以生存[26];在培養基組分上加入乙醇作為碳源,富集窖泥后發現代謝產物乙酸的含量會高于己酸的含量,而以葡萄糖作為碳源時,己酸含量則高于乙酸含量[16]。盡管現在富集培養應用領域十分廣泛,也幫助學者分離或富集了眾多的新種和目的功能菌,但是在白酒上的研究還是較少,限制我們對中國濃香型白酒發酵過程中窖泥微生物驅動原理的了解,所以窖泥中功能微生物的開發、難培養微生物的富集等工作仍是我們現在首要的目標。
本研究設計不同的培養基營養成分和是否使用熱激處理等不同的處理組合(具體處理見表1),通過比較不同處理下6 輪次發酵產物確定最佳發酵處理措施。相關研究結果可以為窖泥功能菌液功能導向性富集、富集產酸培養條件優化、窖泥老熟、難培養微生物的分離等提供理論支撐。

表1 培養基成分表
1 材料與方法
1.1 材料、試劑及儀器
1.1.1 窖泥樣本
優質老窖泥取自瀘州某名優酒廠,用冰盒迅速運回實驗室,于4 ℃冰箱保存,用其配置成富集液樣品1—20號。
1.1.2 主要儀器與設備
氣相色譜-質譜聯用儀,美國Agilent 科技有限公司;厭氧工作站,北京八方世紀科技有限公司。
1.1.3 培養基
窖泥用不同培養基進行富集培養,培養基組分見表1。
1.2 試驗方法
1.2.1 窖泥的富集
取25 g 窖泥于厭氧工作站中接種至250 mL 已除氧液體培養基(1.1.3)中,所有樣品于35 ℃培養7 d 后,以10 %的接種量進行轉接,共富集6 輪(詳見圖1)。將每輪富集液分別保存至4 ℃及-20 ℃冰箱中,用于后續代謝產物研究。
圖1 窖泥富集培養接種方法
1.2.2 窖泥富集液代謝產物
取發酵液20 mL,使用2 mol/L 硫酸酸化至pH2,加無水乙醇定容至25 mL,12000 r/min、4 ℃冷凍離心5 min,取上清液,過0.2 μm 微孔濾膜[30]。進樣前加10 μL乙酸丁酯(84 mg/mL)作為內標混勻。
氣相色譜條件:DB-WAX(60 m×250 μm×0.25 μm)色譜柱;載氣為高純度He,流速1 mL/min,進樣口溫度230 ℃;程序升溫:初始溫度為60 ℃保持1 min,8 ℃/min 的升溫速率升至180 ℃保持2 min,再以15 ℃/min升至230 ℃,保持5 min。
質譜(MS)條件:電子離子源(EI),70 eV 電子能量,采集模式為全掃描,質量范圍20~550 u,離子源溫度230 ℃,四級桿溫度150 ℃,接口溫度230 ℃。
定性分析:質譜圖通過與美國Agilent 公司提供的美國國家標準技術研究所(national institute of standards and technology,NIST)標準譜庫05a.L 進行比對,選擇匹配度均>80的進行定性分析[31]。
半定量分析:以乙酸丁酯作為內標,測定樣品中酸類、酯類、醇類及芳香類化合物的峰面積與乙酸丁酯峰面積之比,再根據乙酸丁酯的質量濃度進一步計算其含量[32]。
2 結果與分析
2.1 窖泥富集液代謝產物
窖泥富集液在不同培養基條件下經過六次富集后,其代謝產物數據顯示(圖2),總酸、乙酸、丁酸和己酸產量范圍分別為61.8~11392 mg/100 mL、0~3491 mg/100 mL、0~9695 mg/100 mL、0~1744 mg/100 mL,對于能起到富集酸作用的培養基而言,總酸富集趨勢為第一輪富集到第三輪富集呈快速上升,第三輪富集到第四輪富集呈緩慢上升,而在第四輪富集到第六輪富集時則呈現下降,可以看出濃香型白酒的主要揮發性酸積累是在第三輪、第四輪富集時得到最大積累量(最高能到11392 mg/100 mL)。因此我們可以將整個發酵過程分為三個階段,第一階段為微生物生長繁殖時期(第一輪、第二輪富集時期),第二階段為微生物代謝時期(第三輪、第四輪富集時期),第三階段為微生物衰退消亡時期(第五輪、第六輪富集時期)。
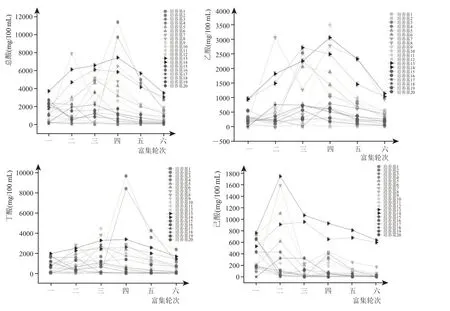
圖2 樣品富集總酸圖
2.2 熱激與未熱激對同組分培養基間的影響
第三輪、第四輪富集時期,為微生物代謝時期,且在該時期有大量的酸積累。所以,將同培養基條件下,第三輪、第四輪富集時期的總酸積累作為分析基礎,對其熱激與未熱激處理下的樣本做顯著性分析,如圖3 所示,相同培養基組分在不同處理結果下,熱激與未熱激對酸的富集不呈顯著性差異,所以認為熱激與未熱激的前處理對微生物發酵中期產酸的影響很小。
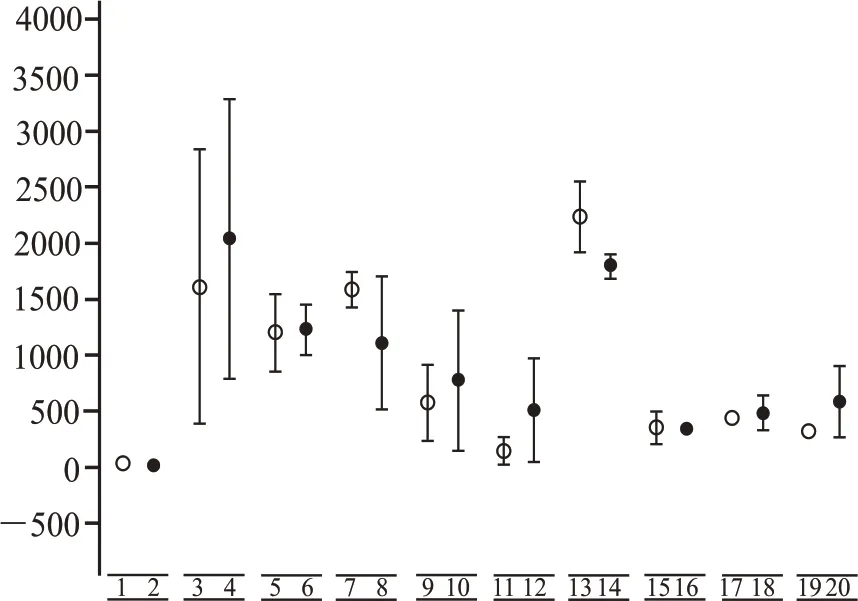
圖3 同培養基組分下,熱激與未熱激處理下微生物的富集與第三輪、第四輪發酵時期總酸積累的顯著性關系
2.3 培養基成分對窖泥富集液代謝產酸的影響
雖然在主發酵時期,是否熱激處理對同組分富集樣本影響較小,但是培養基自身的成分組成對代謝產物的影響極其重要。對此,針對主發酵時期的各個酸代謝量同20 組不同處理的富集樣本的營養物質進行相關性冗余分析(RDA 分析),如圖4 所示,RDA 分析顯示,培養基中的營養物質(硫酸銨、蛋白胨、酵母粉、乙酸鈉、丁酸鈉、可溶性淀粉)與總酸、乙酸、丁酸、己酸呈正相關關系,乳酸、黃水、乙醇、葡萄糖、巰基乙酸鈉、牛肉膏則與上述酸呈負相關關系。
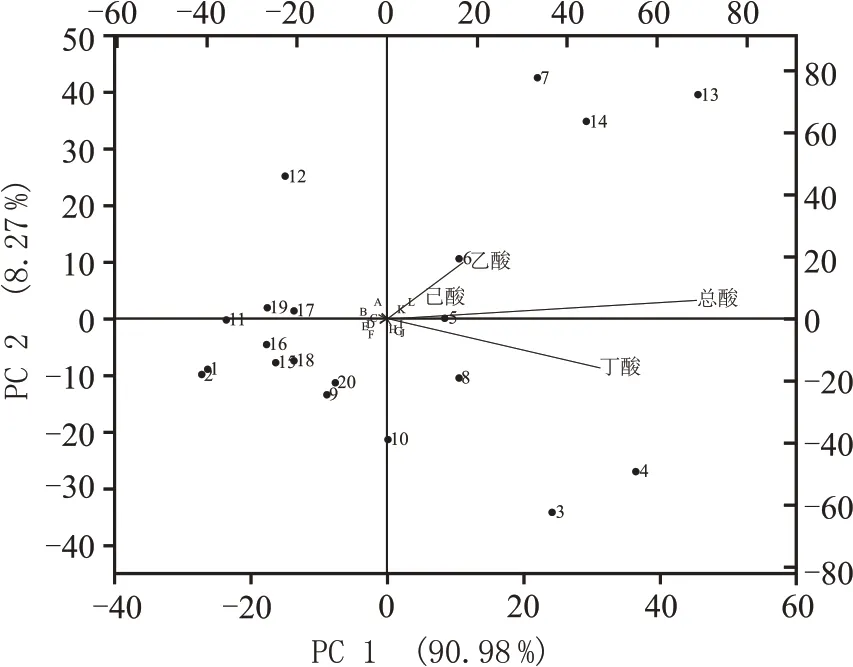
圖4 不同處理下,富集培養在第三輪、第四輪富集時培養基的主要組分和總酸、乙酸、丁酸、己酸的冗余分析(RDA分析)
3號、4號、5號、6號、7號、8號、13號、14號處理與總酸、乙酸、丁酸、己酸呈正相關關系,這些酸也與上述處理中的營養物質(3 號、4 號、5 號、6 號、13號、14 號處理共同的營養組分:乙酸鈉、硫酸銨、蛋白胨、酵母粉)呈正相關,唯獨與7 號、8 號處理中的黃水呈負相關,但這些處理都在富集過程中積累了較好的混合酸(總酸、乙酸、丁酸、己酸)。相關研究發現,在葡萄糖CGM 培養基(本實驗5 號處理使用的培養基)中加入丁酸鈉和乙酸鈉后,能有效提高丁酸、乙酸的產量,進而影響己酸的積累(從654 mg/100 mL 提高至892 mg/100 mL)[16],而3號、4 號、5 號、6 號處理中的丁酸鈉和乙酸鈉與混合酸呈正相關關系,表明丁酸鈉和乙酸鈉對混合酸的積累有著促進作用(圖2,圖4)。其表現為,3號、4 號處理在第四輪富集時,積累了較多的總酸和丁酸(9705.2~11392 mg/100 mL 和8435~9695 mg/100 mL),5 號、6 號處理(獨特的營養組分:丁酸鈉)在第三輪富集時對總酸、乙酸和丁酸有一定積累(4618~5083 mg/100 mL,2061~2259 mg/100 mL,2351~2687 mg/100 mL)。黃水作為濃香型白酒發酵過程中的產物[33],推測其含有較豐富的促生長因子,所以在加入了黃水的7號、8 號處理中表現出較高的乙酸、丁酸積累。其中7 號處理在第二輪富集時積累了較多總酸、乙酸和己酸(7892 mg/100 mL、3067 mg/100 mL 和1587 mg/100 mL),8 號處理則在第三輪富集時主要對總酸、丁酸有所積累(5159 mg/100 mL,3817 mg/100 mL)。己酸乙酯是濃香型白酒中的主體呈香物質,過多的乳酸會抑制濃香白酒主體香的形成,所以現在的研究推行通過“增己降乳”的方法來提高己酸乙酯的含量[34],1 號、2 號、11 號、12 號處理中富含乳酸,并且與總酸、乙酸、丁酸、己酸呈負相關關系,因此推測過高的酸度對微生物代謝形成了反饋抑制,導致了產酸量的減少。Clostridium kluyveri可以利用乙醇來產己酸,但在窖泥菌群研究中,該菌的相對豐度不高[35],本實驗中的9 號、15號、16 號、17 號、18 號處理均加有乙醇,且與總酸、乙酸、丁酸、己酸呈負相關關系,同時產酸(如己酸)較低(平均酸含量<1336.4 mg/100 mL),所以推測乙醇能抑制混菌的生長或能抑制以乙醇為碳源生長的細菌(如Clostridium kluyveri)。有研究表明,巰基乙酸鈉作為抑制劑,可以抑制微生物芽孢的形成[36],所以認為15 號、16 號處理中加入的巰基乙酸鈉,也會使微生物的含量降低,從而使得產酸很低。10號處理中加入乙醇后,依然在第二輪富集中表現出較高的丁酸含量(4465 mg/100 mL),可能因為該培養基在滅菌后加入乙醇,然后又進行了熱激處理,使得乙醇揮發(沸點:78 ℃),不用抑制該培養基的微生物生長。19 號、20 號處理對揮發性酸積累很低(平均酸含量<1336.4 mg/100 mL),可能因為該培養基(MRS 培養基)主要是用來培養乳酸桿菌的,所以使得其它產酸微生物難以生存。13號、14 號處理(獨特的營養組分:可溶性淀粉、葡萄糖)能在第三輪、第四輪富集時積累總酸、乙酸、丁酸、己酸(5843~7444.7 mg/100 mL,2254~3055 mg/100 mL,2452~3383 mg/100 mL,652~1067 mg/100 mL),而且混合酸的含量在富集過程中有先增加后下降的趨勢,說明富集中期時,有利于這些處理對混合酸的積累。
2.4 熱激與否對優勢富集樣本的各揮發性酸的影響
經過多組處理間的總酸比較,篩選出了13 號、14號處理作為最優的富集培養基組合,為進一步探究熱激對其各揮發性酸的影響,我們對其微生物代謝時期的各酸代謝量進行了差異分析,如圖5 所示。對比之下,13號、14號處理,在微生物代謝時期(第三輪、第四輪富集)產混合酸差異很小,兩輪富集乙酸、丁酸、己酸差距分別在225~801 mg/100 mL、116~155 mg/100 mL、141~301 mg/100 mL 之間,并無顯著性差異,且產混合酸能力很高。由于13號、14 號處理在多輪次富集中產酸高且穩定,受熱激處理影響小,所以我們認為其可作為窖泥產酸核心菌群研究的出發樣本。
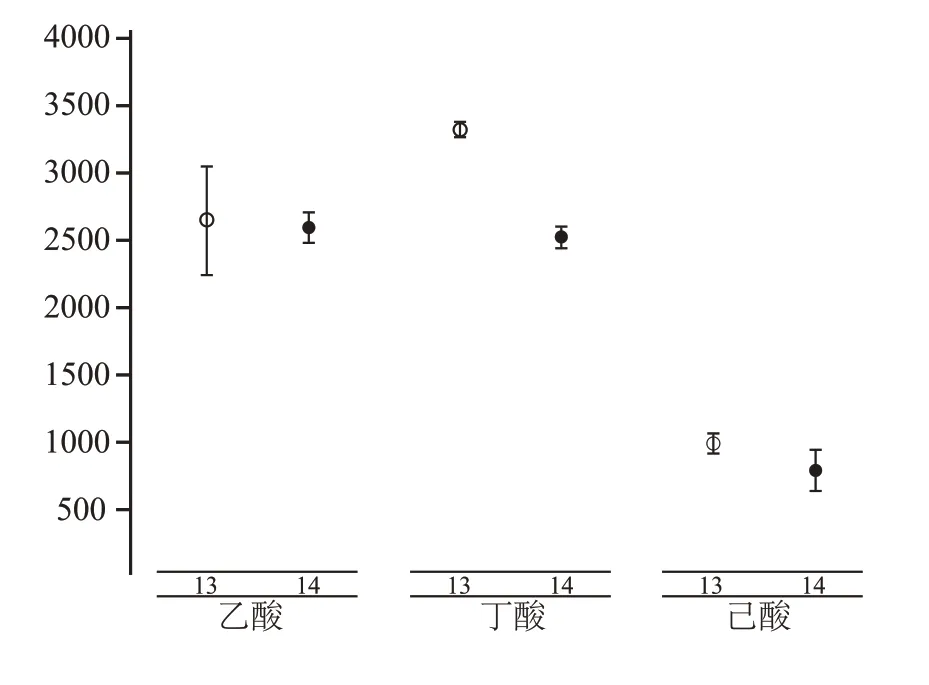
圖5 13號、14號處理第三輪、第四輪富集時,富集輪次與酸之間的顯著性關系
3 結論
本實驗通過不同培養條件對窖泥進行連續富集培養,篩選出了能夠高產酸的13 號、14 號處理。在發酵第三輪、第四輪時,13 號處理和14 號處理間無顯著性差異,且都能夠有效的富集混合酸(乙酸、丁酸、己酸)。在最佳產酸時期,總酸的產值在5000~7500 mg/100 mL之間,乙酸在2254~3055 mg/100 mL之間,丁酸在2452~3383 mg/100 mL之間,己酸在909~1744 mg/100 mL 之間。該項研究成果,后續可作為窖泥產酸核心菌群的研究對象,也可以開展純菌的分離研究。同時本課題相關研究可以為后續單菌分離、改善窖泥質量、生物強化法生產濃香型白酒等提供理論依據及實踐基礎。

