牡丹蔗糖轉運蛋白基因PsSUT1的功能研究
韓靜靜 柴夢娟 朱麒元 栗燕


摘要:蔗糖轉運蛋白屬于MFS家族,該家族是已知最大的轉運體家族。本研究采用“TA”克隆技術,從‘洛陽紅牡丹中得到牡丹蔗糖轉運蛋白基因PsSUT1,基因序列全長為1 846 bp,包含1 557 bp的開放閱讀框,編碼519個氨基酸。進化樹分析顯示該基因序列在進化過程中是保守的。蔗糖轉運活性試驗表明PsSUT1的表達使SUSY7/ura3酵母菌株能夠在蔗糖為唯一碳源的培養基上生長,說明 PsSUT1編碼的蛋白具有蔗糖轉運活性。亞細胞定位試驗結果表明該蛋白定位于細胞膜。將PsSUT1基因異源轉化擬南芥,結果表明 PsSUT1轉基因陽性苗與野生型擬南芥相比,地上部分干重平均增加了46.35%,株高增加了50.44%,種莢數增加了40.54%;擬南芥蔗糖耐受性檢測中,PsSUT1轉基因植株生長正常,根系明顯比野生型擬南芥植株長,葉片發育也正常,沒有花青素積累。本研究為改善盆栽牡丹生長與發育狀況提供分子生物學方面的理論依據和技術支撐。
關鍵詞:牡丹;蔗糖轉運蛋白基因;蔗糖轉運活性;亞細胞定位;異源表達分析
中圖分類號:中圖分類號S685;Q785;Q786文獻標志碼:A文獻標識碼
Functional study of sucrose transporter gene PsSUT1 in peony
HAN? Jingjing,CHAI? Mengjuan,ZHU? Qiyuan,LI? Yan*
(College of Landscape Architecture and Art,Henan Agricultural University,Zhengzhou,Henan 450002,China)
Abstract: ?Sucrose transporters belong to the MFS family, which is the largest known family of transporters.In this study, TA cloning technology was used to obtain the peony sucrose transporter gene PsSUT1 from Luoyanghong peony. The full-length gene sequence is 1 846 bp, including an open reading frame of 1 557 bp, encoding 519 amino acids. Phylogenetic tree analysis showed that the gene sequence was conserved during evolution. The sucrose transport activity assay showed that the expression of PsSUT1 enabled the SUSY7/ura3 yeast strain to grow on the medium with sucrose as the sole carbon source, indicating that the protein encoded by PsSUT1 has sucrose transport activity. The results of subcellular localization assay showed that the protein was localized to the cell membrane. The PsSUT1 gene was heterologously transformed into Arabidopsis, and the results showed that compared with wild-type Arabidopsis, the PsSUT1 transgenic positive seedlings increased the average dry weight of the aerial parts by 46.35%, the plant height by 50.44%, and the number of seed pods by 40.54%; In the Arabidopsis sucrose tolerance test, PsSUT1 transgenic plants grew normally, with significantly longer root systems than wild-type Arabidopsis plants, and normal leaf development without anthocyanin accumulation. This study provides theoretical evidence and technical support in molecular biology for improving the growth and development of potted peony.
Key words: peony;sucrose transporter gene;sucrose transport activity;subcellular localization;heterologous expression analysis
牡丹(Paeonia suffruticosa)屬多年生落葉灌木,因其花型繁多、花冠碩大、花色艷麗,故具有較高的觀賞價值,受到群眾的喜愛,這使得盆栽牡丹在國內外花卉市場的需求量逐年上升。然而,牡丹盆栽種植后常常出現植株矮小、花蕾敗育的現象,嚴重影響了其觀賞價值,這已成為盆栽牡丹產業化發展中的瓶頸問題[1]。已有研究[2]表明,牡丹盆栽種植后,由于根域受到限制,葉片光合速率降低,蔗糖供應不足,從而導致盆栽植株生長發育不良。通過對牡丹葉片、莖、花瓣、生長根進行超微結構觀察發現,這些部位胞間連絲較少,而且篩管伴胞復合體細胞壁內突生長,薄壁細胞胞間隙大,由此推測蔗糖在牡丹植株的裝載、運輸、卸載過程可以通過質外體途徑進行,因此蔗糖轉運蛋白在這個過程中起著至關重要的作用[3-4]。
SUT(Sucrose transporters protein)屬于主要易化子超家族(Major Facilitator Superfamily, MFS),是高度疏水性的蛋白質,有12個跨膜螺旋結構,擁有大約500~600個氨基酸[5],是碳從源到“庫”器官分配的關鍵組成部分,并作為H+/蔗糖同向轉運體,利用質膜上的質子梯度將蔗糖逆濃度梯度運輸到細胞中[6]。根據其序列和結構的相似性,SUTs可以分為五個亞族:SUT1、SUT2、SUT3、SUT4和SUT5。其中SUT1為雙子葉植物特有的基因,SUT3和SUT5為單子葉植物特有基因,SUT2和SUT4為單子葉植物和雙子葉植物共有的基因[7]。SUT1亞家族定位于篩管伴胞細胞質膜,對蔗糖有適度的親和力,并能催化蔗糖被吸收到“庫”器官中[8]。水稻 OsSUT1 在沿運輸途徑從質外體獲取的蔗糖的韌皮部裝載中起作用[9]。大豆 GmSUT1 定位于質膜,在根瘤菌共生過程中有助于蔗糖轉運至根瘤,從而起到固定N2的作用[10]。SUT2亞家族蛋白通常定位于篩管細胞的質膜上,參與“庫”器官韌皮部蔗糖的卸載[11]。SUT4亞家族蛋白定位于液泡膜或者細胞質膜,參與植物韌皮部的蔗糖裝載[12]。
本研究在已獲得 PsSUT1基因全長序列并初步分析其生物信息學特征的基礎上[13],為了進一步了解它的功能,本研究采用“TA”克隆法獲得了 PsSUT1基因,并對該蛋白進行保守結構域分析及三級結構預測,測定了PsSUT1蛋白的蔗糖轉運活性和亞細胞定位分析,并遺傳轉化擬南芥,觀察并測定了轉基因擬南芥的形態特征、蔗糖含量和它對外源蔗糖的利用情況。為探尋盆栽牡丹生長發育不良機理,改善盆栽牡丹生長與發育狀況提供分子生物學方面的理論依據和技術支撐。
1 材料與方法
1.1 材料
試驗材料取自河南農業大學第三生活區7年生盆栽嫁接苗‘洛陽紅牡丹(根砧為鳳丹),采集盛花期生長健壯、長勢一致的植株上中輪花瓣,用錫箔紙包好,放入液氮中快速冷凍,然后在-80℃冰箱保存。煙草(Nicotiana tabacum)培養條件:25℃,濕度60%,16h光照,8h黑暗培養。哥倫比亞型擬南芥(Arabidopsis thaliana)培養條件:23℃,濕度60%,16h光照,8h黑暗培養。
1.2 方法
1.2.1 PsSUT1 的克隆
采用李永華改良版CTAB法分別提取牡丹‘洛陽紅盛花期的花瓣的總RNA[14],之后使用PrimeScriptTM II 1st Strand cDNA Synthesis Kit試劑盒(Takara,中國大連)進行反轉錄,獲得cDNA第1條鏈。
根據NCBI PsSUT1的CDS區域序列,使用Primer Premier 5.0 軟件設計特異性克隆引物(表1)。用PrimeSTAR Max DNA Polymerase(Takara,中國大連)以提取的 cDNA 為模板,進行RT-PCR擴增。反應體系共50 μL:5×PrimeSTAR GXL Buffer 10 μL;dNTP Mixture 4 μL;上下游引物各2 μL;Template(cDNA)5 μL;PrimeSTAR GXL DNA Polymerase 1 μL;ddH2O 26 μL;反應體系共50 μL。PCR反應程序為:94℃,預變性1 min;98 ℃,變性10 s;60 ℃,退火10 s;68℃,延伸2 min;72℃,延伸10 min,進行35個循環。PCR產物使用1% 的瓊脂糖凝膠進行電泳檢測,切膠回收并與T 載體進行連接,而后轉化大腸桿菌感受態細胞進行LB平板藍白斑篩選并搖菌,送鄭州尚亞生物公司進行測序。
1.2.2 PsSUT1 保守基序分析及三級結構預測
利用在線軟件MEME (Multiple Expectation Max-imization for Motif Elicitation)工具(http://meme.nbcr.net/meme/cgi-bin/meme.cgi)進行牡丹 PsSUT1 氨基酸保守基序(motif)分析。使用pfam32.0(http://pfam.xfam.org/)對MEME分析得到的保守基序序列進行在線分析。使用在線軟件SWISS-MODEL(https://swissmodel.expasy.org/)同源建模,對牡丹SUT1蛋白進行三級結構的預測。
1.2.3 PsSUT1 蛋白蔗糖轉運活性鑒定
使用引物 PsSUT1-Fb和 PsSUT1-Rb(表1)擴增含有Spe I和Pst I限制性位點的全長 PsSUT1基因序列,然后構建酵母表達載體pDR196-PsSUT1,轉化SUSY7/ura3酵母突變體。以空載體PDR196作為空白對照,將轉化成功的pDR196-PsSUT1和pDR196的酵母菌液,在2%蔗糖和2%葡萄糖為唯一碳源的SD篩選培養基上劃線培養,30℃培養。觀察其生長情況,并拍照記錄。
1.2.4 亞細胞定位
使用Gateway技術構建載體。利用Primer Premier 5.0軟件設計引物 PsSUT1-Fc和 PsSUT1-Rc(表1),以1.2.1克隆得到的質粒為模板,進行PCR擴增。通過BP反應獲得 pDONR207-PsSUT1入門載體,然后通過LR反應將該入門載體與目的載體PK7WGF2.0 GFP進行重組反應,獲得PK7WGF2.0 GFP-PsSUT1超表達載體。將重組質粒GFP-PsSUT1轉化到農桿菌AGL0中,用注射器將攜帶目標基因的菌液注入煙草葉片中[15]。然后在23℃下對煙草進行48h的培養。用激光共聚焦掃描顯微鏡檢測煙草葉片的GFP熒光信號。
1.2.5 牡丹 PsSUT1在擬南芥的異源表達
1.2.5.1 過表達載體構建
參照1.2.4方法通過Gateway方法構建 PsSUT1基因過表達載體。將1.2.4得到的PsSUT1的入門載體通過LR反應連接得到PsSUT1基因的超表達載體。將構建好的過表達載體質粒轉化至AGL0農桿菌體中。通過浸花法進行農桿菌介導的遺傳轉化,篩選后獲得轉基因的擬南芥植株,培養至T3代并獲得純合株系,用于形態指標的測定。
1.2.5.2 轉基因擬南芥形態學特征和蔗糖含量的測定
(1)T3 代 PsSUT1轉基因株系形態觀測
選取生長周期為30 d的野生型擬南芥 WT 與 T3 代轉 PsSUT1基因陽性苗測定其形態學指標如株高、種莢,并觀察其生長過程中營養生長與生殖生長的情況。
(2)T3 代 PsSUT1轉基因株系地上部分干重測定
測量生長30 d的野生型擬南芥和T3代轉基因擬南芥的地上部分干重。隨機取3株擬南芥,去掉根部,放在65℃的烘箱中12 h至恒重,稱取總重量。地上部分干重=總重量/3,3次重復。
(3)T3 代 PsSUT1轉基因株系蔗糖含量測定
測定野生型和轉基因擬南芥的葉片和花瓣的蔗糖含量,參照張志良[16]的方法分別取干樣0.05g,3次重復。用SPSS 20.0分析不同組別間數值的差異。
1.2.5.3 PsSUT1基因對外源蔗糖的利用
將野生型擬南芥和 PsSUT1基因的T3代轉基因株系和種子分別播種在蔗糖濃度為3%、6%、9%的MS培養基上,生長20 d,觀察其生長情況。
2 結果與分析
2.1 牡丹蔗糖轉運蛋白基因PsSUT1的克隆
以盛花期‘洛陽紅花瓣的cDNA為模板,通過PCR擴增,產物經過瓊脂糖凝膠電泳檢測,得到大約為1 600 bp的條帶(圖1)。經測序鑒定,序列信息與NCBI登錄序列信息一致。PsSUT1基因(基因登錄號:KC542395)序列全長為1 846 bp,包含1 557 bp的開放閱讀框,編碼519個氨基酸。
2.2 牡丹 PsSUT1 蛋白保守基序分析及三級結構預測
通過在線軟件MEME對牡丹SUT1蛋白進行保守基序分析(圖2),從中鑒定出6個保守基序,它們屬于MFS家族中MFS_2成員,該家族可以將蔗糖通過質子/陽離子同向轉運,這6個保守基序排列順序一致,這表明SUT1亞家族的基因在進化過程中是極其保守的。
使用SWISS-MODEL在線軟件對它的三級結構進行了分析(圖3),結果表明,該蛋白含有一個保守的MFS結構域,與 PsSUT1 蛋白最相近的模板為5a2n.1.A,序列相似度為27%,GMQE值為0.41,QMENA值為0.45,說明匹配度適中。蛋白三級結構為同型二聚體,沒有檢測到蛋白-配體相互作用且蛋白氨基酸折疊相似度高。
2.3 牡丹 SUT1基因蔗糖轉運活性分析
2.3.1 酵母重組表達載體的構建及其對SUSY7/ura3酵母突變體的轉化
以pMD18-T-PsSUT1質粒為模板,使用 PsSUT1-Fb和 PsSUT1-Rb引物進行PCR擴增,獲得用于酵母異源表達的 PsSUT1基因片段。將重組質粒pMD18-T-PsSUT1和pDR196質粒進行雙酶切,將酶切膠回收產物通過T4連接酶整合成酵母表達載體pDR196-PsSUT1。將構建好的載體使用Spe I和Pst I酶進行雙酶切驗證,結果如圖4所示,凝膠電泳檢測出現兩條條帶,長度與預期大小一致,說明成功構建了酵母重組表達載體pDR196-PsSUT1。
2.3.2 PsSUT1 蛋白蔗糖轉運活性分析
將構建的重組酵母表達載體pDR196-PsSUT1、pDR196質粒轉化至SUSY7/ura3酵母突變體之后,培養結果顯示(圖5),當培養基的唯一碳源為蔗糖時,含pDR196-PsSUT1重組質粒的酵母突變體可以正常生長,而對照組含空載體pDR196的酵母突變體則不能良好生長。
當培養基的唯一碳源為葡萄糖時,含pDR196-PsSUT1重組質粒的酵母突變體與對照組含空載體 pDR196 的酵母突變體生長狀況一致,均能良好地生長。這說明牡丹PsSUT1基因能夠表達具有蔗糖轉運活性的蛋白。
2.4 牡丹 PsSUT1 蛋白亞細胞定位分析
2.4.1 亞細胞定位載體構建
使用Gateway反應體系構建載體,將目的基因與中間克隆載體 pDNOR207連接,形成入門克隆載體,再經過 LR 反應獲得亞細胞定位載體PK7WGF2.0 GFP-PsSUT1。LR反應菌液PCR瓊脂糖凝膠電泳結果如圖6所示,PCR產物大小與目的基因大小一致,菌液送尚亞公司測序,測序結果與目的基因序列一致,說明亞細胞定位載體構建成功。
2.4.2 PsSUT1 蛋白的亞細胞定位
將構建好的GFP融合表達載體注射到煙草的下表皮組織內,使連接了綠色熒光蛋白基因的 PsSUT1基因在煙草葉片中瞬時表達。將注射后培養兩天的煙草葉片置于激光共聚焦顯微鏡下觀察,結果顯示(圖7)牡丹 PsSUT1 蛋白亞細胞定位于細胞質膜上,與預測結果一致。
2.5 牡丹 PsSUT1基因異源表達分析
2.5.1 轉基因擬南芥的鑒定
構建 PsSUT1基因過表達載體,為了檢驗T0代轉基因擬南芥陽性苗,提取PsSUT1轉基因擬南芥DNA進行PCR檢測,結果如圖8所示。10株T0代轉PsSUT1基因擬南芥中9個有條帶,一個沒有條帶,有條帶的植株為轉基因陽性苗。為了進一步驗證牡丹PsSUT1基因是否在擬南芥中穩定表達,分別提取了3個株系的牡丹PsSUT1基因T3代轉基因陽性苗和野生型擬南芥的總RNA進行半定量檢測,以內參基因Actin作為對照,結果如圖9所示,內參基因在野生型擬南芥和轉基因擬南芥中均正常表達,而目的基因PsSUT1在野生型擬南芥中不表達,但在T3代陽性幼苗中正常表達,說明PsSUT1基因在轉基因陽性苗中穩定表達。
2.5.2 轉基因擬南芥形態學特征測定
通過觀察轉基因擬南芥T3代植株生長情況,發現生長20 d的擬南芥PsSUT1轉基因陽性苗與野生型擬南芥相比,生長情況優于野生型擬南芥(圖10A)。生長45 d的擬南芥(圖10B,表2),3個株系的PsSUT1轉基因陽性苗與野生型擬南芥相比,地上部分干重平均增加了46.35%,株高增加了50.44%,種莢數增加了40.54%。結果表明牡丹PsSUT1基因可能促進了植物體內蔗糖的運輸,從而促進了植物的生長發育。
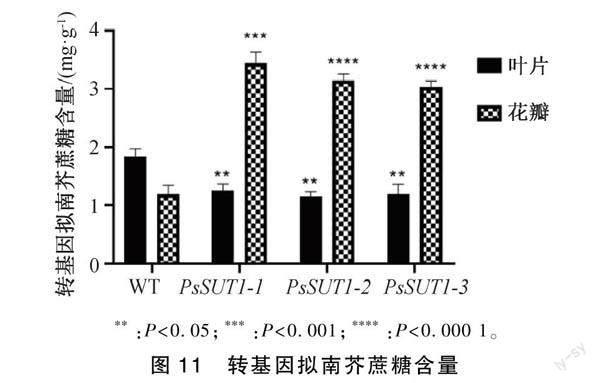
2.5.3 轉基因擬南芥蔗糖含量測定
以30 d的野生型擬南芥和轉基因擬南芥(3個株系)的葉片和花瓣為試驗材料進行蔗糖含量的測定,結果顯示(圖11),野生型擬南芥葉片的蔗糖含量1.84 mg·g-1,3個轉基因擬南芥株系葉片的平均蔗糖含量為1.25 mg·g-1,顯著下降32.06%。野生型擬南芥花瓣的蔗糖含量為1.19 mg·g-1,3個轉基因擬南芥株系花瓣的平均蔗糖含量為3.43 mg·g-1,是野生型擬南芥的2.88倍。說明PsSUT1基因在擬南芥中的過量表達可能促進了光合產物在源葉韌皮部的裝載和在庫器官花瓣中的卸載,從而使轉基因擬南芥葉片中的蔗糖含量下降,而花瓣中的蔗糖含量增加。
2.5.4 轉基因擬南芥對外源蔗糖的利用
將轉基因擬南芥和野生型擬南芥分別播種在蔗糖濃度為3%、6%和9%的培養基上,20 d后,擬南芥的生長情況如圖12。在蔗糖濃度為3%的培養基上,轉基因擬南芥和野生型擬南芥生長均正常,與野生型相比,轉基因植株明顯高于野生型擬南芥,平均根長為2.6 cm,明顯高于野生型擬南芥根長1.38 cm。在蔗糖濃度為6%和9%的培養基上,野生型擬南芥的生長受到抑制,植株矮小,根系發育受阻,葉片中出現花青素的積累,而 PsSUT1轉基因植株生長正常,根長平均為2.3 cm和3 cm,葉片發育正常,沒有花青素積累。這表明PsSUT1基因可以促進擬南芥對外源蔗糖的吸收和利用。
3 討論與結論
本研究從牡丹中克隆得到了蔗糖轉運蛋白基因 PsSUT1,該基因包含1 557 bp的開放閱讀框,編碼519個氨基酸。氨基酸保守基序分析發現牡丹PsSUT1基因氨基酸有6個保守基序,且Motif 1為MFS轉運蛋白家族保守結構域。小麥 TaSUT1A 蛋白在33-253區有SUT基因特有的保守結構域,屬于 MFS 基因家族[17]。菜豆 PvSUT1.1 蛋白7-239區[18]中也同樣發現了 MFS 家族保守結構域。因此說明 PsSUT1 蛋白在進化過程中較為保守。
將牡丹 PsSUT1基因轉入缺陷型酵母 SUSY7/ura3中,酵母在以蔗糖為唯一碳源的培養基上正常生長,恢復了酵母吸收利用蔗糖的能力,說明 PsSUT1 具有蔗糖轉運活性,這個與蘋果 MdSUT1基因[19]、甘薯 IbSUT3基因[20]和黃瓜CsSUT1基因[21]等的研究結果一致。自Riesmeier等[22]第1次通過利用酵母突變體,證明菠菜SoSUT1基因具有蔗糖轉運能力,通過酵母突變體表達體系驗證SUT家族基因蔗糖轉運能力的方法被人們廣泛使用。因此推測牡丹 PsSUT1參與了植物體內蔗糖的轉運,是具有蔗糖轉運功能的膜蛋白。
擬南芥 AtSUC2基因作為牡丹PsSUT1基因同源基因,主要負責植物韌皮部蔗糖的運輸功能,其突變體植株會出現植株矮小,營養組織積累淀粉和蔗糖的現象[23]。馬鈴薯、玉米和水稻的SUT1基因突變體均出現蔗糖運輸受損,積累在葉片中導致植株生長發育不良[24]。本研究將牡丹PsSUT1基因在擬南芥中異源表達之后,在營養生長階段,葉片蔗糖含量顯著性下降,而花瓣中蔗糖含量顯著性上升,此外,轉基因擬南芥的株高、種莢數、地上部分干重也明顯增加。因此推測是因為過表達牡丹PsSUT1基因促使源葉中蔗糖裝載和花瓣蔗糖的卸載能力增強,從而促進了植物的生長。蔗糖不僅是植物體內碳代謝的必須來源,還可以作為信號分子參與調控植物的生長發育[25]。研究[26]表明,蔗糖可以特異性地調節相應的蔗糖轉運蛋白的轉錄與翻譯。擬南芥AtSUC1基因[27]會受到外源蔗糖影響表達量增加。本文研究發現,在高濃度的外源蔗糖培養基上,野生型的擬南芥生長受到抑制,出現植株矮小,根系和葉片生長弱且葉片花青苷積累的現象,而PsSUT1轉基因植株均能有效的緩解外源的高濃度蔗糖,生長正常而且根系發育增強。說明牡丹PsSUT1基因可能參與了植物蔗糖信號響應過程,而促進了植物體內蔗糖裝載、運輸和卸載過程。本研究為改善盆栽牡丹生長與發育狀況提供生物學方面的理論證據和技術支撐。
參考文獻(References)
[1]郭麗麗,侯小改,郭琪,等.盆栽與地栽牡丹花芽的生理生化特性的動態變化[J].江蘇農業科學,2015,43(10):220-222.
GUO L L,HOU X G,GUO Q,et al.Dynamic changes of physiological and biochemical characteristics of potted and ground peony flowerbuds[J].Jiangsu Agricultural Sciences,2015,43(10):220-222.
[2]栗燕,楊旭升,楊秋生,等.牡丹蔗糖轉運蛋白基因PsSUT2的克隆及表達分析[J].農業生物技術學報,2017,25(4):567-578.
LI Y,YANG X S,YANG Q S,et al.Cloning and expression analysis of sucrose transporter gene PsSUT2 from tree peony(Paeonia suffruticosa)[J].Journal of Agricultural Biotechnology,2017,25(4):567-578.
[3]REINDERS A,SIVITZ A B,WARD J M.Evolution of plant sucrose uptake transporters[J].Frontiers in Plant Science,2012,3:22.
[4]SHIRATAKE K.Genetics of sucrose transporter in plants[J].Genes,Genomes and Genomics,2007,1(1):73-80.
[5]REDDY V S,SHLYKOV M A,CASTILLO R,et al.The major facilitator superfamily (MFS) revisited[J].The FEBS Journal,2012,279(11):2022-2035.
[6]BEZRUTCZYK M,YANG J,EOM J S,et al.Sugar flux and signaling in plant-microbe interactions[J].The Plant Journal,2018,93(4):675-685.
[7]KHN C,GROF C P.Sucrose transporters of higher plants[J].Current Opinion in Plant Biology,2010,13:288-298.
[8]ABIRAMAVALLI M,USHA B.Identification, characterization and expression analysis of sucrose transporters in the model plant Nicotiana tabacum cv.petit havana[J].Journal of Environmental Biology,2020,41(4):803-811.
[9]SCOFIELD G N,HIROSE T,AOKI N,et al.Involvement of the sucrose transporter, OsSUT1, in the long-distance pathway for assimilate transport in rice[J].Journal of Experimental Botany,2007,58(12):3155-3169.
[10]BARKER L,KHN C,WEISE A,et al.SUT2, a putative sucrose sensor in sieve elements[J].The Plant Cell,2000,12:1153-1164.
[11]BARTH I,MEYER S,SAUER N.PmSUC3:characterization of a SUT2/SUC3-type sucrose transporter from plantago major[J].Plant Cell,2003,15:1375-1385.
[12]REINDERS A,SIVITZ A B,STARKER C G,et al.Functional analysis of LjSUT4, a vacuolar sucrose transporter from Lotus japonicus[J].Plant Molecular Biology,2008,68(3):289-299 .
[13]LI Y H,GUO T,CUI Y,et al.Cloning and expression of the sucrose transporter gene PsSUT1 from tree peony leaf[J].Genetics and Molecular Research,2015,14(4):12406-12415.
[14]李永華,王翠麗,李永,等.菊花脂肪酸脫飽和酶基因CmFAD7的克隆與表達分析[J].園藝學報,2015,42(1):65-74.
LI Y H,WANG C L,LI Y,et al.Cloning and expression analysis of fatty acid desaturase gene CmFAD7 in Chrysanthemum[J].Acta Horticulturae Sinica,2015,42(1):65-74.
[15]李研,劉慧,黃先忠.陸地棉GhBFT1基因的克隆、表達及亞細胞定位分析[J].石河子大學學報(自然科學版),2019,37(2):183-189.
LI Y,LIU H,HUANG X Z.Cloning, expression and subcellular localization analysis of GhBFT1 gene from Gossypiumhirsutum L.[J].Journal of Shihezi University(Natural Science),2019,37(2):183-189.
[16]張志良.植物生理學實驗指導(第二版)[M].北京:高等教育出版社,1990.
[17]蘇世超,李桂蘭,喬亞科.小麥蔗糖運輸基因TaSUT1A的生物信息學分析[J].河北科技師范學院學報,2015,29(4):32-35.
SU S C,LI G L,QIAO Y K.Bioinformatics analysis of sucrose transporter gene TaSUT1A in wheat(Triticum aestivum ?L.)[J].Journal of Hebei Normal University of Science & Technology,2015,29(4):32-35.
[18]SANTIAGO J P,WARD J M,Sharkey T D.Phaseolus vulgaris SUT1.1 is a high affinity sucrose-roton co-transporter[J].Plant Direct,2020,4(8):e00260.
[19]彭昌操.蘋果蔗糖轉運蛋白基因 MdSUT1 克隆及其互作因子篩選[D].北京:中國農業大學,2006.
[20]王丹丹,柳洪鵑,王紅霞,等.甘薯蔗糖轉運蛋白基因IbSUT3的克隆及功能分析[J].作物學報,2020,46(7):1120-1127.
WANG D D,LIU H J,WANG H X,et al.Cloning and functional analysis of the sweet potato sucrose transporter IbSUT3[J]Acta Agronomica Sinica,2020,46(7):1120-1127.
[21]SUN L L,SUI X L,LUCAS W J,et al.Down-regulation of the sucrose transporter CsSUT1 causes male sterility by altering carbohydrate supply[J].Plant Physiology,2019,180(2):986-997.
[22]RIESMEIER J W,WILLMITZER L,FROMMER W B.Isolation and characterization of a sucrose carrier cDNA from spinach by functional expression in yeast.[J].The EMBO Journal,1992,11(13):4705-4713.
[23]SRIVASTAVA A C,GANESAN S,ISMAIL I O,et al.Functional characterization of the Arabidopsis AtSUC2 sucrose/H+ symporter by tissue-specific complementation reveals an essential role in phloem loading but not in long-distance transport[J]. Plant Physiology,2008,148:200-211.
[24]SLEWINSKI T L,MEELEY R,BRAUN D M.Sucrose transporter1 functions in phloem loading in maize leaves[J].Journal of Experimental Botany,2009,60(3):881-892.
[25]LASTDRAGER J,HANSON J,SMEEKENS S.Sugar signals and the control of plant growth and development[J]. Journal of Experimental Botany,2014,65(3):799-807.
[26]CHIOU T J,BUSH D R.Sucrose is a signal molecule in assimilate partitioning[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(23):13997.
[27]SIVITZ A B,REINDERS A,WARD J M.Arabidopsis sucrose transporter AtSUC1 is important for pollen germination and sucrose-induced anthocyanin accumulation[J].Plant Physiology,2008,147(1):92-100.
(責任編輯:編輯郭蕓婕)
收稿日期:中文收稿日期2022-08-03
基金項目:河南省科技攻關項目(192102110062);河南農業大學科技創新基金項目(KJCX2019A05)
作者簡介:韓靜靜(1996—),女,碩士研究生,專業方向為園林植物分子生物學。
*通信作者:栗燕(1978—),女,高級實驗師,從事園林植物栽培生理與分子生物學方向的研究,e-mail:yanli1978@163.com。

