銅和濃硫酸反應的一體化新設計
西華師范大學化學教育研究所(637000) 周于莉 彭新月 四川省南充市白塔中學(637100) 田 權
銅與濃硫酸反應選自人教版必修2第1單元第1節“硫及其化合物”,《普通高中化學課程標準(2017年版)》[1]對該部分的要求是:對不同含硫價態物質的轉化進行探究,學生能夠例舉、描述、辨識典型物質重要的物理和化學性質及實驗現象,能用化學方程式表示典型物質的主要化學性質。通過銅與濃硫酸反應的實驗,學生能夠掌握濃硫酸的強氧化性、驗證產物二氧化硫的還原性、漂白性和酸性。
化學是一門以實驗為基礎的學科,通過實驗的直觀展示可以提高教學的趣味性、學生的探索欲,但由于大多數化學實驗存在一定的危險性,所以中學實驗通常以教師演示為主,這就要求實驗現象明顯、便于操作、無污染物。銅與濃硫酸反應是高中化學非常重要的一個實驗,值得對其進行探究。
1 研究背景
1.1 教材實驗分析
1.1.1 人教版教材實驗分析[2]
人教版教材實驗(如圖1所示)存在以下缺點:①抽拉銅絲容易受到橡膠塞的阻力,不便于控制反應的發生與停止;②該實驗性質檢驗用品紅溶液和石蕊試液,浪費藥品。

圖1 人教版Cu與濃硫酸反應裝置圖
1.1.2 蘇教版教材實驗分析[3]
蘇教版銅與濃硫酸反應裝置圖如圖2所示。該反應裝置簡單,操作方便。但存在以下幾個弊端:①尾氣處理裝置不當。SO2在水中的溶解性極好,若先撤酒精燈,則容易造成倒吸,若先撤導管,SO2則容易逸出,污染空氣;②反應結束后,試管中的SO2沒有得到處理,會逸出污染空氣。
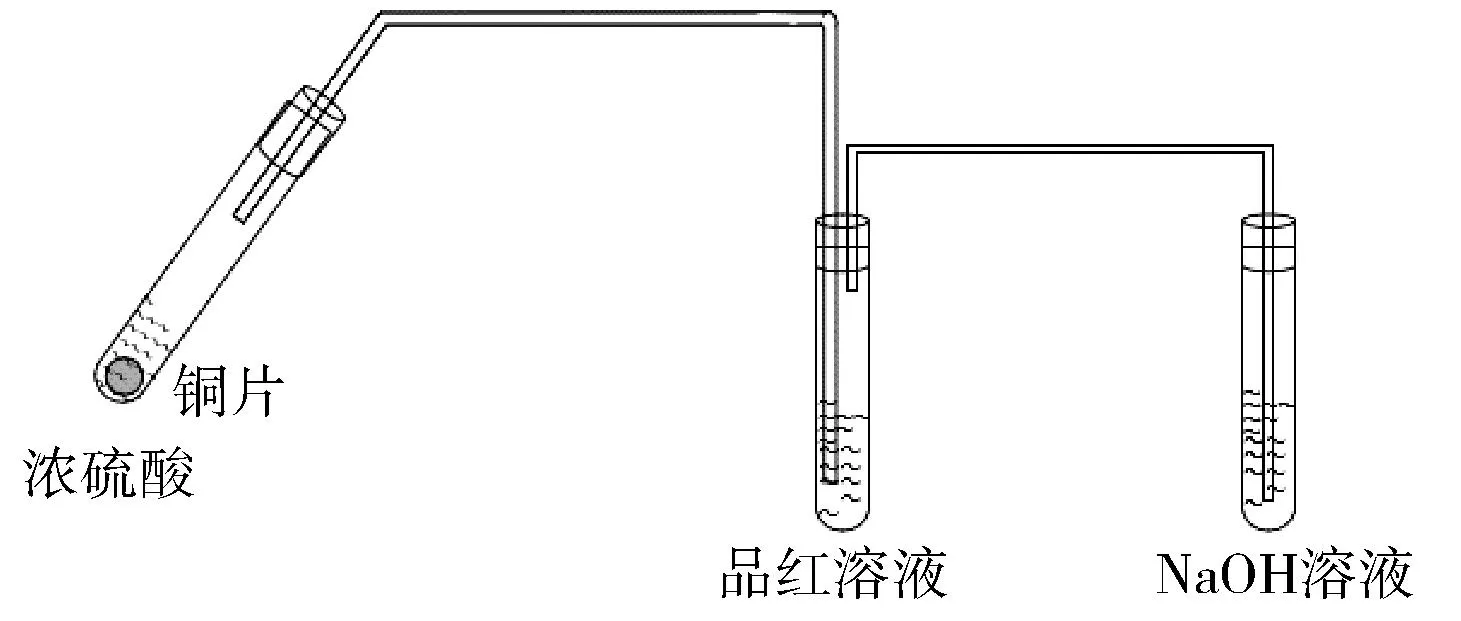
圖2 蘇教版Cu與濃硫酸反應裝置圖
1.1.3 滬教版教材實驗分析[4]
滬教版銅與濃硫酸反應裝置圖如圖3所示。該設計與蘇教版教材極為相似,但在蘇教版基礎上多了一個抽氣裝置,可以將試管中的SO2完全吸收,防止污染空氣。但該裝置仍然存在僅探討了SO2的漂白性,不利于學生系統學習SO2的還原性、酸性的缺點。
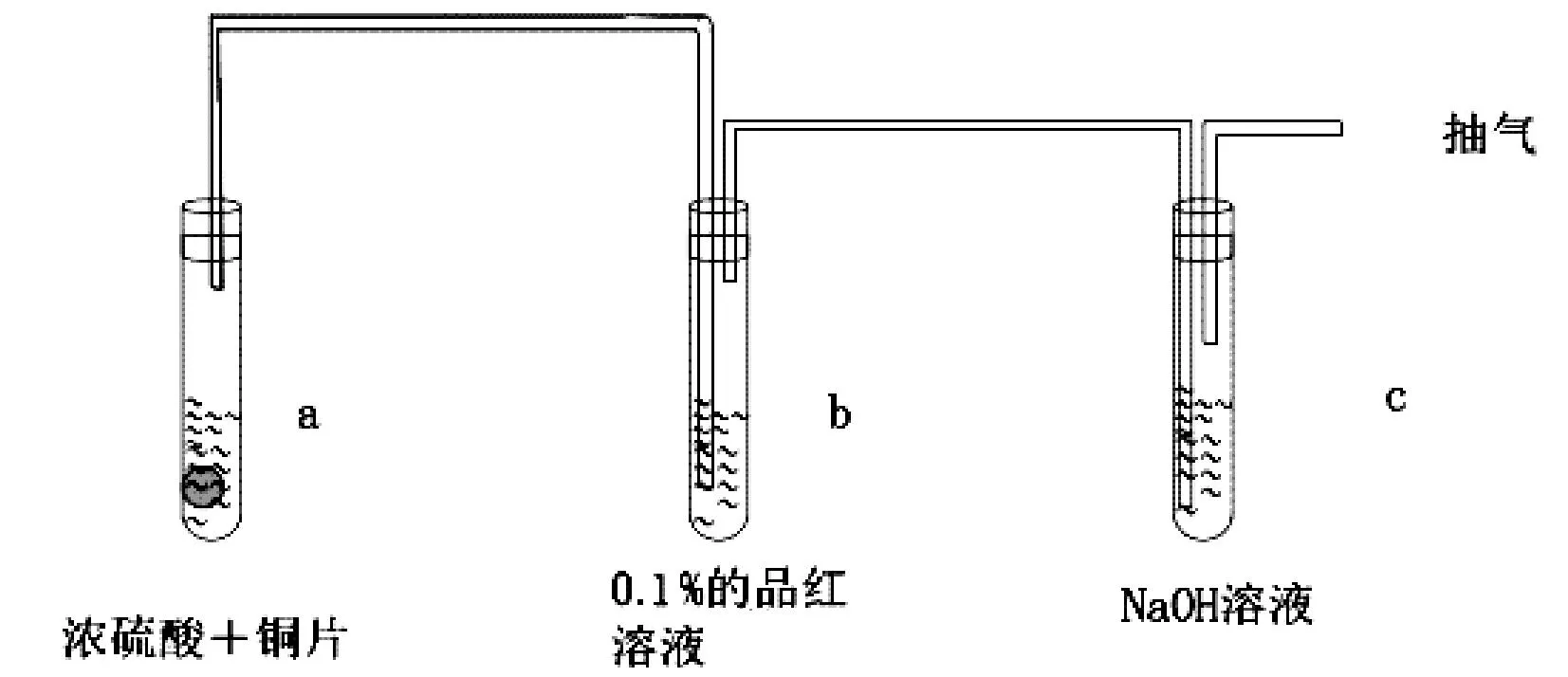
圖3 滬教版Cu與濃硫酸反應裝置圖
1.2 改進實驗分析
針對以上缺點,目前已經有不少人對該實驗進行了改進。主要分為探究不同實驗條件對反應的影響和對實驗裝置進行改進。
探究不同實驗條件主要是通過比對不同酸的用量、反應溫度、銅的用量等來尋找最佳反應條件。例如夏立先[5]對銅與濃硫酸反應溶液呈綠色的原因進行了探究,最后發現是氯元素的摻入影響了實驗探究。在實驗時一定要注意實驗原料的純度,即打磨銅絲、用蒸餾水清洗實驗儀器;鄭茹丹[6]通過讓銅與不同濃度的濃硫酸進行反應,得出濃硫酸的濃度不是越大越好,而是存在一定的最佳范圍的結論。
對裝置進行改進則是從改進反應物參與實驗的方式、藥劑的用量、尾氣的處理等角度出發對實驗裝置進行改進。例如鞏永銳[7]、 陳海濤[8]的設計是通過磁環、攪拌子或者制作封鐵玻璃管利用磁力吸引來控制反應的發生與停止;王丹[9]、張義[10]等人則是通過針管抽拉與橡膠相連的銅絲來控制反應的發生與停止,但大多數還是選擇銅片或銅粉與酸直接接觸保證絕對封閉性來進行反應;王春[11]、曾廣勇[12]等人通過1根防倒吸的導管將尾氣插入到氫氧化鈉溶液中進行尾氣吸收。
通過以上文獻分析,我們可以發現實驗改進仍然存在不少缺點。例如反應裝置復雜,前期準備工作較多;SO2的性質檢驗不全,不利于學生系統學習;尾氣處理不當,容易污染空氣。基于此,筆者提出了一個簡單易行、一體化封閉設計、零污染的實驗改進裝置。
2 實驗改進
2.1 實驗藥品及儀器
(1)實驗藥品:Cu粉、濃硫酸、NaOH溶液、紫色石蕊溶液、高錳酸鉀溶液、品紅溶液。
(2)實驗儀器:U形管、球形干燥管、鐵架臺、酒精燈、脫脂棉團、細線、橡皮塞、橡膠管、打氣筒、大頭針。
2.2 實驗裝置圖
實驗裝置如圖4所示。
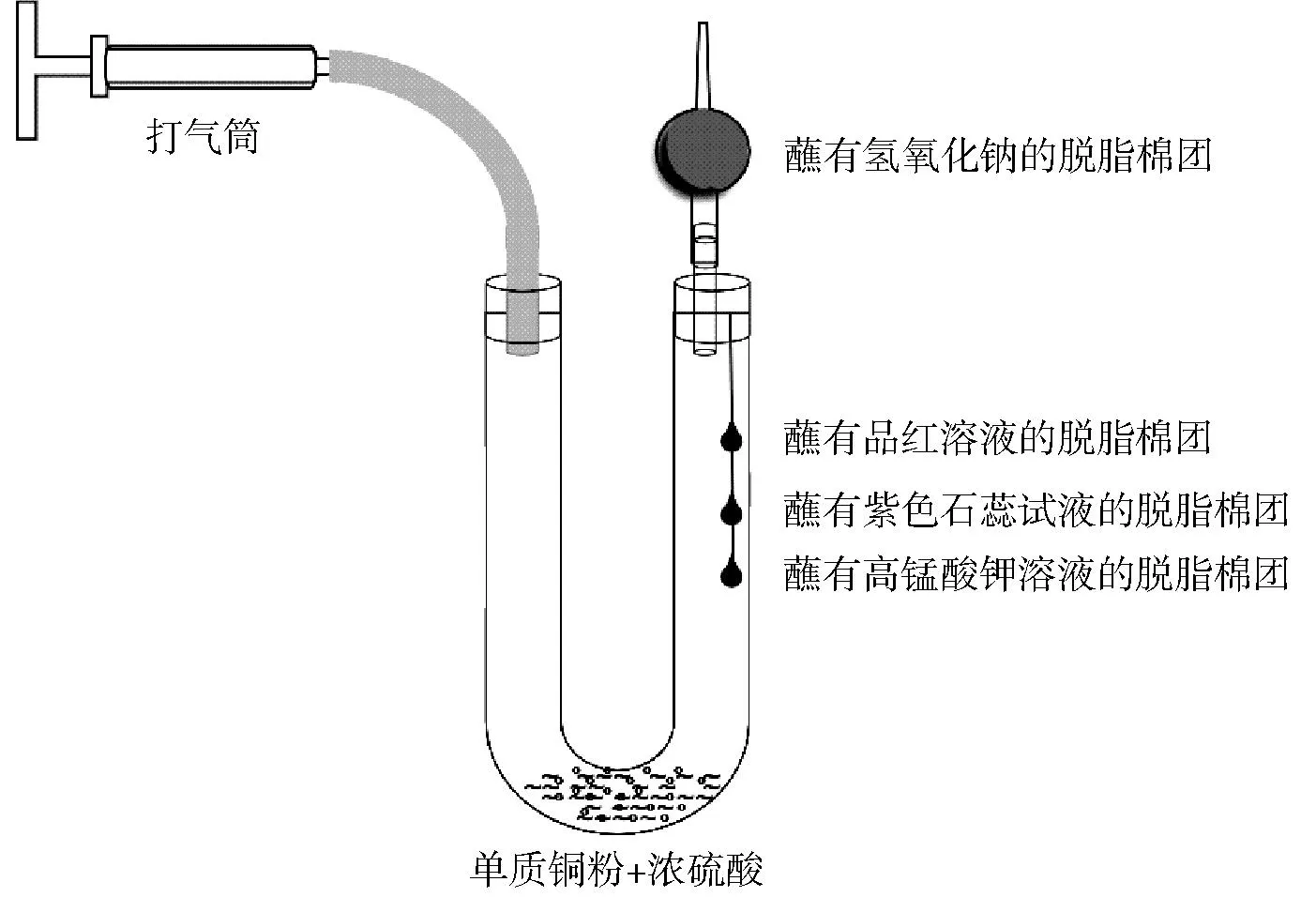
圖4 Cu與濃硫酸反應裝置改進圖
2.3 實驗過程
(1)首先,按照圖4搭建好反應裝置圖。將大頭針穿過脫脂棉團后彎曲交叉,重復完成3個這種脫脂棉團。然后先用蒸餾水將這3個脫脂棉團微微潤濕,然后滴加適量的試劑使棉團著色即可,防止試劑過量各棉團浸潤的溶液滴落造成干擾。最后用細線將這3個脫脂棉團串起來,將細線固定在塞子和試管的夾縫處。
(2)裝置搭建好以后,點燃酒精燈對U形管進行預熱,預熱結束后用酒精燈外焰對U形管底部集中加熱產SO2。
(3)觀察到3個脫脂棉團從上到下依次由紅色變為無色、紫色變為紅色、紫色變為無色時反應結束停止加熱。
(4)反應結束后用打氣筒打氣將瓶內和管道內的SO2氣體全部送到干燥管內的蘸有氫氧化鈉溶液的脫脂棉團處(以使SO2被充分吸收)。
2.4 實驗現象分析
學生通過研究實驗現象的變化,回憶所學知識,尋找證據來支撐自己的猜想,獲取知識的本質,同時通過實驗的呈現來鞏固知識。在驗證產物SO2化學性質的幾個小實驗中,顏色變化非常復雜。脫脂棉團“一褪兩變”:2個紫色脫脂棉球在同等條件下經過一段時間后卻發生了不同的變化形成鮮明對比。學生因此會產生疑惑,教師引導學生通過已學的知識來解釋這種現象:
(1)高錳酸鉀溶液的紫色棉團,反應一段時間后紫色褪去,證明是具有還原性的物質與高錳酸鉀溶液之間發生了氧化還原反應,因此證明產生的氣體是SO2,非SO3。
褪色原理:2KMnO4+5SO2+2H2O=2MnSO4+2H2SO4+K2SO4。
(2)蘸有紫色石蕊試液的脫脂棉團,反應一段時間后變紅,證明SO2是酸性氣體,與水反應生成了能使石蕊變色的物質H2SO3,如圖5所示。
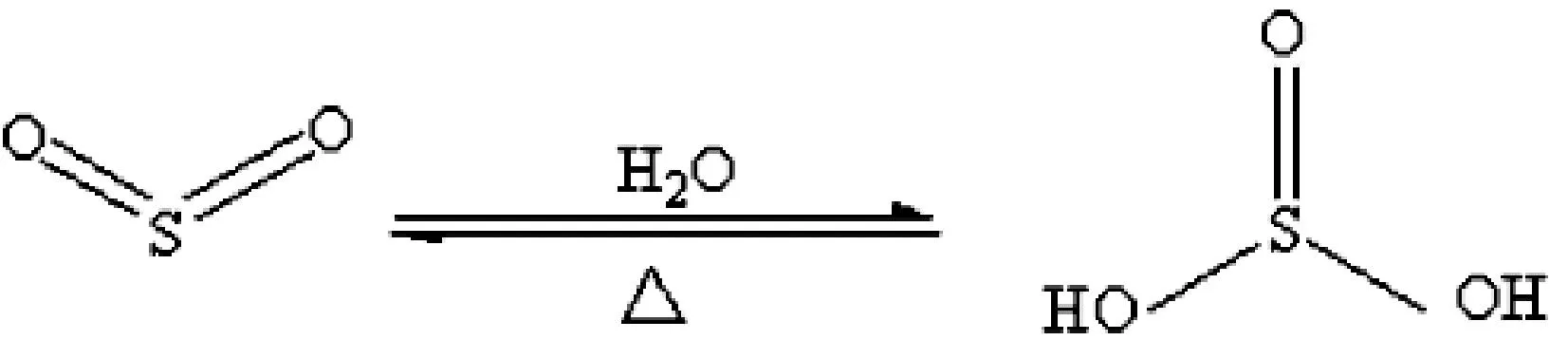
圖5 SO2溶于水
(3)蘸有品紅溶液的脫脂棉團,由紅色變為無色。說明品紅溶液與SO2化合,生成無色物質,如圖6所示。
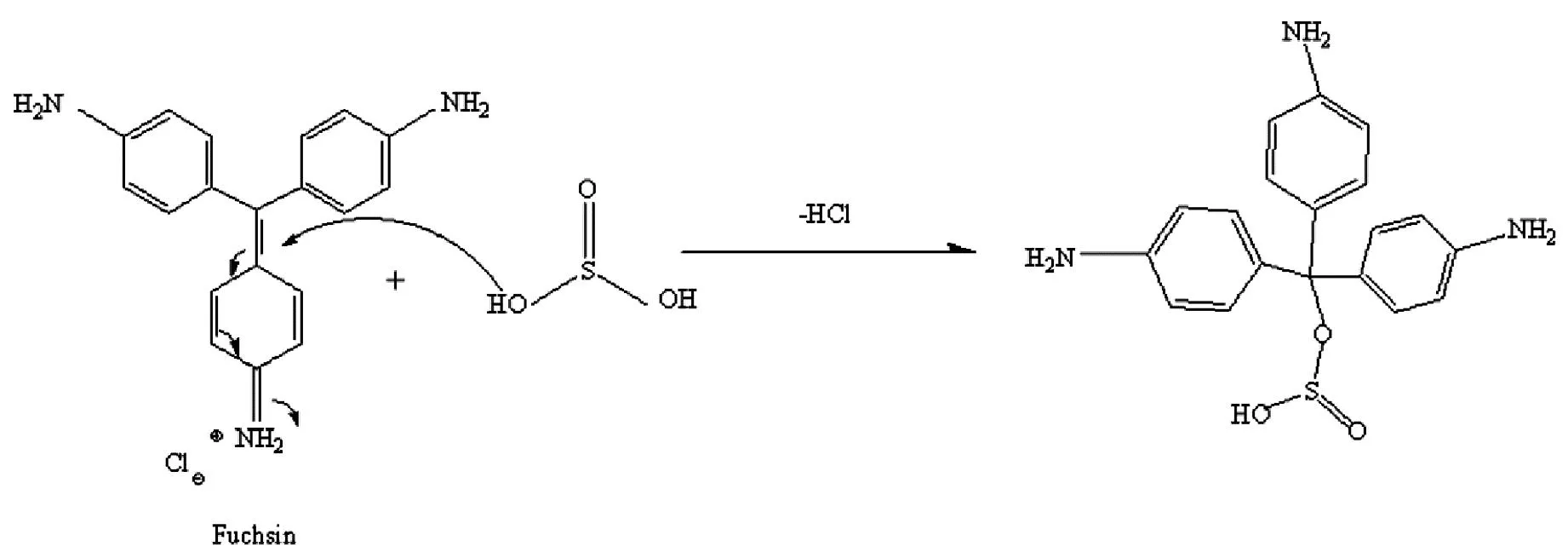
圖6 SO2與品紅溶液反應
3 實驗總結
實驗注意事項:本次實驗改進所需的裝置易得,操作簡單,現象明顯,無毒無害。
①為了使實現現象變化明顯,可先用蒸餾水將脫脂棉團潤濕再滴加試劑;②為了說明產生的氣體是SO2非SO3,需要將最下面的棉團滴加高錳酸鉀溶液。因為蘸有高錳酸鉀溶液的脫脂棉團褪色,證明了產物具有還原性,所以該氣體是SO2。

