運(yùn)用價層電子對數(shù)判斷分子構(gòu)型及π鍵
李 軍
(北京市十一學(xué)校)
在《普通高中化學(xué)課程標(biāo)準(zhǔn)》(2017年版2020年修訂)中,提出了化學(xué)學(xué)科的五個核心素養(yǎng),“證據(jù)推理與模型認(rèn)知”是其中之一,即模型是化學(xué)學(xué)科重要的分析、解決問題的方法。關(guān)于分子空間結(jié)構(gòu)的內(nèi)容要求是:“幾何實(shí)例了解共價分子具有特定的空間結(jié)構(gòu),并可運(yùn)用相關(guān)理論和模型進(jìn)行解釋和預(yù)測。”價層電子對互斥理論是培養(yǎng)學(xué)生模型認(rèn)知的非常好的載體,學(xué)生在學(xué)習(xí)過程中能夠充分體會模型是對客觀世界的簡單描述,是為了預(yù)測、解釋客觀世界的一種闡釋,是人類思維創(chuàng)造的結(jié)果。
“結(jié)構(gòu)決定性質(zhì),性質(zhì)反映結(jié)構(gòu)”,主族元素原子的最外層電子也就是價電子比較容易影響元素的化學(xué)性質(zhì),最外層電子數(shù)也和物質(zhì)的空間結(jié)構(gòu)有一定聯(lián)系。近年來,有關(guān)分子或離子中大π鍵的判斷屢次出現(xiàn)在高考化學(xué)試題中。價層電子如何書寫,價層電子如何影響分子的空間結(jié)構(gòu),又如何運(yùn)用價層電子解釋并推測分子的空間結(jié)構(gòu)和化學(xué)鍵?如何快速確定分子或離子中的大π鍵?本文通過價層電子將這些問題一一呈現(xiàn),讓讀者借助簡單的價層電子便可掌握從電子式書寫到分子空間結(jié)構(gòu)、雜化類型及化學(xué)鍵一系列知識。
一、電子式的由來及電子式的書寫
1.電子式的由來:主族元素的性質(zhì)由原子的最外層電子即價電子決定,為了強(qiáng)調(diào)最外層電子的重要性,在元素符號周圍用“·”或者“×”來表示元素原子的最外層電子。結(jié)合稀有氣體的穩(wěn)定結(jié)構(gòu),演變出了現(xiàn)在的電子式。
2.原子的電子式書寫規(guī)則:主族元素的價電子為s、p層電子,最多為8個。按照價電子排布式,把原子的最外層電子全部排在元素符號周圍,在元素符號上、下、左、右四個方向?qū)懮想娮?每個方向一般不超過2個電子,電子式可寫為:
或者書寫其激發(fā)態(tài),當(dāng)少于4個的時候每個方向先各排一個,多于4個則每個方向先各排一個然后再逐一成對。
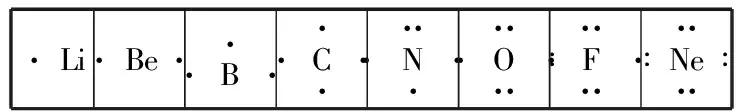
·Li·Be··B···C····N·····O·····∶F·····∶Ne····∶
二、價層電子對互斥理論
單個原子因為存在單電子所以不穩(wěn)定,非金屬原子之間可通過共用電子形成共價鍵降低能量。價層電子對互斥理論認(rèn)為,分子的空間結(jié)構(gòu)是中心原子周圍的“價層電子對”互相排斥的結(jié)果,即價層電子對在空間上盡可能遠(yuǎn)離。“價層電子對”是指分子中的中心原子與結(jié)合原子間的σ鍵電子對和中心原子上的孤電子對。多重鍵只計算其中的σ鍵電子對,不計算π鍵電子對。
(一)用價層電子對互斥理論確定分子或離子空間構(gòu)型的一般步驟
(1)確定分子或離子的價層電子對數(shù);
(2)根據(jù)價層電子對數(shù)確定價層電子對的空間構(gòu)型(VSEPR模型);
(3)略去VSEPR模型中心原子上的孤對電子即可得到分子或離子的空間構(gòu)型。
(二)價層電子對的計算方法
價層電子對數(shù)(VP)、成鍵電子對數(shù)(BP)和孤電子對數(shù)(LP)基本關(guān)系:VP=BP+LP。
對于分子ABx,BP可由化學(xué)式直接確定:BP=中心原子結(jié)合的電子數(shù)=σ鍵電子對數(shù),即電子對數(shù)為x。
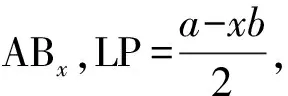
(三)雜化類型
雜化軌道理論是一種價鍵理論,指原子內(nèi)部能量相近的原子軌道重新組合生成與原子軌道數(shù)目相等的一組新軌道的過程,因為雜化軌道只能用于形成σ鍵或者用來容納孤對電子,所以雜化軌道數(shù)等價于價層電子對數(shù),所以雜化類型可以根據(jù)價層電子對進(jìn)行判斷。
雜化類型和VSEPR模型均由價層電子對數(shù)確定,雜化軌道數(shù)目和價層電子對數(shù)相等,價層電子對有幾對,雜化軌道就有幾個。
三、π鍵數(shù)及大π鍵的確定
(一)π鍵形成條件
(1)所有參與形成π鍵的原子在同一平面上。中心原子只能采取sp或sp2雜化。
(2)所有參與形成π鍵的原子必須提供一個或兩個相互平行的p軌道。
(3)形成π鍵的p電子總數(shù)小于p軌道數(shù)的兩倍。
(二)π鍵數(shù)的計算
對于分子ABx,π鍵計算:π鍵數(shù)=總鍵數(shù)-σ鍵數(shù)。

(三)大π鍵
由三個或三個以上的原子上互相平行的p軌道連貫地“肩并肩”重疊在一起形成的π鍵叫大π鍵。大π鍵電子在參與成鍵的多個原子形成的分子或離子骨架中運(yùn)動。
(四)計算及表示方法
方法一:計算法,第一步:確定分子中總價電子數(shù);第二步:畫出分子中σ鍵及不參與成鍵的孤對電子數(shù);第三步:總價電子數(shù)減去這些σ鍵電子數(shù)和孤對電子數(shù),剩余的即為填入離域π鍵的電子數(shù)。
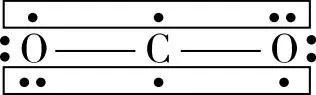
方法二:等電子體法,等電子體是指原子數(shù)、價電子數(shù)相等的分子或離子。等電子體之間往往具有相同的結(jié)構(gòu)特征,這里的“結(jié)構(gòu)特征”既包括分子的立體結(jié)構(gòu),又包括化學(xué)鍵的類型。
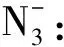
沿著微粒→BP→LP→VP→雜化類型→空間構(gòu)型→π鍵數(shù)→大π鍵的思路逐一分析,就可以很好地解決高考中的空間構(gòu)型、雜化軌道類型及π鍵問題。
具體舉例如表:
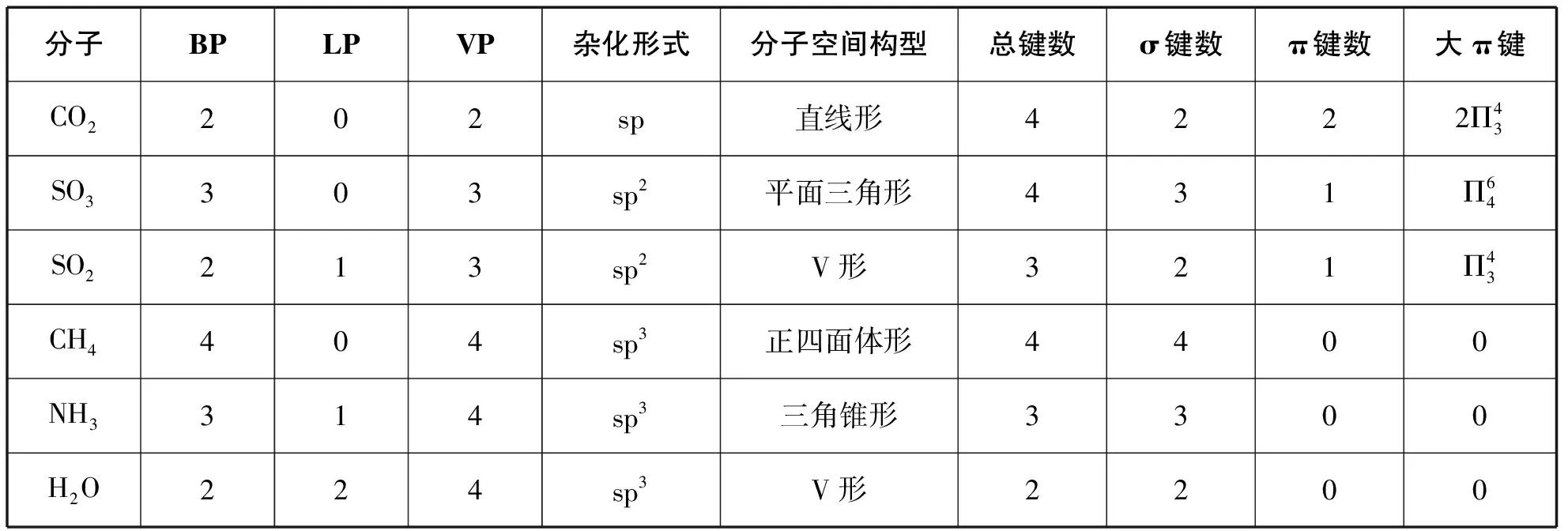
分子BPLPVP雜化形式分子空間構(gòu)型總鍵數(shù)σ鍵數(shù)π鍵數(shù)大π鍵CO2202sp直線形4222Π43SO3303sp2平面三角形431Π64SO2213sp2V形321Π43CH4404sp3正四面體形4400NH3314sp3三角錐形3300H2O224sp3V形2200
四、高考題再現(xiàn)
【例1】(2023年湖北卷,9題)價層電子對互斥理論可以預(yù)測某些微粒的空間結(jié)構(gòu)。下列說法正確的是
( )
A.CH4和H2O的VSEPR模型均為四面體
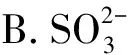
C.CF4和SF4均為非極性分子
D.XeF2與XeO2的鍵角相等
【答案】A
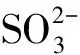
【例2】(2023年山東卷,16題節(jié)選)
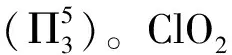
【答案】sp2> ClO2中存在大π鍵,Cl2O中只存在σ鍵,所以ClO2中Cl—O鍵鍵長較短
【解析】由于ClO2分子中存在5電子3中心的大π鍵,而Cl原子與2個O原子還分別形成σ鍵,所以Cl原子未成鍵電子數(shù)為2,即1個孤電子對,所以Cl原子價層電子對數(shù)為3,則其雜化方式為sp2雜化。Cl2O分子中O原子核外有2個孤電子對,所以雜化方式為sp3,所以鍵角:O—Cl—O>Cl—O—Cl。ClO2分子中既存在σ鍵又存在大π鍵,而Cl2O中只存在σ鍵,所以ClO2中Cl—O鍵鍵長較短。
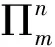

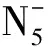
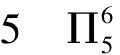
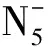
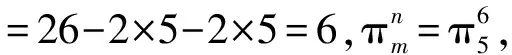

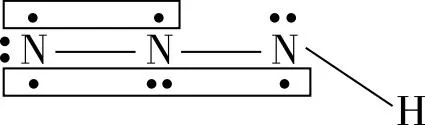
【變式2】疊氮酸的結(jié)構(gòu)式如下,其中存在的大π鍵應(yīng)表示為什么?
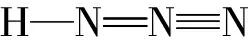
五、總結(jié)
通過對常見微粒的空間構(gòu)型和價層電子對數(shù)計算的理解,學(xué)生熟練掌握價層電子對理論這一重難點(diǎn)知識,能夠進(jìn)行軌道雜化類型和π鍵及大π鍵推理以及對陌生微粒空間構(gòu)型的分析,提升學(xué)生的理解能力。

