下調DDX39A對食管鱗癌細胞生物學行為的影響及其機制
胡瑋彬,孫玄子,張曉智,惠蓓娜
(西安交通大學第一附屬醫院腫瘤放療科,西安 710061;*通訊作者,E-mail:zhangxiao-zhi@xjtu.edu.cn;#共同通訊作者,E-mail:nailpolish@126.com)
食管癌(esophageal cancer, EC)是全球排名第七的常見癌癥,也是第六大癌癥死亡原因[1]。食管癌的病理類型主要包括鱗癌(squamous cell carcinoma)和腺癌(adenocarcinoma),鱗癌占全球食管癌病例的70%,以中國北部及中亞、東南亞地區最常見[2]。盡管治療手段不斷改進,但食管癌的5年生存率仍不足10%,可手術切除患者的5年生存率僅為15%~40%[3]。因此,迫切需要尋找針對食管癌的潛在治療靶點。
DEAD-box蛋白分子家族存在于從病毒到原核生物再到真核哺乳動物的多種物種中,是一類依賴于ATP的RNA解旋酶[4]。DEAD-box蛋白通過調節基因表達和RNA代謝,在生物體天然免疫功能的識別、細胞內信號通路的調控、RNA轉錄和剪接以及核表觀遺傳調控等方面發揮重要作用[5-7]。DDX39蛋白作為DEAD-box蛋白分子家族中的一員,已被越來越多的研究證實與腫瘤的發生發展密切相關。例如,在肝細胞癌中,DDX39可通過激活Wnt/β-連環蛋白途徑(Wnt/β-catenin)促進肝癌細胞生長和轉移[8]。Sugiura等[9]發現DDX39在肺鱗癌中上調,顯示出RNA解旋酶活性和促癌作用。此外,還有研究表明DDX39是一種新的胃腸道間質瘤(gastrointestinal stromal tumors, GIST)預后生物標志物,為GIST的診療提供新思路[10]。DDX39A作為一類DDX39蛋白,同樣也與腫瘤的形成緊密關聯。少部分研究已報道DDX39A在神經母細胞瘤和乳腺癌中的促癌活性[11,12],然而,DDX39A在食管癌中的表達及生物學意義尚不清楚。
本研究擬從生物信息學角度出發,通過多種細胞功能實驗,探究DDX39A對食管鱗癌細胞生物學行為的影響及其中可能的調控機制,以期為食管鱗癌的診治提供新的分子靶點。
1 材料與方法
1.1 生物信息分析
從癌癥基因組圖譜(the cancer genome atlas, TCGA)獲得82例食管鱗癌患者腫瘤樣本和11例癌旁樣本的轉錄組測序數據。從高通量基因表達數據庫(gene expression omnibus, GEO)篩選出GSE38129數據集,該數據集通過GPL571平臺采用Affymetrix Human Genome U133A 2.0 Array芯片對30例食管鱗癌患者的腫瘤組織和鄰近正常組織進行了包含22 277個基因的轉錄組分析。使用R軟件v4.0.3分別對TCGA和GEO的測序數據進行DDX39A基因的單基因表達差異性分析并得到相應的P值。
利用TCGA數據庫中食管鱗癌患者的轉錄組測序數據,采用Spearman相關性分析,共檢索到44 204個DDX39A相關基因,通過設定相關系數r>0.5且P<0.05,最終得到350個與DDX39A表達最相關的基因。使用KEGG rest API(https://www.kegg.jp/kegg/rest/keggapi.html)獲取最新的KEGG Pathway的基因注釋,并以此作為背景將基因映射到背景集合中,對相關基因進行基因集功能富集分析。從GSEA網站(http://software.broadinstitute.org/gsea/index.jsp)獲得了GSEA軟件(version 3.0),并從Molecular Signatures Database(http://www.gsea-msigdb.org/gsea/downloads.jsp)下載h.all.v7.4.symbols.gmt子集合,用以評估相關途徑和分子機制。
1.2 細胞實驗
1.2.1 細胞株及主要試劑 人食管鱗癌KYSE-150、TE-1細胞株由西安交通大學第一附屬醫院科研中心提供。RPMI-1640培養基、DPBS溶液以及Transwell試劑盒購自美國Corning公司,胎牛血清購自北京締一生物科技有限公司,胰酶購自美國Gibco公司,Ham′s F-12完全培養基購自武漢Procell生命科技有限公司,Trizol購自上海普飛生物技術有限公司,結晶紫水溶液(0.5%)購自上海源葉生物科技有限公司,RIPA裂解液和MTT購自上海鼎國生物技術有限公司,DMSO購自上海試一化學試劑有限公司,凋亡試劑盒購自上海賽默飛公司,4%多聚甲醛購自國藥集團化學試劑有限公司,PVDF膜購自美國Millipore公司,蛋白上樣緩沖液購自武漢ASPEN生物技術有限公司,兔DDX39A一抗、兔CDH2一抗購自美國Abcam公司,HRP偶聯Rabbit IgG二抗購自美國CST公司,鼠β-actin一抗購自美國Santa Cruz生物公司。以hU6-MCS-CMV-EGFP(GV115)為載體的RNA干擾(RNA interference, RNAi)陰性對照(Ctrl-RNAi)重組質粒和DDX39A-RNAi重組質粒由上海吉凱基因化學技術有限公司合成。針對目的基因DDX39A,為選擇干擾效果較好的靶點進行后續實驗,分別設計了3條特異性RNAi靶點序列。Ctrl-RNAi靶點序列:5′-TTCTCCGAACGTGTCACGT-3′;3條特異性RNAi靶點序列:①DDX39A-RNAi-1:5′-AGTTAATGTGGCAG-AACTT-3′;②DDX39A-RNAi-2:5′-GAGTCAACATCGTCTTTAA-3′;③DDX39A-RNAi-3:5′-AGGTGATAATCTTCGTCAA-3′。
1.2.2 細胞培養和慢病毒轉染 將人食管鱗癌細胞KYSE-150和TE-1接種在含10%胎牛血清的RPMI-1640培養基中,于37 ℃、5% CO2的培養箱中培養,待細胞匯合度達80%左右傳代培養。取處于對數生長期的細胞胰酶消化,完全培養基制成5×104個/mL細胞懸液接種于6孔板,待鋪板量達到30%時分別加入適當比例Ctrl-RNAi和3種特異性DDX39A-RNAi重組慢病毒濃縮液,并將細胞分別定義為shCtrl組和shDDX39A-1、shDDX39A-2、shDDX39A-3組,無血清培養基培養2 h后加入RPMI-1640培養液繼續培養72 h,熒光顯微鏡觀察綠色熒光蛋白的表達,檢測細胞狀態和感染效率。細胞狀態良好,感染效率達90%以上可收集細胞用于后續實驗。
1.2.3 qPCR檢測食管鱗癌細胞KYSE-150和TE-1中DDX39A的mRNA水平 靶向DDX39A不同序列的3種特異性重組慢病毒感染KYSE-150和TE-1細胞72 h后,利用qPCR檢測DDX39A基因的敲減效率。根據Invitrogen公司的Trizol參考操作步驟提取總RNA,qPCR檢測DDX39A mRNA的表達情況。DDX39A上游和下游引物序列分別為5′-CGTGCGGAATAGGAGCTTCAG-3′和5′-CTGCTTCTCGTGTGGTGTCA-3′,擴增大小為243 bp,以GAPDH為內參。反應條件為預變性95 ℃ 2 min;變性95 ℃ 15 s,退火60 ℃ 30 s,延伸72 ℃ 30 s,40個循環。采用2-ΔΔCt法計算原始Ct值數據。
1.2.4 Western blot法檢測食管鱗癌KYSE-150和TE-1細胞中DDX39A的蛋白表達水平 使用Western blot法檢測靶向DDX39A不同序列的3種特異性重組慢病毒感染KYSE-150和TE-1細胞后DDX39A的蛋白表達水平。RIPA裂解液裂解shCtrl組和shDDX39A組的食管鱗癌細胞,離心并收集上清,加入蛋白上樣緩沖液煮沸。根據DDX39A蛋白分子量大小配置好分離膠與濃縮膠后,將蛋白樣品上樣,在濃縮膠中進行電泳,分離,轉至PVDF膜上,用封閉液封閉,加入兔DDX39A一抗(稀釋度為1∶1 000)4 ℃過夜,TBST洗膜3次后加入HRP偶聯Rabbit IgG二抗(稀釋度為1∶5 000),孵育,TBST洗滌后加配制的ECL混合溶液(顯色液A液和B液按1∶1等體積配制),于暗室中曝光,化學發光儀顯影成像。
1.2.5 MTT法檢測食管鱗癌細胞KYSE-150和TE-1的細胞活力 將處于對數生長期的shCtrl組和shDDX39A組(shDDX39A-3,敲減效率較好)的食管鱗癌細胞KYSE-150和TE-1使用胰酶消化并離心后,RPMI-1640完全培養基重懸成細胞懸液,細胞計數儀計數。在96孔板接種含細胞2 000個/孔的100 μL細胞懸液,每組設5個復孔重復鋪板,待細胞完全沉淀后顯微鏡下觀察細胞密度,隨后放入培養箱中培養。鋪板后第2天開始,于培養終止前4 h每孔中加入20 μL 5 mg/mL的MTT,無需換液,4 h后完全吸去培養液,加入100 μL DMSO溶液溶解甲瓚顆粒。將待測96孔板置于振蕩器中振蕩2~5 min,避光條件下酶標儀490 nm和570 nm檢測OD值,進行數據統計分析。
1.2.6 Celigo法和克隆形成實驗檢測食管鱗癌細胞KYSE-150和TE-1的增殖能力 經慢病毒感染3 d后,將shCtrl組和shDDX39A組的KYSE-150和TE-1食管鱗癌細胞分別鋪于96孔板,鋪板數為1 500個/孔,每組3復孔,置于37 ℃、5% CO2培養箱培養。從鋪板后第2天開始,每天使用Celigo儀檢測讀板1次,連續檢測讀板5 d,計算出每次掃描孔板中帶綠色熒光的細胞的數量,進行統計分析,繪制細胞增殖曲線。
將shCtrl組和shDDX39A組的食管鱗癌細胞KYSE-150和TE-1制成單細胞懸液接種于6孔板(400~1 000個/孔),每組設3個復孔,培養到大多數單個克隆中細胞數大于50為止。每隔3 d進行換液并觀察細胞狀態。熒光顯微鏡下對細胞克隆進行拍照,PBS洗滌細胞1次。每孔加入1 mL 4%多聚甲醛,固定細胞60 min,PBS洗滌細胞1次。最后每孔加入結晶紫染液1 000 μL,染細胞10~20 min,ddH2O洗滌細胞數次,晾干,數碼相機拍照,計數統計分析。
1.2.7 FACS檢測食管鱗癌細胞KYSE-150和TE-1的凋亡水平 使用Annexin Ⅴ-APC單染法檢測細胞凋亡。胰酶消化shCtrl組和shDDX39A組的食管鱗癌細胞KYSE-150和TE-1,完全培養基重懸成細胞懸液,與上清細胞收集于同一5 mL離心管中,每組設3個復孔,1 300 r/min離心5 min,棄上清,4 ℃預冷的PBS洗滌細胞沉淀。1×binding buffer洗滌細胞沉淀一次,1 300 r/min、3 min離心,收集細胞。200 μL 1×binding buffer重懸細胞沉淀,使細胞懸液最終密度為1×106~1×107/ml。加入10 μL Annexin Ⅴ-APC染色,室溫避光10~15 min,上機檢測。
1.2.8 Transwell實驗檢測食管鱗癌細胞KYSE-150和TE-1的遷移和侵襲能力 使用Corning轉移試劑盒檢測細胞遷移能力。將小室置于24孔板中,上室加100 μL無血清培養基,37 ℃培養箱中放置1 h。將shCtrl組和shDDX39A組食管鱗癌細胞KYSE-150和TE-1制備成無血清細胞懸浮液,除去上室中的培養基后加入100 μL細胞懸液,下室內加入600 μL 30% FBS培養基。37 ℃培養箱培養,倒扣小室于吸水紙上以去除培養基,用棉拭子移去小室內非轉移細胞,將小室置于4%多聚甲醛固定液中固定半小時后,將小室撈出,用吸水紙吸干小室表面固定液,滴1~2滴染色液到膜的下表面染色轉移細胞1~3 min后,將小室浸泡沖洗數次,空氣晾干。每個Transwell小室隨機選取視野,拍照計數,進行數據分析。
使用Corning侵襲試劑盒檢測細胞侵襲能力。將小室置于24孔板中,上、下小室各加500 μL無血清培養基,37 ℃培養箱中放置2 h使Matrigel基質層再水化。將shCtrl組和shDDX39A組的食管鱗癌細胞KYSE-150和TE-1制備成無血清細胞懸浮液,待Matrigel基質層再水化完成后,將小室全部轉移至新的孔板中,除去上室中培養基并加入200 μL細胞懸液,下室內加入750 μL 30% FBS培養基。37 ℃培養箱培養后,倒扣小室于吸水紙上以去除培養基,用棉拭子移去小室內非侵襲細胞,滴2~3滴染色液到膜的下表面染色侵襲細胞3~5 min后,將小室浸泡沖洗數次,空氣晾干。每個小室隨機選取視野,拍照計數,進行數據分析。
1.2.9 免疫印跡實驗篩選DDX39A的下游分子 選擇包括AKT、mTOR、ERK、MYC、CDH2等在內的部分腫瘤相關經典通路分子,探究敲減DDX39A對其蛋白表達水平的影響。RIPA裂解液裂解shCtrl組和shDDX39A組食管鱗癌KYSE-150細胞,離心并收集上清,加入蛋白上樣緩沖液煮沸。根據各下游蛋白分子量大小配置好分離膠與濃縮膠后,上樣,進行電泳分離,轉至PVDF膜上,用封閉液封閉,加入各一抗稀釋液4 ℃過夜,TBST洗膜3次后加入二抗稀釋液,孵育,TBST洗滌后加配制的ECL混合溶液(顯色液A液和B液按1∶1等體積配制),于暗室中曝光,化學發光儀顯影成像。
1.2.10 回復實驗檢測過表達CDH2對shDDX39A細胞功能的回復作用 過表達Twist、c-Myc、Vimentin、CDH2這4個敲減DDX39A后蛋白表達明顯下調的分子,利用Celigo法探究其對DDX39A敲減細胞增殖能力的影響。實驗分組情況如下:①shCtrl+NC-OE組:轉染shCtrl慢病毒和過表達空載對照病毒的KYSE-150細胞;②shDDX39A+NC-OE組:轉染shDDX39A慢病毒和過表達空載對照病毒的KYSE-150細胞;③shDDX39A+Twist-OE組:轉染shDDX39A慢病毒和過表達Twist病毒的KYSE-150細胞;④shDDX39A+c-Myc-OE組:轉染shDDX39A慢病毒和過表達c-Myc病毒的KYSE-150細胞;⑤shDDX39A+Vimentin-OE組:轉染shDDX39A慢病毒和過表達Vimentin病毒的KYSE-150細胞;⑥shDDX39A+CDH2-OE組:轉染shDDX39A慢病毒和過表達CDH2病毒的KYSE-150細胞。Celigo法實驗方法同1.2.6。
在DDX39A敲減的食管鱗癌細胞KYSE-150中過表達CDH2(對DDX39A敲減細胞的增殖能力回復作用最明顯),按1.2.5和1.2.8項下內容利用MTT法以及Transwell實驗探究其對DDX39A敲減細胞的細胞活力以及轉移能力的影響。
1.3 裸鼠成瘤實驗探究敲減DDX39A對體內癌細胞的作用
將20只裸鼠分為2組,每組10只。取處于對數生長期的shCtrl和shDDX39A的KYSE-150食管鱗癌細胞制成懸液,分別注射于裸鼠右側腹股溝處,并分別命名為對照組(NC組)和DDX39A敲減組(KD組)。于接種細胞后第9天開始測量腫瘤的長短徑并計算腫瘤體積(腫瘤體積=π/6×長徑×短徑2),之后分別于第12,15,18天再次測量并記錄。至接種細胞后第21天處死小鼠,完整取出瘤塊測量長短徑、計算體積、稱重并白板拍照。
1.4 統計學分析
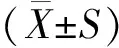
2 結果
2.1 DDX39A在食管鱗癌腫瘤組織中表達顯著上調
TCGA數據庫差異性分析結果顯示:DDX39A在食管鱗癌腫瘤組織中的表達明顯高于正常組織(P<0.001,見圖1A)。GEO數據庫GSE38129數據集的單基因表達分析結果顯示:相較于配對正常組織,DDX39A在食管鱗癌腫瘤組織中高表達(P<0.001,見圖1B)。

注:與癌旁組織相比,***P<0.001。圖1 DDX39A在食管鱗癌患者腫瘤組織和癌旁組織中的表達差異Figure 1 Differential expression of DDX39A in tumor tissues and paracarcinoma tissues from ESCC patients
2.2 DDX39A及其相關基因的富集分析
KEGG分析結果顯示:DDX39A及其相關基因主要參與RNA剪接、切除修復以及核糖體的生物合成等過程(見圖2A)。GSEA基因集富集分析的結果顯示,癌癥初始化(如原癌基因MYC標記)和細胞凋亡相關信號通路(如干擾素γ和PI3K-AKT信號通路)顯著富集(見圖2B)。

圖2 DDX39A及其相關基因的功能富集分析Figure 2 Functional enrichment analysis of DDX39A and its related genes
2.3 轉染慢病毒后食管鱗癌細胞中DDX39A的mRNA和蛋白水平
qPCR實驗結果表明:在KYSE-150細胞系中,shDDX39A-1組、shDDX39A-2組和shDDX39A-3組DDX39A基因的mRNA表達豐度分別為0.202,0.194和0.172;在TE-1細胞系中,shDDX39A-1組、shDDX39A-2組和shDDX39A-3組DDX39A基因的mRNA表達豐度分別為0.453,0.275和0.239(見圖3A)。免疫印跡實驗結果表明:在KYSE-150和TE-1細胞系中,shDDX39A-2組DDX39A蛋白表達水平相對最低,shDDX39A-3組DDX39A蛋白表達水平也相對較低(見圖3B)。綜合考慮后選擇敲減效率較好的shDDX39A-3組細胞進行后續實驗。
2.4 敲減DDX39A抑制食管鱗癌細胞的增殖能力和活力
通過Celigo法分別獲得了KYSE-150和TE-1細胞shCtrl組和shDDX39A組在不同時間點下細胞的生長情況,并繪制了基于細胞計數值的增殖曲線,結果顯示:與shCtrl組相比,shDDX39A組細胞的增殖顯著降低(P<0.001,見圖4)。克隆形成實驗結果表明:與shCtrl組相比,shDDX39A組細胞集落形成的數量明顯減少(P<0.01,見圖5)。MTT實驗結果提示:shDDX39A組具有活力的細胞數量較shCtrl組減少,細胞活力降低(P<0.001,見圖6)。

圖4 Celigo法檢測敲減DDX39A對KYSE-150和TE-1細胞生長的影響Figure 4 Effect of knocking down DDX39A on the growth of KYSE-150 and TE-1 cells detected by Celigo assay
2.5 敲減DDX39A促進食管鱗癌細胞凋亡
流式細胞術檢測結果顯示:shDDX39A組較shCtrl組發生凋亡的KYSE-150和TE-1細胞顯著增加(P<0.01,見圖7),提示DDX39A可抑制食管鱗癌細胞發生凋亡。
2.6 敲減DDX39A抑制食管鱗癌細胞遷移和侵襲
Transwell遷移實驗結果顯示:與shCtrl組相比,shDDX39A組發生遷移的KYSE-150和TE-1細胞數量降低,細胞的遷移能力受到抑制(均P<0.001,見圖8)。同樣,Transwell侵襲實驗的結果顯示:shDDX39A組侵襲至基質膠底部的細胞數較shCtrl組顯著減少(P<0.001,見圖9),表明敲減DDX39A也可抑制食管鱗癌細胞的侵襲能力。

注:與shCtrl組相比,***P<0.001。圖8 敲減DDX39A對KYSE-150和TE-1細胞遷移能力的影響Figure 8 Effect of knocking down DDX39A on migration abilities of KYSE-150 and TE-1 cells
2.7 在體內敲低DDX39A可抑制食管鱗癌腫瘤生長
裸鼠移植瘤實驗結果顯示:相比于NC組,KD組小鼠瘤體的體積和質量均明顯減少(P<0.001,見圖10),提示敲低DDX39A在體內也可抑制腫瘤的生長。

圖10 食管鱗癌細胞KYSE-150移植裸鼠成瘤情況 Figure 10 The tumorigenesis of esophageal squamous cell KYSE-150 transplanted nude mice
2.8 DDX39A下游作用分子的篩選
免疫印跡實驗結果顯示:食管鱗癌KYSE-150細胞中DDX39A基因敲減后,下游CDH2(Cadherin 2),Twist,c-Myc,Vimentin,p-p38,p-AKT蛋白表達明顯下調,而E-Cadherin蛋白表達明顯升高(見圖11)。選擇Twist、c-Myc、Vimentin、CDH2這4個下調相對明顯基因進行進一步篩選。基于Celigo法獲得的細胞增殖曲線可見,相比shCtrl+NC-OE組,shDDX39A+NC-OE組細胞增殖水平明顯減緩;相較于shDDX39A+NC-OE組,shDDX39A+Twist-OE組、shDDX39A+c-Myc-OE組和shDDX39A+Vimentin-OE組細胞增殖趨勢沒有明顯回復,shDDX39A+CDH2-OE組細胞增殖趨勢回復最明顯(P<0.001,見圖12)。

圖11 KYSE-150細胞敲減DDX39A后部分腫瘤相關經典通路分子的蛋白表達水平Figure 11 Protein expression levels of tumor-associated classical pathway molecules in KYSE-150 cells after knocking down DDX39A
2.9 下游基因CDH2對目的基因DDX39A的功能回復作用
細胞增殖活力檢測結果顯示:相比shCtrl+NC-OE組,shDDX39A+NC-OE組KYSE-150細胞活力降低(P<0.001);與shDDX39A+NC-OE組相比,shDDX39A+CDH2-OE組細胞活力增加(P<0.001,見圖13)。Transwell實驗結果表明:相比shCtrl+NC-OE組,shDDX39A+NC-OE組KYSE-150細胞轉移能力減弱(P<0.001);而相比于shDDX39A+NC-OE組,shDDX39A+CDH2-OE組細胞的轉移能力增強(P<0.001,見圖14)。

注:與同時點shCtrl+NC-OE組相比,###P<0.001;與同時點shDDX39A+NC-OE組相比,**P<0.01,***P<0.001。圖13 MTT法檢測過表達CDH2對DDX39A敲減細胞活力的影響Figure 13 Effect of overexpressing CDH2 on viability of KYSE-150 cells after DDX39A knockdown detected by MTT assay
3 討論
食管癌是臨床難治性惡性腫瘤之一,發病率高且早期癥狀不典型,盡管手術切除、放化療、免疫治療等治療方式不斷完善,但因其惡性程度較高,一部分患者在治療后仍可復發,提示預后不良[13]。近年來隨著分子生物學技術的不斷進步,遺傳分子水平因素在腫瘤發病機制中扮演的角色越來越受到關注[14]。有研究表明DDX39A在部分腫瘤中高度表達并與患者的預后相關,然而其在食管癌中的作用目前尚未報道。因此,本研究進行了生物信息學分析及細胞功能學相關實驗,旨在探究DDX39A在食管癌中的表達及其對食管癌細胞生物學行為的影響和潛在的分子機制。
首先通過生物信息學方法證實了DDX39A在食管鱗癌中表達顯著上調,進一步對DDX39A及其相關基因的富集分析提示DDX39A主要參與遺傳信息的翻譯與加工和細胞凋亡等過程。隨后的Celigo法、克隆形成和MTT實驗顯示敲減DDX39A在體外可降低食管鱗癌細胞的增殖能力和活力。流式細胞分析的結果顯示下調DDX39A的表達可以促進癌細胞發生凋亡。Transwell實驗表明敲減DDX39A還可以抑制食管鱗癌細胞的遷移、侵襲能力。此外,我們還構建了移植瘤模型,證實了敲低DDX39A在裸鼠體內也可抑制腫瘤的生長。
先前大量的研究已表明,DEAD-box家族的蛋白可以促進癌細胞的異型增生和惡性轉化[15],但其中具體的機制尚不清楚。作為DEAD-box家族中的一員,Karni等[16]曾報道DDX39可能通過與其他剪接因子如SF2/ASF相互作用而發揮致癌作用。Su-giura等[17]提出DDX39和CIP29(一種增殖與凋亡調節蛋白)結合形成的復合物可以通過與RNA結合蛋白FUS/TLS結合來調節細胞周期。此外,Pérez-Calero等[18]的實驗結果提示UAP56/DDX39是維持RNA結構穩定的關鍵螺旋酶,干擾其合成可阻斷癌細胞的轉錄和復制。本研究對下游可能作用分子的免疫印跡實驗顯示敲減DDX39A后,CDH2,Twist,c-Myc,Vimentin蛋白表達明顯下調,而E-Cadherin蛋白表達明顯升高,提示DDX39A很可能通過誘導上皮間充質轉化促進腫瘤細胞的生長、遷移與侵襲。回復實驗結果顯示,過表達CDH2對DDX39A敲減細胞的增殖趨勢回復最明顯,且過表達CDH2的MTT和Transwell等實驗均表明下游基因CDH2對目的基因DDX39A有功能回復作用,這表明CDH2很有可能是DDX39A促EMT的直接作用靶點,但相關具體機制仍需進一步探究。
總之,本研究首次揭示了DDX39A可通過調控EMT相關通路影響食管鱗癌細胞的惡性生物學行為,這將為后續分子機制的研究以及尋找有效的抗癌靶點提供參考。

