提高玉米秸稈飼料化品質的食用菌篩選
黃泰富, 于洪文,3, 黃利春, 韓雪容,2
(1.長春理工大學生命科學技術學院,吉林 長春 130000;2.吉林農業大學食藥用菌教育部工程研究中心,吉林 長春 130000;3.中國科學院東北地理與農業生態研究所,吉林 長春 130000;4.興安盟農牧科學研究所,內蒙古 烏蘭浩特 137400)
我國作為一個農業生產大國, 農作物生物質副產物秸稈年產量近9 億t (石祖梁等,2019)。2022 年全國農作物秸稈中玉米秸稈占比40.27%,但因其纖維素等難以被消化,其中的養分吸收利用率低,動物采食率較低,適口性差,只能作為動物的劣質粗飼料使用(李岫峰等,2022)。研究發現,食用菌有較強降解木質素的能力,且食用菌發酵不存在明顯的安全問題 (尹珺伊等,2022; 叢立新,2014)。 在實際的食用菌栽培中杏鮑菇、 平菇和金針菇等多種常見食用菌菌糠可直接作為飼料或飼料添加劑(馮雪彬等,2021)。王雨瓊等(2021)選用3 株分別為粉褶側耳,糙皮側耳和漏斗狀側耳的側耳屬白腐菌發酵飼料, 發現其能夠有效改善發酵青稞秸稈的營養品質, 提高秸稈的利用效率。 綜上所述,食用菌具有分解稻草、玉米等秸稈中木質纖維素的能力, 同時在其自身生長發育過程中可產生多糖、 蛋白質和脂肪酸等多種營養成分, 作為秸稈飼料化營養配方改良用真菌前景廣闊。 然而直接將食用菌作為秸稈等生物質的添加菌劑發酵培養的研究較少, 缺乏相關食用菌用作提高玉米秸稈飼料品質的基礎數據。
本研究擬對經粗篩降解酶系酶活較高, 且生長速率快的8 株食用菌使用ITS 條形碼進行鑒定,再以玉米秸稈為唯一碳源作為培養料,通過比較該8 株食用菌對玉米秸稈中木質纖維素的降解率,對比粗蛋白質、粗脂肪、鈣和磷等含量,并采用掃描電鏡能譜儀觀察玉米秸稈結構的微觀形態學,篩選出能高效降解玉米秸稈木質纖維素,同時能提高飼料化玉米秸稈營養價值的食用菌菌株,為高效利用玉米秸稈提供參考和基礎數據支持。
1 材料與方法
1.1 試驗材料 供試菌種: 分別編號為S1 ~S8的8 株食用菌由吉林農業大學提供。 玉米秸稈在吉林省長春市長春新區周邊玉米地獲得。
1.2 培養基 PDA 固體培養基 (劉紅菊等,2018):馬鈴薯去皮切小塊200 g,煮沸30 min 過濾,葡萄糖20 g,瓊脂粉20 g,去離子水定容至1 L,pH 自然,115 ℃高壓滅菌30 min。 秸稈培養料配方:玉米秸稈粉(40 目)99.9%,多菌靈0.1%。
1.3 試劑及儀器 儀器:Synergy HIM 全功能微孔檢測儀(美國Biotek 公司);5430R 臺式冷凍離心機(德國Eppendorf 公司);SKGL-1200 管式爐(中國中科院上海光學精密機械研究所);BSA224S-CW 分析天平(德國Sartorius 公司);連續流動分析儀SAN++(荷蘭Skalar);5PrimeG/02基因擴增儀(比比科技有限公司);IT-500 掃描電鏡能譜儀 (日本JEOL 株式會社);Vario MACRO cube 元素分析儀(德國Elementar 公司)。
試劑: 生工SK8259 Ezup 柱式真菌基因組DNA 抽提試劑盒、 瓊脂糖、TAE、TaqDNA 聚合酶、通用引物ITS1 及ITS4、5×PCR Buffer、dNTP 和DNA Ladder Mix maker 購自上海生工生物工程技術服務有限公司,Gel Extraction Kit 瓊脂糖凝膠DNA 回收試劑盒購自康為世紀生物科技有限公司。
1.4 試驗方法
1.4.1 8 種食用菌菌株培養 將8 種食用菌菌株(S1 ~S8)分別接種在PDA 固體培養基中,于搖床27 ℃恒溫培養7 d。
1.4.2 菌種基因組DNA 提取方法 待PDA 培養基上長滿菌絲后, 用鑷子分別挑取8 種食用菌菌絲20 mg, 采用上海生工SK8259 Ezup 柱式真菌基因組DNA 抽提試劑盒提取各菌株的DNA。
1.4.3 8 株菌種ITS 條形碼的PCR 擴增與測序用真菌通用引物ITS1/ITS4(由上海生物工程有限公司合成)進行PCR 擴增。 ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTAT TGATATGC-3’。
PCR 反應體系(25 μL):基因組DNA 0.5 μL,5×PCR Buffer(含MgCl2)2.5 μL,dNTP(2.5 mmol/L)1 μL,F Primer 0.5 μL,R Primer 0.5 μL,Taq DNA聚合酶0.2 μL,最后加ddH2O 補至總體積為25 μL。PCR 反應條件:94 ℃預變性4 min,94 ℃變性45 s,55 ℃退火45 s,72 ℃延伸1 min,共36 個循環,再72 ℃延伸10 min,4 ℃保存。
在凝膠成像系統中觀察經瓊脂糖凝膠電泳后的PCR 產物,用小刀切下8 條編號為S1 ~S8,長度為600 ~700 bp 的條帶, 采用Gel Extraction Kit 瓊脂糖凝膠DNA 回收試劑盒回收目的PCR產物,于上海生工生物工程有限公司測序。
1.4.4 8 株菌株分子系統發育樹構建 將經公司測序后擴增的8 條ITS 序列輸入NCBI 數據庫,經BLAST 比對,選取與鑒定菌種相似度在99%以上序列,用MEGA5.0 構建系統發育樹,系統發育分析采用MEGA 5.0 中的鄰近相鄰法(NJ)構建、分析。各分支的置信度經bootstrap 1000 次循環檢驗各分支的系統學意義與可靠性。
1.4.5 8 株菌種與玉米秸稈共培養 將PDA 上培養的S1 ~S8 菌每組取三個相同菌塊, 分別接種在過40 目篩, 經121 ℃、30 min 蒸汽高壓處理后, 含有1.5 L 玉米秸稈培養料的2 L 體積燒杯中,空白試驗組為不接種食用菌的秸稈培養料。 在27 ℃,培養28 d 后,將每個試驗組的降解后玉米秸稈培養料全部取出,均勻混合,放于50 ℃烘箱干燥4 h,研磨過40 目篩。每個試驗組收集100 g 樣品供后續試驗使用。
1.4.6 培養料中纖維素、半纖維素、酸性洗滌木質素含量的測定 采用Van Soest(Tian 等,2017)法測定纖維素、半纖維素、木質素含量。
1.4.7 經8 株菌株分解的玉米秸稈掃描電鏡分析每個試驗組取樣品質量1.0000 g, 同組試驗的三個樣品均勻混合,重新標號為a ~i。9 組樣品用研缽研磨成粉末狀,用牙簽挑取少許處理后樣品,在銅臺上用導電膠粘好后放入離子鍍膜儀上噴鍍黃金,再用IT-500 掃描電鏡能譜儀,在真空條件下觀察拍照。
1.4.8 經側耳屬真菌處理后的玉米秸稈粗脂肪含量檢測 采用索氏抽提法(Huijun 等,2022)測定培養料中粗脂肪含量。
1.4.9 經8 株菌株處理后的玉米秸稈元素含量檢測 全氮測定方法:LY/T1269-1999 森林植物與枯枝落葉層全氮的測定。 準確稱取磨細的樣品0.3000 g 于三角瓶中,加1.8 g 催化劑(硒粉:硫酸銅:硫酸鉀=1:10:100),加4 mL 濃硫酸,于電熱板上消煮至溶液清亮即可,取下冷卻后轉入100 mL容量瓶中,蒸餾水定容,搖勻待測。 待測液用連續流動化學分析儀(SKALAR SAN++)測定。
全N/(mg/kg)=測值×100/樣重。
鈣元素測定方法:LY/T1270-1999 電感耦合等離子體發射光譜(ICPS-7500)ICP-AES 法。 稱取風干磨碎的樣品0.5 g 于三角瓶中,加5 mL 濃HNO3,2 mL HClO4, 于電熱板上消煮至溶液變成透明, 有少量白煙。 取下冷卻, 加2.5 mL 10%HNO3,轉入50 mL 容量瓶中,用去離子水定容,搖勻待測,同時做空白試驗。待測液用電感耦合等離子體發射光譜(ICPS-7500) 或電感耦合等離子體質譜(NeXion350D)測定。
鈣/(mg/kg)=(測值-空白)×50/樣重。
植物全磷采用LY/T1270-1999 連續流動分析儀(SAN++)測定。 準確稱取粉碎的樣品0.3000 g于三角瓶中,加5 mL HNO3,2 mL HClO4,于電熱板上消煮至透明,取下冷卻,轉入100 mL 容量瓶中,用蒸餾水定容,搖勻待測。 待測液用連續流動化學分析儀(SKALAR SAN++)測定。
全磷/(mg/kg)=測值×100/樣重。
計算培養料粗蛋白質含量; 以上每個處理設3 次重復。
1.5 數據統計分析 采用Excel 軟件和SPSS 20.0 軟件進行數據統計分析,結果以“平均值±標準差”表示,以P<0.05 作為差異顯著性判斷標準。
2 結果與分析
2.1 基于ITS 系統發育樹的8 種菌株分類 8 個獲得的ITS 序列測序結果在GenBank 中進行對比后,得到同源性較高菌株的ITS 序列。同時下載16 個具有代表性菌株序列與本試驗所測的8 個菌株ITS 序列用MEGA5 軟件采用鄰近相鄰法構建系統發育樹,結果見圖1。
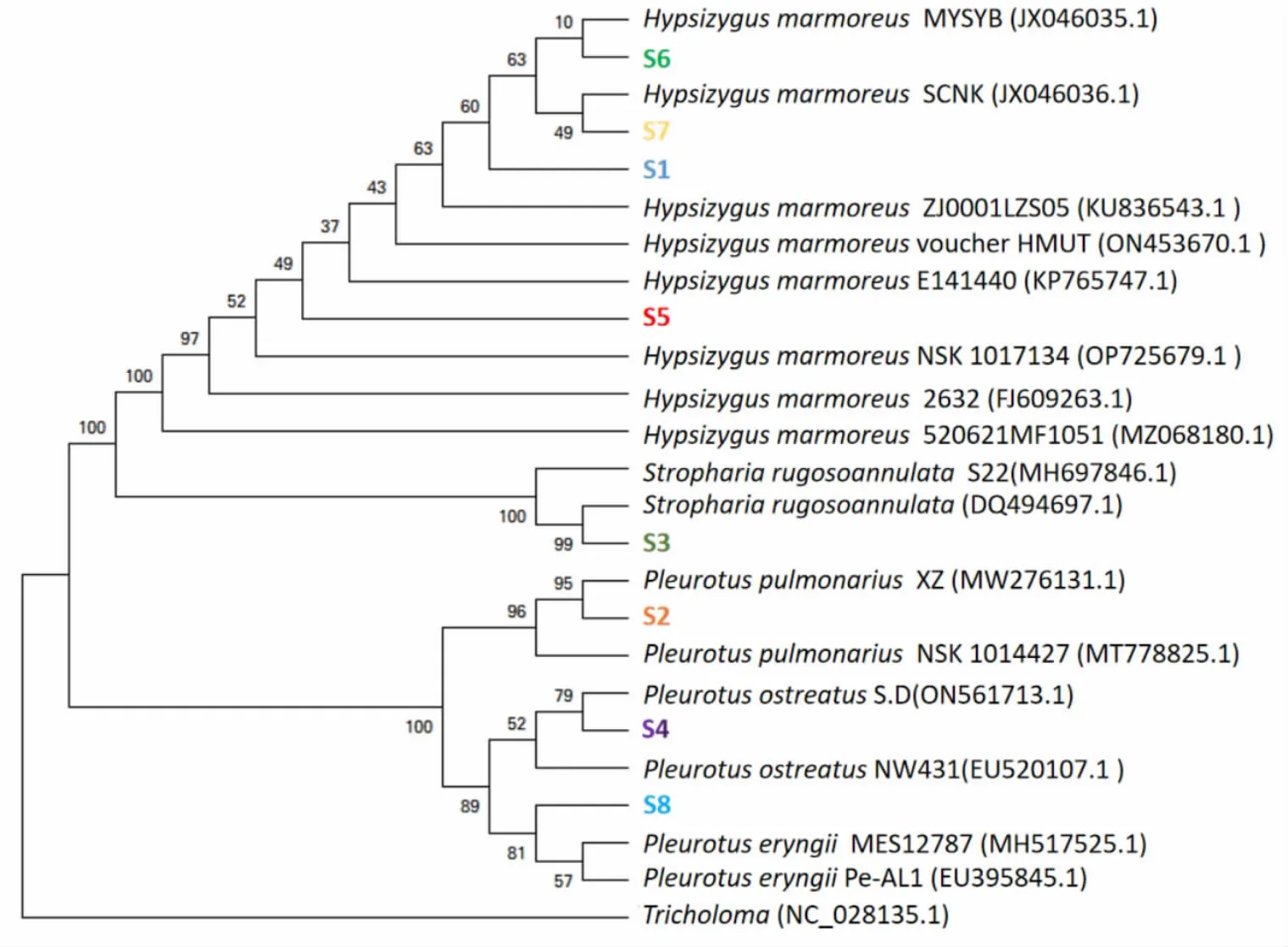
圖1 S1 ~S8 食用菌及其參考菌株ITS 序列的系統發育樹
由圖1 可知, 菌株S1、S5、S6 和S7 分別與Hypsizygus marmoreus(KU836544.1,MK966519.1,JX046017.1,JX046031.1) 同源性為 100% 、99.82%、100%和100%,以上菌株被鑒定為斑玉蕈(Hypsizygus marmoreus)。 菌株S2 與Pleurotus pulmonarius(MN244439.2)同源性為100%,被鑒定為肺形側耳(Pleurotus pulmonarius)。菌株S3 與Stropharia rugosoannulat(MN622796.1)同源性為100%,被鑒定為大球蓋菇(Stropharia rugosoannulat)。 菌株S4 與Pleurotus ostreatus(MN244441.2)同源性為100%,被鑒定為糙皮側耳(Pleurotus ostreatus)。菌 株 S8 與Pleurotus eryngii(MH517524.1)同源性為100%,被鑒定為刺芹側耳(Pleurotus eryngii)。
2.2 8 株菌株與玉米秸稈共培養后的木質纖維素含量及營養成分變化
2.2.1 玉米秸稈中酸性洗滌木質素、纖維素、半纖維素含量 在接種了8 株食用菌28 d 后,玉米秸稈纖維素、半纖維素、酸性洗滌木質素和營養成分含量變化見表1,與不接種食用菌的對照組相比,秸稈培養料中的纖維素、 半纖維素和酸性洗滌木質素顯著降低。8 株菌對纖維素降解中,S4 號菌株降解效果最好達到了48.4%, 其次是S7 號菌株,達27.35%。 對半纖維素降解中,S1 號菌株降解效果最好達到了62.85%, 其次是S5 號菌株,達60.15%。 對酸性洗滌木質素降解中,S4 號菌株降解效果最好達到了71.2%, 其次是S8 號菌株,達53.79%。 綜合比較玉米秸稈各組降解率,糙皮側耳的S4 菌株降解秸稈能力最強。
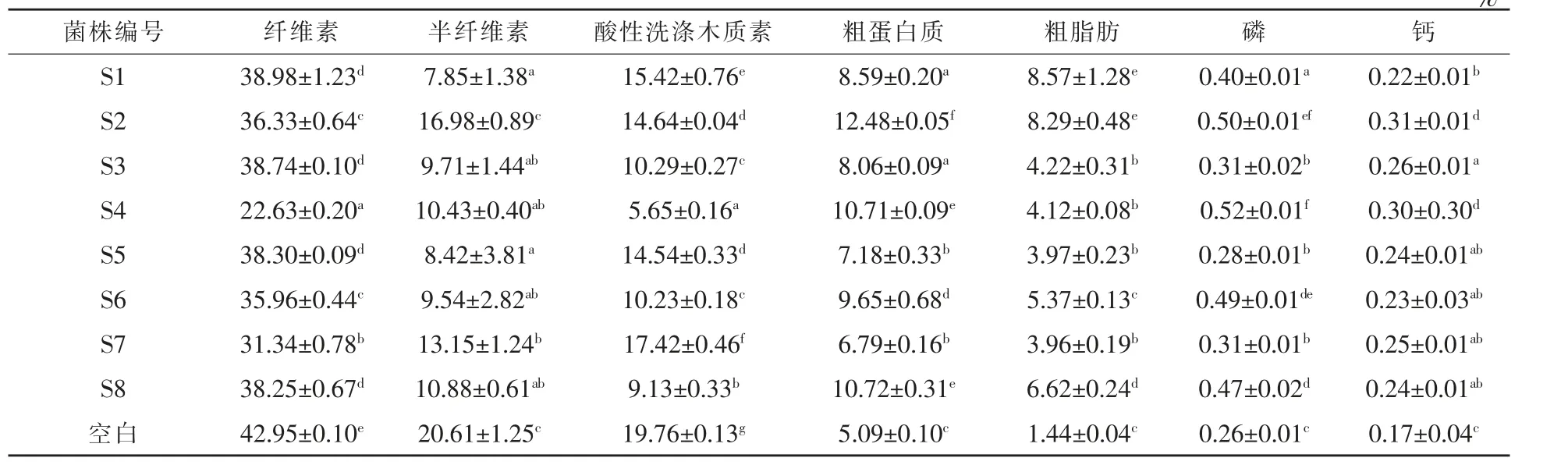
表1 食用菌對秸稈木質纖維素含量及營養成分的影響 %
2.2.2 培養料中營養成分含量 由表1 可知,在接種了8 株食用菌28 d 后,和不接種食用菌的空白對照組相比, 秸稈培養料中的營養元素均有明顯提升。 粗蛋白質含量,S2 號菌株提升效果最好,提升了145%,其次是S8 號和S4 號菌株,粗蛋白質含量提升了111%和110%。 粗脂肪含量,S1 號菌株提升效果最好,提升了495%,其次是S2 號菌株,粗脂肪含量提升了476%。 鈣含量,S2 號菌株提升效果最好, 提升了82%, 其次是S4 號菌株, 提升了76%。 磷含量,S4 號菌株提升效果最好,磷含量提升了100%,其次是S2 號菌株,磷含量提升了92%。
2.3 與8 株食用菌菌株共培養后玉米秸稈的微觀結構變化 在玉米秸稈培養料接種食用菌28 d后, 采用掃描電鏡觀察玉米秸稈結構的微觀形態學變化(圖2)。 圖2a 為玉米秸稈,纖維組成部分排列十分清晰,結構緊密,表面較為光滑。圖2b ~圖2i 分別對應S1~S8 號食用菌與玉米秸稈共培養后的掃描電鏡, 均觀察到秸稈結構受到不同程度破壞的微觀形貌,其中S3、S6 試驗組(圖2d、圖2g)中能觀察到秸稈結構嚴重受損,秸稈相互交錯且界限模糊,S4、S8(圖2e、圖2i)中能觀察到秸稈暴露出中間層的木質纖維素骨架。
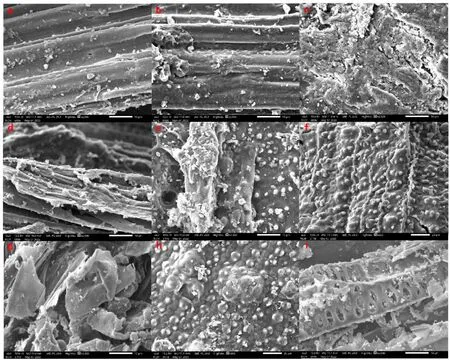
圖2 S1 ~S8 對玉米秸稈的結構影響
3 討論
目前已有研究表明, 飼料復合酶添加劑比單一酶添加劑發酵效果好, 但是復合菌制劑對發酵條件要求高,工藝繁瑣,生產成本高,還可能存在拮抗和抑制的情況(李國祥等,2022)。食用菌通過分泌各種降解酶降解玉米秸稈各組分, 且降解效果優于復合酶添加劑(司徒成等,2022)。本研究中鑒定為糙皮側耳的S4 菌株降解秸稈能力最強,Wan 等(2010)研究中白腐真菌Ceriporiopsis subvermispora降解玉米秸稈的木質素降解率為31.59%,對纖維素的降解率低于6%(18d)。 甄靜等(2017)研究中Trametes hirsutaXYG422 在玉米秸稈中培養60 d 后,木質素、纖維素和半纖維素的降解率分別為83.54%、50.65%和19.53%。該菌在培養28 d 后對玉米秸稈中纖維素、半纖維素和木質素降解率可達48.40%、48.89%和71.2%。 通過掃描電鏡能譜儀觀察玉米秸稈微觀層面降解,SEM 結果顯示,食用菌降解后的玉米秸稈帚化嚴重,可見其結晶度明顯降低,與郭曉威等(2017)研究結果一致, 可以證明食用菌能明顯降低玉米秸稈的結晶度,提高適口性。粗蛋白質含量是衡量飼料品質的重要指標。 本試驗結果表明,接種S2 菌株發酵28 d 飼料粗蛋白質含量可達12.48%,相比未接種食用菌粗蛋白質含量提升了145%。 對比秸稈氨化,微貯50 d,飼料中粗蛋白質含量為8.89%和5.67%, 相對只提升了70.31%和8.6%。(楊勤等,2015)。 而Pleurotus ostreatus F6 處理秸稈30 d 后粗蛋白質含量提升了151%(Bhuvnesh等,2011),本研究結果與之接近。同時食用菌中含有豐富的氨基酸、多糖、多肽、皂甙和多種微量元素,可以通過調節畜牧腸道微生物群,發揮抗菌、增強免疫力作用(郭遠等,2022;劉啟燕等,2019;袁建國,2010)。
4 結論
綜上所述,食用菌發酵玉米秸稈是可行的,且不同菌種效果不一。 本研究證實糙皮側耳菌是發酵飼用玉米秸稈的優勢菌株, 該菌株具有較高的木質素降解能力,可改善玉米飼料的適口性,同時能顯著提高飼料粗蛋白質等營養元素含量。 糙皮側耳有作為玉米秸稈飼料改良菌的極大潛力。

