21色流式檢測人非小細胞肺癌組織中免疫細胞亞群方案的建立
郭婷婷 謝鴻觀
肺癌是全球發病率極高的癌癥之一,也是癌癥相關死亡的主要原因,每年約2萬新發病例和1.76萬死亡病例[1]。肺癌主要分為小細胞肺癌(small cell lung cancer, SCLC)和非小細胞肺癌(non-small cell lung cancer, NSCLC),其中NSCLC約占85%[2]。NSCLC由于早期癥狀不明顯,多數發現時已屬中晚期狀態,且易對化療和放療抵抗,致5年生存率僅為10%-20%[3]。而肺癌的發生和進展與免疫微環境的改變相關,因此通過檢測肺癌組織中免疫細胞亞群的比例可監測疾病的進展及預后等[4,5]。
目前,流式細胞術能快速進行各種免疫細胞量和功能的檢測[6],對臨床診斷與治療具有指導意義[7]。常規流式方案分析的參數少,需要多管聯合分析,細胞需求量大,耗時較長,結果不夠穩定及準確,解析各細胞亞群之間和細胞表型相互關系的能力弱[8]。隨著流式細胞儀的更新換代,檢測的熒光通道增加,多參數流式細胞術的優勢逐漸顯現出來[9]。多色流式能快速準確并穩定地檢測多個指標,從而識別出罕見細胞群體,為疾病的診斷、藥物開發提供強大的工具[10]。因此,本實驗建立了在單管中加入20種熒光抗體和1種熒光染料以檢測人肺癌組織中免疫細胞主要亞群的流式檢測方案,可實現單管同時分析人肺癌組織中多種免疫細胞的表達和細胞亞群間的關聯,并同時呈現免疫細胞功能與分化狀態。現報道如下。
1 資料與方法
1.1 材料
1.1.1 實驗材料 6份健康志愿者外周血樣本和6例肺癌樣本取自四川大學華西醫院,肺癌患者病理診斷均為NSCLC。受試者均簽署知情同意書。
1.1.2 試劑 熒光抗體分化簇(cluster of differentiation, CD)3、CD19、CD27、CD69、CD56、CD8、CD25、CD127、趨化因子受體8(chemokine receptor 8, CCR8)、CD39、CD11c、CD62L、CCR7、CD45RA購自美國BD公司;CD45、CD4、CD38、CD103、人類白細胞抗原(human leukocyte antigen,HLA)-DR、程序性死亡受體1(programmed cell death 1,PD-1)購自Biolegend公司;LIVE/DEAD Fixable Blue Dead Cell Stain(L/D)、BV stain buffer購自Sigma-Aldrich公司;胎牛血清(FBS, 500 mL, 319801-5)購自ZETA LIFE公司;IV型膠原酶(50 U/mL, 17104-019)購自Thermo Fisher公司;脫氧核糖核酸酶I(DNase I, 20 U/mL, 10104159002)購自Roche公司。
1.1.3 儀器 Symphony A5流式細胞儀(美國BD Bioscience)配置355、405、488、561、640 nm激光器。
1.2 方法
1.2.1 抗體或熒光素搭配 根據流式細胞儀的配置,包括激光和檢測濾片等以及多色流式中抗原抗體結合的強弱搭配原則,即強表達抗原選擇弱熒光素抗體,反之。通過多次預實驗找到抗體與熒光素的最佳搭配方案。表1為所需抗體信息。

表1 21色流式檢測人肺癌組織中免疫細胞亞群方案Tab 1 The 21-color panel for flow cytometry of leukocytic subsets in human lung cancer tissue
1.2.2 樣本采集
1.2.2.1 外周血樣本處理 選取6名健康成年志愿者,男女各3名,年齡范圍25-30歲。采集外周靜脈血5 mL于含有EDTA抗凝劑的真空采血管中,顛倒混勻,轉移到離心管中,以1:1比例,將外周血緩慢加入Ficoll液中,4oC、800g離心20 min,吸取白膜層于5 mL RPMI-1640中,4oC、500g離心7 min,棄上清。PBS清洗,4oC、500g離心5 min,獲取外周血單個核細胞(peripheral blood mononuclear cells,PBMCs)。將細胞重懸于PBS,計數后備用[11]。
1.2.2.2 肺癌組織樣本處理 收集NSCLC樣本,共6例。手術切除的NSCLC樣本,盡量去除壞死組織,PBS沖洗,置于10% FBS+RPMI-1640中,冰上運輸。提前配置10 mL 0.5 mg/mL IV型膠原酶+RPMI-1640和10 mL 2%FBS+RPMI-1640,冰上預冷,待組織取回后,將組織置于2%FBS+RPMI-1640中,剪取約5 mm×5 mm×5 mm,盡量剪碎,加入5 mL消化酶,37oC培養箱旋轉消化30 min。消化完成后,4oC、100g離心1 min,將未消化的組織離心到管底,吸取上清。加入1倍體積的2% FBS+RPMI-1640終止消化,70 μm濾網過濾,4oC、500g離心5 min、去上清。1 mL 2%FBS+RPMI-1640重懸,40 μm濾網過濾,將細胞懸液調節成1.0×107個/mL備用[12]。
1.2.3 抗體濃度滴定 方案里的所有抗體均進行濃度滴定,共設立6個抗體的工作濃度梯度,分別為0.0、0.5、1.0、2.0、4.0及8.0 μg/mL,根據反應體系(100.00 μL)及質量濃度(200.00 μg/mL)分別加入各對應的抗體體積,即0.00、0.25、0.50、1.00、2.00和4.00 μL。以CD4抗體滴定為例,準備6支流式管,通過倍比稀釋的方法,在第1管中加入96 μL PBS,其余5管中分別加入50 μL PBS。于第1管中加入4 μL CD4抗體,充分混勻后吸出50 μL至第2管,依次加入第5管,混勻后取50 μL混合液丟棄,第6管則作為空白對照組。各管中均加入50 μL已準備好的細胞懸液,完全混勻后室溫避光孵育15 min,加入1 mL PBS,500g離心5 min清洗。棄上清,300 μL PBS重懸,上機檢測,收集約106個Events,Flowjo 10.8.0軟件分析,計算CD4的染色指數(stain index,SI)。選取最大SI值,即陽性與陰性細胞群分離度最大的值為該抗體最適濃度。其余抗體滴定及結果分析均依照此方法進行。
1.2.4 電壓優化、減一色對照及單色染色 在流式檢測過程中,以空白對照組確定基準電壓,后在此基礎上依次增加40 V,共檢測6個不同的電壓值,再通過計算SI值找到該抗體最適電壓,即SI值最大時的電壓值。減一色染色指不加多色染色方案中某一種抗體或染料,驗證其余抗體或染料對該相應通道的影響。單色染色為確定每個抗體或染料的最佳質量濃度后,并用于檢測通道的補償調節。
1.2.5 流式方案驗證 根據已確定好的流式檢測條件,檢測分析6例健康人PBMCs。將6份抗體及染料混合于300 μL PBS中,再分別加50 μL于各管中,分別加入已準備好的50 μL細胞懸液并充分混勻,室溫避光孵育15 min,加入1 mL PBS,500g離心5 min,清洗,棄上清,300 μL PBS重懸,上機檢測,收集約106個Events,Flowjo 10.8.0軟件分析。
1.2.6 樣本檢測 根據已確定好的流式檢測方案,檢測分析6例人NSCLC組織樣本。將20種熒光抗體和L/D染料按滴定好的濃度混合于50 μL PBS中,加入已準備好的50 μL細胞懸液并充分混勻,室溫下避光孵育15 min,加入1 mL PBS,400g離心5 min,清洗,棄上清,300 μL PBS重懸,上機檢測,至少收集106個Events,Flowjo 10.8.0軟件進行流式數據分析。
1.3 統計學分析 采用Flowjo 10.8.0(BD, USA)對數據進行分析。通過Flow AI軟件包去除質量較差的細胞;R-tsne軟件包進行降維分析;數據呈現為軟件導出;呈正態分布的連續變量以均數±標準差(Mean±SD)表示。
2 結果
2.1 抗體滴定 根據SI值,該體系下CD4抗體加入的體積為0.25 μL,工作濃度為0.50 μg/mL時,SI值最大,陰性群和陽性群分離度最大;CD45、CD3、CD19、CD8、CD25、CD127、CD39、CD103、CCR8、CD38、CD69、CD27和CD56抗體加入體積均為1 μL,則工作濃度為2.00 μg/mL;CD45RA、CCR7、CD62L、HLA-DR、CD11c和PD-1抗體加入體積均為2 μL,工作濃度為4.00 μg/mL;L/D染料工作濃度為0.10 μg/mL。如圖1A所示,加入0.25 μL CD4抗體時為最適工作濃度。

圖1 CD4抗體最適質量濃度的選擇(A)和最適電壓選擇(B)Fig 1 Optimal mass concentration (A) and optimal voltage (B) of CD4 antibody
2.2 檢測電壓優化、補償調節 根據得到的各個通道的SI值,確立了CD45、CD3、CD19、CD4、CD8、CD39、CD103、CD25、CD127、CCR8、CD56、CD11c、HLA-DR、CD62L、CD45RA、CCR7、CD69、CD38、CD27、PD-1抗體和L/D染料檢測通道的電壓為430、510、410、530、550、530、540、550、550、520、450、420、550、300、400、380、460、390、530、480和450 V。圖1B為CD4抗體電壓滴定結果,其余抗體均按此方法進行。補償調節可先通過自動補償進行調節,后再用單染樣本調節并通過全染的樣本進行驗證。
2.3 樣本檢測與分析 已確定的流式檢測方案對6名健康成年人外周血及6例人NSCLC組織進行檢測,主要細胞亞群比例見表2。流式分析過程見圖2,圖2A為PBMCs設門步驟,圖2B為肺癌組織設門步驟。分別通過Time參數設門選擇信號穩定的細胞群進行分析;根據FSC-A/SSC-A設門以去除碎片和部分死細胞;FSC-A/FSCH設門,去除粘連細胞;L/D陰性為活細胞;CD45和L/D選擇CD45+L/D-細胞群進行后續分析。圖3為PBMCs和肺癌組織主要亞群分析策略,圖3A為PBMCs分析策略,圖3B為肺癌組織分析策略,分別選取CD45+活細胞,進行T細胞、B細胞、自然殺傷(natural killer, NK)細胞、樹突狀細胞(dentric cell,DC)以及B細胞亞群漿細胞(plasma cells)、組織駐留B細胞(resident memory B cells, Brm)、記憶B細胞(memory B cells)等細胞群的分析。圖4來源細胞為CD4+/CD8+T細胞的亞群進一步分析,圖4A為PBMCs分析,圖4B為肺癌組織分析,包括調節性T細胞(regulatory T cells, Tregs)和CD4+中央記憶細胞(central memory cells, Tcm)CD8+腫瘤浸潤T細胞(tumor-infiltrating lymphocytes CD8, CD8 TILs)、PD-1分析及CD8+組織駐留細胞(tissue resident memory cells,Trm)的分析,以及CD4+初始T細胞(naive T cells, Tn)、效應記憶型T細胞(effector memory T cells, Tem)、中央記憶型T細胞(central memory T cells, Tcm)的檢測。圖5為t-SNE分析,選擇L/D-和CD45+細胞群,分析結果。圖5A為肺癌組織中除L/D和CD45外的19個抗體在腫瘤組織上的表達情況,包括T細胞、B細胞、NK細胞和Treg細胞亞群的分布情況,為整合后的6個肺癌樣本。可見T細胞為CD3+,B細胞為CD19+,CD11c主要表現在非淋巴細胞;CD4和CD8高表達在T細胞;CD25、CD127和CD103主要在T細胞表達;CD38只在B細胞表達;CD27、CD39、HLA-DR、CD45RA、CCR7、CD62L和CD69在多個細胞群有表達。其中,CD25+CD127-則為Treg細胞;CD19+CD38+CD27+為漿細胞;CD11c+HLA-DR+為DC細胞;CD8+CD39+CD103+為CD8 TILs細胞;CD8+CD69+CD103+為Trm細胞。
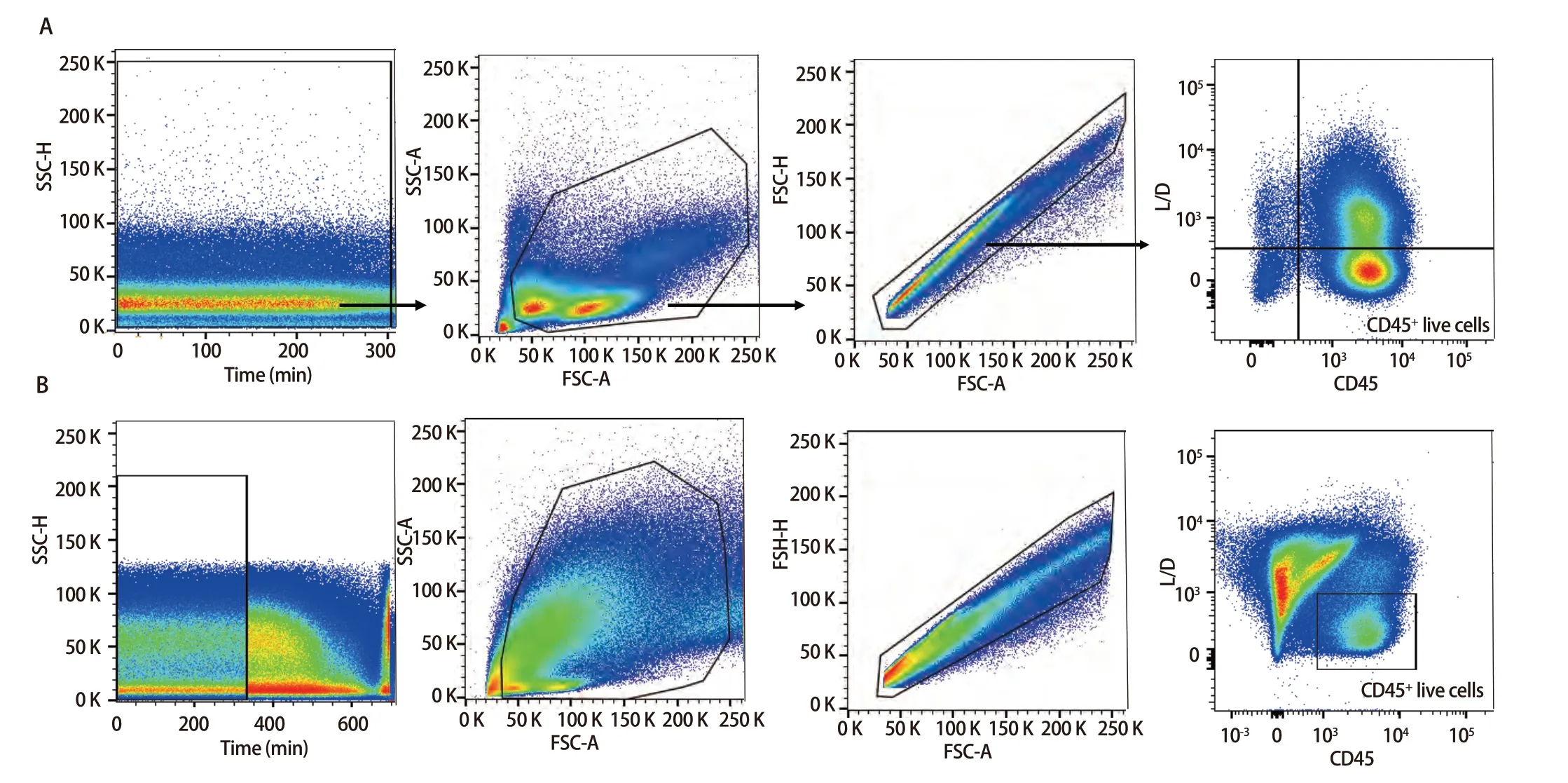
圖2 PBMCs和肺癌組織設門步驟。A:PBMCs設門步驟;B:肺癌組織設門步驟。Fig 2 Gating steps for PBMCs and lung cancer tissues. A: PBMCs gating step; B: Lung cancer tissues gating step.

圖3 PBMCs和肺癌組織主要亞群分析策略。A:PBMCs分析策略;B:肺癌組織分析策略。圖3A、3B分別分析了PBMCs和肺癌組織的T細胞、B細胞、NK細胞、NK T細胞、DC、漿細胞等細胞亞群,結果顯示不同組織之間具有差異性。Fig 3 Analysis strategies for major subpopulation of PBMCs and lung cancer tissues. A: PBMCs analysis strategy; B: Lung cancer tissues analysis strategy. Fig 3A and 3B analyses the cell subpopulations of T cells, B cells, NK cells, NK T cells, DC and plasma cells in PBMCs and lung cancer tissues, respectively, with variability between different tissues.
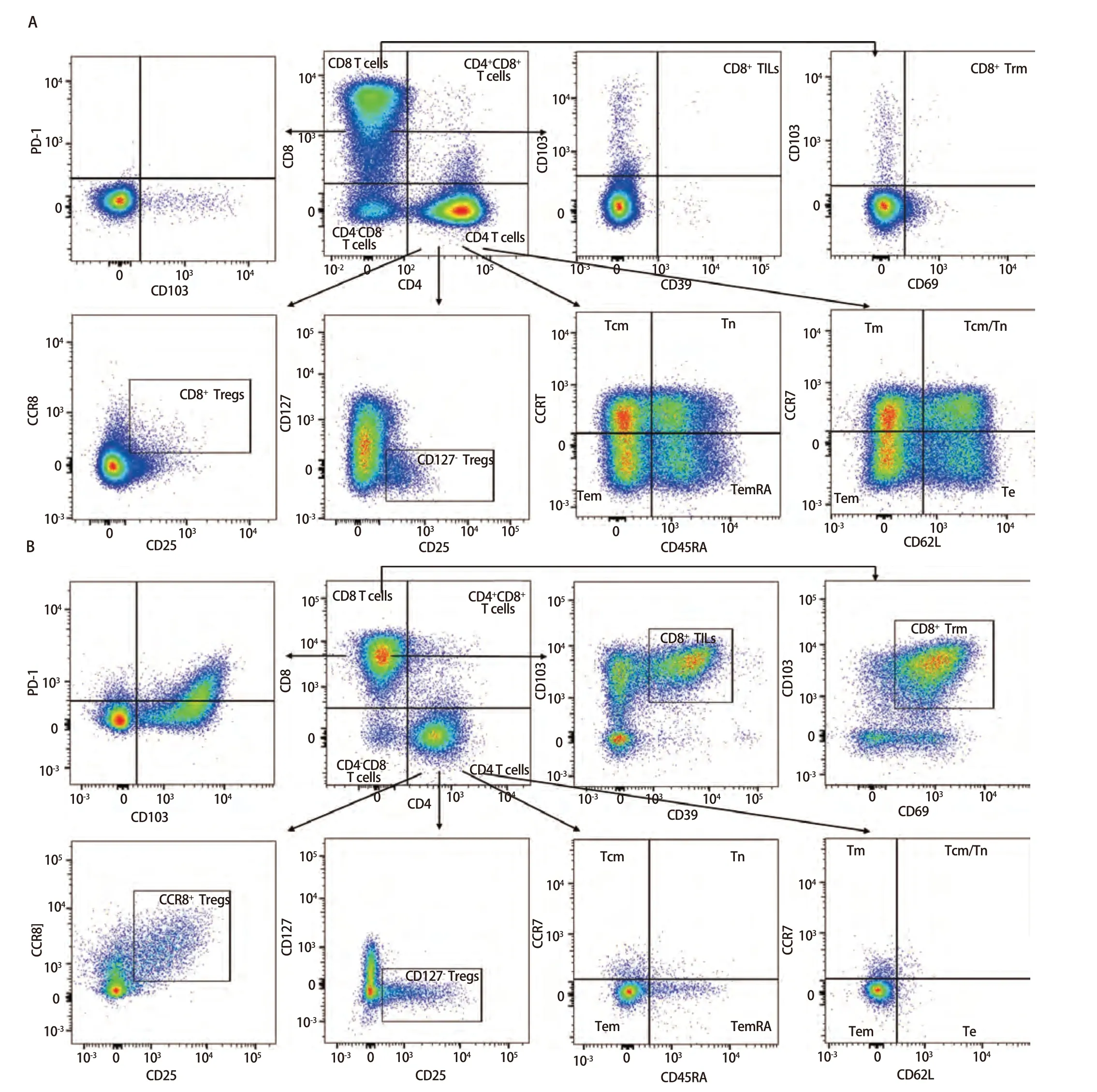
圖4 PBMCs和肺癌組織中CD4+/CD8+ T細胞亞群功能、活化分析。A:PBMCs分析;B:肺癌組織分析。圖4A、4B分別分析了PBMCs和肺癌組織的功能和活化的細胞亞群,如Tregs、CD8+ TILs、CD8+ Trm、Tcm、Tn、Tem以及PD-1的表達等,結果不同組織之間具有差異性。Fig 4 Functional and activation analysis of CD4+/CD8+ T cell subsets in PBMCs and lung cancer tissues. A: PBMCs analysis; B: Lung cancer tissues analysis. Fig 4A and 4B analyses the function of PBMCs and lung cancer tissues, respectively, and the activated cell subpopulations, such as Tregs,CD8+ TILs, CD8+ Trm, Tcm, Tn, Tem and PD-1 expression, which were differentiated between the different tissues. Tcm: central memory cells; Tn:naive T cells; Tm: memory T cells; Tem: effector memory T cells; Te: effector T cells.
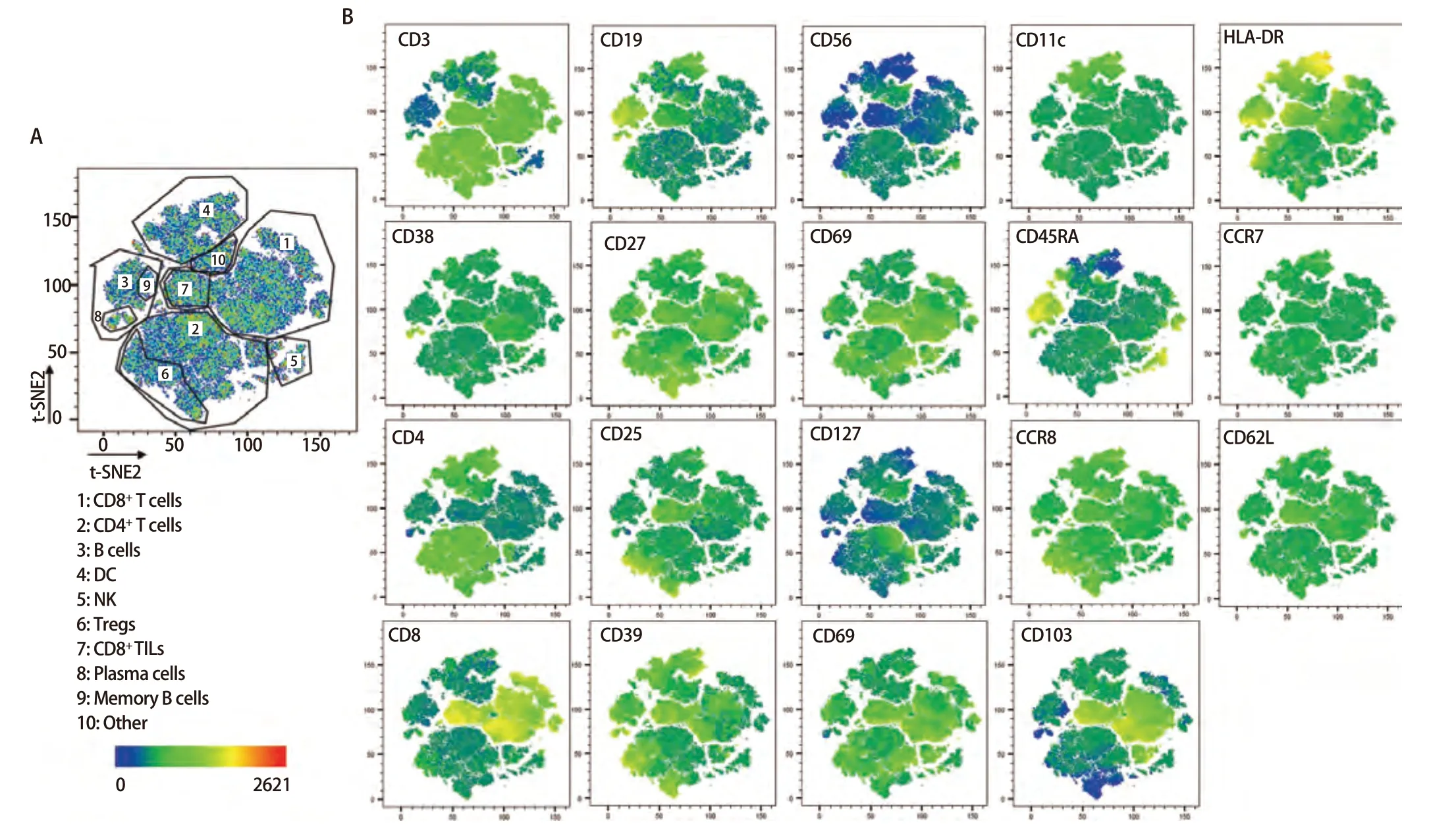
圖5 肺癌組織t-SNE分析。圖5A呈現了6例肺癌組織的整體分布,可將其分為多各細胞亞群,包括CD8+ T細胞、CD4+ T細胞、NK細胞、DC等細胞亞群,圖5B展現了除CD45和L/D外的其余抗體標記在整體的分布情況。Fig 5 Analysis of lung cancer tissues by t-SNE. Fig 5A presents the overall distribution of the lung cancer tissues of the six cases, which can be classified into multiple various cellular subpopulations, including CD8+ T cells, CD4+ T cells, NK cells, DC and other cellular subpopulations, and Fig 5B demonstrates the distribution of the rest of the antibody markers in the overall distribution of the antibody markers except CD45 and L/D.

表2 外周血PBMCs和NSCLC組織免疫細胞主要細胞亞群占比Tab 2 The percentage of major cell subsets of immune cells in PBMCs and NSCLC tissues
3 討論
多色流式細胞術具有便捷、準確、易于標準化的特點,其因能高通量分析細胞水平而被臨床和科研廣泛應用。多色流式細胞術可使用多個標志物進行單細胞研究,并通過多個分析參數解析細胞,最終獲得更準確界定的細胞群和更豐富的生物學信息,且具有樣本使用量少、成本較低等優勢[13,14]。例如,Keyel等[15]通過多色流式來鑒定混合群體(腫瘤、骨髓或血液)中的神經母細胞瘤細胞,操作簡單、準確、快速。宋洋子等[16]通過十色流式檢測外周血中T細胞亞群及活化狀態,方案簡單可靠,研究證實了多色流式的可行性,但并未加入外周血中其他亞群的分析。楊敏等[17]和Kathryn等[18]都曾設計了多色流式方案對腫瘤微環境中的T細胞、巨噬細胞、NK細胞等進行更細致的分型,從而獲得影響腫瘤細胞進展相關的研究手段,卻未納入細胞分化等指標。
本實驗建立了一個21色流式方案,以檢測人NSCLC組織樣本的免疫細胞亞群。Treg細胞表達CD45、CD3、CD4、CD25、FoxP3、CCR8,低或不表達CD127,其中FoxP3為核轉錄因子,染色前需進行細胞固定破膜,操作復雜且易損失細胞,CD127為表面標記抗原,因此本方案選擇CD25+CD127-/low來定義Treg細胞[19]。有研究[20]表明CCR8是一種腫瘤浸潤Treg細胞,且高表達的CCR8與多種癌癥相關。在胸腺、脾臟和外周血的Treg細胞中表達量較低,本實驗加入CCR8來驗證外周血Treg是否浸潤。CD45RA、CCR7和CD62L為細胞分化的標志,可表示細胞的分化情況。CD39和CD103作為細胞功能的標志,有報道[21,22]稱,CD39+CD103+為腫瘤特異性及耗竭性T細胞并可識別實體瘤中的腫瘤反應性CD8+T細胞,而針對PD-1的治療策略已被開發為包括NSCLC在內的各種癌癥類型的腫瘤進展的免疫療法[23]。
通過對抗體濃度和電壓的優化以及多色方案的改進,本研究建立了穩定可靠的可于單管中分析人PBMCs和肺癌組織中主要細胞亞群占比的方法,PBMCs中各主要細胞亞群的比例的均值與文獻[24]報道接近。而肺癌組織中具有個體差異性,表2為本實驗所用腫瘤樣本比例統計,且能清晰地看到T細胞、B細胞、NK細胞及DC等主要細胞亞群的分布,同時充分展現了這些細胞亞群之間的關聯。實驗操作簡單,耗時較短,一定程度上節約了時間和費用。另外還可進行方案的優化或根據條件補充方案,例如將DC細胞亞群細分,如傳統DCs(conventional DCs,cDCs)、血漿DCs(plasmacytoid DCs, pDCs)、朗格漢斯細胞(Langerhans cells, LCs)等納入分析,以及其他腫瘤組織適用性驗證。
綜上,本實驗建立了穩定的檢測人NSCLC組織樣本免疫細胞亞群的21色流式方案,方案適用于PBMCs與肺癌組織樣本,可系統性地檢測PBMCs與肺癌組織中細胞亞群含量以及亞群的功能與活化情況,細胞分群清晰,且能清楚地展現PBMCs與肺癌樣本中細胞分群的差異性,為流式監測疾病的進展等提供了一種可靠的新方案。
Competing interests
The authors declare that they have no competing interests.
Author contributions
Guo TT and Xie HG conceived and designed the study. GuoTT performed the experiments, analysed the data and wrote the article, and Xie HG was responsible for article revisions. Both the authors read and approved the final manuscript as submitted.

