殺菌劑甲基托布津和多菌靈對泥鰍的急性毒性及肝臟酶活性的影響
譚婷,楊超超,楊娜,王琪,雷忻
(1.延安大學生命科學學院,陜西 延安 716000;2.延安市生態恢復重點實驗室,陜西 延安 716000)
近年來,隨著殺菌劑的廣泛使用,其在環境中的殘留與日俱增,對生態系統和人類健康產生了潛在的危害[1],引起了人們的關注。甲基托布津(Methyltobuzine,TM,化學分子式為C12H14N4O4L2)是一種廣譜內吸性殺菌劑,對禾谷類、蔬菜類、果樹上的多種病害有較好的防治作用[2]。TM通過轉化為2-苯并咪唑類物質產生殺菌作用,易在生態環境中富集[3]。據報道,在大白菜、黃瓜、柑橘、海帶等均可檢測到TM殘留[4],對水生生物也有一定威脅,如嚴重破壞萼花臂尾輪蟲(Brachionus calyciflorus Pallas)的無性生殖和有性生殖[5],對小球藻(Chlorella)、水蚤(Daphnia)、網狀水母(Plathymentia reticulata Blgelou)、虹鱒(Oncorhynchus keta)也可產生毒性效應[6]。TM可對不同生長時期的黃顙魚(Pelteobagrus fulvidraco)具有較強毒性,影響生長發育相關基因的表達[7]。TM暴露對大鼠產前發育有影響,造成局部性壞死、微泡性脂肪變性、炎癥浸潤、肝細胞核固縮,并誘發母體毒性效應[8]。多菌靈(Carbendazim,BCM,化學分子式為C9H9N3O2)為食品、土壤和水中經常檢測到的主要污染物[9,10],通過農藥噴灑和水體徑流等方式進入水體環境[11]。佘偉鐸等[12]對長江流域重慶段水體和沉積物檢測發現,BCM 濃度范圍為2.1~46.9 ng·L-1。BCM 不僅可誘導斑馬魚(Danio rerio)快速游動,增加攻擊性行為和異常行為的表現[13],還可改變斑馬魚組織中的總蛋白水平,降低魚類的營養價值以及生理和代謝狀態[14],神經毒性作用還顯著改變參與抗原處理和呈遞、凋亡、自噬和代謝相關基因的表達[15]。目前TM和BCM殺菌劑的毒性效應研究,主要是分析蔬菜、水果等食品的殘留與降解,其次是對水生生物的生殖毒性和神經毒性報道較豐富,而2 種殺菌劑對水生生物肝臟代謝的干擾作用及關鍵生化指標的影響,目前研究報道尚少。一定劑量農藥在動物機體內累積可誘發產生大量活性氧(Reactive oxygen species,ROS)[16],攻擊機體組織,造成一定程度過氧化損傷,機體需要及時清除或降低過量ROS,其中過氧化物酶(Peroxidase,POD)可將體內過氧化產物轉化為H2O 和O2,也是目前評價機體氧化損傷程度的生物標志物[17,18]。同時動物體需對外源化合物進行一系列代謝反應,其中主要包括谷草轉氨酶(Aspartate aminotransferase,GOT)和谷丙轉氨酶(Glutamate pyruvic transa,GPT)2種關鍵酶。外源污染物進入機體,組織中GOT 和GPT 大量釋放,加速體內代謝產物排出,緩解或消除過氧化帶來的組織損傷,維持肝臟組織正常運轉,其也可作為污染物毒性檢測的生物標志物[19,20]。泥鰍(Misgurnus anguillicaudatus)一般生存在沙泥底層的緩流淺水區,適應能力較強,廣泛分布于我國各個水系,可作為毒理學試驗的試驗模式生物。
本研究通過檢測泥鰍96 h 內的死亡數,以評估TM和BCM對6 月齡泥鰍的急性毒性,并檢測28 d內TM 和BCM 脅迫對POD、GOT 和GPT 活性的變化,探究兩種殺菌劑對泥鰍抗氧化酶的影響及其毒性效應,以期為兩種殺菌劑的污染治理和安全合理使用提供科學依據。
1 材料與方法
1.1 材料
6 月齡泥鰍平均體長(6.3±0.7)cm、平均質量(2.4±0.5)g,購于陜西省水產貿易市場。實驗開始前,選擇體型相當,反應靈敏,體質健康的泥鰍,在實驗室環境中用自然脫氯的水馴養7 d,使泥鰍適應環境,每天喂食少量食物。實驗開始前一天停止喂食。實驗期間,試液每24 h 更換,維持水溫在(25±2)℃,pH(7.5±0.2)。
水中農藥殘留測定儀(CSY-N12A,深圳芬析儀器制造有限公司);酶標分析儀(Multiskan FC,上海博訊公司);高速離心機(KH19A,湖南凱達科學儀器有限公司);恒溫水浴鍋(DZKW-C,河南沃林儀器設備有限公司);電子分析天平(BCE64-1CCN,聚儀惠供應鏈有限公司)。
甲基托布津(CAs:23564-05-8,純度≥95%,上海允發化工有限公司);多菌靈(CAs:10605-21-7,純度≥98%,江蘇藍豐生物化工股份有限公司);二甲基亞砜(DMSO,分析純,濟南歐萊博生物科技有限公司);生理鹽水(四川科倫藥業股份有限公司);2,4 二硝基苯肼(分析純,上海吉至生化科技有限公司);磷酸緩沖液(pH 為7.4);NaOH(0.4 mmol·L-1);HCl(0.05 mmol·L-1,10 mmol·L-1);愈創木酚、過硫酸銨、硝酸銀(均為分析純,上海易恩化學技術有限公司)。
1.2 方法
1.2.1 急性毒性實驗
依據預實驗和相關文獻[21,22],分別設5 個質量濃度處理組:TM 為65 mg·L-1、85 mg·L-1、112 mg·L-1、146 mg·L-1和191 mg·L-1;BCM 為26 mg·L-1、34 mg·L-1、45 mg·L-1、58 mg·L-1和76 mg·L-1。采用半靜水實驗法,設3 個重復,每個重復放健康、活潑且體型相近的20 尾泥鰍,觀察96 h,統計死亡率。每24 h 更換1 次試驗試劑,若有死亡及時撈出,以保證水環境酸堿度、含氧量等性質穩定。根據最大耐受濃度和最小全致死濃度,記錄泥鰍死亡情況,計算得到TM 和BCM 的LC50和安全濃度(SC)。
1.2.2 肝臟酶活性檢測
將TM和BCM用去DMSO 配制為1.00 g·L-1的母液,根據急性毒性24 h 安全濃度等梯度設置TM和BCM 濃度為分別 為0.05 mg·L-1、0.50 mg·L-1、5.00 mg·L-1和0.02 mg·L-1、0.10 mg·L-1、0.50 mg·L-1、2.50 mg·L-1,并設置空白對照組與溶劑對照組(DMSO 水溶液),每組設3 個重復,每個重復中放入規格相似的泥鰍15 尾。實驗周期為28 d,每24 h 更換實驗試劑,每隔3 h 測定各實驗組2 種藥物濃度變化,保證實驗濃度波動于±0.50 ng·L-1。實驗第7 d、14 d、21 d、28 d 取樣,觀察記錄泥鰍情況,有死亡泥鰍及時記錄并撈出。
酶活性測定時,拍暈泥鰍,沿著泄殖孔剪開,提取肝臟組織、稱量,將預冷過的生理鹽水依據重量∶體積=1∶19 的比率加入,于研缽中在冰袋上研磨為組織勻漿,做好標記,以轉速3 000 r/min處理20 min,取上清于干凈離心管中在4 ℃冰箱中保存以便后續測定酶活性。
用愈創木酚法[23]檢測POD 活性,25 ℃環境下1 mg 組織蛋白1 min 催化分解l μg 底物為1 個酶活性單位;GOT 和GPT 活性用賴氏比色法[24]檢測,37 ℃環境下1 mg 組織蛋白與底物反應30 min后形成1 g 丙酮酸為1 個酶活性單位。
1.3 數據處理
在急性毒性實驗中,用Excel 軟件和SPSS 26.0軟件,利用TM和BCM質量濃度對數值與泥鰍死亡幾率制作線性回歸分析方程y=ax+b,計算出24 h、48 h、72 h 和96 h TM 和BCM 對6 月齡泥鰍的LC50和24 h SC[25],計算公式為:
24 h SC=48 h LC500.3/(24 h LC50/48 h LC50)2。
在亞急性毒性實驗中,數據均用平均值±標準偏差(Mean±SD)來表示,利用統計軟件SPSS 20.0開展單因素方差分析,采用Duncan 法比較組間差異,使用GraphPad 8.0 作圖。當0.01<P<0.05 時,用“*”標注表示處理組與對照組之間差異顯著;P<0.01 時,用“**”標注表示處理組與對照組之間差異極顯著。
2 結果與分析
2.1 急性毒性效應
2.1.1 TM 對泥鰍的急性毒性效應
高濃度TM 脅迫期間,泥鰍體色發紅,在水中不活躍,隨著暴露時長增加,泥鰍身體失衡側翻,魚體明顯彎曲,并分泌紅色黏液,最終死亡。由表1可得,TM對泥鰍LC50隨時間增長而減小,泥鰍死亡數量隨時間延長增加。TM 對泥鰍24 h、48 h、72 h和96 h LC50分別為35.48 mg·L-1、26.98 mg·L-1、17.25mg·L-1和10.03mg·L-1,24h 的SC為6.16mg·L-1。
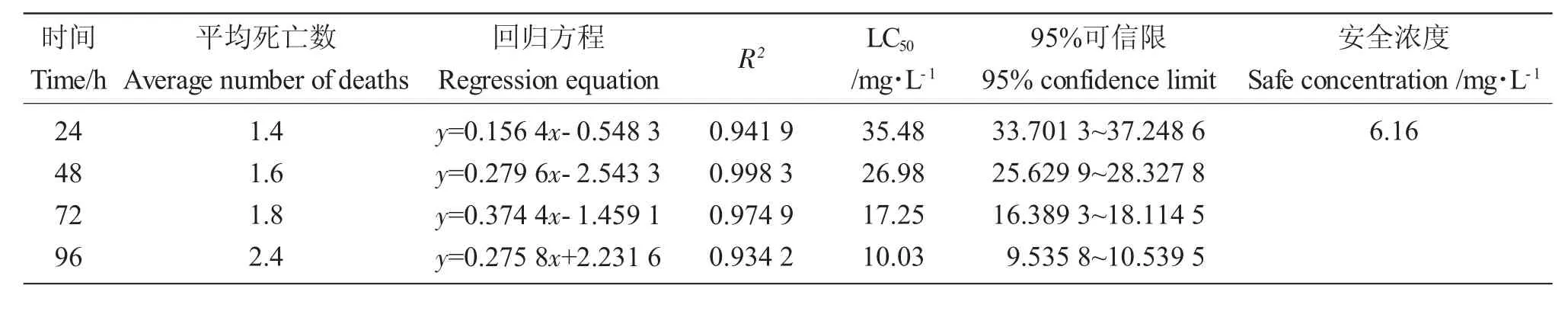
表1 TM 對泥鰍急性毒性結果Tab.1 Results of acute toxicity of TM to loach
2.1.2 BCM 對泥鰍的急性毒性效應
高質量濃度BCM組的泥鰍泄殖腔分泌黃色黏液,體表褶皺變形,在水中的興奮性降低,對食物敏感性下降,魚體發白逐漸死亡。BCM對泥鰍的LC50隨時間增長而減小,泥鰍死亡數量隨脅迫時間持續上升。BCM對泥鰍的24 h、48 h、72 h 和96 h LC50分別為23.53 mg·L-1、17.66 mg·L-1、6.54 mg·L-1和3.58 mg·L-1,24 h 的SC 為3.98 mg·L-1(表2)。
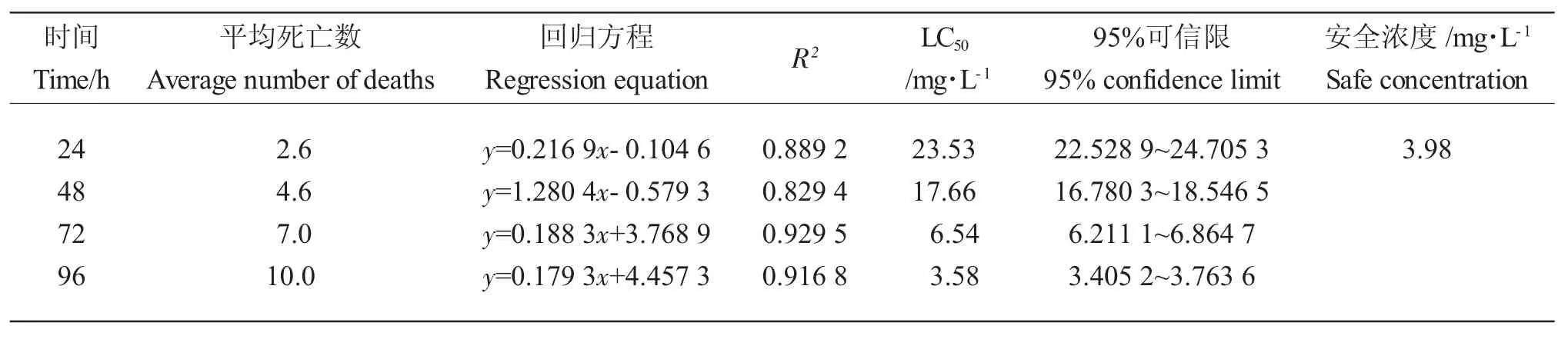
表2 BCM 對泥鰍急性毒性結果Tab.2 Results of acute toxicity of BCM to loach
2.2 2 種殺菌劑對泥鰍亞急性毒性效應
2.2.1 對泥鰍死亡數目影響
由圖1 可知,空白對照組與溶劑對照組泥鰍死亡數目相同,未出現顯著差異。由圖1-a 可知,各TM處理組泥鰍死亡數目差異較大,脅迫7 d、14 d、21 d 和28 d 時,泥鰍死亡數目隨脅迫濃度增加呈現升高趨勢,其中5.00 mg·L-1濃度組死亡數目最多;由圖1-b 可知,各BCM處理組泥鰍死亡數目同樣差異較大,脅迫期內泥鰍死亡數目的增加與脅迫濃度存在明顯劑量效應,其中2.50 mg·L-1濃度組死亡數目大于其他3 個濃度組;同一TM、BCM濃度脅迫下,泥鰍死亡數目隨脅迫時間增加而升高,TM、BCM脅迫下泥鰍死亡數目表現為:7 d<14 d<21 d<28 d,整體上BCM脅迫下泥鰍死亡數目大于TM。

圖1 泥鰍死亡數目隨TM、BCM 脅迫時間的變化Fig.1 Changes in death member in loach liver with TM and BCM stress period
2.2.2 對肝臟POD 活性的影響
由圖2-a 可知,TM 各濃度組脅迫7 d 時泥鰍肝臟POD 活性顯著高于對照組,14 d 時活性達到最高,21 d 時活性明顯下降,28 d 時活性最低,高濃度組(5.00 mg·L-1)POD 活性低于對照組。由圖2-b 可知,BCM 各濃度組脅迫7d 時泥鰍肝臟POD活性顯著高于對照組,其中0.02 mg·L-1、0.10 mg·L-1、0.50 mg·L-1濃度組脅迫14 d 時活性最高,之后下降。高濃度組(2.50 mg·L-1)在脅迫7 d 時POD 活性即達到最大值,脅迫14 d 時活性顯著下降,28 d時活性最低。
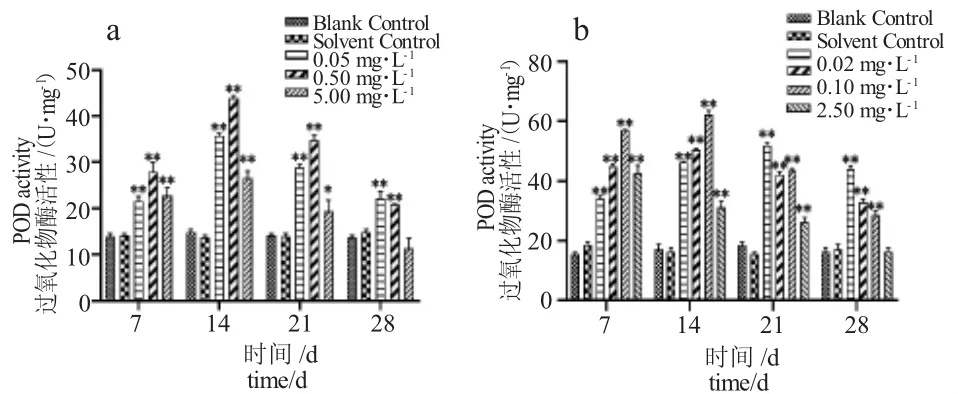
圖2 泥鰍肝臟抗氧化物酶活性隨TM、BCM 脅迫時間的變化Fig.2 Changes in POD activity in loach liver with TM and BCM stress period
2.2.3 對GOT 活性的影響
由圖3-a 可知,TM各濃度組脅迫7 d 時泥鰍肝臟GOT 活性顯著高于對照組,TM脅迫14 d 后高濃度組GOT 活性下降,脅迫28 d 時各濃度組GOT 活性均受到抑制作用,低濃度組(0.05 mg·L-1)活性最大。由圖3-b 可知,與對照組相比,BCM脅迫7 d 時各濃度組GOT 活性被顯著激活,脅迫28 d 時各濃度組GOT 活性被明顯抑制。在不同濃度TM 和BCM脅迫時,隨著脅迫濃度的增大,GOT 活性表現為低濃度時促進高濃度時抑制的現象,BCM處理組GOT 活性變化較TM處理組更敏感。
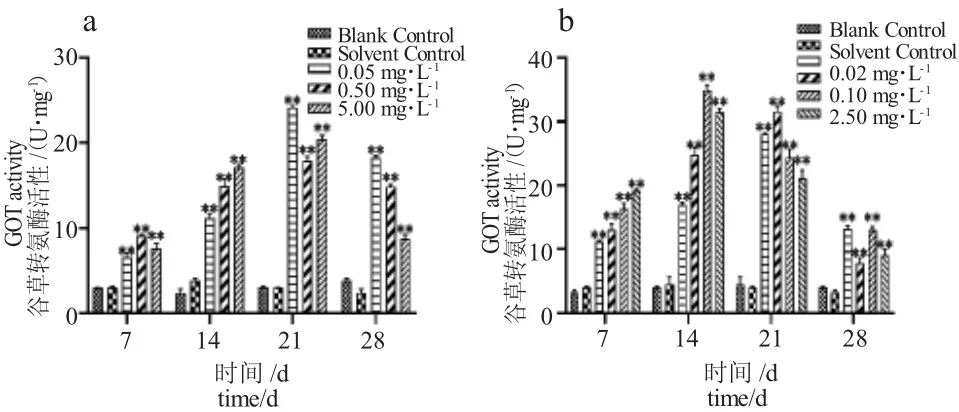
圖3 泥鰍肝臟谷草轉氨酶活性隨TM、BCM 脅迫時間的變化Fig.3 Changes in GOT activity in loach liver with TM and BCM stress period
2.2.4 對GPT 活性的影響
由圖4-a 可知,與對照組相比,TM各濃度組脅迫7 d 時GPT 活性顯著升高,超出對照組活性2倍,脅迫14 d 后各濃度組GPT 活性均下降,隨著濃度提升GPT 活性逐漸下降,出現明顯的劑量-效應關系。由圖4-b 可得,與對照組相比,BCM脅迫7 d各濃度組GPT 活性呈顯著上升趨勢,脅迫14 d 后活性總體下降,高濃度組(2.50 mg·L-1)28 d 時GPT活性低于對照組。
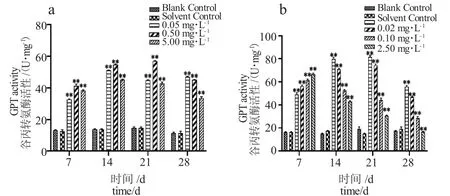
圖4 泥鰍肝臟谷丙轉氨酶活性隨TM、BCM 脅迫時間的變化Fig.4 Changes in GPT activity in loach liver with TM and BCM stress period
3 討論
3.1 TM 和BCM 對泥鰍的急性毒性效應
施用殺菌劑農藥對水生動物有一定毒性效應,其毒性等級在評價農藥毒性中扮演著重要角色。李亞夢[26]研究發現,BCM 對克氏原螯蝦(Procambarus clarkii)成體具中度毒性。袁思亮[27]研究發現,有效成分為50%的BCM 和TM 懸浮劑對大型溞(Daphnia magna)分別具有中毒與低毒。依照目前農藥對魚類毒性等級分級準則:LC50(96 h)>10.0 mg·L-1的為低毒,1.0 mg·L-1<LC50≤10.0 mg·L-1的為中毒,0.1 mg·L-1<LC50≤1.0 mg·L-1的為高毒,LC50mg·L-1≤0.1 mg·L-1為劇毒[28],不同物種間毒性等級研究中可能存在一定差別,這可能與2 種殺菌劑的制劑類型、物種間差異和物種的生長階段密切相關。在本研究中,TM 96 h LC50為10.03 mg·L-1,對6 月齡毒性等級為低毒;BCM 96 h LC50為3.58 mg·L-1,對6 月齡泥鰍毒性等級為中毒,這與熊昭娣等[29]發現有效成分22%BCM殺菌劑96 h LC50為7.64 mg·L-1,對斑馬魚毒性屬于中毒的研究結果相似。
3.2 TM 和BCM 對泥鰍亞急性毒性效應
TM和BCM長期脅迫對泥鰍的影響嚴重,兩種殺菌劑刺激泥鰍死亡數目變化趨勢相似,BCM脅迫下泥鰍死亡數趨勢變化更顯著。TM和BCM同一時間脅迫下,泥鰍死亡數目均隨脅迫濃度增加而不斷增加,高濃度組死亡數持續上升;同一TM、BCM 濃度脅迫下,泥鰍死亡數目均隨脅迫時間增加而升高,呈現明顯時間效應。
3.2.1 TM 和BCM 對泥鰍肝臟POD 活性的影響
動物中毒時會發生氧化應激[30,31]。POD 可將H2O2轉化為羥基化合物并排出體外[32],調節機體變化,維持機體穩態,廣泛存在于各個組織中,尤其是肝臟。張曉紅等[33]研究發現,低濃度丁草胺誘導金魚(Carassius auratus)POD 活性,但伴隨毒素積累肝臟受損其活性出現下降。本研究中,TM 脅迫7 d、14 d、21 d,泥鰍肝臟POD 活性隨濃度的升高呈先上升后下降的趨勢,存在明顯的劑量-效應關系,說明TM對泥鰍肝臟POD 先誘導后抑制,其中高濃度組脅迫28 d,抑制作用最明顯。低劑量TM雖然可以誘導POD 活性,但隨著TM 在體內累積,所產生的超氧陰離子濃度超過機體承受能力,POD 活性降低。BCM脅迫14 d 0.02 mg·L-1、0.10 mg·L-1、0.50 mg·L-1濃度組活性均顯著誘導,而2.50 mg·L-1脅迫14 d明顯抑制POD 活性,說明高濃度BCM脅迫短時間即可使機體產生大量超氧陰離子,從而抑制POD 活性。TM和BCM脅迫一定時間后活性氧自由基的積累已遠超過抗氧化酶系統清理自由氧的能力,過量的氧自由基不能被抗氧化酶及時、高效地清除掉,導致POD 活性被抑制,這與林海[34]研究氟唑菌酰胺對斑馬魚POD 影響的結果類似。
3.2.2 TM 和BCM 對泥鰍肝臟GOT 和GPT 活性的影響
GOT 和GPT 是魚類肝臟中的主要解毒酶[35],當肝細胞發生炎癥、中毒、壞死時兩種轉氨酶釋放,因此轉氨酶可作為動物毒性損傷效應的標志酶。在各組織中,GOT 在心臟中的活力最大,其次是肝臟;而GPT 則在肝臟中活力最大[36]。在氯氰菊酯脅迫下鯽(Carassius auratus)腎臟LDH 和血清GOT 活性變化研究中發現,各活性隨脅迫時間的延長產生先誘導后抑制的作用[37];在亞甲基雙硫氰酸酯脅迫下斑鱧(Channa maculata)肝臟GOT 活性變化中發現,一定處理時間內,高濃度脅迫GOT 活性短時間內上升,而較低質量濃度脅迫中,GOT 活性上升時間較高濃度更長[38]。本研究中,BCM比TM對泥鰍肝臟GOT活性更敏感,泥鰍肝臟GOT 活性均先上升后下降,表明兩種殺菌劑低劑量脅迫誘導GOT 活性,高劑量抑制其活性,呈現明顯的劑量-效應關系,干擾泥鰍肝臟GOT 平衡。在低濃度TM組GOT 活性在脅迫21 d 達到最大值,高濃度組GOT 活性脅迫14 d達到最大值,而BCM各濃度組28 d GOT 均呈下降趨勢,說明伴隨暴露時間增加肝臟調節能力下降,即使泥鰍一定時間后處于低質量濃度污染中,相關活性也仍舊會偏低。
GPT 抗活性氧毒性程度可作為干擾魚氧自由基的污染物檢測標志[39]。在聲脅迫對斜帶石斑魚(Epinephelus coioides)的研究中發現,GPT 活性隨著脅迫時間延長和強度增加而升高[40]。本研究中,兩種殺菌劑脅迫下GPT 均有顯著變化,TM脅迫14 d 高濃度組GPT 活性呈下降趨勢,TM 脅迫會誘導泥鰍體內過氧化物過度累積,大量異常積累會誘使GPT 防御失敗、活性降低。BCM脅迫7 d 各濃度組顯著誘導GPT 活性,脅迫14 d 后,各濃度組GPT 活性均受抑制,當脅迫濃度高于一定程度時,體內GPT 未能及時清除機體的有害物質,導致細胞結構受到破壞,酶活性逐漸下降。泥鰍肝臟對殺菌劑應激反應中GPT 比GOT 活性變化更顯著,可能是GPT 和GOT 的主要作用部位不相同所致[41]。
本文研究了兩種常用殺菌劑TM 和BCM 的毒性。結果表明,TM對泥鰍的毒性等級為低毒,BCM對泥鰍的毒性等級為中毒。兩種殺菌劑短期脅迫不同程度刺激泥鰍死亡,誘導POD、GOT、GPT 活性,而隨著脅迫時間延長,泥鰍死亡數目持續增加,對POD、GOT、GPT 活性誘導程度減弱甚至顯著抑制,并與毒物濃度呈明顯劑量效應。BCM對泥鰍毒性大于TM,且水環境中一定劑量TM、BCM長期存在可能嚴重影響泥鰍抗氧化酶系統,在生產中應合理使用。

