辣椒素生物活性及其遞送系統研究進展
王馨瑤,陳夢娟,肖 何,劉 洋,王蓉蓉,蔣立文
(湖南農業大學食品科學技術學院,食品科學與生物技術湖南省重點實驗室,湖南 長沙 410128)
辣椒(Capsicum annuumL.)是我國種植面積最大的蔬菜作物,其年種植面積穩定在210萬 hm2以上,消費量占中國調味品的30%[1]。辣椒除可用作烹飪、調味和加工外,還能用于藥食同源食品的研發[2]。辣椒素(capsaicin,CAP)是辣椒中主要的生物活性化合物,由CAP合酶通過辣椒胎盤組織中的香草胺和支鏈脂肪酸的生物反應合成[3]。除CAP外,辣椒中還發現了許多與CAP化學結構類似的天然CAP類化合物,如二氫辣椒素、去甲二氫辣椒素、高二氫辣椒素和高辣椒素等,其結構差異僅體現在脂肪族側鏈的長度和烷基側鏈區域中的飽和度不同(圖1)[4-5]。其中,CAP和二氫辣椒素占辣椒中CAP類化合物總量的80%~90%,是主要的辛辣成分,表達出的辣度是次要CAP的兩倍左右[3]。CAP具有鎮痛[6]、抗炎[7]、抗氧化[8]、抗癌[9]、代謝調節[10-11]等生物學效應,但由于其水溶性差且刺激性強,極大地限制了CAP在食品藥品領域的應用。目前,已設計出包括脂質體[12]、膠束[13]、微乳液[14]、納米乳液[15]、Pickering乳液[16]和納米粒子等遞送系統,用以提高CAP的生物利用度并減輕其刺激性[6-7]。本文主要闡述CAP的生物學功能,并總結了目前用于提高CAP穩定性和生物利用度的各種遞送系統。
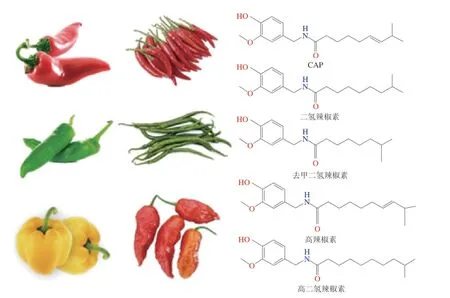
圖1 CAP的化學結構Fig.1 Chemical structures of CAP
1 CAP的生物學效應
CAP作為辣椒的主要生物活性成分,其在動物、體外、人體中的生物學效應已得到廣泛研究(表1),探究其機制,發現CAP可與瞬時受體電位香草素1(transient receptor potential vanillin 1,TRPV1)受體結合發揮作用(圖2),也可獨立于TRPV1直接作用于特定的細胞,改變細胞膜流動性、離子通量和活性氧水平[17]。此外,CAP還可通過直接或間接影響腸道微生物菌群的組成、豐度和結構改善腸道微生物環境,從而有效預防肥胖[18]、糖尿病[19]或炎癥性腸病[20]等疾病的發生。

表1 CAP的生物學效應研究Table 1 Recent studies on biological effects of CAP
1.1 鎮痛作用
TRPV1離子通道在初級感覺神經元中充當有害信號的分子檢測器,其受體主要在Aδ和C傷害性感覺神經上高度表達,因此TRPV1的激活會導致神經系統對疼痛的感知[37]。然而,局部應用TRPV1通道激動劑CAP可激活TRPV1-表達傷害感受器中的TRPV1受體。CAP在TRPV1 S3和S4之間的通道-脂質界面上與TRPV1受體結合,磷脂酶C的Ca2+依賴性激活可引起局部質膜水通道蛋白PIP2水解為1,4,5-三磷酸和二酰基甘油,導致TRPV1通道失活[39]。CAP與TRPV1受體結合引起初始神經元興奮和促炎介質釋放,且反復使用低濃度CAP局部給藥可導致TRPV1離子通道受體脫敏,增強疼痛敏感性[38]。此外,CAP還可導致離子通道失活產生短期的去功能化,起到短時鎮痛作用。然而,高濃度的CAP可介導大量Ca2+流入并激活鈣蛋白酶引起軸突末端結構消融,導致TRPV1+傳入神經長期去功能化,起到長效鎮痛作用[40-41]。目前,CAP已被用于治療類風濕關節炎[42]、帶狀皰疹后神經痛[43]、糖尿病性神經病[44]及非糖尿病性周圍神經病等慢性肌肉骨骼和神經性疼痛[40]。
1.2 抗炎作用
慢性炎癥是心血管病、癌癥、糖尿病、非酒精性脂肪性肝病、自身免疫病等慢性疾病的基礎,全球一半以上的死亡都可歸因于與慢性炎癥相關的疾病[45]。因此,采取措施預防或控制慢性炎癥極有必要。CAP通過降低促炎因子、趨化因子、細胞黏附分子和免疫細胞功能的表達,表現出抗炎特性[46-48]。Tang Jing等[49]證明CAP可通過時間和劑量依賴方式減少脂多糖刺激的THP-1巨噬細胞中促炎因子白細胞介素-1β、白細胞介素6和腫瘤壞死因子-α的產生。同時,CAP可激活過氧化物酶體增殖物激活受體γ,誘導肝X受體α的表達上調,從而阻斷核轉錄因子介導的炎癥基因表達。Mendivil等[22]發現長期口服CAP(2 mg/(kgmb·d))可降低胃炎Wistar大鼠胃黏膜中促炎細胞因子和環氧化物酶-2的表達,對大鼠胃保護率達到61.1%,有效減少了胃炎Wistar大鼠胃部炎癥浸潤和潰瘍面積,起到了胃保護作用。
1.3 抗氧化作用
氧化應激是指體內氧化劑在生成和中和之間的一種失衡狀態,會導致組織和器官功能的漸進性喪失,引起不同的病理狀態[50]。CAP的抗氧化作用已在Wistar大鼠紅細胞[26]、人臍靜脈內皮細胞[51]和大鼠肝線粒體膜[52]等多種模型中得到證實。Chaudhary等[26]發現CAP通過提高等離子體鐵還原能力、細胞內谷胱甘肽水平和質膜氧化還原系統活性,降低活性氧、丙二醛、蛋白質羰基和晚期氧化蛋白產物水平,對氧化應激具有顯著抑制作用。Chen等[51]發現CAP(50 μmol/L)具有明顯的自由基清除活性,其對1,1-二苯基-2-三硝基苯肼自由基清除率為52.8%。此外,CAP還可通過調節活性氧生成酶和清除酶的表達活性,抑制人臍靜脈內皮細胞中氧化低密度脂蛋白誘導的活性氧的產生。此外,CAP還能有效抑制輻射引起的脂質過氧化和蛋白質氧化,從而在防止輻射引起的抗氧化酶和重要的內源性抗氧化劑谷胱甘肽活性喪失方面發揮重要作用[52]。
1.4 抗癌作用
癌癥也稱惡性腫瘤,是由于機體細胞持續過度分裂失去正常調控的疾病,其發病率和死亡率以驚人的速度增長[53-54]。CAP作為一種潛在的抗癌化合物,在乳腺癌[33]、肺癌[9]、胃癌[55]、肝癌[56]和前列腺癌[32]等的治療中均有應用。CAP可與多種藥物聯用增強抗癌活性[57-58],其抗癌機制主要通過誘導腫瘤細胞凋亡和周期阻滯、抑制腫瘤細胞侵襲和遷移、阻止腫瘤血管生成實現[59]。陳晗等[60]以不同濃度CAP處理前列腺癌細胞PC-3,發現CAP通過上調PC-3中DNA復制所必需的重要蛋白PCNA和細胞周期驅動因子Cyclin D1,下調細胞周期蛋白依賴性激酶抑制劑P21抑制PC-3增殖;并通過干預PC-3中B淋巴細胞瘤-2基因表達上調和細胞凋亡調控因子Bax表達下調,從而促進其凋亡。此外,經CAP干預后,下游E-鈣黏蛋白和緊密連接蛋白、抗閉鎖小帶蛋白-1表達上調,N-鈣黏蛋白和波形蛋白表達下調,從而抑制了PC-3的遷移。Lee等[61]以20 mg/kgmbCAP喂食腫瘤抑制基因APC缺失的ApcMin+/小鼠4 周,發現小鼠腸道中的息肉數量和腫瘤負荷減少,表明CAP是一種潛在的抗癌藥物。
1.5 心血管保護作用
心血管疾病包括動脈粥樣硬化負荷引起的冠狀動脈疾病、急性心肌梗死、缺血后心力衰竭和不同病因的心力衰竭,其發病率在全球范圍內不斷上升[62]。CAP能夠通過釋放降鈣素基因相關肽和P物質等感覺神經肽作為保護介質,進入血液到達血管和心臟,發揮抗動脈粥樣硬化和心臟保護作用[63-64]。Li Jianping等[63]給正常鈉(0.5%,質量分數,下同)飲食Wistar大鼠注射100 μg/kgmbCAP,可增加大鼠血漿中降鈣素基因相關肽水平,降低平均動脈壓。此外,CAP還可通過激活TRPV1通道減輕動脈粥樣硬化。Ma Liqun等[65]以0.01% CAP長期(24 周)喂食高脂飲食(high fat diet,HFD)ApoE-/-小鼠,結果表明CAP能顯著增加ATP結合盒轉運體A1的表達,降低低密度脂蛋白相關蛋白1的表達及血漿中總膽固醇和甘油三酯濃度,改善動脈粥樣硬化病變。Li Binghu等[66]發現CAP激活TRPV1可減輕氧化低密度脂蛋白損傷的血管平滑肌細胞自噬,激活自噬-溶酶體通路,起到抗粥樣動脈硬化的效果。近期研究也表明,CAP可通過上調沉默信息調節因子6促進缺氧誘導因子-1α的脫乙酰化和降解,防止動脈鈣化[67]。
1.6 代謝調節
代謝綜合征主要由胰島素抵抗和肥胖組成,可增加心血管疾病、2型糖尿病和非酒精性脂肪性肝病發生的風險。CAP可通過激活TRPV1調節單磷酸腺苷活化蛋白激酶、過氧化物酶體增殖物激活受體α、解偶聯蛋白1和胰高血糖素樣肽1在內的代謝調節劑,從而增加脂肪氧化[68-69]、調節葡萄糖穩態[70]、改善心臟和肝臟功能[71]。此外,CAP還可通過調節腸道微生物組成和相對豐度,有效減輕代謝紊亂[72]。
1.6.1 CAP對糖代謝的影響
CAP可激活TRPV1通道,從而增強胰島素分泌和抑制胰高血糖素釋放降低血糖[73]。Zhang Shiqi等[74]以6 mg/(kgmb·d)CAP喂食鏈脲佐菌素誘導的糖尿病大鼠,發現大鼠體質量增加,其肝糖原和肌糖原含量分別增加66.0%和69.3%。此外,CAP激活了肝臟和胰腺中的TRPV1,導致肝X受體和胰十二指腸同源盒-1的表達上調,從而調節葡萄糖激酶、葡萄糖轉運蛋白2、磷酸烯醇丙酮酸羧激酶和葡萄糖6-磷酸酶的表達控制糖代謝。Hui Suocheng等[75]給2型糖尿病db/db小鼠喂食含CAP的食物8 周,發現CAP通過減少糖異生和增加肝臟中的糖原合成顯著改善葡萄糖耐量和胰島素敏感性。此外,與食物喂養小鼠相比,CAP可抑制乳酸桿菌屬相對豐度增加及膽汁鹽水解酶活性,增強肝膽汁酸的合成,從而改善葡萄糖代謝,增加胰島素敏感性[30]。
1.6.2 CAP對脂代謝的影響
CAP可通過激活TRPV1陽離子通道抑制脂肪細胞分化,誘導白色脂肪細胞褐變,增加產熱并降低細胞內脂質含量[76-77]。在3T3-L1前脂肪細胞和脂肪細胞中,低劑量CAP能降低過氧化物酶體增殖物激活受體γ、CAAT區增強子結合蛋白α和瘦素的表達,同時誘導細胞凋亡并生成抗脂肪基因,以此抑制脂肪生成[78]。Wu Tao等[79]發現與HFD喂養的小鼠相比,以200 mg/(kgmb·d)CAP喂食HFD小鼠12 周可使小鼠體質量減輕27.5%,葡萄糖耐量顯著逆轉,血清甘油三酯、總膽固醇、低密度脂蛋白膽固醇和三甲胺N-氧化物水平降低,微生物多樣性增加。Takeda等[18]發現CAP不僅能激活解偶聯蛋白1基因,還激活了一系列參與甘油三酯代謝、脂肪酸代謝、糖酵解途徑和適應性產熱的代謝基因,促進了脂肪細胞褐變,提高了棕色脂肪細胞轉化效率。
2 CAP遞送系統
CAP是一種強疏水性物質,室溫下幾乎不溶于水,而低溶解度會導致其體內生物利用度低,生物功效受到很大限制[80]。此外,CAP還具有強刺激性,直接口服會刺激口腔和胃部導致口腔潰瘍和胃潰瘍,且與皮膚直接接觸也會引起皮膚灼痛或刺痛[81]。為了提高CAP的生物利用度并緩解其強刺激性,目前已設計了多種CAP封裝遞送系統,包括脂質體、膠束、微乳液、納米乳液、Pickering乳液和納米粒子等(圖3)。
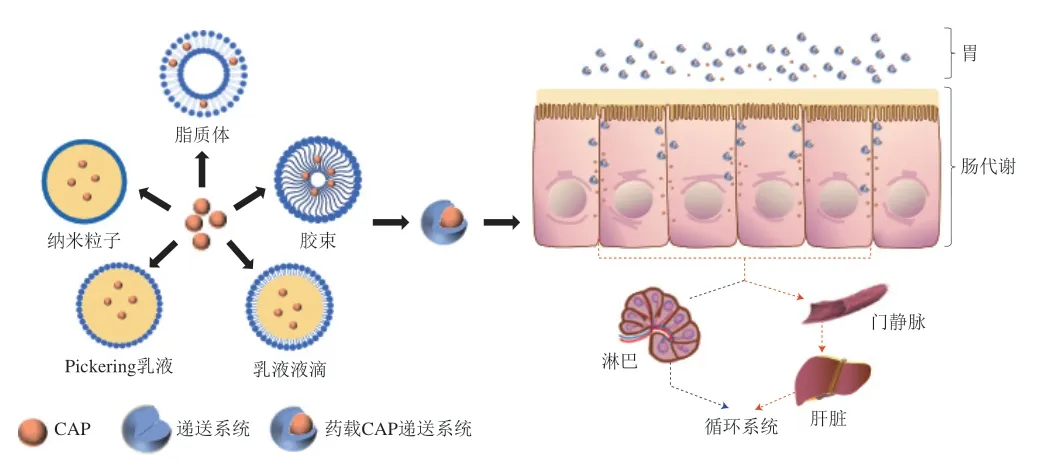
圖3 增強CAP生物利用度的遞送系統[41]Fig.3 Delivery systems to enhance CAP bioavailability[41]
2.1 脂質體
脂質體的主要成分是脂質和脂肪酸,由于其天然存在于細胞膜中,因此被認為具有內在生物相容性和可生物降解性。在結構上,脂質體由兩親分子自組裝成雙層球體,是不同極性分子的理想載體[82]。脂質體通過穩定化合物、增加藥物濃度及克服細胞和組織攝取障礙增加藥物在靶細胞中的停留時間,從而提高藥物的治療指數[83]。Zhu Yuan等[12]應用薄膜分散技術制備了荷載CAP的脂質體,其平均包封率為81.9%,且與游離CAP相比,相對生物利用度增加了3.34 倍。低劑量CAP(質量分數為0.075%)已被證明可有效緩解神經性疼痛,但提高劑量可能會導致應用部位出現紅斑、疼痛、瘙癢和丘疹等副作用;而脂質體CAP制劑可在較低劑量情況下實現緩慢釋放,達到更持久的鎮痛效果,并減輕甚至消除副作用[84-86]。Shomorony等[87]發現荷載少量CAP和河豚毒素的脂質體可實現持續釋放,達到約18 h的麻醉效果,且未發現任何毒性作用。
2.2 膠束
膠束與雙尾磷脂形成雙層結構的脂質體不同,是封閉的脂質單層,表面具有極性頭基,內部具有疏水尾,可將多種疏水性藥物的溶解性提高10~5000 倍。此外,膠束的納米尺寸(10~100 nm)能夠增強藥物滲透性,并延長藥物保留時間,從而提高其生物利用度[88-89]。基于以上優勢,膠束可用于皮外[90]、口服性[91]、注射性[92]和靶向性抗癌藥物遞送[93]。Zhu Yuan等[13]采用薄膜分散法設計了一種由磷脂、膽酸鈉和聚乙烯吡咯烷酮組合的載有CAP且粒徑低于50 nm混合聚合物膠束,經大鼠給藥及動力學研究表明,該膠束減少了CAP對大鼠胃黏膜的刺激,增加了CAP的體外釋放,使CAP的口服生物利用度相較于游離CAP提高了2.42 倍。另一方面,膠束還可用于光動力學療法。Trubitsyn等[94]用尼羅紅和共價羅丹明對聚乙二醇-聚羥基辛酸進行標記,其形成的熒光聚合物膠束穩定性顯著改善可用于治療診斷。
2.3 乳液
2.3.1 微/納米乳
微乳液是由水、油和表面活性劑制成各向同性且熱力學穩定的分散體[95],而納米乳液是納米級顆粒的分散體,其與自發形成的微乳液不同,可通過高壓均質機、超聲波發生器和微流化器等機械力獲得[96-97]。微/納米乳液具有增加穩定性、改善控釋性能和提高生物可及性等優點[98]。Zhu Yuan等[14]以聚氧乙烯蓖麻油EL、乙醇、中鏈甘油三酯和水制備了荷載CAP的微乳液,其平均包封率約85.0%,與游離CAP相比,CAP微乳液在體外釋放中呈現更快的釋放速率,且延長了釋放時間,表明微乳液可提高CAP的溶解度和生物利用度。在大鼠體內研究發現,CAP微乳液的口服生物利用度比游離CAP高2.64 倍,明顯降低了對胃黏膜的刺激。Lu Muwen等[15]以荷載CAP的有機凝膠為油相,Tween 80為乳化劑,經超聲處理得到平均液滴尺寸為168 nm且CAP荷載量為80.4 mg/mL的納米乳液。經體外和體內研究表明,與游離CAP相比,納米乳荷載的CAP更易于吸收,用其喂食HFD大鼠既能夠緩解CAP對胃黏膜刺激,還能提高CAP的生物可及性,并表現出了抗肥胖作用。Han Jingjing等[99]在高壓均質下使用生育酚聚乙二醇1000琥珀酸酯作為乳化劑制備荷載CAP的納米乳液,其包封率為91.9%,穩定性和抗氧化特性均增強。生物學研究表明,相比于游離CAP,乳液對大鼠肝臟細胞的毒性較低,且對胃腸道黏膜的刺激性也較低,表明納米乳液在封裝和遞送刺激性生物活性物質方面具有潛在應用。
2.3.2 Pickering乳液
Pickering乳液是由固體顆粒穩定的不含表面活性劑的乳液,其獨特結構使其具有良好的穩定性、優異的生物相容性和環境友好性,被廣泛用于疏水性生物活性物質的裝載、遞送和控釋[100]。此外,當Pickering乳液體積分數超過74%時可形成高內相Pickering乳液,同樣具有很強的荷載能力[101]。Wu Xiaolin等[16]將CAP與海藻酸鈉混合形成CAP的水分散形式,將其與玉米油、蜂蠟、聚甘油蓖麻醇酸酯混合后在高速剪切條件下得到荷載CAP的油包水高內相乳液(water-in-oil high internal phase emulsion,W/O HIPE),CAP包封率為98.7%,且儲存28 d后乳液仍保持穩定。體外消化模擬實驗表明,荷載CAP的W/O HIPE在模擬口腔和胃條件下CAP幾乎沒有釋放;通過在模擬腸液中緩慢和可持續釋放,有效提高了CAP的生物利用度。此外,小鼠胃組織切片的組織學形態表明,將CAP荷載于W/O HIPE中對小鼠胃組織未造成任何明顯的損害。
2.4 納米粒子
納米粒子由于其生物相容性、抗炎、抗菌、高荷載能力和靶向遞送能力,常用于生物[102-103]、醫學[104]和環境方面[105]。納米粒子不僅能提高生物活性物質的穩定性,還能攜帶其穿過細胞膜和生物屏障,達到靶向遞送和持續釋放的效果[106]。Xu Mengqing等[107]采用氣體擴散反應和一鍋法合成了一種荷載CAP的酸響應性CaCO3納米顆粒,其釋放的CAP可特異性激活TRPV1通道,使細胞內鈣離子濃度超載引起細胞凋亡,從而達到治療腫瘤的效果。Ni Xiaoyue等[108]將CAP修飾的半導體聚合物納米粒子在無需額外添加鈣離子條件下,用于NIR-II熒光成像引導的鈣超載/PDT聯合治療。Tao Xiaoqi等[109]用秈米淀粉納米粒子荷載CAP,其包封率為70.1%,且CAP可從秈米淀粉納米粒子中持續釋放。Feng Yingshu等[80]制備的自組裝CAP納米顆粒相對口服生物利用度可達游離CAP的3.2 倍,降低了肝組織和血液樣本的某些脂質指數。總之,納米顆粒系統通過口服給藥增強了CAP的生物利用度,提高其穩定性并降低對黏膜的刺激。
3 結語
本文首先綜述了CAP的生物學效應,主要包括鎮痛、抗氧化、抗炎、抗癌和代謝調節等。目前,醫學領域已將CAP與其他藥物聯合制備成具有鎮痛效果的外用貼劑,鎮痛效果及耐受性較好。生物學研究表明,CAP可通過下調促炎性細胞因子和炎癥介質起到抗炎作用。作為一種抗氧化物質,CAP也具有良好的清除活性氧的潛力,且可通過抑制過氧化物酶活性減輕氧化應激。此外,CAP還可預防和治療肥胖、糖尿病及心血管等疾病。體外研究表明,CAP通過誘導癌細胞凋亡和周期阻滯、抑制癌細胞遷移從而起到抗癌作用。然而,由于CAP水溶性差導致生物利用度較低,且辛辣味會引起口腔和胃強烈的燒灼感,影響了其在食品藥品領域中的應用。基于以上問題,本文總結了可用于改善CAP應用限制條件的遞送系統,包括脂質體、膠束、微/納米乳和納米顆粒等。CAP在這些遞送系統中的穩定性、荷載能力和包封率均得到提高,通過實現緩釋延長CAP的作用時間,有效減少刺激并提高其生物利用度。
盡管CAP在食品藥品領域的應用已取得較大進展,但由于CAP的強刺激性,在急性接觸下可能會出現腫脹、惡心、嘔吐、結膜炎和腹痛等急性副作用,故需對其使用劑量和作用時間開展進一步研究。目前,CAP的使用劑量、作用時間及實驗模型的種類和條件差異較大,很難明確其發揮生物學效應的實際機制。因此,仍需深入開展體內、體外和臨床研究,進一步了解CAP的作用機制。此外,用于荷載CAP的遞送系統仍缺乏對不可控藥效學組分及不利理化性質的研究,后期研究中應加強對具有較強特異靶向性、良好生物相容性及穩定性的CAP遞送系統的開發。

