基于Logistic回歸分析絕經后女性椎體壓縮性骨折創建Nomogram預測模型*
朱玉平 陸冬玲 王大壽
(北京積水潭醫院貴州醫院1.疼痛科;2.內科一病區,貴州 貴陽 550014)
眾所周知,絕經后女性骨質疏松與骨折密不可分。據研究不完全統計,至少10%的世界人口和30%的絕經后女性患有骨質疏松,50歲以上人群椎體骨折的發生率約為25%~50%,遠高于髖部和腕部等。另外的文獻報道50%的50歲以上女性仍有可能發生首次骨折[1-3]。骨折引起疼痛和肢體功能障礙,嚴重影響患者的生活質量和縮短其預期壽命,長期的臥床可能導致較高的致死率(20%)和致殘率(50%)[1,4]。由此可見,椎體是骨折最常見的部位,也是造成絕經后女性發病、死亡的主要原因。鑒于絕經后女性骨質疏松并椎體壓縮性骨折(Vertebral compression fractures,VCF)的人群龐大,值得社會的關注。目前仍缺乏對這一特殊人群的臨床預測模型研究。基于FRAX、QFracture、BFH-OST等骨折預測工具及臨床研究報道[5-8],本研究針對患者的首診年齡、絕經年齡、外傷史、身高、體重、體重指數(BMI)、體表面積(Body surface area,BSA)、同型半胱氨酸(Hcy)、膽固醇(TC)、甘油三酯(TG)、腰椎骨密度(Lumbar spine bone mineral density,LSBMD)等臨床常見因素建立簡單、易用的絕經后女性椎體壓縮性骨折(Postmenopausal women vertebral compression fracture,PWVCF)的Logistic回歸模型,并建立Nomogram預測模型。
1 資料與方法
1.1 一般資料 回顧性分析2019年12月—2021年11月在我院以骨科疾病住院的絕經后女性患者123例,根據患者椎體是否骨折分為骨折組(n=75)和非骨折組(n=48)。納入標準:①自然絕經女性。②病例資料完整。③首次就診我院并首次完善LSBMD檢查、首次診斷或發現VCF。④無意識障礙、智力障礙并能正常溝通。⑤肝腎功能、電解質檢查正常。排除標準:①住院期間未完善LSBMD檢查或生化檢查者。②精神疾病不配合者。③嚴重心、肺、腎等疾病者。④絕經前已行子宮及附件切除術者。⑤既往或近半年內使用糖皮質激素治療。⑥近半年服用抗骨質疏松藥物治療(如:雙膦酸鹽類、RANK-L受體抑制劑、鮭魚-降鈣素、雌激素及雌激素調節劑、甲狀旁腺激素類似物等)。⑦既往有腰椎成形術、腰椎釘棒系統內固定術或橈骨骨折病史,影響骨礦物質代謝和骨密度(Bone mineral density,BMD)檢查結果者。⑧惡性腫瘤骨轉移或腫瘤侵犯導致的病理性骨折。符合納入標準者,若出現任一條排除標準則剔除本研究。研究因素包括首診年齡、絕經年齡、外傷史、身高、體重、BSA、BMI、TC、TG、Hcy、LSBMD。本研究獲醫院醫學倫理委員會審批(倫理號:LW20221019)。
1.2 診斷標準 根據Genant提出的半定量法,椎體高度減少至少>20%或脊柱MRI提示新鮮微骨折影像學表現(T1WI低信號,T2WI等信號或高信號,脂肪抑制像高信號)。影像學結合患者癥狀(主要是背部疼痛)、體格檢查(如:脊柱畸形、棘突壓痛、腰部活動受限等)即可診斷VCF[1,9]。
1.3 檢查方法 所有患者使用我院雙能X線吸收測定法(Dual-energy X-ray absorptiometry,DXA)檢查脊柱正位骨密度,取L1-L4的T值代表BMD狀態。所研究病例均在空腹情況下晨起抽取3~4 mL靜脈血檢測生化指標(包括Hcy),所檢驗的血清樣本由西門子ADVIA-chemistry-XPT全自動生化分析儀完成,檢測試劑、質控品、校驗品均由西門子公司提供。
1.4 統計學分析 采用SPSS 22.0統計軟件進行分析,用兩個獨立樣本的t檢驗分析計量資料,χ2檢驗分析分類計數資料,先分別對各研究因素進行單因素的Logistic二分類回歸分析,將P<0.10的因素再納入多因素的Logistic回歸模型中分析。將多因素Logistic回歸所得的獨立影響因素(P<0.05)納入到R4.2.1軟件中繪制Nomogram模型,用calibrate plot繪制校正曲線,并運用C-指數和ROC曲線評判該預測模型的效果。P<0.05為差異有統計學意義。
2 結果
2.1 納入研究患者的一般資料 共收集符合研究標準的患者123例,首診年齡:49~93歲,平均(69.95±9.05)歲;絕經年齡:37~60歲,平均(48.4±3.76)歲;有外傷史30例,共發生VCF 75例;體重:35~83 kg,平均(56.11±10.58)kg,身高:141~170 cm,平均(154±5.1)cm;BMI:15.56~35.56 kg/m2,平均(23.62±4.03)kg/m2。按照中國成年女性體表面積計算公式:BSA(m2)=0.00586×身高(cm)+0.0126×體重-0.046 1計算患者的體表面積,結果為1.27~1.95 m2,平均(1.57±0.15)m2;Hcy:5.14~90.5 μmol/L,平均(17.61±16.71) μmol/mL;TC:1.10~8.98 mmol/L,平均(5.09±1.35) mmol/L;TG:0.62~8.48 mmol/L,平均(1.79±1.22) mmol/L;LSBMD T值:-6.1~4.0,平均-2.79±1.7。
2.2 骨折組與非骨折組一般資料比較 兩組在首診年齡、絕經年齡、外傷史、體重、LSBMD等方面比較,差異有統計學意義(P<0.05),身高、BMI、BSA、Hcy、TC、TG等方面比較,差異無統計學意義(P>0.05),見表1。
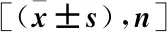
表1 骨折組與非骨折組一般資料比較
2.3 PWVCF單因素Logistic回歸分析 將首診年齡、絕經年齡、外傷史、體重、身高、BMI、BSA、Hcy、TC、TG、BMD等要素視為可能影響VCF的影響因素,并逐個要素進行單因素Logistic回歸分析。結果顯示:首診年齡、絕經年齡、外傷史、體重、LSBMD等因素影響PWVCF,差異有統計學意義(P<0.05) ,見表2。
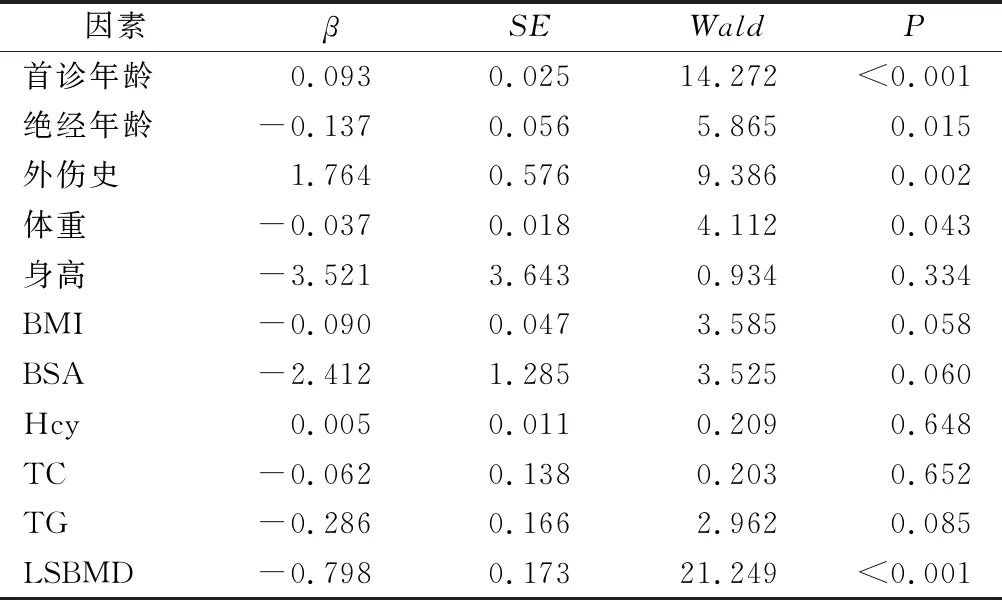
表2 PWVCF單因素的Logistic回歸分析結果
2.4 PWVCF多因素Logistic回歸分析 將單因素Logistic回歸分析中P<0.10的影響因素納入Logistic回歸模型進行多因素分析。結果顯示:首診年齡、外傷史、LSBMD是影響PWVCF的預后獨立危險因素(P<0.05)(表3),使用Graphpad 8.0對Logistic回歸分析中P<0.05的因素OR值進行可視化處理,見圖1。
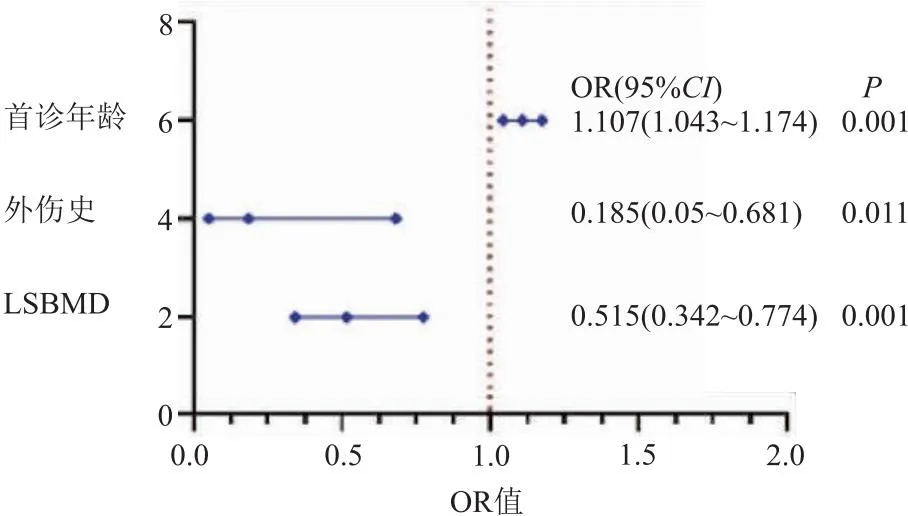
圖1 PWVCF Logistic回歸分析優勢比圖
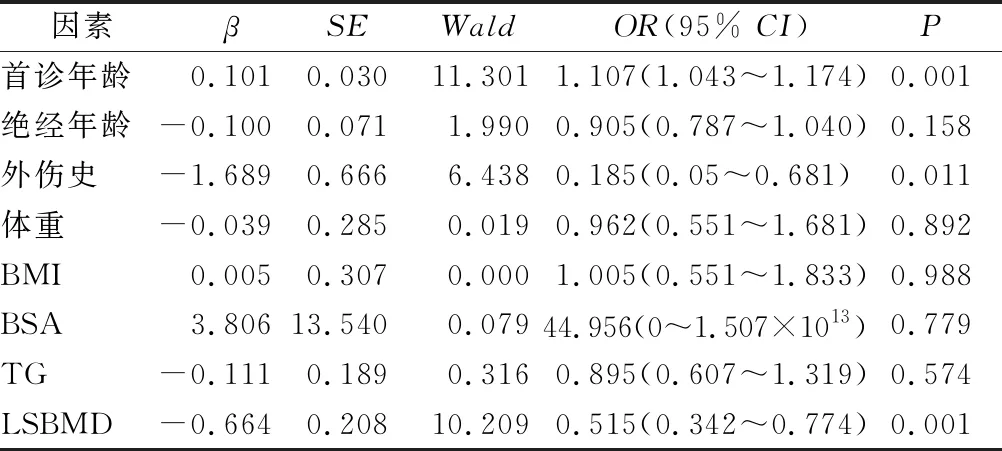
表3 PWVCF多因素的Logistic回歸分析結果
2.5 PWVCF的Nomogram預測模型 Nomogram結果顯示:首診年齡每增加5歲,預測模型評分增加7分,表明首診年齡越大,發生PWVCF的風險越大。
絕經后無外傷史其評分位67分,有外傷史患者其評分增加25分,LSBMD T值每下降一個標準差其評分增加10分,見圖2。
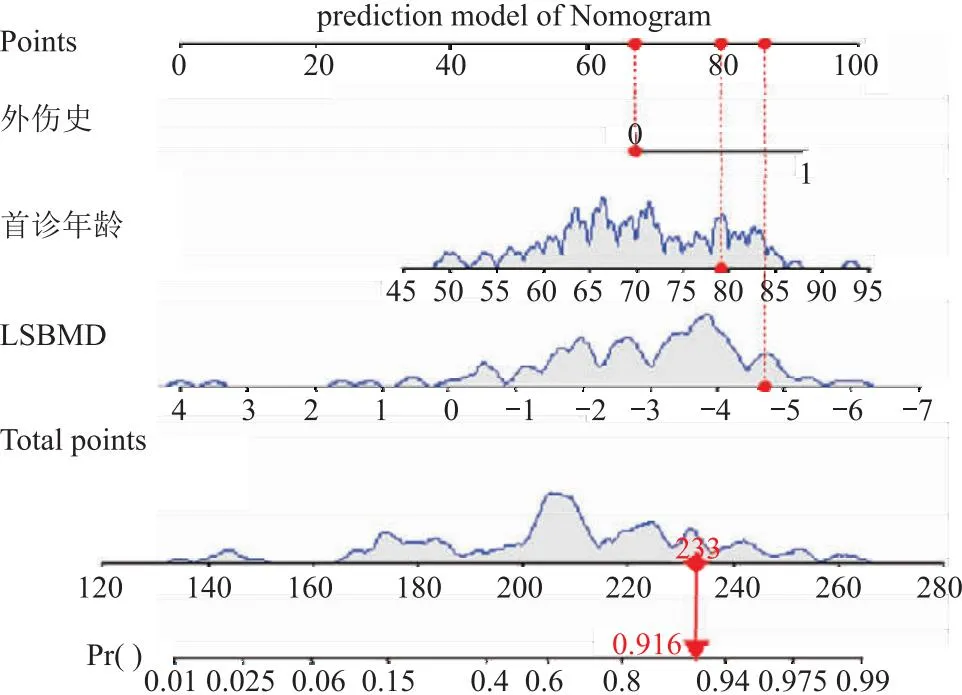
圖2 PWVCF的Nomogram預測模型
2.6 Nomogram的校正與驗證 使用R語言中hoslem.test函數對模型進行Hosmer-Lemeshow擬合優度檢驗,結果顯示:χ2=9.682,P=0.288(P>0.05代表擬合優度良好)。運用R語言rms包中的calibrate函數作Nomogram預測模型的校正曲線(重復1 000次偏差校正,引導平均絕對誤差=0.023,n=123)(圖3),曲線斜率約等于1。運用C-指數和ROC曲線判斷Nomogram模型預測值與真實值的區分度,結果顯示:C-指數為0.847,ROC曲線的AUC值為0.846 8(95%CI:0.773 4~0.920 3),ROC曲線最佳閾值為0.302,特異度和靈敏度分別為0.688、0.893,提示該模型具有較高的準確性,見圖4。

圖3 PWVCF Nomogram預測模型的校正曲線
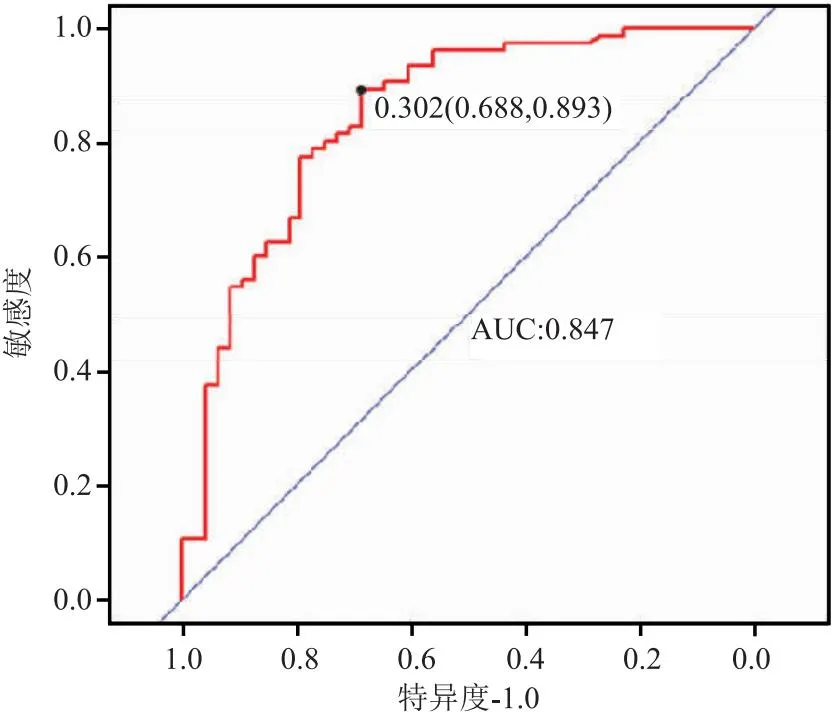
圖4 PWVCF Nomogram預測模型的ROC曲線
3 討論
BMD與骨骼顯微結構密不可分,骨小梁的數量、質量(粗細或長短)、走向以及骨小梁之間的相互連接紊亂等均可能影響BMD和骨折[10]。BMD越低代表骨組織結構越差,骨骼所承受的應力在骨小梁中分布不均勻,更易引發骨折。Bernstein等[11]曾指出股骨粗隆間骨折與BMD減低相關。Lee等[12]研究發現骨量減少和骨質疏松人群發生VCF分別是骨量正常人群的1.57倍和2.2倍。本研究預測模型得出:LSBMD T值每下降1個標準差,PWVCF評分增加10分,預示著LSBMD越低發生PWVCF的風險越高,與上述學者[11-12]報道基本一致。文獻報道,最佳部位BMD的檢查受體重、睡姿、優勢肢體及肌肉力量等因素的影響,可能對預測骨折能力存在一定的差異[13]。常用的FRAX和Garvan等骨折預測工具均基于股骨頸BMD,而有的文獻報道LSBMD在女性患者中預測骨折的能力優于股骨頸BMD[14-15]。因此,本研究單從LSBMD研究不排除存在一定的偏倚,仍需聯合股骨頸、橈骨或全髖部等部位的研究進一步證實。其次,若BMD與VCF發生率不匹配時,需要補充其他因素(如:年齡、外傷史等)評估。Negreiros等[16]發現大約1/4的低BMD人群(T值<-2)存在無癥狀性VCF,年齡≥61歲是危險因素之一。Watt等[17]也報道BMD變化和外傷史均能影響VCF的發生。
年齡不僅影響BMD的變化,也能影響骨折的發生,在絕經后女性患者中的表現尤為突出[18-19]。Pan等[20]研究臺灣65歲以上老年人骨折發現,女性發生骨折的風險是男性的2.19倍。Holloway等[21]報道,大部分女性在50歲后發生首次骨折,隨著年齡的增長,骨折發生的風險也隨之升高。Cui等[22]調查北京地區絕經后婦女椎體骨折,發現60歲以下女性椎體骨折患病率為13%,80歲以上年齡則上升至58.1%;Cho等[23]橫斷面研究韓國PWVCF與年齡的關系,其中發現50歲以上年齡段VCF發生的概率為29.5%,60歲以上年齡段其發生骨折的概率為42.2%,70歲以上年齡段為63%。各地區報道絕經后女性年齡影響VCF的發生率不一,但整體趨勢呈現出年齡越大,發生率越高。分析絕經后女性易發生椎體骨折的可能原因如下[24-25]:絕經后女性的雌激素水平大幅度下降,年齡不斷變老,肌肉逐漸萎縮、運動量下降也使得肌肉力量不斷減弱,骨形成的刺激減少,以致BMD出現下降趨勢,增加骨折的風險。結合本研究表1結果和Nomogram模型得出,骨折組年齡高于非骨折組(P<0.05),年齡每增加5歲,發生PWVCF的風險評分增加7分。進一步說明年老的患者更易發生PWVCF,與上述文獻報道的結論一致。
外傷是造成骨折的重要原因之一。從表1看出,骨折組與非骨折組在外傷史方面的χ2檢驗差異性有統計學意義(P<0.05),Logistic回歸分析也提示有外傷史的患者發生椎體骨折的風險較無外傷史者高18.5%。Nomogram模型預測骨折顯示有外傷史者較無外傷史者高25分。上述結果均提示外傷確實能增加PWVCF的風險。絕經年齡雖在本研究中不影響PWVCF,但絕經后婦女無外傷史的患者Nomogram預測模型高達67分,間接說明絕經狀態(是否絕經)可能影響VCF。對無外傷史患者而言,除了考慮年齡和BMD之外,不排除與某些基因的改變有關,如:Ahn等[26]研究發現絕經后婦女TS基因和MATHFR基因的3′-UTR多態性與骨質疏松及骨質疏松性VCF的易感性有關。這一觀點仍需與非絕經患者及基因學進一步研究證實。
此前部分研究表明,絕經年齡、BMI、血脂水平(TC、TG)是PWVCF的危險因素[8,22,27]。但本文的Logistic回歸分析顯示:絕經年齡、BMI、血脂水平均無統計學差異(P>0.05),本研究與既往其他研究結果相矛盾,后續需多中心、大樣本、雙盲進一步研究證明。
4 結論
在評估PWVCF的過程中,應將首診年齡、外傷史、LSBMD狀態常規作為VCF的重要危險因素。C-指數和AUC值大于0.7以上,本研究構建PWVCF的Nomogram預測模型具有較高準確性,提高判斷高危人群的效率,為PWVCF的早期預防和診斷提供一定價值。

