Aβ1-42誘導的阿爾茨海默病細胞模型中神經(jīng)損傷及凋亡的機制
王昱馳,馬宏玉,王振宇,張少軒,張育泰,高宇航,孫嘉偉(石河子大學醫(yī)學院基礎(chǔ)醫(yī)學系病理生理學教研室,石河子 832002;通訊作者,E-mail:jiaweisun01@163.com)
AD是老齡化人口中普遍存在的一種進行性神經(jīng)系統(tǒng)退行性疾病,主要以腦皮質(zhì)與海馬神經(jīng)元丟失、β-淀粉樣蛋白(Aβ)沉積和Tau蛋白磷酸化(p-Tau)引起的神經(jīng)纖維纏結(jié)為特征,其臨床表現(xiàn)為進行性認知功能障礙和記憶力損害[3-5]。AD可導致神經(jīng)元細胞的廣泛凋亡,但其具體致病機制至今仍不明確[6]。已知細胞凋亡中最主要的病理性生化事件為半胱天冬酶(cysteiny laspartate specific proteinase,CASP)級聯(lián)反應的激活,且半胱氨酸酶-3(Caspase-3)是細胞凋亡過程中最主要的終末剪切酶,研究表明在AD患者的樣本中檢測到其水平的改變[7]。早期AD中常見的病理變化為神經(jīng)元突觸素(synapsin,SYP)、維持微管穩(wěn)定的蛋白(microtubule associated protein 2,MAP-2)的降低導致突觸處于不穩(wěn)定狀態(tài)甚至損傷,以及淀粉樣蛋白(amyloid β,Aβ)不受控制的寡聚化和聚集造成的神經(jīng)元細胞凋亡[8]。故我們選擇Caspase-3、SYP、MAP-2作為鑒別AD神經(jīng)元的蛋白指標。此外,神經(jīng)突蛋白1(Neuritin 1,NRN1)是一種與神經(jīng)發(fā)育和神經(jīng)可塑性密切相關(guān)的營養(yǎng)因子,對損傷神經(jīng)元具有一定的修復作用[9],其在神經(jīng)元中的表達具有一定的積極意義。
Aβ來自于其前體淀粉樣蛋白前體蛋白(amyloid precursor protein,APP)第672~711殘基裂解片段。有研究表明,Aβ1-42是AD患者腦中主要的淀粉樣蛋白沉積物,且Aβ1-42是Aβ中傳播性最強的亞型[10,11]。據(jù)報道,過多的Aβ可直接或間接通過影響線粒體的結(jié)構(gòu)或者功能進而誘發(fā)氧化應激、激活凋亡信號通路等級聯(lián)反應,導致大量的神經(jīng)元細胞損傷[12]。因此,結(jié)合Aβ的作用結(jié)果以及AD的病理特征,我們選擇Aβ1-42來誘導AD細胞模型的建立。
目前治療AD藥物的研發(fā)進展緩慢,AD預防和治療依然是相關(guān)研究領(lǐng)域的熱點[2]。已有的細胞模型缺乏對凋亡機制的預測和研究,因此建立適宜的AD細胞模型,有利于進一步研究AD發(fā)病機制及其預防和治療方法。本實驗擬通過Aβ1-42誘導小鼠海馬神經(jīng)元細胞HT22建立AD細胞模型,并通過生物信息學分析進一步明確Aβ1-42導致細胞凋亡的相關(guān)信號通路。
1 材料與方法
1.1 材料與試劑
Aβ1-42寡聚肽購自上海強耀科技有限公司;10%FBS和0.25%Trypsin-EDTA購自美國Thermo Fisher公司;DMEM培養(yǎng)基購自美國HyClone公司;0.01 mol/L PBS購自美國Sangon公司;Triton X-100購自加拿大Biosharp公司;BSA購自德國VETEC公司;PVDF膜購自美國Immobilon公司;RIPA裂解液、10%SDS、SDS-PAGE電泳液、CCK-8試劑盒、BCA蛋白濃度測定試劑盒均購自上海碧云天生物技術(shù)有限公司;cleaved-Caspase-3抗體、Caspase-3抗體、ERK抗體、p-ERK抗體均購自美國CST公司;MAP-2抗體、SYP抗體和NRN1抗體購自英國abcam公司;β-actin抗體以及山羊抗兔IgG、山羊抗小鼠IgG二抗均購自北京中杉金橋生物技術(shù)有限公司。
1.2 設(shè)備
生化培養(yǎng)箱購自上海博迅醫(yī)療生物儀器股份有限公司;熒光倒置顯微鏡購自德國ZEISS公司;多功能酶標儀與高速離心機購自美國Thermo Fisher公司;免疫印跡反式半干轉(zhuǎn)儀購自美國Bio-rad公司;全自動化學成像儀購自上海天能生命科學有限公司。
1.3 方法
1.3.1 細胞培養(yǎng)及實驗分組 HT22細胞株由黃瑾教授課題組惠贈,使用含10%FBS的DMEM培養(yǎng)基在37 ℃,5%CO2的細胞培養(yǎng)箱中培養(yǎng),細胞每隔2 d傳一代,傳代前1 d半量換液,定期觀察細胞形態(tài)及生長、貼壁情況。將HT22細胞懸液轉(zhuǎn)移至96孔細胞培養(yǎng)板中(100 μL/孔,約5 000個/孔),在細胞培養(yǎng)箱中孵育,待細胞貼壁;使用0.01 mol/L PBS(pH=7.4)溶解Aβ1-42粉末,配制不同濃度的Aβ1-42溶液(0,0.625,1.25,2.5,5,10,20,40 μmol/L),置于-80 ℃凍存,使用前置于37 ℃下老化7 d。分別使用各濃度Aβ1-42溶液干預處于生長對數(shù)期的細胞,其中Aβ1-42濃度為0 μmol/L的細胞中僅添加同體積PBS,以便與其他組別形成對照。每個濃度設(shè)置5個復孔,2 d后觀察細胞形態(tài)、檢測細胞存活率。每組實驗重復3次,確定建立AD細胞模型的最適濃度;隨后使用最適濃度干預HT22細胞,分別在6,12,24,48 h后觀察細胞形態(tài)、檢測細胞存活率。每組實驗重復3次,確定建立AD細胞模型的最適時間。
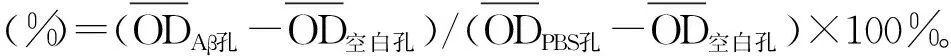
1.3.3 AD細胞模型的特征性蛋白鑒定 為明確Aβ1-42干預HT22細胞建立AD細胞模型的有效性,在Aβ1-42干預HT22細胞建立AD細胞模型的最適條件下,將細胞分為AD組(Aβ1-42+PBS)和NC組(PBS)。AD組取已用PBS配制好的20 μmol/L Aβ1-42溶液,NC組取同體積PBS溶液,分別干預處于生長對數(shù)期的細胞24 h。提取各組細胞蛋白,使用BCA試劑盒測定各組蛋白濃度,Western blot檢測cleaved-Capase-3、SYP、NRN1、MAP-2、ERK蛋白表達情況,免疫熒光檢測MAP-2分布情況。一抗分別為anti-cleaved-Caspase-3(1∶1 000)、anti-Caspase-3(1∶1 000)、anti-SYP(1∶5 000)、anti-MAP-2(1∶1 000)、anti-NRN1(1∶1 000)、anti-ERK(1∶1 000)、anti-p-ERK(1∶2 000),4 ℃孵育過夜;TBST洗膜4次,每次8 min,室溫下孵育二抗(1∶5 000)2 h,TBST洗膜4次,每次8 min,室溫孵育2 h,使用全自動化學成像儀曝光,以anti-β-actin(1∶1 000)作為內(nèi)參。
樣品配制:0.2 mL臭牡丹粗提物溶液(5.0 mg/mL)與0.2 mL DPPH甲醇溶液(25.0 mg/mL)混合均勻,37 °C下避光孵育30 min,直接進行HPLC-QTOF-MS/MS檢測.等體積甲醇替代DPPH自由基溶液作為空白對照組.
制作AD組和NC組細胞爬片,使用anti-MAP-2(1∶200)一抗4 ℃孵育過夜;孵育后第2天,室溫靜置30 min,使用PBS清洗3次,每次5 min;滴加二抗(FITC Goat anti-Rabbit IgG,1∶100),37 ℃孵育30 min。PBS洗3次,每次5 min。使用含DAPI的封片劑封片,避光陰干,熒光倒置鏡下觀察各組細胞MAP-2熒光分布情況。從滴加二抗開始,全程避光。
1.3.4 生物信息學分析 為探索Aβ、ERK與凋亡三者間可能存在的相關(guān)性,在Genecards上檢索了Aβ、ERK與Caspase-3相關(guān)基因。同時,在美國國家生物信息技術(shù)中心(National Center for Biotechnology Information,NCBI)網(wǎng)站GEO Data Sets數(shù)據(jù)庫中(https://www.Ncbi.nlm.nih.gov/gds)以阿爾茨海默病和海馬體為指標進行檢索,排除表觀遺傳學的影響,獲得了在AD模型海馬體CA1中表達的基因數(shù)據(jù)集(GSE28146)。之后,篩選出數(shù)據(jù)集中AD樣本(n=22),通過boxplot進行箱線圖繪制使得數(shù)據(jù)標準化,使用Spearman相關(guān)分析來描述不考慮分布情況的相關(guān)基因變量之間的相關(guān)性,并通過R軟件包pheatmap進行多基因相關(guān)性熱圖的展示,P<0.05被認為差異具有統(tǒng)計學意義。
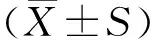
2 結(jié)果
2.1 確定Aβ1-42建立AD細胞模型的最適濃度
2.1.1 不同濃度下細胞形態(tài)學變化 倒置顯微鏡下觀察細胞形態(tài),結(jié)果顯示:正常HT22細胞(Aβ1-42濃度為0時),細胞伸展良好、細胞透亮,神經(jīng)突明顯;隨著Aβ1-42濃度梯度的增加,細胞形態(tài)變化明顯,體積變小,核固縮、細胞碎片明顯增多,存活細胞數(shù)量明顯減少(見圖1)。
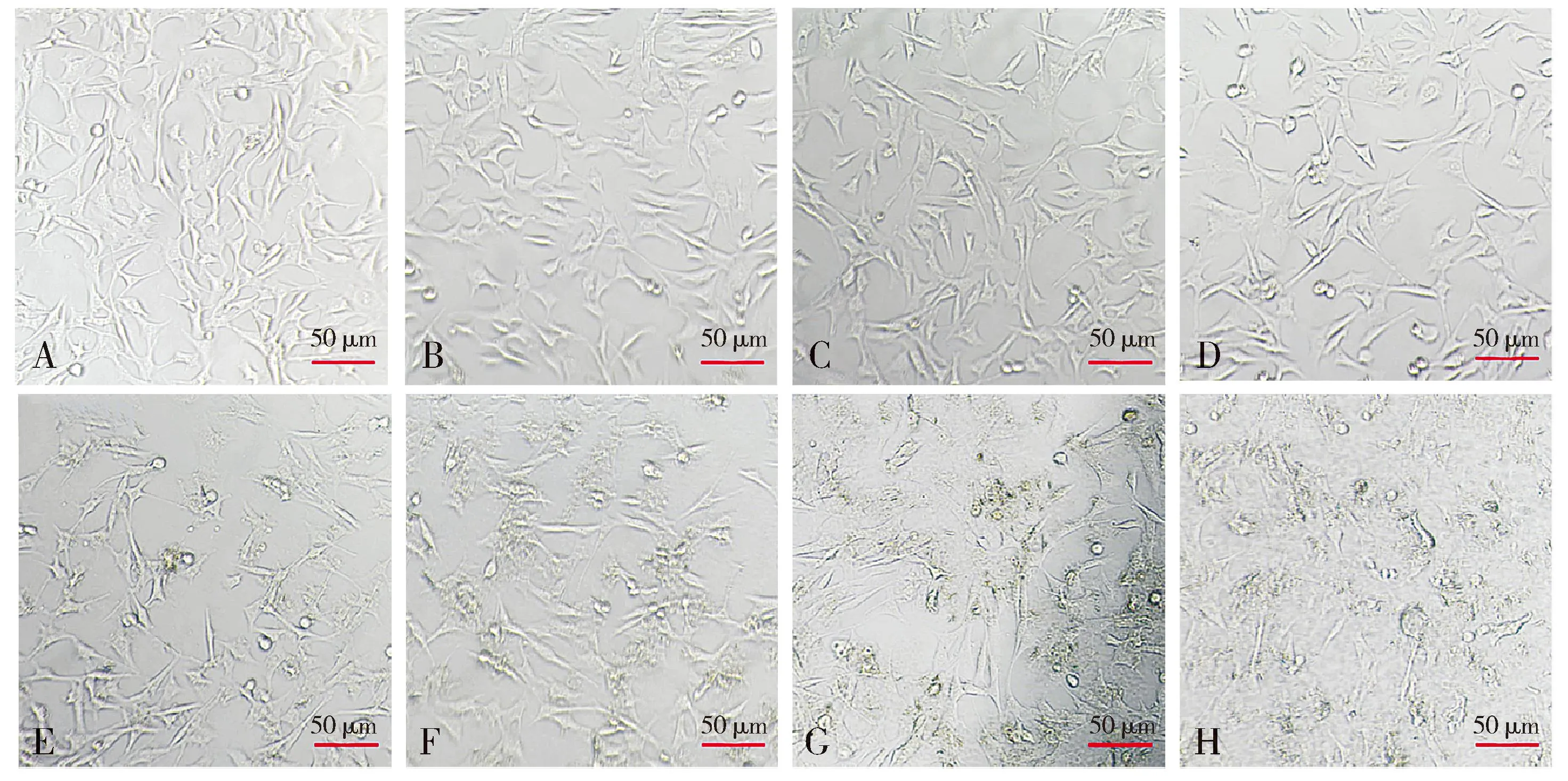
注:A-H.Aβ1-42濃度分別為0,0.625,1.25,2.5,5,10,20,40 μmol/L。圖1 不同濃度Aβ1-42干預HT22細胞的形態(tài)觀察Figure 1 Morphological changes of HT22 cells after intervened with different concentrations of Aβ1-42
2.1.2 不同濃度下細胞存活率變化 CCK-8結(jié)果顯示,隨著Aβ1-42濃度的增加,細胞活性逐漸降低;與正常HT22細胞相比,20 μmol/L Aβ1-42作用后,HT22細胞存活率降低,差異具有統(tǒng)計學意義(P<0.000 1,見圖2),且部分存活細胞仍能保持正常細胞的形態(tài)。結(jié)合形態(tài)學觀察和存活率檢測,選擇20 μmol/L作為Aβ1-42干預HT22細胞建立AD細胞模型的最適濃度。
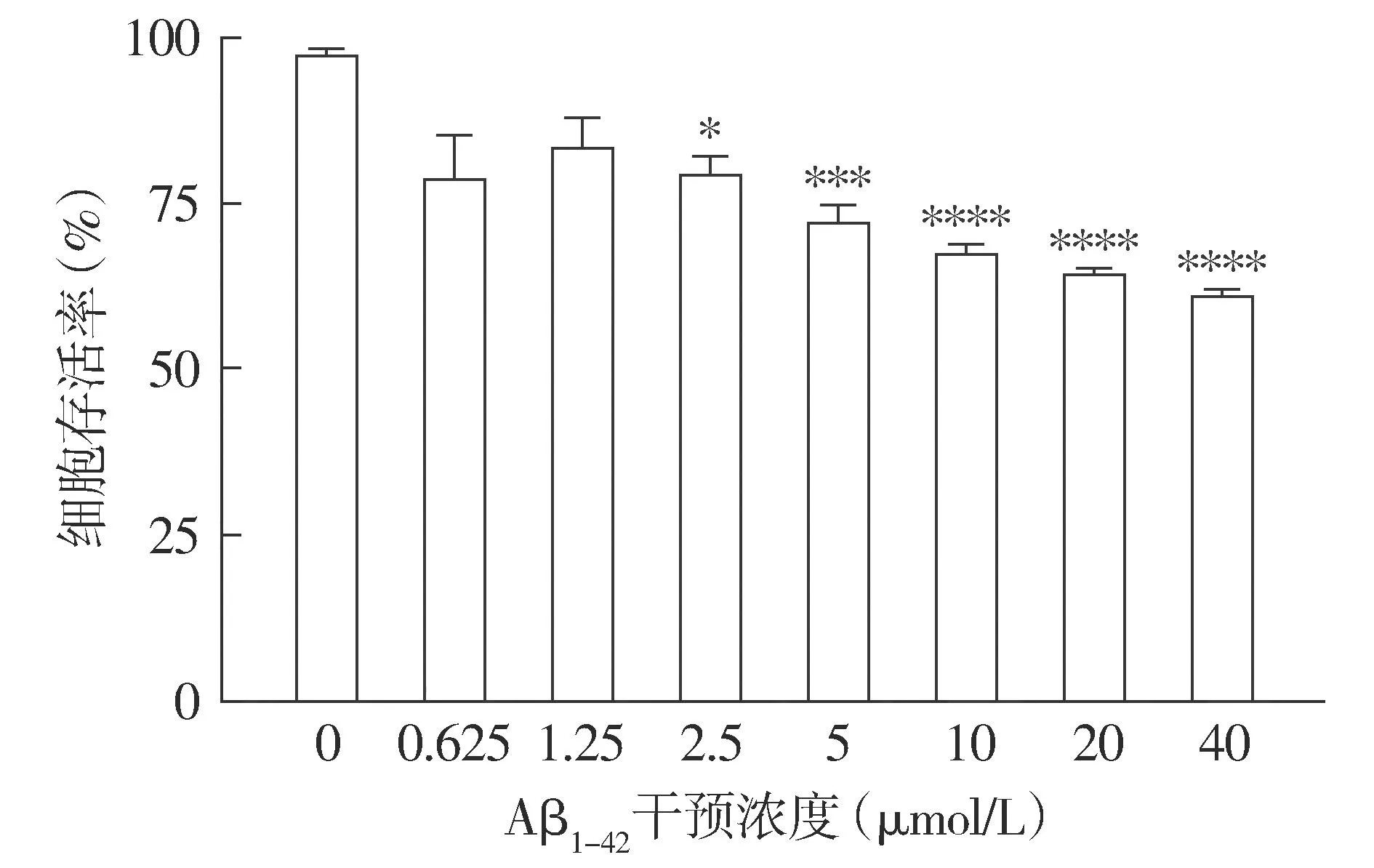
注:與0 μmol/L相比較,*P<0.05,***P<0.001,****P<0.000 1。圖2 不同濃度Aβ1-42干預后HT22細胞存活率的變化Figure 2 Viability of HT22 cells after intervened with different concentrations of Aβ1-42
2.2 確定Aβ1-42建立AD細胞模型的最適時間
2.2.1 不同干預時間后細胞形態(tài)學變化 根據(jù)上述實驗,我們使用Aβ1-42的最適濃度20 μmol/L干預HT22細胞,分別在6,12,24,48 h觀察各組細胞形態(tài)學變化。結(jié)果顯示:隨著干預時間的延長,細胞胞體收縮、變形,細胞膜完整性破壞,細胞外基質(zhì)雜亂不清,可見較多凋亡、壞死細胞(見圖3)。

圖3 不同時間Aβ1-42干預HT22細胞的形態(tài)觀察Figure 3 Morphological changes of HT22 cells after Aβ1-42 intervention for different time
2.2.2 不同干預時間后細胞存活率變化 CCK-8結(jié)果顯示,隨著干預時間延長,Aβ1-42對細胞的毒性作用明顯增加,細胞活性呈整體降低趨勢(見圖4);與6 h相比,干預24 h時,細胞存活率降低,差異有統(tǒng)計學意義(P<0.001,見圖4),且部分存活細胞仍能保持正常細胞的形態(tài)。結(jié)合形態(tài)學觀察和存活率檢測,選擇24 h作為Aβ1-42干預HT22細胞建立AD細胞模型的最適時間。
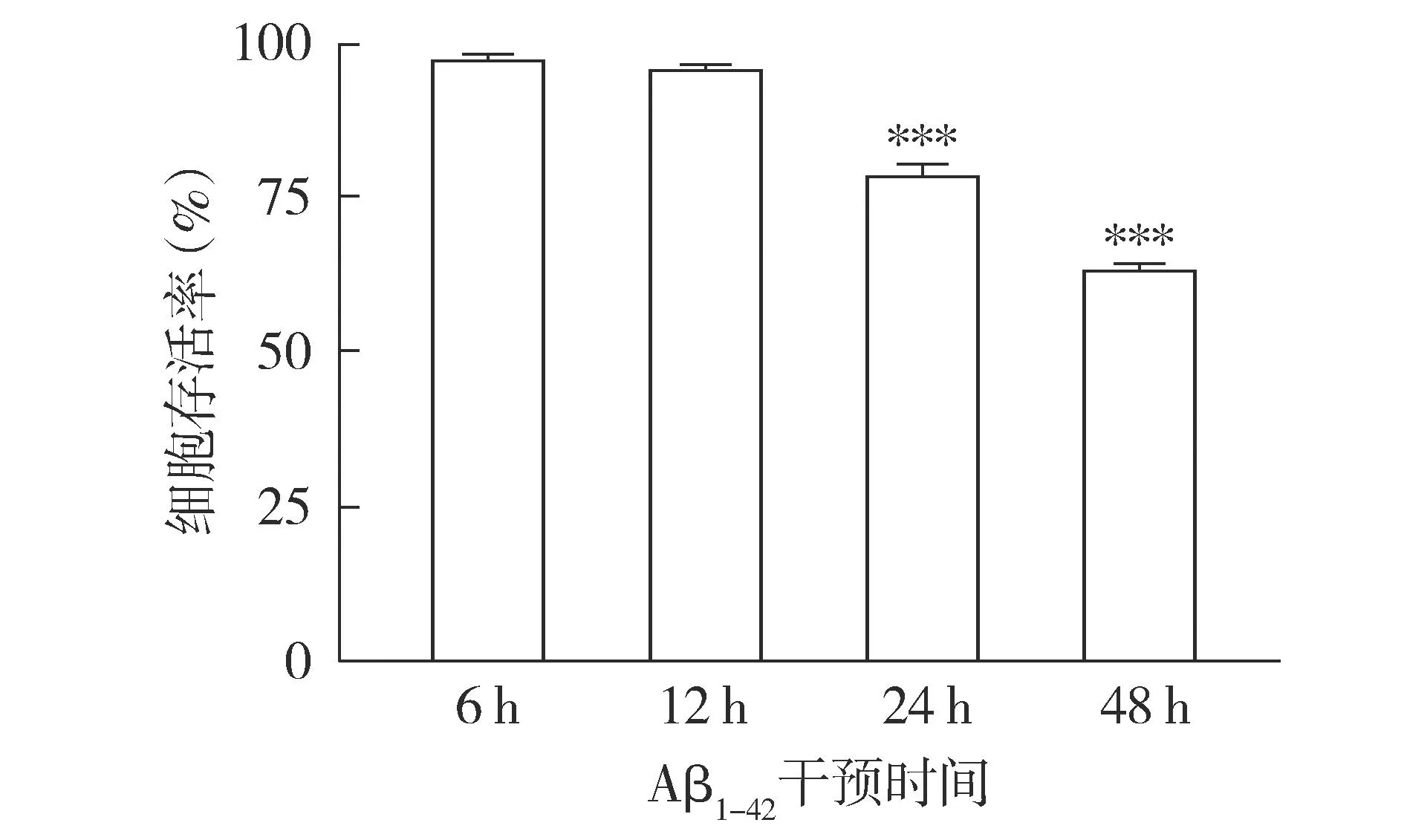
注:與6 h相比較,***P<0.001。圖4 20 μmol/L Aβ1-42干預不同時間后HT22細胞存活率變化Figure 4 Viability of HT22 cells after intervention with 20 μmol/L Aβ1-42 for different time
2.3 Aβ1-42干預HT22細胞建立AD細胞模型的特征性蛋白鑒定
2.3.1 AD細胞模型的凋亡蛋白及神經(jīng)營養(yǎng)因子檢測 Western blot結(jié)果顯示,與NC組相比,AD組中cleaved-Caspase-3的表達明顯增多,且cleaved-Caspase-3/Caspase-3比值升高(P<0.01,見圖5);AD組中NRN1蛋白的表達降低(P<0.000 1,見圖5)。
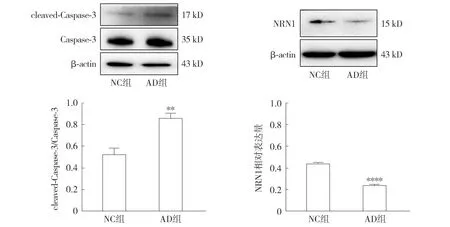
注:與NC組相比較,**P<0.01,****P<0.000 1。圖5 Western blot檢測Aβ1-42對HT22細胞凋亡及神經(jīng)營養(yǎng)相關(guān)蛋白表達的影響Figure 5 Effect of Aβ1-42 on expressions of apoptosis- and neurotrophic-related proteins in HT22 cells detected by Western blot
2.3.2 AD細胞模型的神經(jīng)突觸生長檢測 Western blot結(jié)果顯示,與NC組相比,AD組SYP蛋白與MAP-2蛋白的表達降低(P<0.01,見圖6)。免疫熒光檢測各組MAP-2在HT22細胞中的表達及分布情況,結(jié)果顯示:AD組細胞核周圍的MAP-2蛋白含量明顯減少(見圖7)。
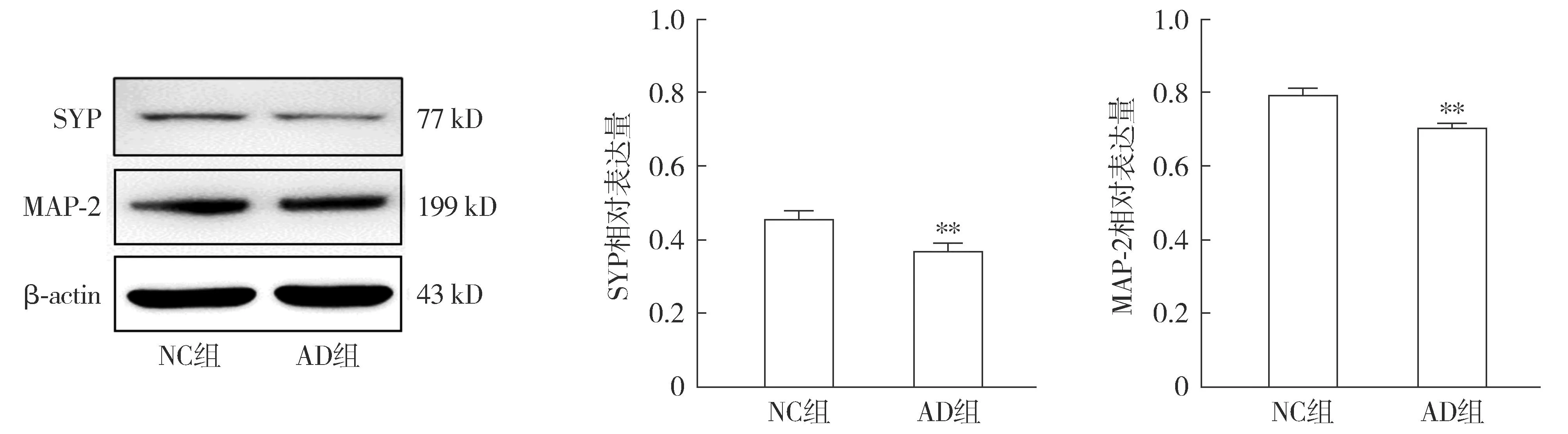
注:與NC組相比較,**P<0.01。圖6 Western blot檢測Aβ1-42對HT22細胞神經(jīng)突觸生長相關(guān)蛋白表達的影響Figure 6 Effects of Aβ1-42 on expressions of synaptic growth-related proteins in HT22 cells detected by Western blot
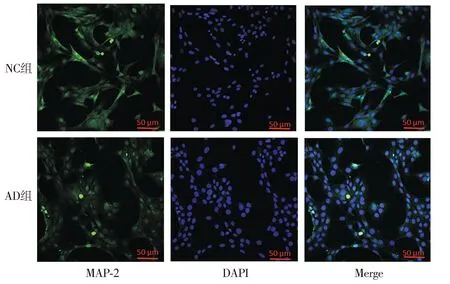
注:MAP-2為綠色熒光(FITC),細胞核為藍色熒光(DAPI)。圖7 AD細胞模型中MAP-2免疫熒光結(jié)果Figure 7 Immunofluorescence results of MAP-2 in AD cell models
2.4 AD模型相關(guān)信號通路的生物信息學分析及鑒定
2.4.1 AD模型相關(guān)信號通路的生物信息學分析 Genecards檢索結(jié)果示Aβ和ERK1/2蛋白的結(jié)構(gòu)基因為APP、MAPK3、MAPK1;Swiss-Prot數(shù)據(jù)庫結(jié)果示Caspase-8,9,10參與凋亡通路的激活,其結(jié)構(gòu)基因分別為CASP8、CASP9、CASP10。相關(guān)性分析結(jié)果顯示:22個AD樣本基因表達量基本相同,可認為樣本同質(zhì)(見圖8A);MAPK3(ERK1)與APP呈明顯正相關(guān)(r=0.634,P<0.01),與CASP9(Caspase-3重要的激動劑)呈正相關(guān)(r=0.513,P<0.05,見圖8B)。
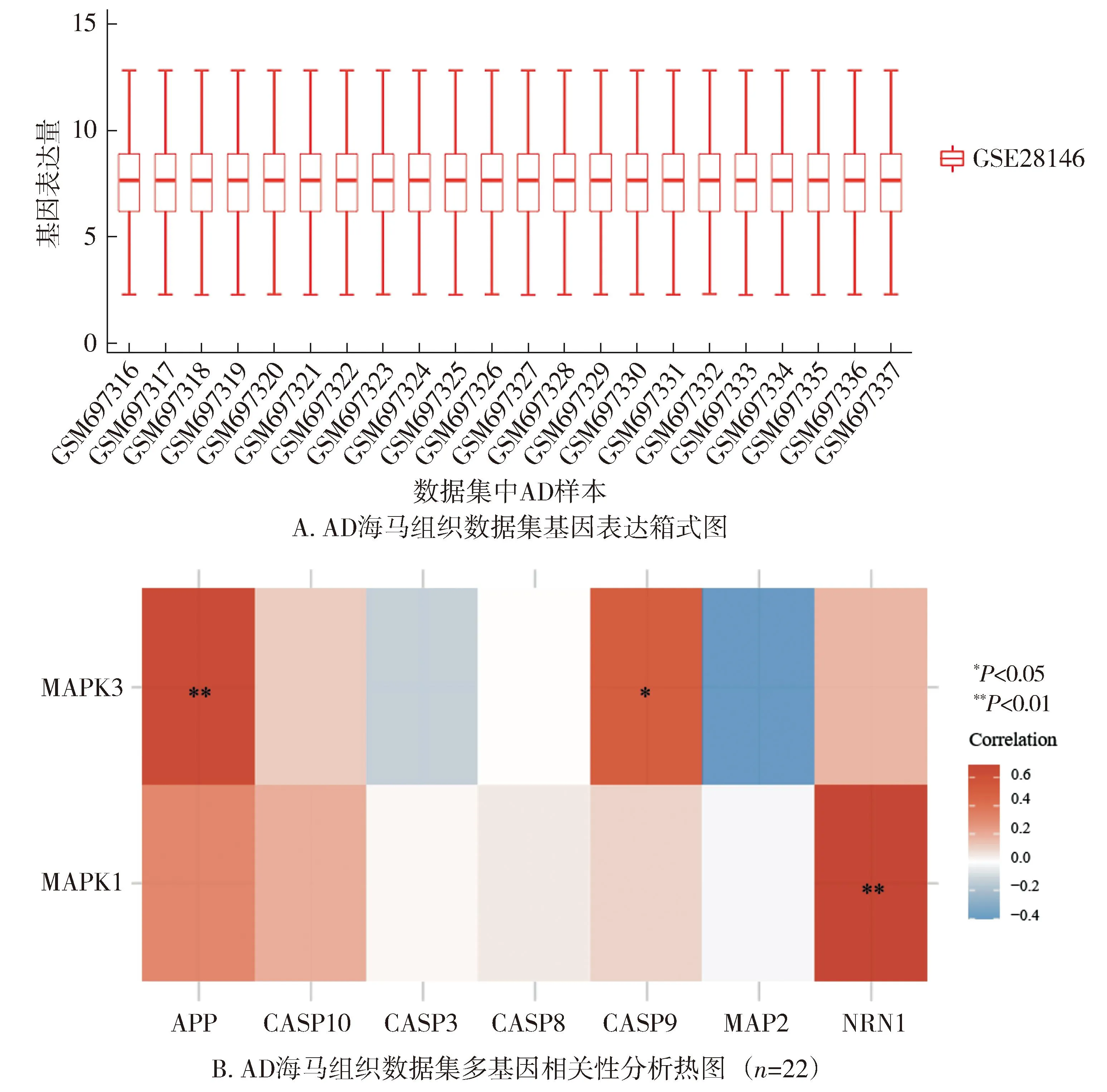
圖8 AD模型相關(guān)信號通路的生物信息學分析Figure 8 Bioinformatics analysis of signaling pathways associated with AD models
2.4.2 AD細胞模型中ERK信號通路變化的檢測 Western blot結(jié)果顯示,與NC組相比,AD組中p-ERK/ERK比值升高,差異具有統(tǒng)計學意義(P<0.05,見圖9)。表明本文建立的AD細胞模型中ERK激活增多,提示ERK信號通路的激活可能與AD進展(Aβ表達增加)相關(guān)。
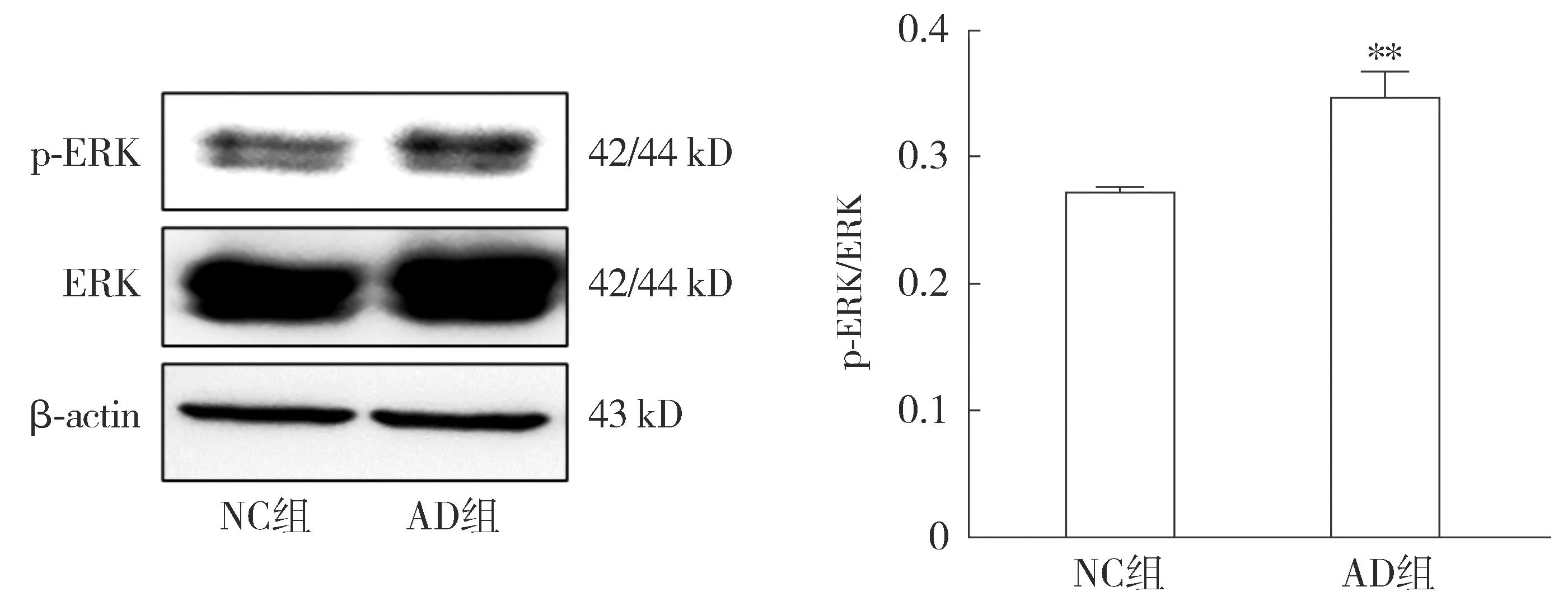
注:與NC組相比較,**P<0.01。圖9 Western blot檢測Aβ1-42對HT22細胞ERK信號通路相關(guān)蛋白表達的影響Figure 9 Effects of Aβ1-42 on the expressions of ERK signaling pathway-related proteins in HT22 cells detected by Western blot
3 討論
AD是一種常見的神經(jīng)系統(tǒng)退行性疾病,其核心表現(xiàn)為腦內(nèi)淀粉樣斑塊堆積和MAPT/tau神經(jīng)纖維纏結(jié)。Aβ清除失調(diào)對于其在大腦內(nèi)的積聚和斑塊的形成具有重要意義[13]。目前的研究仍然無法明確AD疾病發(fā)病的確切機制,它的診斷治療和干預措施也受到限制[14]。關(guān)于AD的發(fā)病機制,目前提出了淀粉樣蛋白學說、細胞凋亡學說、氧化應激學說、鈣超載學說、膽堿能學說等多種學說[15,16]。研究表明,AD的發(fā)生發(fā)展多與神經(jīng)元丟失、神經(jīng)元凋亡密切相關(guān)[17]。為進一步探索其發(fā)生機制,我們建立了適宜的AD細胞模型。
本實驗采用不同濃度梯度的Aβ1-42干預HT22細胞,在一定范圍內(nèi),Aβ1-42濃度和干預時間均與HT22細胞活性整體呈負相關(guān),較高濃度和較長干預時間的Aβ1-42能夠更好地誘導HT22細胞分化成AD樣細胞。因此,根據(jù)細胞存活率以及鏡下觀察結(jié)果得出,當Aβ1-42濃度為20 μmol/L,干預時間為24 h時,能夠保證HT22細胞在較高存活率的前提下,在細胞水平上表現(xiàn)出明顯的早期AD樣特征:神經(jīng)元結(jié)構(gòu)受損、突觸可塑性降低、和部分神經(jīng)元凋亡。
為確保模型的有效性,本實驗通過Western blot和免疫熒光來分析AD組和NC組在細胞凋亡相關(guān)蛋白Caspase-3,神經(jīng)突觸生長相關(guān)蛋白SYP、MAP-2,神經(jīng)營養(yǎng)因子NRN1的表達差異。結(jié)果顯示:與NC組相比,AD組凋亡活化指標cleaved-Caspase-3蛋白表達升高,神經(jīng)營養(yǎng)因子NRN1表達降低,神經(jīng)元結(jié)構(gòu)相關(guān)指標SYP、MAP-2蛋白表達降低。上述結(jié)果表明AD組細胞凋亡增多、神經(jīng)元結(jié)構(gòu)受損、突觸穩(wěn)定性下降。這與AD早期病理變化特征相一致,提示Aβ1-42對HT22細胞具有明顯的毒性作用。以上實驗證明我們所建立的AD細胞在蛋白水平上具有較典型的AD樣特征,即可認為Aβ1-42干預濃度和時間分別為20 μmol/L和24 h,為較理想的AD建模條件。
大量證據(jù)表明,神經(jīng)元的丟失與多種信號通路的相互作用密切相關(guān)[18-21]。即AD退行性進展與其信號通路的改變有關(guān)。細胞外調(diào)節(jié)蛋白激酶(extracellular regulated protein kinases,ERK)信號通路是經(jīng)典MAPK信號通路成員之一,其成員包括ERK1和ERK2,分子量分別為44 kD和42 kD[22]。有研究發(fā)現(xiàn),ERK在中樞神經(jīng)系統(tǒng)中對神經(jīng)細胞增殖和分化、突觸可塑性、學習記憶能力和軸突生長等具有重要意義[23]。據(jù)報道,ERK主要存在神經(jīng)元細胞的軸突、樹突中,其通路激活(即ERK磷酸化)可以將刺激信號傳導到細胞核內(nèi),且ERK信號通路參與了AD的病理發(fā)展過程,在APP的加工過程中發(fā)揮重要作用[24]。Pak等[20]和Hong等[21]最新研究發(fā)現(xiàn),ERK(正常調(diào)控范圍下)能激活細胞外信號調(diào)節(jié)激酶(cAMP)反應元件結(jié)合蛋白信號通路(ERK/CREB),進而激活Ras-MAPK通路促進神經(jīng)元生長再生。另外,Sun等[22]的研究表明,ERK信號通路激活能增加α-分泌酶的活性,進而促進可溶性APPα釋放,減少Aβ的產(chǎn)生和沉積。
為探討Aβ1-42導致HT22分化及凋亡的機制,我們通過分析ERK與Aβ及凋亡基因的相關(guān)性來分析可能的靶向信號通路,結(jié)果顯示:在基因組水平上,ERK與APP,CASP9表達呈正相關(guān)。而Caspase-9為Caspase-3的激動劑,可以通過促進Caspase-3剪切成cleaved-Caspase-3激活細胞凋亡機制。據(jù)報道,分子層面上,Aβ斑塊可刺激促進神經(jīng)元中與細胞周期進展相關(guān)的因子的異常表達,從而導致Caspase-3激活增加,促進神經(jīng)元凋亡[25]。為進一步明確Aβ、ERK與凋亡的相關(guān)性,我們通過Western blot發(fā)現(xiàn)AD組ERK磷酸化比例增高,即ERK信號通路處于高激活狀態(tài)。現(xiàn)有研究報道,AD細胞中多個信號通路共同作用,具體表現(xiàn)為:Ras-ERK信號通路參與細胞周期和凋亡的進展、JNK信號通路與抗凋亡蛋白表達呈負相關(guān)、ERK信號通路磷酸化與不可溶性蛋白沉積密切相關(guān)、JAK-STAT信號通路增強Caspase-3介導的神經(jīng)變性[4,26]。因此,我們推測Aβ1-42可能增強Ras-ERK信號級聯(lián),而ERK信號通路很可能為Aβ1-42導致HT22細胞凋亡、阻滯細胞分裂,分化為AD細胞的靶向通路之一。
結(jié)合眾多研究,我們認為ERK通路對AD進展可能具有輕度抑制作用。但由于AD病程不可逆性的加劇,APP基因調(diào)控生成Aβ斑塊的能力可能大于ERK通路清除Aβ斑塊的能力,故ERK在一定程度上可能延緩AD進展,但并不能逆轉(zhuǎn)AD進程。因此我們推測:AD病程不可逆性的加劇可能與ERK通路磷酸化程度有關(guān),即p-ERK/ERK比值。然而,ERK是否在AD進程中發(fā)揮抑制作用,以及ERK在AD進程中發(fā)揮作用的具體機制仍未完全闡明。因此,未來我們將把更多精力投入在AD細胞模型中ERK信號通路相關(guān)蛋白的監(jiān)測上,以期通過熒光顯微鏡技術(shù)等標記信號分子和細胞結(jié)構(gòu),通過活細胞成像實時觀察信號分子的動態(tài)變化。
綜上所述,在Aβ1-42濃度為20 μmol/L,干預時間為24 h的培養(yǎng)條件下,HT22細胞表現(xiàn)出較明顯的AD病理特征,可以認為是較理想的AD細胞建模條件。同時,本實驗利用生物信息學的技術(shù),分析并驗證Aβ1-42導致神經(jīng)損傷及細胞凋亡的候選靶向信號通路之一是ERK,繼而為探索AD的發(fā)病機制提供新的思路,對于在細胞水平和分子水平上研究AD的發(fā)病機制提供科學依據(jù)。

