經尿道等離子電切術聯合吡柔比星膀胱灌注治療腺性膀胱炎后復發的影響因素及其風險預測
袁金成,杜亞斌,李方龍,孟曉東,趙新鴻
腺性膀胱炎(cystitis glandularis,CG)是正常膀胱黏膜被覆尿路上皮的一種化生性病變,發病率為0.1%~1.9%,但隨著膀胱炎癥刺激增加、泌尿外科內鏡技術應用增多,其患病率呈逐漸升高趨勢[1,2]。CG病因目前尚未完全明確,研究認為與反復持續的膀胱慢性刺激、Pund退化、臍尿管關閉異常有關,臨床癥狀不典型,常見為尿路刺激征、血尿,因此常被誤診為尿道綜合征[1]。臨床上CG曾被認為是膀胱癌前病變,多按腫瘤原則處理[3],但觀點不一,爭議較大。目前經尿道等離子電切術是臨床常用治療CG的方式,具有術后并發癥少、近期療效顯著的優勢,但術后復發率仍居高不下,嚴重影響患者身心健康[4]。因此,有學者提出對CG患者術后給予藥物膀胱灌注可提高遠期療效,降低復發率[5]。吡柔比星是腫瘤抗生素,羅超[6]發現,經尿道等離子電切術后給予吡柔比星灌注化療能降低其復發率。國內外關于經尿道等離子電切術聯合吡柔比星膀胱灌注對CG復發危險因素及風險預測研究較少。因此,本研究回顧性方式分析經尿道等離子電切術聯合吡柔比星膀胱灌注化療的CG患者臨床資料,探討其治療后復發情況及建立預測風險模型,早期預防,減少CG復發,提高患者生活質量。
1 資料與方法
1.1 一般資料 回顧性分析2017-08至2020-08聯勤保障部隊第980醫院收治并行經尿道等離子電切術后吡柔比星膀胱灌注化療的240例CG患者臨床資料。其中男80例,女160例,年齡18~65(56.24±5.11)歲,體質量指數18~27(24.46±1.69)kg/m2,病程6~34(22.96±5.48)個月。納入標準:(1)經非手術治療無效;(2)尿常規檢查白細胞、紅細胞升高,超聲檢查顯示膀胱內黏膜增厚或占位性病變;(3)術后病理確診為CG。排除標準:(1)合并難以控制的泌尿系統感染;(2)合并心、肝、腎等功能不全;(3)合并膀胱功能障礙、尿道狹窄及前列腺惡性腫瘤;(4)靜脈腎盂造影發現上尿路病變;(5)隨訪資料不全。
1.2 治療方法 參考[7]制定本研究治療方案。患者取截石位,采用腰麻或腰麻聯合硬膜外麻醉,使用司邁等離子電切器SM20C和等離子電切鏡26 Fr經尿道等離子體雙極電切系統治療,設置電極、電凝功率分別為100 W、60 W,術中生理鹽水充盈膀胱,并連續沖洗,以電切環切除膀胱內病變黏膜及肉眼可見距離病變周圍1 cm內膀胱黏膜,深至淺肌層,術后常規留置尿管3 d,常規抗炎;切除標本送病理。術后即刻膀胱灌注化療,吡柔比星30 mg膀胱灌注化療,保留時間1 h,每周1次,持續灌注8周后,此后每月1次,共10次。
1.3 復發判斷 術后1年內每3個月復查膀胱鏡,之后每6個月門診復查1次,隨訪至治療后2年,復發:膀胱鏡中發現異常者行活檢術,活檢復查出現CG。
1.4 資料收集 收集患者臨床資料,包括年齡、體質指數、病程、吸煙史、飲酒史、高血壓史、糖尿病史、有無尿路感染及尿路結石、臨床分型、病理類型、手術時間、術中出血量、并發癥、病灶位置、尿素氮(blood urea nitrogen,BUN)、白蛋白(albumin,ALB)、血肌酐(serum creatinine,SCr)、紅細胞分布寬度(red blood cell distribution width,RDW)、中性粒細胞與淋巴細胞比值(neutrophil lymphocyte ratio,NLR)等。
2 結 果
2.1 CG復發情況 240例CG患者經尿道等離子電切術聯合吡柔比星膀胱灌注治療并隨訪2年后,CG復發34例,復發率為14.17%,未復發206例(85.83%)。
2.2 復發與未復發患者臨床資料比較 復發組與未復發組患者性別、體質指數、病程、吸煙史、飲酒史、高血壓史、糖尿病史、手術時間、術中出血量、并發癥、BUN、ALB、SCr比較,差異無統計學意義(P>0.05);復發組患者年齡、RDW、NLR及尿路感染、尿路結石、高危型、腸化生型、彌漫型比例高于未復發組(P<0.05,表1)。
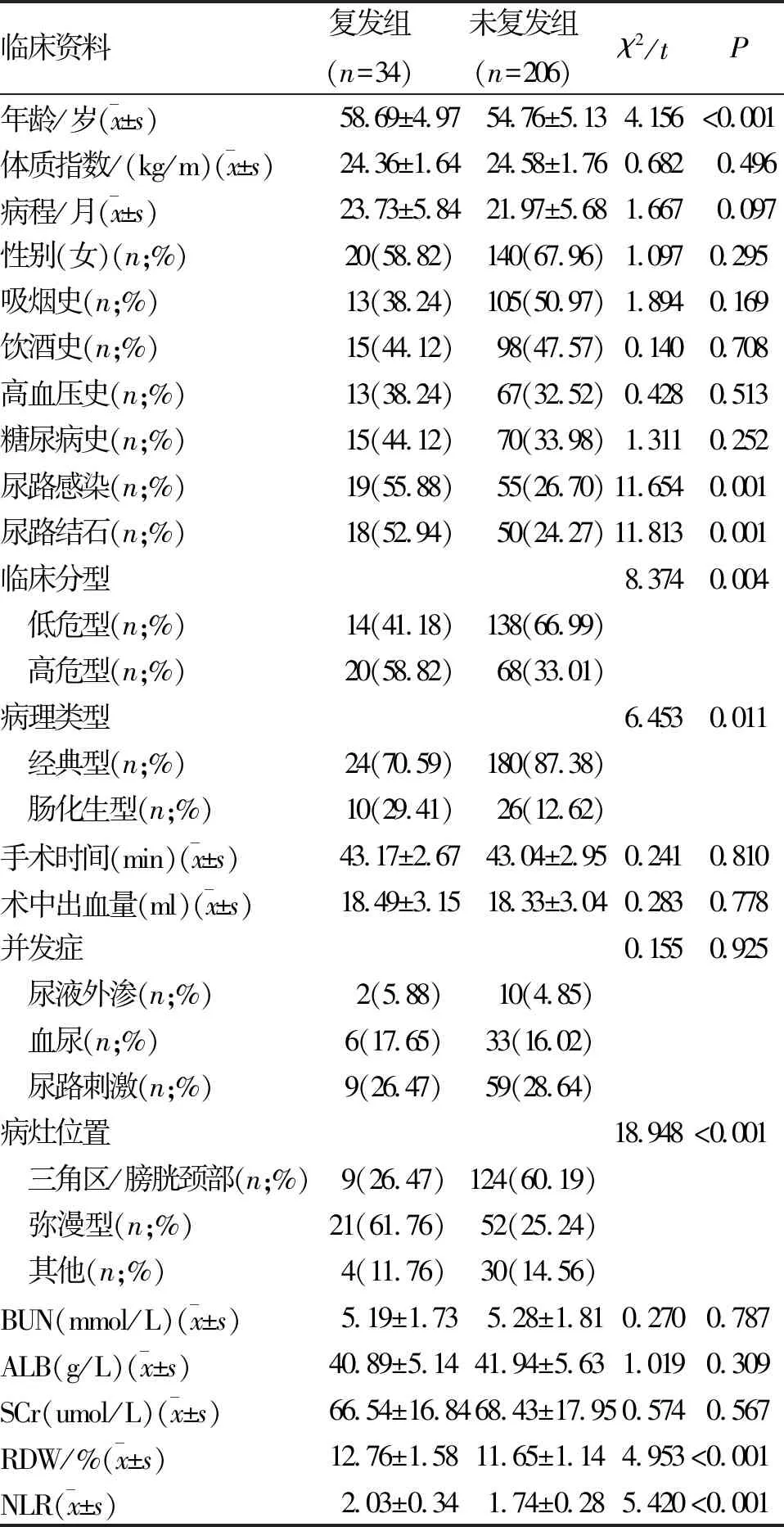
表1 腺性膀胱炎經經尿道等離子電切術聯合吡柔比星膀胱灌注治療后復發與未復發患者臨床資料比較
2.3 復發的Logistic多因素回歸分析 以CG經尿道等離子電切術聯合吡柔比星膀胱灌注化療后有無復發作為自應變量,賦值(復發=1,未復發=0),將復發與未復發患者臨床資料中存在差異的因素作為自變量進行賦值,尿路感染(有=1,無=0)、尿路結石(有=1,無=0)、臨床分型(高危型=1,低危型=0)、病理類型(腸化生型=1,經典型=0)、病灶位置(彌漫型=1,三角區/頸部、其他=0)。臨床分型、病理類型、RDW、NLR是CG經尿道等離子電切術聯合吡柔比星膀胱灌注化療后復發的獨立危險因素(P<0.05,表2)。將臨床分型、病理類型、RDW、NLR作為協變量,CG經尿道等離子電切術聯合吡柔比星膀胱灌注化療后有無復發作為因變量(賦值:復發=1,未復發=0),構建風險模型,其表達式為P=h0(t)exp[(0.659×臨床分型)+(0.536×病理類型)+(0.587×RDW)+(0.642×NLR)]。通過Hosmer-Lemeshow擬合優度檢驗,差異無統計學意義(P>0.05),風險模型整體擬合良好。
2.4 風險模型預測CG經尿道等離子電切術聯合吡柔比星膀胱灌注化療復發的效能 ROC曲線顯示,風險模型預測CG經尿道等離子電切術聯合吡柔比星膀胱灌注化療復發的曲線下面積(area under curve,AUC)為0.843(95%CI:0.791~0.887),最佳閾值為0.221,靈敏度為67.5%,特異度為87.9%(圖1)。
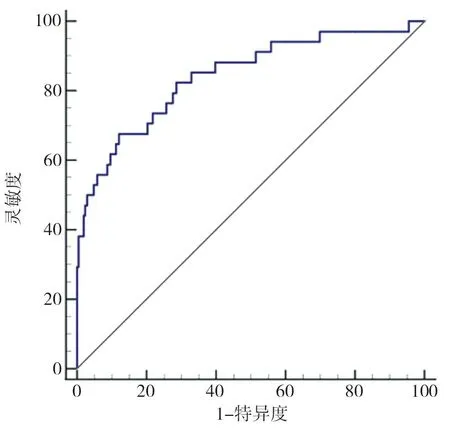
圖1 風險模型預測腺性膀胱炎經尿道等離子電切術聯合吡柔比星膀胱灌注化療復發的ROC
3 討 論
CG是膀胱黏膜一種特殊類型的病理性改變,臨床發病率較低,但隨著膀胱鏡、病理活檢廣泛應用,泌尿外科醫師、病理醫師對CG認知提高,使臨床CG診斷率有升高趨勢[8]。鏡檢下顯示CG乳頭表面光滑,無血管介入,不見血管分支,無浸潤性生長,認為是一種良性病變。CG是否會進展為惡性腫瘤尚無定論,治療方式無統一意見,單純行泌尿系統抗感染治療效果不佳,癥狀反復發作[9]。經尿道等離子電切術是目前公認治療CG有效的重要外科手段。采用雙極回路,術中生理鹽水持續沖洗可降低電切綜合征發生,等離子電切無熱傳導效應,無電流通過病灶相鄰的器官和組織,能減少膀胱穿孔機會[10]。雖然經尿道等離子電切術在治療CG上具有一定優勢,但手術視野小,對隱匿病灶、難以電切病灶、輸尿管周圍病灶等難以徹底切除存在一定局限,術后病灶殘余率高,增加術后復發風險[6]。研究證實,吡柔比星膀胱內灌注能使藥物迅速被膀胱內黏膜吸收,10 min后可達到黏膜固有層深度,同時機體其他部位吸收較少,安全性較好[11]。此外,絲裂霉素也是常見灌注藥物,其作用原理為通過抗代謝、在還原酶活化作用下解聚和交聯細胞DNA、抑制RNA合成,抑制腫瘤細胞分裂,且藥物分子劑量較大,不易被膀胱吸收,可直接作用于病變部位,因而不良反應較少;但高濃度易引發化學性膀胱炎,劑量控制存在一定困難[12]。
HU等[13]發現,經尿道電切術后患者隨訪27個月,約有59.35%的患者出現病理性復發或者癥狀復發。本研究結果顯示,240例中,CG復發34例,復發率為14.17%。周大海等[14]發現,經尿道電切術聯合吡柔比星灌注化療治療CG經10~24個月隨訪,復發率為13.04%,與本研究結果相符。張國紅[15]發現,吡柔比星膀胱灌注化療能抑制膀胱黏膜組織中殘留CG,防止病灶復發,繼而彌補經尿道等離子電切術治療的不足,降低CG復發率。提示經尿道等離子電切術聯合吡柔比星膀胱灌注治療可減少CG復發。
雖然CG術后進行吡柔比星膀胱灌注化療可降低其復發率,但復發率仍較高,同時術后膀胱灌注有過度治療之嫌,增加患者心理負擔。因此臨床需要對于高風險復發的患者確定針對性的隨訪策略。本研究結果顯示,CG復發患者年齡、RDW、NLR及尿路感染、尿路結石、高危型、腸化生型、彌漫型比例高于未復發患者。年齡較高的CG患者對炎癥反應耐受性下降,易引起炎癥擴散,增加感染風險,年齡高者往往合并前列腺增生、膀胱頸肥厚情況,術中解除這類慢性刺激可有效預防復發[16]。尿路感染、尿路結石可直接刺激膀胱局部細胞腺皮化。目前臨床上對CG的分型包括低危型和高危型,鏡下顯示紅潤乳頭瘤樣認定為高危型,慢性炎癥或小范圍濾泡樣為低危型,高危型CG有惡變可能,可將其視為癌前病變,增殖細胞抗核抗原、P53在高危型CG患者中表達較高,在膀胱腫瘤發生中起重要作用[1,17]。王晨靜等[18]發現,增殖細胞抗核抗原67在膀胱尿路上皮癌患者中高表達,與病變級別、分期有關,增加復發率。方新顏等[19]發現,P53在膀胱癌中高表達,與分化程度、被膜浸潤有關,可預測其復發。說明高危型CG患者有惡變可能,復發率更高。本研究中腸化生型占所有患者的15.00%,治療后復發率是經典型的2.40倍,較蘇醒等[20]研究結果中的3.712倍低,可能與復發樣本量有關,腸化生型CG端粒長度較正常尿路上皮細胞短,與尿路上皮癌存在相似染色體異常,參與腸上皮細胞分化和表型維持的轉錄因子Cdx2在腸化生型中表達較高。對此類CG可能存在復發和惡性風險的患者需進行長期規律隨訪。彌漫型為侵犯2處膀胱壁以上,手術可能難以徹底切除,術后極易復發。
炎癥在正常膀胱黏膜組織破壞、增生、化生過程中起重要作用,炎癥失控可促進炎性介質過度釋放,可促進CG進展[21,22]。大量研究發現,白介素-1、6表達水平升高可刺激血管內皮生長因子分泌,導致術區病灶組織增殖、復發[23,24]。顧建華等[25]發現,炎癥與CG術后復發的關系尚不明確,但RDW與CG術后復發呈獨立相關,而RDW能反映機體炎癥反映,與炎性指標相關,RDW每增高1%,CG復發概率可增加2.12倍。NLR為全身炎癥指標,具有調節和保護淋巴細胞平衡的作用,在多種惡性腫瘤的預后中具有一定預測價值。CG患者治療后持續慢性炎癥刺激會導致其復發,因此,對于RDW、NLR較高的CG患者可能存在復發的高風險,需引起足夠重視。
本研究發現,臨床分型、病理類型、RDW、NLR是CG經尿道等離子電切術聯合吡柔比星膀胱灌注化療后復發的獨立危險因素。顧建華等[25]研究顯示,RDW是CG術后復發的獨立相關因素;蘇醒等[20]發現,腸化生型、NLR是CG患者術后復發的獨立危險因素,與本研究結果相符,但NLR及其他炎癥標志物可能受CG外的其他炎性疾病或身體狀況因素影響結果準確性。邰雯雯等[16]發現,通過構建預測模式對診斷CG復發、風險分層具有較高的應用價值。本研究發現,風險模型預測CG經尿道等離子電切術聯合吡柔比星膀胱灌注化療復發的AUC為0.843,最佳閾值為0.221,敏感度67.5%、特異度87.9%,提示該模型利于早期識別CG復發的高風險人群。
綜上所述,經尿道等離子電切術聯合吡柔比星膀胱灌注化療可降低CG復發率,臨床分型、病理類型、RDW、NLR是其復發的獨立危險因素,建立風險模型后預測CG復發具有一定臨床價值。但由于本研究為單中心回顧性研究,樣本量較小,納入病例均為男性,無法代表所有CG患者,部分患者隨訪不規律,影響復發評估,可能會導致結論存在偏倚,需進一步多中心、擴大樣本量研究證實本結論。

