西洋參花多糖閃式提取工藝優(yōu)化及抗氧化活性研究
康忠禹,趙大慶,姚佳婧,趙麗明,黃寶泰,劉 莉,*,齊 濱,*
(1.長春中醫(yī)藥大學(xué),吉林省人參科學(xué)研究院,吉林長春 130117;2.長春中醫(yī)藥大學(xué)藥學(xué)院,吉林長春 130117)
西洋參(Panax quinquefoliumL.)為五加科人參屬多年生的草本植物,別名為花旗參、西洋人參等。具有補(bǔ)氣養(yǎng)陰,清熱生津的功效[1]。西洋參原產(chǎn)于加拿大和美國,最初是通過英法殖民地轉(zhuǎn)運(yùn)到東亞,之后傳入中國。我國于20 世紀(jì)70 年代,在東北、華北等地引種栽培成功[2]。2020 年1 月,西洋參正式被納入藥食物質(zhì)目錄管理[3]。根部為西洋參藥用部位,故其地上部分往往不被重視,所以研究相對較少。西洋參花為西洋參的花蕾,其主要成分包括皂苷類、黃酮類、木質(zhì)素類、揮發(fā)油及多糖等[4-8]。劉雪瑩等[9]研究表明西洋參花多糖具有免疫調(diào)節(jié)作用。在種植過程中,為保證其品質(zhì),往往要進(jìn)行摘蕾處理,但研究表明西洋參地上部分花蕾和葉中總皂苷含量最多[10]。這表明西洋參花的研究對于西洋參產(chǎn)業(yè)的開發(fā)具有重要意義。
目前的報道多為對西洋參傳統(tǒng)藥用部位即根部多糖提取工藝的研究[11-14],而對于其非藥用部位西洋參花多糖的提取工藝研究很少。閃式提取法是一種新型提取方法,其具有提取速度快、時間短等特點(diǎn),現(xiàn)已廣泛應(yīng)用于多糖的提取[15-18]。因此本研究運(yùn)用閃式提取法提取西洋參花粗多糖,利用Box-Behnken響應(yīng)面試驗(yàn),篩選出西洋參花多糖的最佳提取工藝。探討其抗氧化活性,為西洋參花多糖的開發(fā)與利用提供理論基礎(chǔ)。
1 材料與方法
1.1 材料與儀器
西洋參花 吉林省白山市西洋參種植基地,2022 年8 月份采收,批號:20220810-1;DPPH、抗壞血酸(VC)、鄰二氮菲 分析純,美國Sigma 公司;三氯乙酸、無水葡萄糖、鐵氰化鉀、苯酚、三氯化鐵、無水乙醇、濃鹽酸等 國產(chǎn)分析純,北京化工廠。
FA1204B 電子天平 上海精密科學(xué)儀器有限公司;JHBE-50S 型閃式提取器 北京金鼎科技有限公司;UV-2550 紫外-可見分光光度計(jì) 日本島津公司;Centrifuge 5804R 離心機(jī) 德國Eppendorf 公司;ALPHA 3-4 LSC basic 凍干機(jī) 德國CHRIST 公司。
1.2 實(shí)驗(yàn)方法
1.2.1 西洋參花粗多糖的閃式提取 西洋參花于45 ℃條件下烘干至恒重,粉碎成粉末過60 目篩,稱取西洋參花粉末20 g,加入95%乙醇200 mL,于80 ℃條件下回流4 h,殘?jiān)娓蓚溆茫∥餮髤⒒堅(jiān)尤腴W式提取器中,以水為提取溶劑,根據(jù)單因素實(shí)驗(yàn)及響應(yīng)面試驗(yàn)設(shè)計(jì)要求,設(shè)置提取電壓、液料比、提取時間及提取次數(shù)。提取結(jié)束后抽濾,濾液減壓濃縮至50 mL,sevage 法除蛋白三次,用無水乙醇調(diào)節(jié)至多糖溶液中乙醇體積分?jǐn)?shù)為80%,4 ℃醇沉過夜,離心收集沉淀,烘干至其無醇味,適量蒸餾水溶解,冷凍干燥,即得西洋參花粗多糖[19]。
1.2.2 西洋參花多糖得率的測定
1.2.2.1 葡萄糖標(biāo)準(zhǔn)曲線的繪制 標(biāo)準(zhǔn)曲線繪制:稱取無水葡萄糖10.00 mg,定容于100 mL 容量瓶中,分別移取0、0.2、0.4、0.6、0.8、1.0 mL 于玻璃試管中,分別加去離子水補(bǔ)足至1 mL,每個濃度重復(fù)三次。每只試管中加入0.5 mL 6%苯酚溶液及2.5 mL濃硫酸,迅速振蕩,靜置至室溫,用紫外-可見分光光度儀檢測樣品在490 nm 處的吸光度,橫坐標(biāo)為葡萄糖濃度,縱坐標(biāo)為吸光度,繪制葡萄糖標(biāo)準(zhǔn)曲線[20]。線性回歸方程為:y=12.305x-0.0225,R2=0.9997。
西洋參花粗多糖含量的測定:取0.1 mg/mL 西洋參花粗多糖溶液,根據(jù)標(biāo)準(zhǔn)曲線測定步驟測定西洋參花粗多糖吸光度值,并根據(jù)標(biāo)準(zhǔn)曲線計(jì)算多糖濃度。
1.2.2.2 多糖得率的計(jì)算 多糖得率按照下式進(jìn)行計(jì)算。
式中:C:樣品中多糖濃度,g/mL;V:樣品體積,mL;m:西洋參花質(zhì)量,g。
1.2.3 單因素實(shí)驗(yàn) 根據(jù)1.2.1 的方法,稱取西洋參花粉末20 g,以水為溶劑進(jìn)行閃式提取,考察不同提取電壓、液料比、提取時間及提取次數(shù)對西洋參花多糖得率的影響。進(jìn)行單因素實(shí)驗(yàn)考察時,固定條件分別為:提取電壓130 V、液料比30:1 mL/g、提取時間100 s、提取次數(shù)2 次。西洋參花多糖提取液經(jīng)抽濾、減壓濃縮、除蛋白、醇沉處理后得到粗多糖,采用1.2.2.1 中方法測定西洋參花多糖濃度。
1.2.4 響應(yīng)面法優(yōu)化西洋參花多糖提取 參考西洋參花多糖提取單因素實(shí)驗(yàn)結(jié)果,以西洋參花多糖得率為響應(yīng)值,考察提取電壓、液料比、提取時間三個因素對西洋參花多糖得率的影響,試驗(yàn)影響因素和水平見表1。

表1 響應(yīng)面試驗(yàn)因素水平Table 1 Experimental factors and levels of response surface
1.2.5 西洋參花多糖抗氧化活性測定
1.2.5.1 西洋參花多糖對DPPH 自由基清除能力的測定 參照文獻(xiàn)[21]中的方法測定西洋參花多糖對DPPH 自由基清除率:稱量一定質(zhì)量的西洋參花多糖樣品以及水溶性VC,分別配制成0.1、0.4、0.8、1.2、1.6、2.0 mol/L 的樣品溶液。準(zhǔn)確量取1 mL 西洋參花多糖樣品以及水溶性VC樣品溶液于試管中,加入4.5 mL 0.1 mmol/L 的DPPH 溶液混合,避光反應(yīng)30 min,515 nm 波長下測定西洋參花多糖樣品以及水溶性VC的吸光度值。樣品對DPPH 自由基的清除作用按以下公式計(jì)算:
式中:A0、A1、A2分別代表對照品、多糖樣品、樣品空白的吸光度值。
1.2.5.2 西洋參花多糖對羥基自由基清除能力的測定 西洋參花多糖對羥基自由基的清除率,采用鄰二氮菲法進(jìn)行測定[22]。取0.75 mmol/L 鄰二氮菲溶液1 mL 和0.2 mol/L PBS 溶液(pH7.4)2 mL 于試管中,加入不同濃度樣品溶液混勻,加入0.75 mmol/L FeSO4溶液1 mL 和0.025% H2O2溶液1 mL,混勻,37 ℃水浴反應(yīng)1 h,536 nm 波長處測定吸光度值。1 mL 蒸餾水代替西洋參花多糖樣品溶液作為空白對照組,1 mL 蒸餾水代替0.025% H2O2溶液作為樣品對照組,西洋參花多糖樣品對羥基自由基清除率的計(jì)算公式如下:
式中:A0、A1、A2分別代表空白對照組、多糖樣品組、樣品對照組的吸光度值。
1.2.5.3 西洋參花多糖總還原能力的測定 參照文獻(xiàn)[23]中的方法,取1 mL 不同濃度的西洋參花多糖溶液,分別加入0.2 mol/L 磷酸鹽緩沖溶液和1.0%鐵氰化鉀溶液各2.5 mL,迅速混勻,水浴50 ℃反應(yīng)20 min,待溶液冷卻至室溫后,向試管中分別加入10%三氯乙酸溶液2.5 mL,離心取上清液2.5 mL,加入2.5 mL 蒸餾水和0.1%三氯化鐵0.5 mL,混勻,測定其在700 nm 波長處吸光度值,以蒸餾水替代樣品作為對照組,VC為陽性對照組,按照以下公式計(jì)算還原力:
式中:A1為樣品吸光度值;A2為對照組吸光度值。
1.3 數(shù)據(jù)處理
所有西洋參花多糖的提取實(shí)驗(yàn)均重復(fù)三次。運(yùn)用Design-Expert 8.0.6.1 軟件對西洋參花多糖提取工藝數(shù)據(jù)進(jìn)行分析,西洋參花多糖抗氧化活性分析繪圖利用GraphPad prism 8.0.2 軟件完成。
2 結(jié)果與分析
2.1 西洋參花多糖閃式提取單因素考察結(jié)果
2.1.1 提取電壓對多糖得率的影響 由圖1 可知,西洋參花多糖得率在提取電壓為70~130 V 的范圍內(nèi)逐漸升高,分析其原因可能為隨著電壓升高,閃式提取器內(nèi)剪切刀轉(zhuǎn)速增快,剪切力增加,由于剪切力的影響,西洋參花多糖更易溶出[17]。但是當(dāng)超過130 V時,多糖得率明顯下降,可能原因?yàn)椋S著電壓增加,刀頭轉(zhuǎn)速加快,西洋參花顆粒過小,多糖被吸附在顆粒表面不易溶出,導(dǎo)致西洋參花多糖得率下降,因此選擇110、130、150 V 電壓進(jìn)行后續(xù)試驗(yàn)[24]。

圖1 提取電壓對西洋參花多糖得率的影響Fig.1 Effect of extraction voltage on polysaccharides yield of American ginseng flower
2.1.2 液料比對多糖得率的影響 由圖2 可知,當(dāng)液料比從20:1 增加到30:1 時,西洋參花多糖得率明顯增加,液料比為30:1 mL/g 時多糖得率最高。之后西洋參花多糖得率開始下降,可能是隨著液料比比重的增加,影響了溶劑間的熱傳遞,從而不利于多糖的溶出,導(dǎo)致西洋參花多糖得率下降,而當(dāng)液料比過低時,多糖溶液的黏度過大,活性成分不易擴(kuò)散,導(dǎo)致西洋參花多糖得率較低[25]。因此選擇液料比20:1、30:1 和40:1 mL/g 作為響應(yīng)面優(yōu)化水平。

圖2 液料比對西洋參花多糖得率的影響Fig.2 Effect of liquid to solid ratio on polysaccharides yield of American ginseng flower
2.1.3 提取時間對多糖得率的影響 由圖3 可知,提取時間選擇40~100 s,隨著提取時間的增加,西洋參花多糖得率呈現(xiàn)上升趨勢,提取時間為100 s 時得率最高,之后得率開始逐漸降低,分析可能原因?yàn)殡S著提取時間的延長,西洋參花多糖溶出增多,從而西洋參花多糖得率上升,但隨著提取時間繼續(xù)延長,閃式提取器內(nèi)溫度增加,從而使西洋參花多糖分解,因此選擇80、100、120 s 進(jìn)行后續(xù)試驗(yàn)[26]。
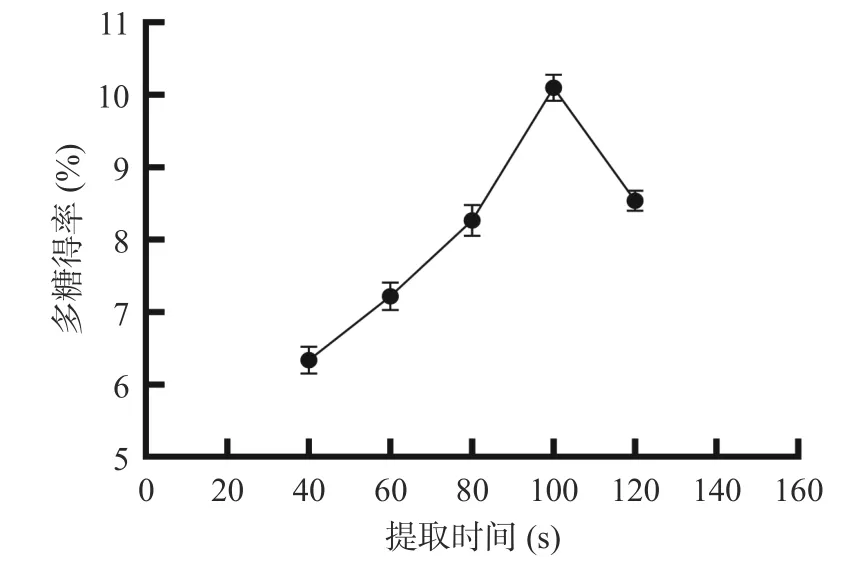
圖3 提取時間對西洋參花多糖得率的影響Fig.3 Effect of extraction time on polysaccharides yield of American ginseng flower
2.1.4 提取次數(shù)對多糖得率的影響 由圖4 可知,西洋參花多糖得率隨提取次數(shù)增加呈上升趨勢,當(dāng)提取次數(shù)為2 次時西洋參花多糖得率趨于穩(wěn)定。說明提取2 次時,西洋參花多糖已經(jīng)基本提取完全。考慮時間及成本問題,最終選擇2 次為最佳提取次數(shù)。

圖4 提取次數(shù)對西洋參花多糖得率的影響Fig.4 Effect of extraction times on polysaccharides yield of American ginseng flower
2.2 響應(yīng)面法優(yōu)化西洋參花多糖提取工藝試驗(yàn)結(jié)果
2.2.1 試驗(yàn)設(shè)計(jì)方案及結(jié)果 參考閃式提取西洋參花多糖單因素實(shí)驗(yàn)結(jié)果,以閃式提取電壓、液料比、提取時間為影響因素,設(shè)計(jì)Box-Behnken 試驗(yàn),以西洋參花多糖得率為響應(yīng)值。設(shè)計(jì)方案及結(jié)果見表2。
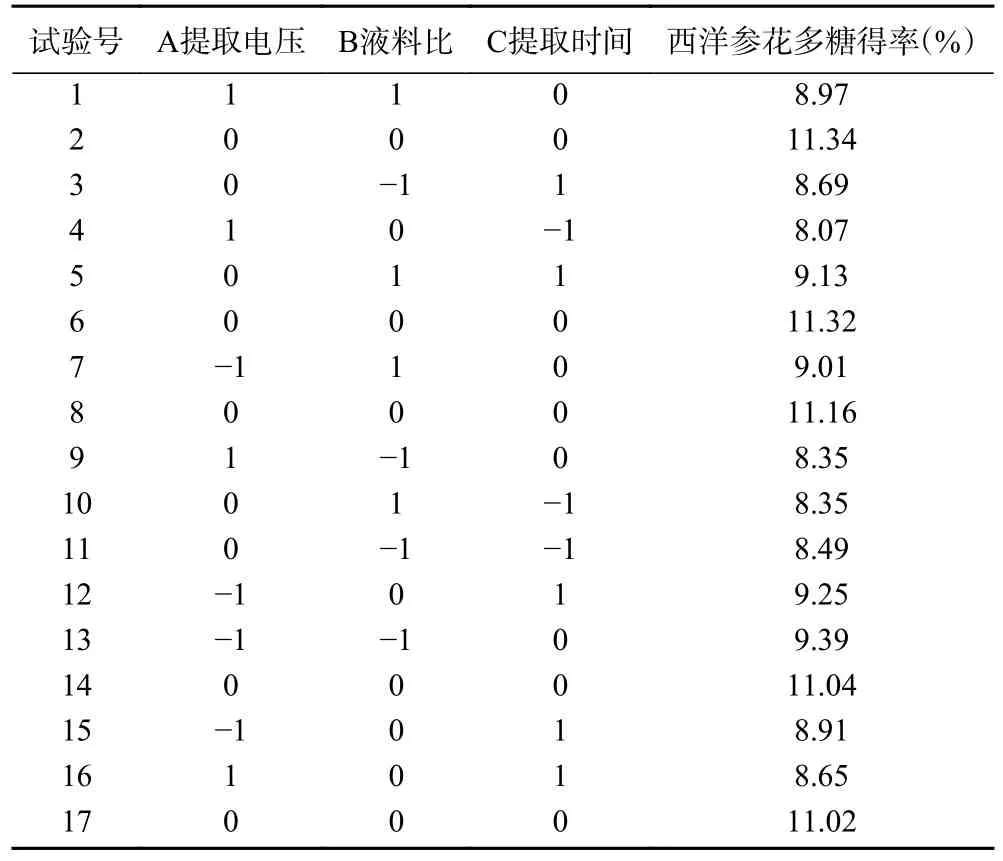
表2 響應(yīng)面試驗(yàn)設(shè)計(jì)方案及結(jié)果Table 2 Design and test results of response surface methodology
2.2.2 回歸模型的建立及分析 對表2 數(shù)據(jù)進(jìn)行擬合,得到的二次多項(xiàng)回歸方程為:多糖得率=11.18-0.27A+0.068B-0.24C+0.25AB-0.051AC-0.15BC-1.14A2-1.10B2-1.41C2。響應(yīng)面回歸模型方差分析結(jié)果見表3。
由表3 可以看出,該模型的P<0.01,表明響應(yīng)值差異極顯著,建模成功。三個考察因素對于西洋參花多糖得率的影響程度大小順序?yàn)椋禾崛‰妷海咎崛r間>液料比。失擬項(xiàng)P值為0.9906>0.05,說明模型擬合好,本試驗(yàn)不存在失擬因素。模型的決定系數(shù)R2=0.9933,調(diào)整決定系數(shù)R2adj=0.9874,說明所建立模型能夠較好地確定關(guān)鍵影響因素,可以應(yīng)用所建立的模型對西洋參花多糖進(jìn)行提取工藝的優(yōu)化,模型中一次項(xiàng)A、C 達(dá)到極顯著(P<0.01),AB 達(dá)到顯著水平(P<0.05),各因素的二次項(xiàng)對西洋參花多糖得率的影響均達(dá)到了極顯著水平(P<0.01)。
2.2.3 響應(yīng)面優(yōu)化分析 由圖5 可以看出,提取電壓和液料比、提取電壓和提取時間以及液料比和提取時間每兩個因素的交互作用響應(yīng)面圖中曲面變化幅度均較大,且其等高線圖均接近橢圓形,說明每兩個因素的交互作用均對西洋參花多糖得率有影響。其中提取電壓和液料比兩因素的交互作用曲面幅度更大,等高線接近橢圓形更加明顯,說明其對西洋參花多糖得率的影響也更加顯著。
2.2.4 優(yōu)化與驗(yàn)證實(shí)驗(yàn) 經(jīng)響應(yīng)面分析預(yù)測得到最佳提取條件為:提取電壓:127.75 V,液料比:30.24:1 mL/g,提取時間:98.31 s,西洋參花多糖的得率為11.20%。根據(jù)實(shí)際情況,調(diào)整后的提取工藝條件為:提取電壓:130 V,液料比:30:1 mL/g,提取時間:100 s。在調(diào)整后實(shí)驗(yàn)條件基礎(chǔ)上,進(jìn)行3 次工藝驗(yàn)證實(shí)驗(yàn),得到西洋參花多糖得率為11.12%±0.23%。與預(yù)測值11.20%相差甚小,說明本模型可以較好地反映西洋參花多糖的提取過程,該工藝可靠合理。同時,與傳統(tǒng)水煎煮提取西洋參花多糖相比較[9],多糖得率由5.72%提升至11.12%,多糖得率得到明顯提升,應(yīng)用閃式提取法也極大地縮短了提取時間,由此表明應(yīng)用閃式提取法提取西洋參花多糖可用于指導(dǎo)實(shí)際生產(chǎn)和實(shí)驗(yàn)過程。
2.3 西洋參花多糖的抗氧化活性
2.3.1 DPPH 自由基清除能力 如圖6 所示,當(dāng)西洋參花多糖的濃度在0.1~1.6 mg/mL 范圍內(nèi)時,對DPPH 自由基的清除率隨著西洋參花多糖濃度的增加而增強(qiáng)。但當(dāng)西洋參花多糖濃度超過1.6 mg/mL時,曲線變緩,表明西洋參花多糖對DPPH 自由基的清除能力逐漸達(dá)到飽和。當(dāng)西洋參花多糖濃度為2.0 mg/mL 時,其DPPH 自由基清除率達(dá)到最高值為61.48%。IC50值為1.34 mg/mL,與VC相比效果欠佳。但是與西洋參莖和葉相比,西洋參花多糖對DPPH 自由基的清除能力要強(qiáng)于西洋參莖和葉多糖對DPPH 自由基的清除能力[27]。

圖6 西洋參花多糖的DPPH 自由基清除率Fig.6 DPPH free radical scavenging rate of American ginseng flower polysaccharides
2.3.2 羥基自由基清除能力 由圖7 可知,西洋參花多糖對羥基自由基的清除效果隨多糖濃度增加而不斷增大,但隨著西洋參花多糖濃度增高而逐漸變緩,當(dāng)濃度為2.0 mg/mL 時,其對羥基自由基清除率達(dá)到最高值為60.01%,IC50值為1.42 mg/mL。但與VC相比效果仍欠佳。與西洋參莖和葉相比,西洋參花多糖對羥基自由基的清除能力要強(qiáng)于西洋參莖和葉多糖對羥基自由基的清除能力[27]。
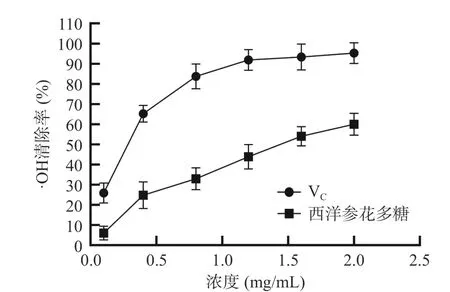
圖7 西洋參花多糖的·OH 清除率Fig.7 ·OH scavenging rate of American ginseng flower polysaccharides
2.3.3 總還原能力 多糖分子中含有苷羥基,一定條件下可異變?yōu)轸驶Y(jié)構(gòu),因而具有一定還原性。如圖8 所示,西洋參花多糖具有一定的還原力。當(dāng)多糖濃度在0.1~2.0 mg/mL 時,其還原能力逐漸增強(qiáng),但是仍然弱于VC。
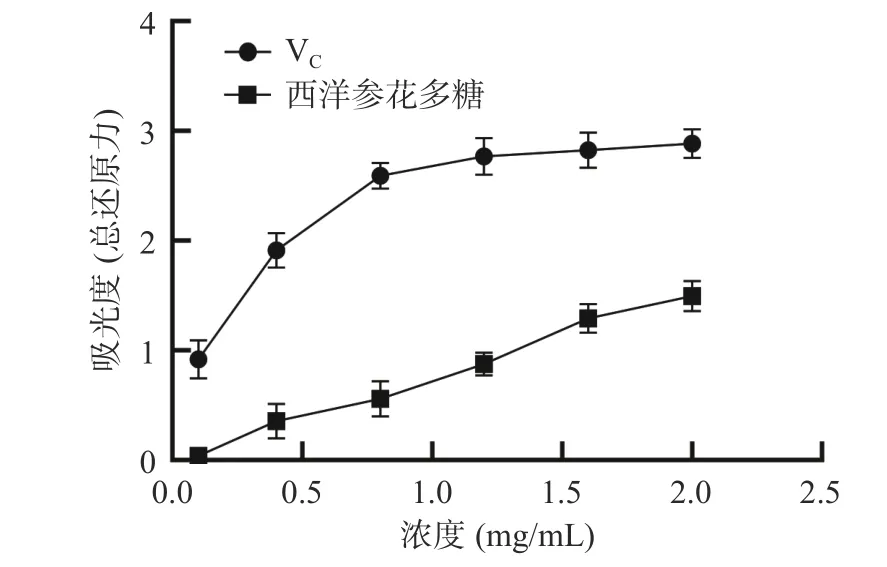
圖8 西洋參花多糖總還原力的測定Fig.8 Determination of total reducing power of American ginseng flower polysaccharides
3 結(jié)論
本研究通過響應(yīng)面法優(yōu)化了閃式提取西洋參花多糖的最佳提取工藝,得到西洋參花多糖的最優(yōu)提取工藝為:提取電壓:130 V,液料比:30:1 mL/g,提取時間:100 s,同時在最優(yōu)工藝的實(shí)驗(yàn)條件上進(jìn)行了三次驗(yàn)證實(shí)驗(yàn),最后得到多糖得率的平均值為11.12%±0.23%,與預(yù)測值接近。另外,西洋參花多糖對于DPPH 自由基、羥基自由基的清除以及總還原力都具有良好的效果,這說明西洋參花具有較好的抗氧化活性。西洋參花作為西洋參的非藥用部位,對其的深入研究對于西洋參產(chǎn)業(yè)的開發(fā)和利用具有重要意義,本研究為西洋參花多糖的提取和活性研究提供了技術(shù)支持。
? The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

