腹腔鏡下精準肝切除治療原發性肝癌的臨床效果
王石楓 劉輝 王艷 劉榮梁 黃學楷 王旭升 符春輝 劉新海
(贛州市第五人民醫院肝膽外科,江西 贛州 341000)
原發性肝癌主要是發生于患者肝細胞或肝內膽管細胞的惡性腫瘤,近年來其發生率在世界范圍內呈遞增趨勢〔1〕。雖然針對原發性肝癌的病因尚未明確,但可能與患者存在病毒性肝炎、長時間酗酒、遺傳因素等關系密切。臨床針對原發性肝癌的治療方面,手術切除是目前最佳的治療方案,但會對患者造成較大創傷,因此需要對臨床治療手段進行合理優化〔2〕。既往實施的腹腔鏡肝腫瘤切除術,選擇腫瘤中心部位以外2 cm以上的范圍做不規則切除處理,但手術切除過程中,考慮到肝臟組織生理解剖結構相對特殊,而且血流、血管組織豐富,會導致患者術野受限,可能會出現術中出血量明顯增多,病灶未徹底清除的情況。精準肝切除術屬于將抗訴康復理念與微創手術相結合的治療方式,對病灶進行精準切除,減輕對病灶的過度擠壓,避免惡性物質進入血液,增加疾病復發、轉移風險〔3〕。本研究為旨在探討精準肝切除術對原發性肝癌患者的治療效果。
1 資料與方法
1.1一般資料 擇取贛州市第五人民醫院2019年1月至2022年12月收治的60例原發性肝癌患者,以隨機數字表法分為研究組和對照組各30例。納入標準:①能夠耐受肝臟切除術者;②經卡氏功能狀態評分表評估患者得分≥70分;③預計生存時間≥3個月;④已獲取患者、直系親屬知情同意;⑤研究已獲本院醫學倫理委員會批準。排除標準:①合并其他臟器功能損傷;②術前檢查發現癌細胞轉移;③經Child-Pugh分級標準評估等級為C級。研究組男14例、女16例,年齡61~80歲,平均(67.22±5.48)歲,Child-Pugh分級A級22例、B級8例,腫瘤直徑4~8 cm,平均(6.11±1.02)cm。對照組男12例、女18例,年齡60~79歲,平均(67.21±5.58)歲,Child-Pugh分級A級21例、B級9例,腫瘤直徑5~8 cm,平均(6.21±1.01)cm。兩組間基線資料差異無統計學意義(P<0.05)。
1.2方法 對照組采用傳統肝切除術。術前借助影像學檢查確認手術區域,距病灶1~2 cm切除,采用Pringle法阻斷肝血流,10~20 min后恢復5 min血流,以鉗夾法離斷肝臟,之后縫合斷面,術后常規置引流管。
研究組采用腹腔鏡下精準肝切除術。患者以平臥位或頭高足低位實施手術;對于肝臟右前下段或右后下段腫瘤,患者可選擇左側臥位實施手術;采用臍下或臍周為觀察孔的5孔操作法,在建立氣腹后,根據病灶位置決定操作孔位置;術前借助CT、磁共振成像(MRI)等影像學檢查,建立三維成像,確定患者病灶位置及周邊組織、血管分布情況。(1)探查及游離肝臟:依次離斷肝圓韌帶、鐮狀韌帶,然后根據病灶部位游離肝臟。若患者病灶位于肝臟第2段,靠近左三角韌帶和冠狀韌帶者,需離斷上述韌帶;若患者病灶位于右后葉者,需離斷肝腎韌帶、右三角韌帶及部分右冠狀韌帶,以充分顯露病灶。(2)術中再次定位借助:術中借助超聲觀察是否有術前遺漏病灶;進一步明確腫瘤部位、邊界、有無子灶,了解腫瘤與周圍管道關系及切線上血管走行。(3)離斷肝實質:采用超聲刀等斷肝器械離斷肝實質,必要時術中超聲引導,確保基底部切緣,遇較大的管道組織,可吸收夾或鈦夾夾閉后再切斷。(4)肝斷面處理及放置腹腔引流:完整切除后,肝斷面徹底止血,可用雙極電凝或氬氣刀止血,采用4-0~5-0無損傷縫線縫合活動性出血或膽漏。肝斷面覆蓋止血材料,放置腹腔引流管。(5)取出標本。
1.3觀察指標 (1)對比兩組術中各項指標,包括手術時間、術中出血量、術中輸血量、腹腔引流量及肝門阻斷時間。(2)肝功能:手術前后分別取患者靜脈血3 ml,離心后取上層血清化驗血清總膽紅素(TBIL)、丙氨酸氨基(ALT)、谷丙轉氨酶(AST)、白蛋白(ALB)水平。(3)肝癌活性指標:手術后以免疫增強化學發光法檢測兩組血清Polo樣激酶(Plk)1、凋亡抑制因子(Livin)、胸腺激酶(TK1)、X連鎖凋亡抑制蛋白(Xiap)。(4)并發癥發生率:記錄兩組癌殘留情況、胸腔積液、膽汁外漏、腹腔積液、肝衰竭發生情況。(5)遠期生存質量:手術前后分別采用健康調查簡表(SF-36)評估兩組生存質量,包含生理職能、生理功能、精力等8個項目,50分為正常平均分數,換算得分公式=(實際得分-該方面的可能最低得分)/該方面可能的最高得分與最低得分差值×100,患者得分越高表示其生存質量越高。
1.4統計學方法 采用SPSS25.0軟件進行χ2檢驗、t檢驗。
2 結 果
2.1兩組術中各項指標比較 研究組術中出血量、輸血量及腹腔引流量少于對照組,手術時間、肝門阻斷時間長于對照組,差異有統計學意義(P<0.01),見表1。

表1 兩組術中各項指標比較
2.2兩組手術前后肝功能比較 術前,兩組TBIL、ALT、AST、ALB水平差異無統計學意義(P>0.05);術后,兩組上述指標與術前比較差異顯著(P<0.05),且研究組TBIL、ALT、AST水平顯著低于對照組,ALB水平顯著高于對照組(P<0.001),見表2。

表2 兩組手術前后肝功能比較
2.3兩組肝癌活性指標比較 研究組TKI、Plk1、Livin、Xiap水平低于對照組,差異有統計學意義(P<0.05),見表3。

表3 兩組肝癌活性指標比較
2.4兩組并發癥發生率比較 研究組并發癥發生率〔3例(10.00%);其中癌殘留、胸腔積液、腹腔積液各1例〕低于對照組〔10例(33.33%);殘 瘤情況4例、胸腔積液2例、膽汁外漏1例、腹腔積液3例〕,差異顯著(χ2=4.812,P=0.028)。
2.5兩組遠期生存質量比較 術前,兩組生理功能、生理職能、軀體疼痛、一般健康狀況、精力、社會功能、情感職能、精神健康評分無統計學差異(P>0.05);術后,兩組上述指標均顯著優于術前(P<0.05),且研究組遠期生存質量逐項評分均高于對照組,差異有統計學意義(P<0.05),見表4。
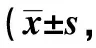
表4 兩組遠期生存質量比較分,n=30)
3 討 論
原發性肝癌的病情進展迅速,患者死亡率較高,目前,肝臟切除術是針對該病的首選治療方式,與傳統治療肝臟治療方式不同,精準肝切除手術是針對有不同需求的病例個體,在術前借助影像學檢查結果對患者肝臟做精確定位,能夠保障在高精度及高標準的前提下優化對患者實施現代科學理論技術,該手術的理念涵蓋了影像學及外科治療的雙重過程〔4,5〕。精準肝切除術借助超聲的精確定位,不僅對病灶能夠達到精準切除,且減少了傳統肝臟切除手術在術中觸碰患者大血管造成術中出血量激增的不良事件,同時由于手術前、術中均需要借助精準儀器對患者病灶進行定位并在術中實施操作,因此精準肝切除術的手術時間相對更長,但在合理范圍內。
本研究表明,術后研究組TBIL、ALT、AST水平低于對照組,ALB水平高于對照組,是由于精準肝臟切除術在術中使用的半肝入肝血流阻斷方式,在保留患者健側肝臟正常血流的同時,避免肝臟出現缺血,減少因缺血造成的肝功能不全甚至衰竭問題。有學者提出,精準肝臟切除手術目前已成為臨床一線的常用手術方式,且降低了手術對昂貴儀器的依賴性〔6〕。精準肝切除通過優先處理預切除肝臟的入肝血流,根據缺血線尋找斷肝平面,減少全肝阻斷時間,有利于控制術中出血,減輕剩余肝臟缺血再灌注損傷,并降低術中腫瘤經門靜脈播散的風險。術中目標肝段的精準定位是肝切除的重點與難點,通過合適的方法處理Glisson肝蒂是手術成功的關鍵〔7,8〕。本研究結果提示,精準肝切除術患者術后并發癥發生風險更低。是由于該術式能夠清楚解剖肝臟內的管道結構,降低對保留血管、膽管產生不必要損傷;手術中采用電凝止血能夠及時將創面流出的膽汁、血液、組織液進行清理,保障手術視野的清晰度,提升手術操作安全性〔9~11〕。
近年來,隨著臨床醫療水平的提高和外科設備的完善,腹腔鏡技術日漸成熟,已成為臨床治療的主要方法,也被廣泛用于肝腫瘤疾病治療中,但改善手術方式存在手術操作視野受限,易造成腫瘤殘留,為患者遠期生存質量產生負面影響。本研究結果提示,針對原發性肝癌患者以精準肝臟切除手術進行治療,患者遠期生活質量有所保障。分析原因:精準肝臟切除手術是基于常規腹腔鏡肝腫瘤切除術,并結合微創理念而新發展的一種手術方法,其目的在于積極清除手術病灶組織,同時要保證剩余肝臟解剖完整性,保證其功能正常,并最大程度降低手術對患者身體造成的不良反應,降低術中出血量,以實現最佳手術療效。同時,精準肝臟切除術是以現代醫療技術為基礎,在明確肝臟生理解剖結構特點、病變狀況基礎上,為患者提供精準的手術操作,降低患者正常肝組織的損失,規避傳統手術中存在的視野受限導致病灶組織切除不徹底,對患者正常肝組織提供最大程度保護,降低手術創傷性,促使患者在術后盡快恢復,提升遠期生存質量〔12~14〕。
綜上,將精準肝臟切除手術用于原發性肝癌患者,能夠有效減少患者在術中的出血量,維持生命穩定,降低術后并發癥發生風險,保障殘余肝功能滿足機體需求,促進術后恢復。

