豬圓環(huán)病毒2型疫苗的應用和研發(fā)進展
王鵬,沈偉楨,周斌
(1. 南京江北新區(qū)農村工作管理服務中心,江蘇 南京 211899;2. 南京農業(yè)大學動物醫(yī)學院,江蘇 南京 210095)
豬圓環(huán)病毒(PCV)是一種單鏈環(huán)狀DNA病毒,屬于圓環(huán)病毒科圓環(huán)病毒屬,是已知最小的動物病毒之一[1],根據全基因組核苷酸序列可分為PCV1型(PCV1)、2型(PCV2)、3型(PCV3)和4型(PCV4)4個血清型,PCV2又可細分為a~h 8個亞型[2]。豬對PCV2具有較強的易感性,4周齡斷奶仔豬最易感,常引發(fā)斷奶仔豬多系統(tǒng)衰竭綜合征(PMWS),臨床表現(xiàn)多樣,漸進性消瘦或生長遲緩是最常見的癥狀,易與其他病原混合感染,大大提高病豬的死亡率[3]。豬圓環(huán)病毒病于1991年在加拿大首次被發(fā)現(xiàn),之后世界各國均有大量報道[4-5],我國自2001年首次分離到PCV2以來,浙江、山東、廣東、河南等省份先后均有該傳染病流行的報道發(fā)生。目前為止,PCV2經歷過2次重大抗原變異:2003年,PCV2b亞型在全球大部分地區(qū)取代PCV2a亞型成為主導毒株;2012年,中國、韓國等部分地區(qū)的PCV2b亞型開始被PCV2d亞型取代。
全球各國養(yǎng)豬產業(yè)正遭受著PCV2引起的嚴重影響與經濟負擔,因此疫苗接種被視為預防該病的最有效手段并逐漸成為近年來的主要關注點之一。在此背景下,傳統(tǒng)滅活疫苗、亞單位疫苗、嵌合疫苗和合成肽疫苗陸續(xù)問世并投入使用,同時實驗室也致力于開發(fā)新型活載體疫苗、核酸疫苗等,商業(yè)疫苗的投入使用和實驗室疫苗的不斷優(yōu)化在防控PCV2感染和提高豬群生長性能發(fā)揮了重要作用。然而,疫苗佐劑的篩選、PCV2d的流行也為疫苗的研發(fā)提出了新的挑戰(zhàn)。
1 PCV2疫苗的應用現(xiàn)狀
自2006年開始進入我國市場的PCV2商業(yè)疫苗(表1,表2)均有報道表明可顯著降低PMWS感染豬的臨床病理表現(xiàn)并改善其生長性能[6]。在接種疫苗后,豬群的平均日增重和瘦肉產量百分比有所提高,增加了飼料轉化率并降低了接種疫苗豬群的藥物成本。目前我國商業(yè)化的PCV2疫苗主要可以分為2類:滅活疫苗和以衣殼(Cap)蛋白作為免疫原的亞單位疫苗。然而,滅活疫苗通常是在豬腎傳代細胞系(PK-15)中生產,有著病毒滴度低的缺點[7];亞單位疫苗可在大腸桿菌或桿狀病毒表達系統(tǒng)中生產,但需要昂貴的超離心或層析純化[8]。因此,目前研究的重心逐漸偏向于成本更低、安全性更高并且保護作用更持久的活載體疫苗和核酸疫苗。
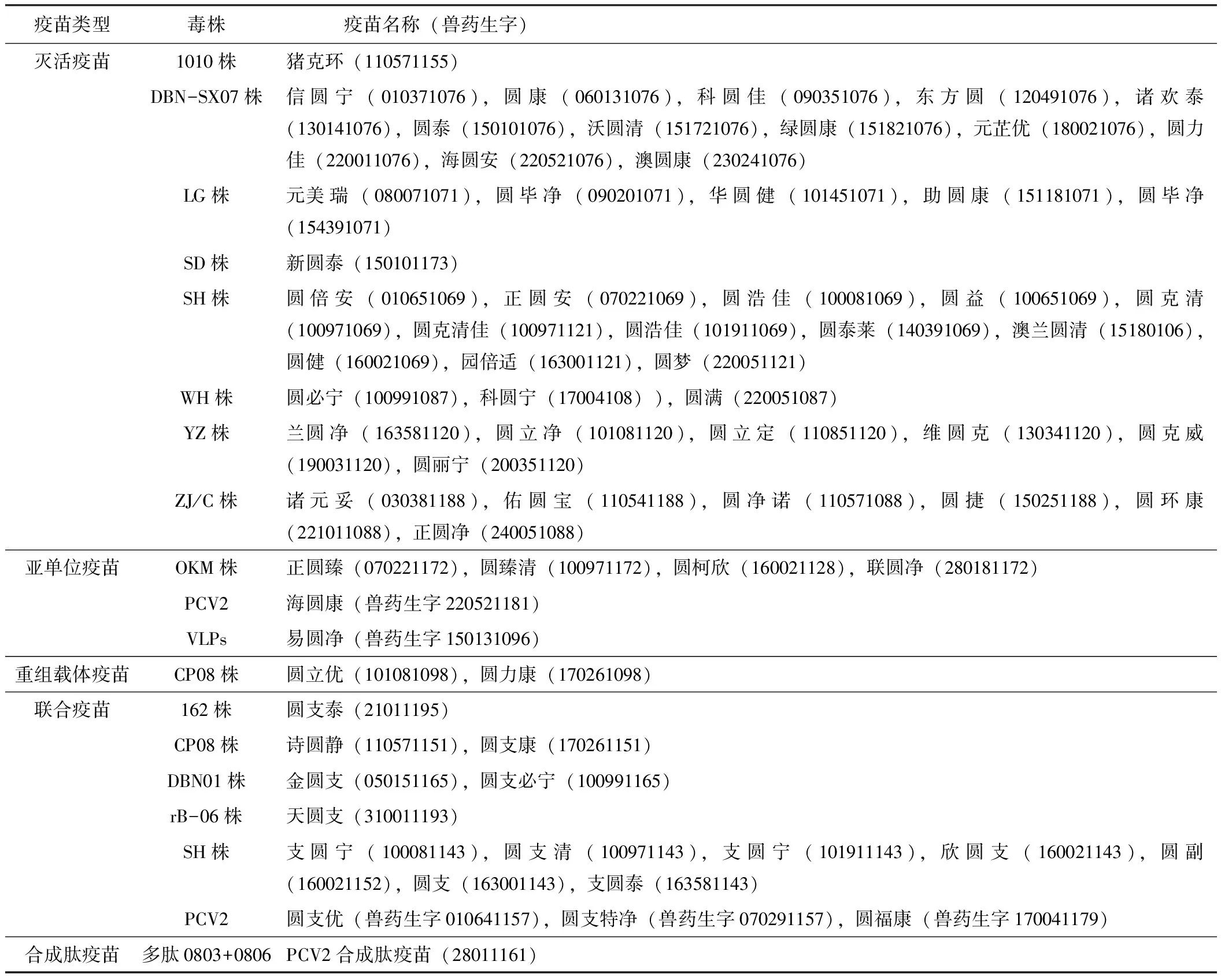
表1 國內PCV2商品疫苗匯總
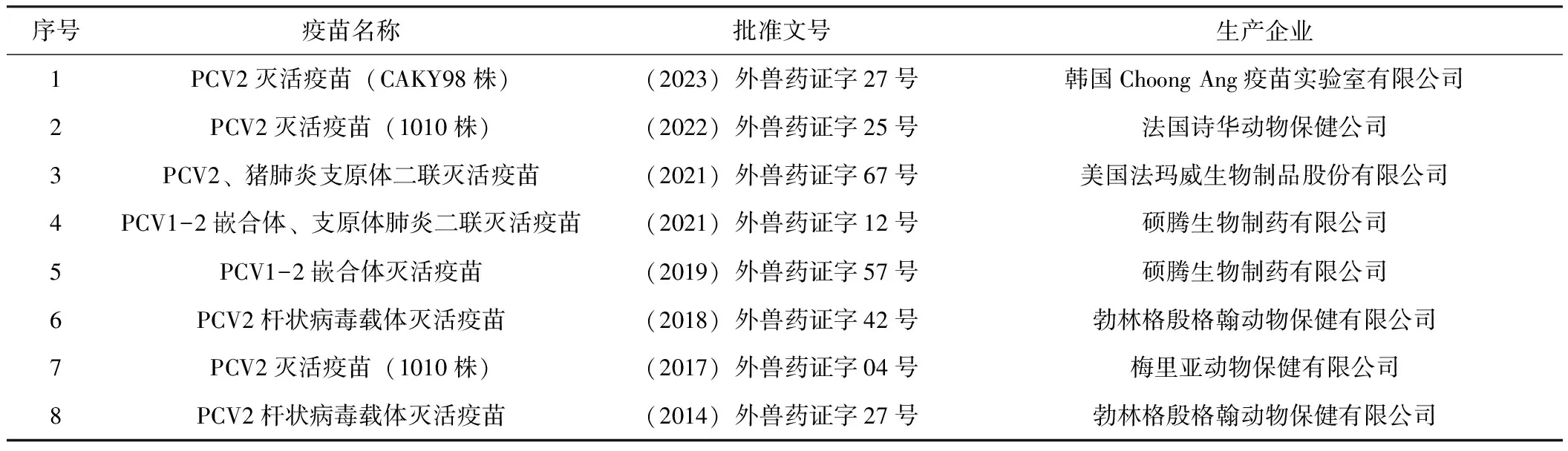
表2 國內進口PCV2疫苗匯總
2 傳統(tǒng)疫苗
2.1 滅活疫苗
滅活疫苗由于病原微生物已經完全滅活,在使用安全性和儲存穩(wěn)定性等方面相比弱毒疫苗有優(yōu)勢,還具有對母源抗體的中和作用不敏感的優(yōu)點。最早的PCV2滅活疫苗是法國梅里亞公司于2006年研發(fā)的PCV2全病毒滅活疫苗Circovac?[9-11],疫苗通過歐盟認證,是世界上首個以輕石蠟油為佐劑的PCV2疫苗,同時Circovac?可用于繁育母豬和3周齡以上仔豬,也是目前唯一一個既適用于母豬又適用于仔豬的PCV2疫苗。它能有效降低感染仔豬各組織器官中的病毒載量,降低病毒血癥的發(fā)生并減輕病毒組織器官的負荷和病毒散播,促進新生仔豬的生長發(fā)育。我國最早的PCV2滅活疫苗是南京農業(yè)大學姜平教授科研團隊研發(fā)的PCV2滅活疫苗(SH株)[12]。目前國內滅活疫苗主要基于SH株、LG株、ZJ/C株、DBN-SX07株等毒株研制,均屬于PCV2b亞型,在本質上沒有區(qū)別[13]。
2.2 弱毒疫苗
由于弱毒疫苗毒力容易返強、致弱毒株毒力評價難度較大等問題,截至目前為止市場上還沒有針對PCV2的弱毒疫苗。Fenaux等[14]在PK-15細胞中連續(xù)傳代PCV2分離株達120代后,對第1代病毒(VP1)和最后1代病毒(VP120)在生物學特性、遺傳特征上通過試驗進行表征,發(fā)現(xiàn)從第1代到第120代的過程中,整個病毒基因組發(fā)生了2處核苷酸變異:C328G和A573C。這2處變異導致Cap蛋白第110位的脯氨酸變?yōu)楸彼?P110A),第191位的精氨酸變?yōu)榻z氨酸(R191S)。進一步研究發(fā)現(xiàn)這些突變增強了PCV2的體外生長能力并減弱了體內感染能力,這一發(fā)現(xiàn)對研發(fā)出有效的PCV2弱毒疫苗的具有重要指導作用。
3 基因工程疫苗
3.1 亞單位疫苗
目前商業(yè)PCV2亞單位疫苗的設計和研發(fā)主要基于ORF2所編碼的Cap蛋白,它是PCV2的主要結構蛋白和免疫保護性抗原,具有中和性表位和誘導保護性免疫反應的潛力[15-16]。目前國際市場上有3種PCV2亞單位疫苗,分別是CircoFlex?,Circument?和Porcilis PCV?[17]。它們都利用桿狀病毒系統(tǒng)表達ORF2制成,經滅活和純化后病毒樣顆粒(VLPs)在形態(tài)上與PCV2顆粒相同[8]。一項試驗同時評估了Circovac?、CircoFlex?和Porcilis PCV?,結果表明,與商業(yè)化滅活疫苗相比,亞單位疫苗CircoFlex?和Porcilis PCV?表現(xiàn)出更低的病毒載量和散播,更溫和的組織病理學病變,更高水平的PCV2特異性中和抗體和細胞介導免疫[18]。王琳琳等[19]利用桿狀病毒表達系統(tǒng)高效表達Cap蛋白,采用水性佐劑制備成滅活疫苗,仔豬免疫后精神、食欲和行為活動均正常,酶聯(lián)免疫吸附試驗(ELISA)抗體效價在1∶400~1∶800,具有良好的免疫原性和安全性,可作為預防PCVAD的候選疫苗。Xi等[20]通過大腸桿菌表達重組Cap蛋白,在中性緩沖液中自組裝成與完整PCV2病毒相似的VLPs。通過試驗證明該蛋白具有良好的免疫原性,能有效刺激機體產生特異性抗體介導的免疫應答,并保護機體免受PCV2-SH毒株的感染,而且生產成本較低,是一種具有潛在競爭力的亞單位疫苗。目前國內注冊上市的亞單位疫苗有正圓臻、圓柯欣、圓臻清、圓環(huán)力康、易圓凈等。
3.2 重組載體疫苗
重組載體疫苗利用基因工程技術以減毒活病毒或細菌作為基因表達載體,將編碼特定病原微生物免疫原性蛋白的基因插入載體中,輸入機體后在體內表達免疫原性蛋白,從而激發(fā)機體產生特異性抗體和細胞免疫應答,預防相應病原微生物的感染[21]。當前PCV2重組載體疫苗主要有腺病毒載體疫苗、偽狂犬病毒載體疫苗以及桿狀病毒載體疫苗[22]。
3.2.1 桿狀病毒載體疫苗
昆蟲桿狀病毒表達載體系統(tǒng)(BEVS)已成熟應用于多種蛋白的表達中,為疫苗研發(fā)提供了大量原材料,適用于多基因表達設計和大規(guī)模的無血清培養(yǎng)條件下的重組蛋白生產[23]。He等[24]利用桿狀病毒感染的家蠶幼蟲和大腸桿菌BL21(DE3)原核表達系統(tǒng)表達了PCV2 Cap蛋白,通過ELISA證實了產生的VLPs的免疫原性,表明桿狀病毒感染的家蠶幼蟲表達系統(tǒng)是獲得PCV2 VLPs的良好選擇,具有開發(fā)低成本、高效疫苗的潛力。Xu等[25]針對PRRSV GP5蛋白和PCV2 Cap蛋白利用BEVS構建了重組BacSC-Dual-GP5-Cap疫苗,其能產生相當高的病毒中和滴度并誘導淋巴細胞增殖反應,是抵抗兩者感染的潛在二價亞單位疫苗。目前國內上市的桿狀病毒表達Cap蛋白的載體疫苗有國藥集團動物保健股份有限公司的圓力康和揚州優(yōu)邦生物藥品有限公司的圓立優(yōu)[22]。
3.2.2 腺病毒載體疫苗
腺病毒載體疫苗通過將保護性抗原基因重組到腺病毒基因組中構建而成,具有簡單構建和誘導體液免疫、黏膜免疫和細胞免疫的優(yōu)勢[26]。Li等[27]構建了分泌型重組腺病毒和非分泌型重組腺病毒,ELISA和病毒中和試驗(VNT)結果表明,分泌型重組腺病毒誘導的體液免疫應答明顯高于PCV2-SH菌株,并且在PCV2攻毒試驗中病毒載量顯著降低,表明分泌型重組腺病毒疫苗比商業(yè)滅活疫苗PCV2-SH菌株能引起更強的免疫應答和更好的保護作用,是一種潛在的PCVAD候選疫苗。為了降低腺病毒蛋白的免疫原性,Li等[28]構建了用Intron A、WPRE修飾和CD40L、GMCSF修飾的PCV2腺病毒載體疫苗,這類修飾后的疫苗誘導了更強的體液和細胞免疫反應,提供了比未修飾疫苗更好的保護作用。然而,腺病毒的靶向性差,首過效應強,且不能整合到靶細胞的基因組DNA中并穩(wěn)定表達外源基因,因此只有不斷優(yōu)化腺病毒載體以提高其特異性和安全性,才能最大限度發(fā)揮它的潛在應用價值[29]。
3.2.3 偽狂犬病毒活載體疫苗
偽狂犬病毒(PRV)因其基因組結構獨特、宿主覆蓋范圍廣泛和生物安全性,已成為研發(fā)活載體疫苗的重要工具。將表達保護性抗原基因的重組偽狂犬病毒構建疫苗模型,可以預防包括偽狂犬病在內的多種疾病,實現(xiàn)一針多防的目的,而且能簡化免疫過程、降低成本,在商業(yè)和應用前景上具有潛在優(yōu)勢[30]。Zheng等[31]構建了一種表達PCV2 Cap蛋白和白細胞介素18(IL-18)的重組偽狂犬病毒,用PRV-ORF2- IL18、PRV- ORF2、PRV HB98或滅活的PCV2免疫小鼠,ELISA、VNT、異性淋巴細胞增殖試驗、CD3+、CD4+和CD8+T淋巴細胞分析顯示,PRV-ORF2-IL18在小鼠中可誘導高滴度的血清中和抗體,并產生具有較強的細胞介導免疫應答。PRV-ORF2 - IL18免疫可保護小鼠免受PRV-Fa毒株的致命攻擊,并顯著降低PCV2病毒血癥的數(shù)量。PRV-ORF2-IL18重組病毒可能是預防豬PCV2和PRV感染的一種有吸引力的候選疫苗。
3.3 合成肽疫苗
合成肽疫苗是一種僅含有免疫決定簇的短肽疫苗,將根據病原體蛋白質的氨基酸序列合成的保護性短肽與載體結合,再加入佐劑制備而成[32]。Jeong等[33]根據來自歐洲、北美洲和亞洲的不同分離株的氨基酸序列比對來構建Cap蛋白的氨基酸序列并合成小肽,使用氫氧化鋁、氧化鈷和脂質體為佐劑制備疫苗,結果表明以脂質體佐劑制備的合成肽疫苗免疫效果較好,但整體保護作用較當前商品疫苗略差一些。南京農業(yè)大學姜平教授研究團隊深入分析PCV2免疫保護抗原和抗原表位后,確定并篩選出由50~51個氨基酸組成的2條多肽序列,成功研制出PCV2合成肽疫苗[34]。疫苗免疫保護效力達100%,免疫持續(xù)期4個月,為防控PCVAD提供了又一種重要手段。
3.4 核酸疫苗
核酸疫苗能夠直接引入編碼特定抗原蛋白的DNA或RNA到免疫動物的細胞中,通過宿主細胞的表達機制轉化和翻譯外源核酸,形成的抗原蛋白刺激機體產生針對該抗原蛋白的免疫反應,最終達到預防或治療某種疾病的目的[35]。Sylla等[36]利用pEGFP-N1載體構建PCV2 Cap基因重組疫苗,對80只BALB/c小鼠以2周的間隔接種pEGFP-Cap、LG株疫苗、pEGFP- N1載體或PBS 3次,然后用PCV2攻毒。結果發(fā)現(xiàn),接種pEGFP-Cap的小鼠通過誘導高度特異的血清IgG抗體和細胞因子(γ干擾素和白細胞介素10),以及較小的PCV2病毒載量,有效地保護了小鼠免受PCV2感染。因此,這項研究表明,重組pEGFP- Cap可顯著減輕小鼠的PCV2感染,并提供證據證明DNA疫苗可以替代針對PMWS的PCV2疫苗。由于外源基因在宿主細胞中的表達調控和在細胞間的轉移機制研究尚不完善,可能會引起意外的免疫反應和其他問題,因此核酸疫苗的安全性和有效性還需進一步研究驗證,這是目前核酸疫苗研究僅限于實驗室研究的主要瓶頸原因之一[35]。
3.5 嵌合疫苗
嵌合疫苗能夠將2種或多種病原體的基因組或片段通過基因工程技術連接或替換,形成的重組基因能夠表達2種或更多的病原體抗原,然后再通過傳統(tǒng)方法設計和制造滅活疫苗、弱毒疫苗和亞單位疫苗等[37]。美國富道公司將致病性PCV2中的ORF 2片段置換不致病的PCV1中的ORF 2片段,構建了PCV1-2嵌合病毒并將其制成滅活疫苗。多次試驗表明,嵌合病毒滅活疫苗能夠為豬群提供較好的免疫防護,特別是在抑制病毒和降低病毒血癥的效果上有著顯著的優(yōu)勢。目前該疫苗已經在美國、加拿大、丹麥和墨西哥等國家獲得注冊并被廣泛使用[38-39]。國內市場上現(xiàn)有的PCV2嵌合疫苗為2019在我國注冊上市的碩騰公司生產的PCV1-2型嵌合體滅活疫苗。
4 PCV2聯(lián)合疫苗
聯(lián)合疫苗是指將2個或2個以上的疫苗抗原通過混合、聯(lián)合或同時施用的方式進行免疫接種,從而實現(xiàn)預防多個疾病的疫苗。聯(lián)合疫苗尤其是多聯(lián)疫苗在研制和臨床試驗過程中,應該充分考慮各種組分之間的相互作用以及它們對聯(lián)合疫苗安全性和有效性的可能影響[40]。國內市場上現(xiàn)有的PCV2聯(lián)合疫苗種類分為PCV2型、豬肺炎支原體二聯(lián)疫苗和PCV2型、副豬嗜血桿菌二聯(lián)疫苗,已獲批的國產疫苗有圓支優(yōu)、圓支康、圓支泰、圓支必寧等。陳昌海等[41]對PCV2滅活疫苗和豬瘟病毒凍干活疫苗聯(lián)合免疫效果進行了評估,結果表明2種疫苗聯(lián)合接種并未影響相應抗體的產生,反而在一定程度上發(fā)揮了協(xié)同作用,促進了2種抗體在豬群個體間的穩(wěn)定分布。張召等[42]對豬瘟活疫苗、PCV2型基因工程疫苗和豬肺炎支原體滅活疫苗3種疫苗聯(lián)合免疫的可行性進行評價,發(fā)現(xiàn)3種疫苗之間互不干擾,聯(lián)合免疫效果與單苗免疫一致,而且接種后的豬群在生長性能上表現(xiàn)更優(yōu),證明三者聯(lián)合免疫安全有效。
5 佐劑在PCV2疫苗中的應用
針對各種疫苗接種所需的佐劑而言,其效用與原理各有差異,故而在決定或挑選某種特定疫苗所用的佐劑的過程中,必須全面權衡靶動物種類、疫苗免疫原性質、需要激活的免疫類型、免疫應答的途徑以及期望達到的免疫效果等多方面因素[43]。目前PCV2商品疫苗的佐劑主要為化學佐劑和分子佐劑兩大類[44],在滅活疫苗、亞單位疫苗、合成肽疫苗等類型的疫苗中都有廣泛的應用。趙本進等[45]使用水包油佐劑Merckinade SDA 25、HS1010和雙向佐劑Montanide ISA 206制成PCV2滅活疫苗,對3種疫苗的穩(wěn)定性、黏度、接種仔豬后的有效性和安全性進行評估。結果表明,佐劑Montanide lSA 206相較Merckinade SDA 25可誘導更高水平抗體效價,考慮到佐劑產品的成熟度,確定滅活疫苗使用Montanide ISA 206。孫瑩慧等[46]將重組的PCV2 Cap蛋白與與氫氧化鋁膠佐劑、ISA 15 AVG佐劑和IMS 251C VG佐劑混合制備疫苗,并選擇PCV2陰性仔豬(14日齡)開展動物安全性檢驗和免疫效力檢驗。研究結果顯示,使用佐劑ISA 15A VG制備的亞單位疫苗,在接種仔豬后可刺激機體產生較高水平的體液免疫應答。劉新月等[47]將IMS 251C VG、GEL 02 PR、ISA 15A VG、ISA 206 VG、ISA 61 VG、臺灣細菌鞭毛、卡波姆、多糖共8種佐劑與適量PCV2多肽抗原按照特定方法配制成不同疫苗,采用小鼠試驗初步檢驗疫苗安全性及免疫效果,篩選出較優(yōu)的佐劑進行仔豬免疫攻毒保護試驗,研究結果表明油佐劑ISA 61 VG佐劑和水佐劑GEL 02 PR制備的PCV2合成肽疫苗無安全性問題,且具有極好的體液免疫和細胞免疫反應,對預防PCV2感染具有較好的免疫保護作用,是一種很好的合成肽疫苗佐劑。
分子佐劑能夠非特異性地改變或增強機體對抗原的特異性免疫應答,它們的形式與傳統(tǒng)佐劑不同,是質粒編碼的蛋白質,其作用方式依賴靶向先天免疫受體或分子信號轉導事件,包括模式識別受體激動劑、細胞因子、趨化因子和免疫靶向基因等[48]。Fu等[49]比較了泛素(Ub)、熱休克蛋白70 C端多肽結合區(qū)( Hsp70c)和白細胞介素-2(IL-2)這3種分子佐劑在基于PCV2 ORF2基因DNA疫苗中的增強能力,結果表明相較于Hsp70c和IL-2,利用Ub作為分子佐劑可誘導更強的Th1型細胞免疫,血清中Cap蛋白特異性IgG抗體水平也更高,而且在感染后的大部分時間內產生的特異性免疫均強于其他2組。因此,對于PCV2 DNA疫苗接種,Ub是比Hsp70c和IL-2更好的分子佐劑。
6 PCV2疫苗對不同亞型毒株的保護能力
目前PCV2的商業(yè)疫苗大多都來源于PCV2a和PCV2b亞型毒株,面對當前流行的主流PCV2d亞型毒株,已有研究者們評估了它們能否提供可靠的保護。Jeong等[50]、Opressing等[9]、黃亞平等[51]使用現(xiàn)有商品PCV2滅活疫苗對流行的PCV2d毒株的免疫保護效果進行評估,F(xiàn)ort等[8]通過試驗驗證了基于PCV2 Cap蛋白的亞單位疫苗對來自具有不同基因型和地理來源的4種不同 PCV2分離株的保護作用,結果均表明現(xiàn)有商品疫苗能完全保護PCV不同基因型的攻擊。然而,Li等[52]比較了基于基因型2b和2d的2種試驗性PCV1-2滅活嵌合疫苗的保護能力,結果表明2個疫苗接種組在攻毒后的體液免疫反應、PCV2b載量或 PCV 相關微觀病變方面沒有顯著差異。然而,在接種PCV2b疫苗豬的腹股溝淺表淋巴結中沒有檢測到來自攻擊毒株的DNA,但攻毒后21 d在PCV2d免疫組的1頭豬中檢測到來自攻擊毒株的DNA。Kang等[53]發(fā)現(xiàn)在韓國田間分離的PCV2毒株[QIA215(PCV2a)、QIA418(PCV2b)、QIA169(PCV2d)和QIA244(PCV2d)]表現(xiàn)出不同的抗原結合活性,觀察到不同基因型之間以及相同基因型的毒株之間存在交叉保護差異。Reiner等[54]也發(fā)現(xiàn)了一致的結果,與未接種疫苗的豬群相比,接種疫苗的豬群中感染PCV2a的頻率相對降低,而感染PCV2b的情況正好相反。綜上所述,當受到異源毒株感染時,目前商品疫苗雖然也能引起對臨床綜合征的充分保護,并減少病毒復制,但是病毒感染和復制并不能被完全阻止,并且在不太理想的條件下(例如不準確的疫苗接種、免疫抑制、母源免疫下降、伴隨感染等)免疫可能不太有效[52]。
7 討論和展望
目前,國際和國內上應用的PCV2商品疫苗在防治PCVAD方面臨床效果較好,且對PCV2感染有效,但由于PCV的高度變異性和免疫逃逸等特點,目前尚未有一種完全有效的疫苗能夠提供長期的保護。傳統(tǒng)的滅活疫苗具有很強的免疫原性,制備過程簡單,成本較低,但在大規(guī)模應用中,由于長時間的病毒培養(yǎng)周期,這些疫苗的產量通常無法滿足需求并存在安全性較差的問題。新型純凈性較高、安全性較好的基因工程疫苗正在逐漸取代一些傳統(tǒng)疫苗,但這些新型疫苗的免疫原性較弱,單獨使用時無法引發(fā)有效的免疫反應[55]。新上市的的PCV2合成肽疫苗在技術上層面實現(xiàn)了突破性創(chuàng)新,為疫苗的標準化、大規(guī)模產業(yè)化生產提供了可能,為規(guī)模化養(yǎng)殖企業(yè)帶來了更多選擇,有力保障了生豬產業(yè)的持續(xù)健康發(fā)展。然而,單獨的基于肽的疫苗,即使包含最佳B細胞和T細胞表位,仍需佐劑和適當?shù)倪f送系統(tǒng)才能更高效地發(fā)揮疫苗效果[33,56]。因此,目前需要開發(fā)能夠應對疫苗應用范圍擴大,并且能夠適用于多種給藥途徑的多樣化應用方法的新型免疫佐劑來進一步提高疫苗的免疫效果。
研究表明,當前的PCV2疫苗對于不同亞型的毒株具有保護作用,能夠有效地預防臨床癥狀的發(fā)展,減輕病毒血癥并產生有效的體液和細胞免疫反應。然而,同樣也有試驗數(shù)據表明這些疫苗往往對同源攻擊比異源攻擊表現(xiàn)出更高的保護作用,并有部分流行病學調查分析和統(tǒng)計評估指出,觀察到的PCV2基因型轉變通常與地方流行毒株和使用疫苗的不同保護有關[57]。盡管無法得到確切的證實,但從個體試驗數(shù)據到地區(qū)流行調查統(tǒng)計的一致結果均表明了特定基因型疫苗誘導免疫在推動PCV2變異過程中起到了一定作用,從長遠來看可能對當前疫苗免疫效力產生不利影響。
隨著分子生物學和基因工程技術的不斷進步,研究者們在基于現(xiàn)有研究成果的基礎上積極探索如何改進、創(chuàng)新PCV2疫苗,比如改良免疫原設計、提高免疫效力、減少副反應等。研發(fā)出一種安全高效且生產成本低的PCV2基因工程疫苗,已成為疫苗研發(fā)的主流方向,相信隨著相關研究的不斷深入,一定能研制出理想的疫苗。

