微流控技術(shù)在生物膜研究中的應(yīng)用
王珊珊 殷敏 張鳳娟 余紫英 陳楠 呂敏
DOI:?10.3969/J.ISSN.1000-5137.2024.01.015
收稿日期:?2023-11-01
基金項目:?國家自然科學(xué)基金(31971310,?32371439)
作者簡介:?王珊珊(2000—),?女,?碩士研究生,?主要從事單細(xì)胞水平分析生物膜行為等方面的研究. E-mail:wss3185660968@163.com
* 通信作者:?呂?敏(1984—),?女,?研究員,?主要從事納米抗菌材料與微生物群體感應(yīng)等方面的研究. E-mail:lvmin@shnu.edu.cn
引用格式:?王珊珊,?殷敏,?張鳳娟,?等. 微流控技術(shù)在生物膜研究中的應(yīng)用?[J]. 上海師范大學(xué)學(xué)報?(自然科學(xué)版中英文),2024,53(1):113?119.
Citation format:?WANG S S,?YIN M,?ZHANG F J,?et al. Application of microfluidic technology in biofilm research [J].Journal of Shanghai Normal University (Natural Sciences),?2024,53(1):113?119.
摘??要:?生物膜是由細(xì)菌及其分泌的胞外聚合物組成的微生物簇. 目前,生物膜培養(yǎng)和研究多采用靜態(tài)培養(yǎng)平臺(如培養(yǎng)皿和孔板),這種方式缺乏精準(zhǔn)模擬理化微環(huán)境、高通量以及原位分析細(xì)菌行為的能力. 近年來,微流控技術(shù)作為一種在微米尺度處理和操縱流體的新技術(shù),在生物膜研究中的應(yīng)用不斷增加,且取得了一系列突破性進展. 文章系統(tǒng)綜述了最新的基于微流控技術(shù)的生物膜研究成果,總結(jié)并展望了微流控技術(shù)輔助生物膜研究的優(yōu)缺點及未來方向,以期為全面了解和拓展微流控技術(shù)在生物膜研究中的應(yīng)用提供幫助.
關(guān)鍵詞:?微流控技術(shù);?生物膜;?高通量;?可視化分析;?單細(xì)胞水平
中圖分類號:?Q 939 ???文獻標(biāo)志碼:?A ???文章編號:?1000-5137(2024)01-0113-07
Abstract:?Biofilm is a microbial community composed of bacteria and their secreted extracellular polymers. Currently,?biofilm culture and research mainly use static culture platforms(such as Petri dishes and well-plate),?which lack the ability to accurately simulate physicochemical microenvironments and perform high-throughput in situ?analysis of bacterial behavior. Microfluidics,?a new technique for processing or manipulating fluids at the micron scale,?has been used in biofilm research in recent years and several breakthroughs have been achieved. This paper systematically reviews recent research on the application of microfluidic technology to biofilms and summarizes the advantages,?disadvantages,?and future directions of microfluidic technology-assisted biofilm research to provide assistance for a comprehensive understanding and extension of the application of microfluidic technology in biofilm research.
Key words:?microfluidic technology;?biofilm;?high-throughput;?visual analysis;?single cell level
0 ?引?言
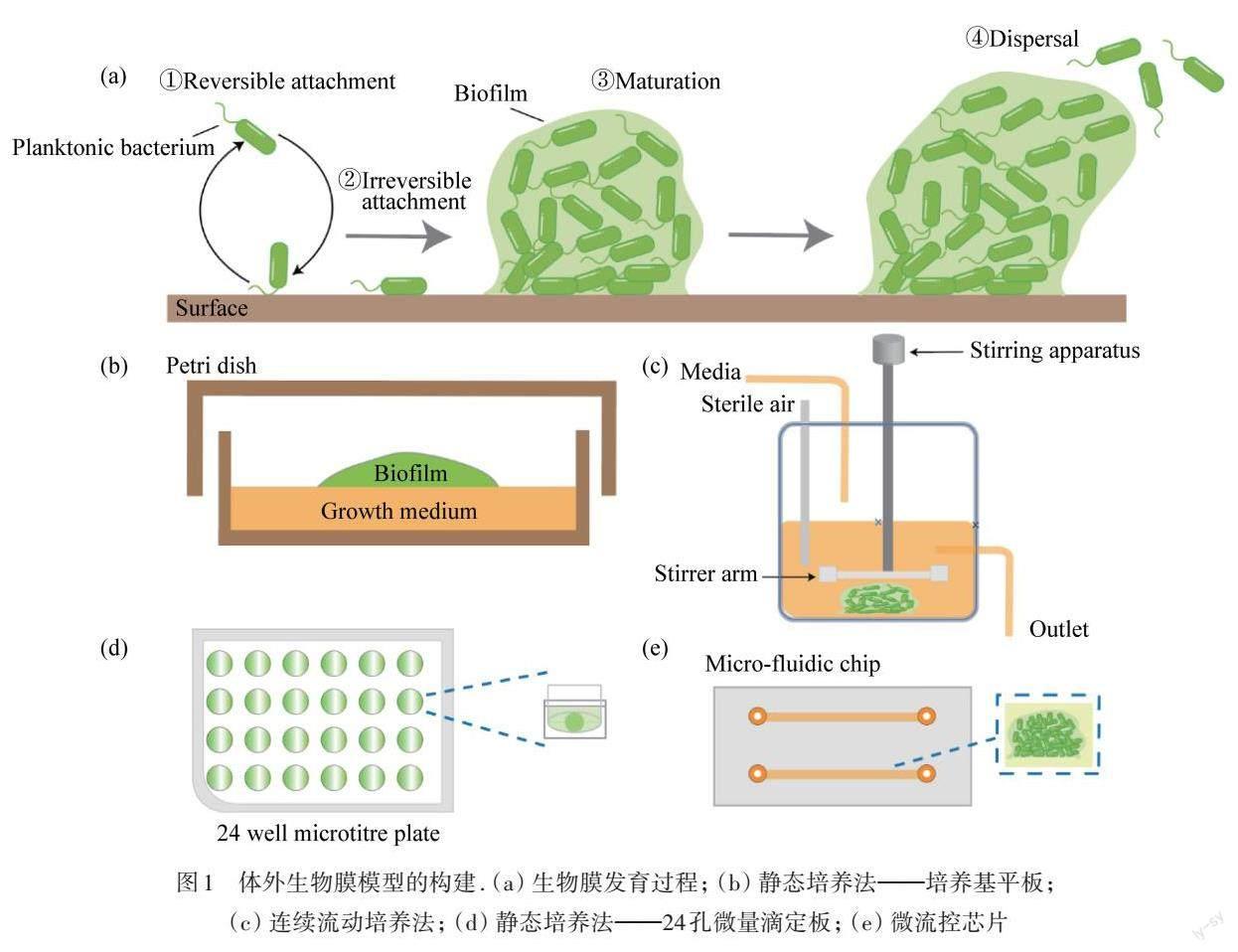
生物膜(Biofilm)存在于地球上幾乎所有的棲息地,它是微生物群體及其分泌的胞外聚合物(EPS)組成的三維類水凝膠結(jié)構(gòu)群落[1]. EPS主要是由多糖、蛋白質(zhì)、核酸和脂質(zhì)等生物大分子交聯(lián)而成的網(wǎng)絡(luò)結(jié)構(gòu),它介導(dǎo)細(xì)菌黏附于表面,連接生物膜細(xì)胞并瞬時固定,為生物膜提供瞬時穩(wěn)定性[2]. 生物膜發(fā)育是一個動態(tài)的過程,如圖1(a)所示,包括以下幾個階段[3]:(1)?細(xì)胞通過范德華力和疏水相互作用可逆地附著在表面[4];(2)?細(xì)胞由表面結(jié)構(gòu)如IV型菌毛介導(dǎo)的不可逆附著[5];(3)?細(xì)胞快速增殖和分泌EPS形成成熟的微菌落;(4)?生物膜中的細(xì)菌擴散出去進入新的生長周期. 生物膜對自然環(huán)境和人類健康有利亦有害. 一方面,生物膜作為細(xì)菌的普遍存在形式,在地球物質(zhì)的分解和循環(huán)利用、生態(tài)環(huán)境平衡等方面起著積極作用;另一方面,生物膜對食品加工和存儲運輸?shù)阮I(lǐng)域造成嚴(yán)重的生物污染,全球每年需要花費數(shù)十億美元應(yīng)對生物膜污染問題[6]. 生物膜能造成臨床80%以上的感染疾病[7],特別是定植于可植入醫(yī)療設(shè)備上[8-9]. 因此,深入研究生物膜行為,趨利避害,發(fā)展生物膜應(yīng)對策略成為當(dāng)前生物醫(yī)學(xué)、生物材料以及環(huán)境治理等領(lǐng)域的前沿?zé)狳c.
目前,生物膜主要是浮游細(xì)菌通過靜態(tài)培養(yǎng)而成的,即在平板或孔板上培養(yǎng)細(xì)菌,使其發(fā)展為成熟生物膜結(jié)構(gòu),如圖1(b)和(d)所示. 培養(yǎng)器皿內(nèi)液體或固體培養(yǎng)基與空氣形成氣液或氣固交界面,這些相對固定的界面環(huán)境,微生態(tài)條件的變化較少,存在培養(yǎng)液無法持續(xù)更新、生物膜生長環(huán)境單一的缺點. 因此,利用流動反應(yīng)器或恒化器動態(tài)培養(yǎng)生物膜成為研究者關(guān)注的焦點,如圖1(c)所示. 流動培養(yǎng)的優(yōu)勢在于能夠在生物膜的形成過程中施加流體剪切力并持續(xù)更新培養(yǎng)液和刺激物. 然而,恒化器等設(shè)備的設(shè)計制作較為復(fù)雜,培養(yǎng)液消耗量較大.

圖1 體外生物膜模型的構(gòu)建. (a)?生物膜發(fā)育過程;?(b)?靜態(tài)培養(yǎng)法——培養(yǎng)基平板;?(c)?連續(xù)流動培養(yǎng)法;?(d)?靜態(tài)培養(yǎng)法——24孔微量滴定板;?(e)?微流控芯片
微流控技術(shù)(Microfluidic technology)作為一種在微米尺度上處理和控制液體的技術(shù),在生物傳感、分析檢測和生物成像方面有著廣泛的應(yīng)用. 尤其是,微流控技術(shù)對時間和空間的精確可控、多路復(fù)用和高通量監(jiān)測,在單細(xì)胞和單分子等生物研究中扮演重要的工具角色[10-11]. 近年來,研究者將微流控裝置用于生物膜的培養(yǎng)和研究,如圖1(e)所示,其三維微通道可以模擬生物膜生長的理化微環(huán)境,精準(zhǔn)控制流體剪切力、溫度、氧含量、pH值和藥物濃度等微環(huán)境參數(shù). 同時,微流控技術(shù)與高分辨顯微成像技術(shù)相結(jié)合,成為實時、原位、高通量觀察和分析生物膜行為的最佳技術(shù)[12]. 本文綜述了微流控技術(shù)用于生物膜研究的最新進展,包括模擬生物膜生長微環(huán)境以及高通量、可視化分析生物膜行為,分析了微流控技術(shù)在生物膜研究中的優(yōu)勢和局限性,并討論了其在未來的可能發(fā)展方向,為全面了解和拓展微流控技術(shù)在生物膜研究中的應(yīng)用提供綜合解讀.
1 ?微流控技術(shù)用于模擬生物膜的生長微環(huán)境
生物膜被視為是微生物群體組成的小型“社會”. 當(dāng)外界物理、化學(xué)環(huán)境發(fā)生改變時,生物膜的群落結(jié)構(gòu)、形態(tài)、致病性、耐藥性等特性都會發(fā)生變化[13]. 為了更好地分析環(huán)境因素對生物膜的影響,研究者將微流控芯片的通道底面作為生物膜生長的基底,通過設(shè)計不同的通道幾何形狀,來創(chuàng)造三維的生長平臺,并且通過調(diào)控流體流動剪切力、效應(yīng)物或溶解氧濃度梯度等多種理化因素,探究影響生物膜生長的關(guān)鍵微環(huán)境因素[14]. 微流體的發(fā)展使對環(huán)境條件的控制更加精確,并提供了前所未有的優(yōu)勢.
1.1 微流控技術(shù)模擬物理環(huán)境對生物膜的作用
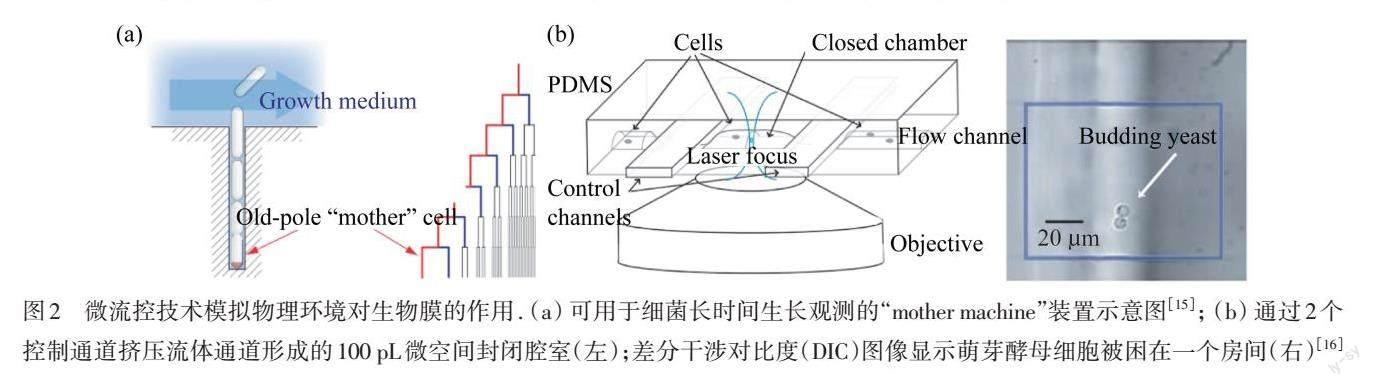
微流控技術(shù)可以為細(xì)菌提供微尺度的生長空間,這有利于長時間、原位觀察某一個或某一處生物膜形成. WANG等[15]設(shè)計并構(gòu)建了“mother machine”微流控裝置,如圖2(a)所示,實現(xiàn)了對單個細(xì)菌在均勻營養(yǎng)環(huán)境中長達(dá)數(shù)周的生長觀測,這在宏觀實驗中是不可能實現(xiàn)的. CAI等[16]將細(xì)菌“困”在一個100 pL腔室的微流控裝置中,如圖2(b)所示,實現(xiàn)了對單細(xì)胞水平上的蛋白表達(dá)隨機性的觀測. 這些結(jié)果為深入理解流體動力環(huán)境下生物膜的生長提供了便利的、參數(shù)精確可控的實驗?zāi)P?

圖2 微流控技術(shù)模擬物理環(huán)境對生物膜的作用. (a)?可用于細(xì)菌長時間生長觀測的“mother machine”裝置示意圖[15];?(b)?通過2個控制通道擠壓流體通道形成的100 pL微空間封閉腔室(左);差分干涉對比度(DIC)圖像顯示萌芽酵母細(xì)胞被困在一個房間(右)[16]
在單相體系中考察流體流速對生物膜生命進程的作用是一項非常重要的研究. 利用聚二甲基硅氧烷(PDMS)微通道可以考察微環(huán)境中流體力學(xué)因素(流體剪切力和流動條件)對生物膜結(jié)構(gòu)的影響. ZHANG等[17]利用微流控裝置產(chǎn)生的強剪切力,研究了細(xì)菌在極端剪切環(huán)境下的黏附行為. 結(jié)果顯示:與對抗生素高度耐受的普通持久性細(xì)胞不同,強剪切流持續(xù)細(xì)胞(SSP)可以抵抗各種聚合物材料表面的機械沖洗,并可以形成對高劑量氨基糖苷類抗生素耐受的獨特生物膜. 隨后,制備了雙面玻璃型微流控流動樣品池[18],實現(xiàn)了細(xì)菌生物膜的在線培養(yǎng),結(jié)合全內(nèi)反射顯微成像技術(shù)原位觀察黏附細(xì)菌的生長行為,直接觀察到細(xì)菌細(xì)胞通過一個最近的接觸點附著在表面,隨著細(xì)胞分裂,逐漸變?yōu)?個接觸點. KIM等[19]通過調(diào)節(jié)微通道寬窄來控制流速,并利用雷諾數(shù)(Re)和通道的寬高比(r)表征了銅綠假單胞菌生物膜的空間結(jié)構(gòu),結(jié)果顯示:在低Re時,較高的流速刺激生物膜的生長;而在高Re時,較高的流速卻抑制生物膜的生長. 同時,不同的流體環(huán)境還可以影響生物膜內(nèi)細(xì)菌的群體感應(yīng)特性(QS),進而改變生物膜的構(gòu)成與致病性. BASSLER等[20]的研究發(fā)現(xiàn),利用微流控技術(shù),在流動條件下,相同基因型細(xì)菌由于QS在時間和空間上的差異而出現(xiàn)不同的表型,表現(xiàn)出不同程度的定殖和致病能力. 這些結(jié)果顯示:相比傳統(tǒng)的靜態(tài)培養(yǎng)方法,微流控芯片上的生物膜培養(yǎng)顯示出更好的生長可控性,對生物膜的流體動力學(xué)及其相關(guān)影響因素的研究也有了更精確的定量.
1.2 微流控技術(shù)分析化學(xué)效應(yīng)物濃度對生物膜的影響
在復(fù)雜生態(tài)環(huán)境中,微生物(特別是細(xì)菌)能夠感知周圍環(huán)境中的化學(xué)物質(zhì)及氧氣的變化,并沿著化學(xué)物質(zhì)的濃度梯度產(chǎn)生定向的趨化行為,這種趨化行為在生物膜的形成、分散與致病等生命活動中起著至關(guān)重要的作用.

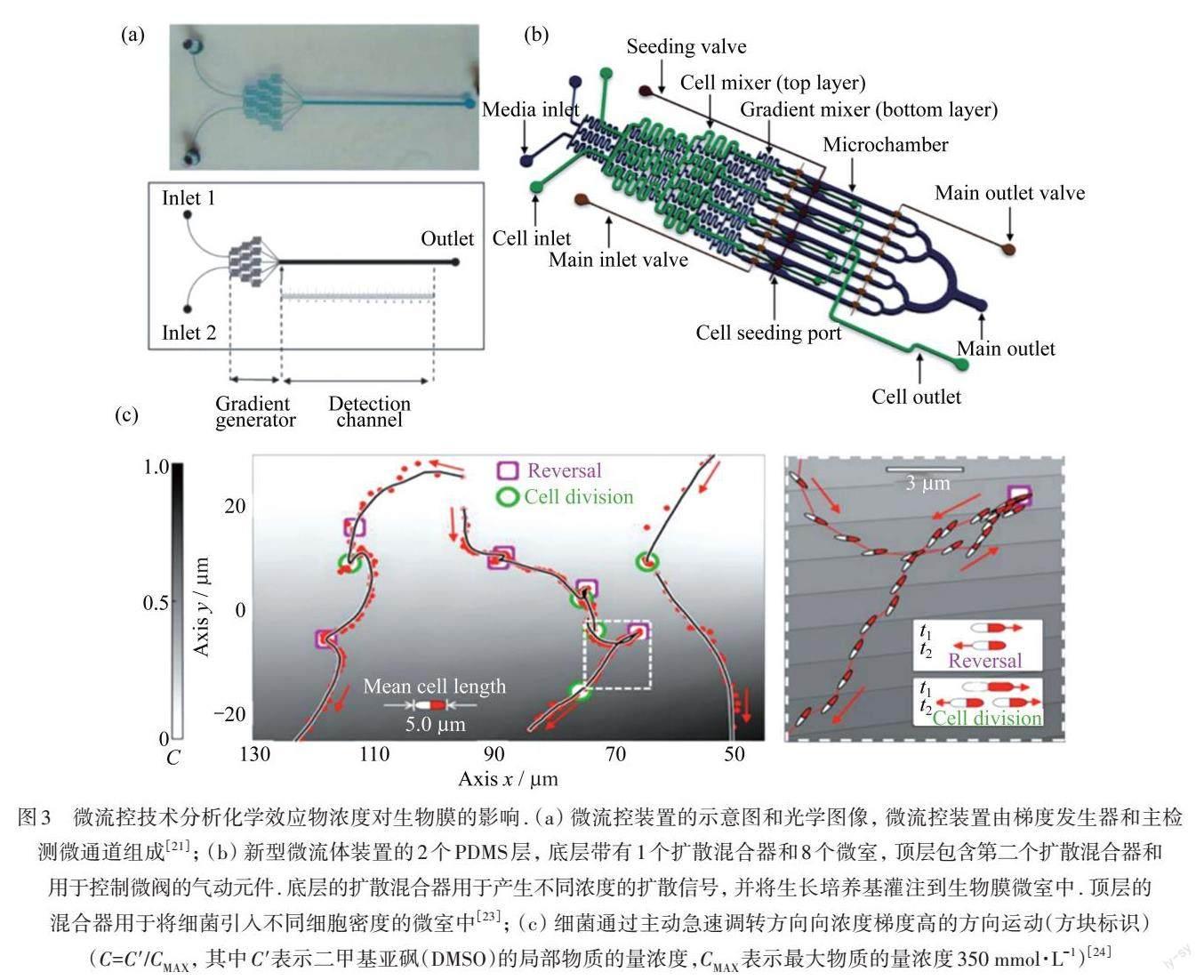
圖3 微流控技術(shù)分析化學(xué)效應(yīng)物濃度對生物膜的影響. (a)?微流控裝置的示意圖和光學(xué)圖像,?微流控裝置由梯度發(fā)生器和主檢測微通道組成[21];?(b)?新型微流體裝置的2個PDMS層,?底層帶有1個擴散混合器和8個微室,?頂層包含第二個擴散混合器和用于控制微閥的氣動元件. 底層的擴散混合器用于產(chǎn)生不同濃度的擴散信號,?并將生長培養(yǎng)基灌注到生物膜微室中. 頂層的混合器用于將細(xì)菌引入不同細(xì)胞密度的微室中[23];?(c)?細(xì)菌通過主動急速調(diào)轉(zhuǎn)方向向濃度梯度高的方向運動(方塊標(biāo)識)(C=C'/CMAX,?其中C'表示二甲基亞砜(DMSO)的局部物質(zhì)的量濃度,CMAX表示最大物質(zhì)的量濃度350 mmol·L-1)[24]
利用分子在水凝膠中的擴散特性,微流控芯片可以設(shè)計為可精準(zhǔn)調(diào)控物質(zhì)濃度梯度的裝置,用于研究效應(yīng)物及氧氣對生物膜的影響. KIM等[21]構(gòu)筑的濃度梯度微流控芯片可用于原位監(jiān)測抗生素對生物膜的最小去除濃度(MBEC),如圖3(a)所示,發(fā)現(xiàn)銅綠假單胞菌生物膜的MBEC遠(yuǎn)高于其在臨床中使用的最小抑制濃度(MIC),該方法更加精確、快捷,對于臨床用藥具有重要的指導(dǎo)意義. SKOLIMOWSKI等[22]設(shè)計了一種可以產(chǎn)生不同溶解氧濃度梯度的微流控芯片,用于觀察銅綠假單胞菌生物膜在不同氧濃度下的生長形態(tài),為微需氧或厭氧條件下生物膜的研究提供新技術(shù)支撐. HONG等[23]設(shè)計了集成了多個閥門的多層PDMS微流控芯片,如圖3(b)所示,通過精確的程序化添加效應(yīng)物分子來控制大腸桿菌生物膜的生長,使改造的工程菌株成功取代已存在的生物膜,為臨床清除生物膜提供了新策略. OLIVEIRA等[24]將微流控技術(shù)和大規(guī)模并行自動跟蹤技術(shù)相結(jié)合,研究銅綠假單胞菌早期生物膜發(fā)育行為,該研究證明了單附著細(xì)菌可以對化學(xué)梯度作出反應(yīng),如圖3(c)所示. 運動的細(xì)菌就像螞蟻穿過巢穴一樣,能夠在化學(xué)和生物環(huán)境中為自己導(dǎo)航,這對認(rèn)識細(xì)菌群落的生物行為以及操縱它們的發(fā)育有重要意義.
2 ?微流控技術(shù)用于高通量、原位示蹤研究生物膜
生物膜會引發(fā)多種慢性感染疾病,如中耳炎、囊性纖維化和心內(nèi)膜炎等. 為了及時控制或去除致病生物膜感染,臨床需要快速確定防治生物膜的有效藥物,并鑒定生物膜耐藥的抗性基因. 微流控芯片的高通量特點,結(jié)合化學(xué)修飾方法和可視化技術(shù)能夠很好地滿足這一需求. BENOIT等[25]使用Bioflux公司的商品化微流控芯片結(jié)合綠色熒光蛋白示蹤技術(shù),鑒定了銅綠假單胞菌生物膜對抗生素的敏感性,如圖4(a)所示. 該芯片可以同時對96個生物被膜進行培養(yǎng)與鑒定,極大地提高了通量與效率. 利用3D顯微打印技術(shù),CONNELL等[26]用明膠打印出相鄰的或鑲嵌的十幾至幾十微米大小的微菌落,并利用明膠的通透性研究不同菌株間的抗藥交互作用,如圖4(b)所示.

圖4 微流控技術(shù)用于高通量、可視化研究生物膜. (a)?生物通量微流體通道的特寫(黑線). 每個通道都有一個蛇形區(qū)域(一個蛇形區(qū)域封閉在一個盒子中)以提供足夠的背壓和一個用于顯微鏡觀察的腔室(箭頭)[25];?(b)?剖面3D掩模重建(上)和明場圖像(下)描繪了不同幾何形狀和細(xì)胞密度的嵌套多微生物群落的示例[26];?(c)?使用Biorender創(chuàng)建的用于生物膜原位連續(xù)監(jiān)測的微流體系統(tǒng)示意圖[27]
細(xì)菌生物膜的實時原位連續(xù)監(jiān)測是篩選新型抗生物膜試劑的基礎(chǔ). 2023年,SONG等[27]提出了一種利用石墨烯修飾微電極陣列傳感器的微流控系統(tǒng),通過電化學(xué)阻抗實現(xiàn)細(xì)菌生物膜的動態(tài)監(jiān)測,如圖4(c)所示. 結(jié)果表明:由于傳感界面上細(xì)菌細(xì)胞負(fù)荷的增加,生物膜狀態(tài)的觀察窗口期顯著延長,從而大大提高了傳感信號質(zhì)量. PAULA等[28]構(gòu)建了微流控系統(tǒng)、高分辨率延時共焦成像以及3D標(biāo)量映射算法相結(jié)合的分析系統(tǒng),多尺度、長時程呈現(xiàn)了變形鏈球菌從單細(xì)胞到多細(xì)胞群落的生長動力學(xué). 發(fā)現(xiàn)生物膜類似城市化的空間和結(jié)構(gòu)模式,其中一些“定居者”保持靜止,而另一些則成長為聚集物(村莊),這些聚集物進一步擴展為人口稠密的微殖民地,這些微殖民地被封閉在明確的邊界(城市)中,反過來又相互融合,形成更大的生物膜上層建筑(特大城市). 微流控技術(shù)為長時間、原位連續(xù)監(jiān)測生物膜種群增長和擴張的空間和結(jié)構(gòu)研究提供了有力工具.
3 ?結(jié)論與展望
經(jīng)典的靜態(tài)培養(yǎng)皿或平板培養(yǎng)是過去幾十年培養(yǎng)和研究生物膜的重要平臺. 但是,隨著微流控技術(shù)的飛速發(fā)展和在生物醫(yī)學(xué)領(lǐng)域的應(yīng)用,目前,微流控技術(shù)已成為一種重要的生物膜培養(yǎng)和研究技術(shù). 微流控芯片在精準(zhǔn)控制和研究環(huán)境參數(shù)(例如物理空間、化學(xué)物質(zhì)梯度以及流體剪切力等)對生物膜發(fā)育的影響方面起到舉足輕重的作用. 但是,微流控技術(shù)用于生物膜長期培養(yǎng)時存在高污染的風(fēng)險,特別是在富含高營養(yǎng)的培養(yǎng)介質(zhì)中. 因此,微流控芯片培養(yǎng)生物膜時,需要對其管道、微流體通道和培養(yǎng)介質(zhì)進行徹底無菌處理. 此外,細(xì)菌不僅黏附在微通道底部,而且會相互黏附在低流速區(qū)域形成大的細(xì)菌團簇,特別容易發(fā)生微流體系統(tǒng)堵塞問題. 因此,設(shè)計不同結(jié)構(gòu)的微流控芯片以適應(yīng)生物膜培養(yǎng)需求是未來發(fā)展的方向之一. 例如,設(shè)計有3個入口通道,合并成1個單獨的腔室,然后是1個出口通道的微流控系統(tǒng),它能夠控制來自3個不同液體儲存器的流速,層流狀態(tài)不同可導(dǎo)致不同介質(zhì)在空間上分離流動,避免發(fā)生堵塞,如圖5所示[29].

圖5 微流體平臺的設(shè)計和微流體室的特寫示意圖[29]
同時,微流控技術(shù)與多種成像技術(shù)相結(jié)合,已成為高通量、實時動態(tài)追蹤細(xì)菌發(fā)展為生物膜的有力工具. 目前,基于微流控技術(shù)的成像分析平臺在單細(xì)菌水平上研究細(xì)菌的演化、營養(yǎng)適應(yīng)性、分裂不對稱性、與宿主相互作用和抗生素耐受性等方面取得的進展,為深入認(rèn)識和理解細(xì)菌及生物膜行為奠定了理論基礎(chǔ). 可以預(yù)見,隨著顯微鏡技術(shù)及圖像識別和分析技術(shù)的升級,基于微流控技術(shù)的細(xì)菌研究平臺必將在解析生物膜行為方面獲得新理論,為臨床和生產(chǎn)實踐防治生物膜感染和利用有益生物膜提供理論指導(dǎo).
參考文獻:
[1] VAN WOLFEREN M,?ORELL A,?ALBERS S V. Archaeal biofilm formation [J]. Nature Reviews Microbiology,?2018,16(11):699-713.
[2] FLEMMING H C,?WINGENDER J. The biofilm matrix [J]. Nature Reviews Microbiology,?2010,8(9):623-633.
[3] FLEMMING H C,?WINGENDER J,?SZEWZYK U,?et al. Biofilms:?an emergent form of bacterial life [J]. Nature Reviews Microbiology,?2016,14(9):563-575.
[4] GARRETT T R,?BHAKOO M,?ZHANG Z. Bacterial adhesion and biofilms on surfaces [J]. Progress in Natural Science,2008,18(9):1049-1056.
[5] MAIER B,?WONG G C L. How Bacteria use type Ⅳ pili machinery on surfaces [J]. Trends in Microbiology,?2015,23(12):775-788.
[6] MACFARLANE S,?DILLON J F. Microbial biofilms in the human gastrointestinal tract [J]. Journal of Applied Microbiology,?2007,102(5):1187-1196.
[7] LEWIS K. Riddle of biofilm resistance [J]. Antimicrobial Agents and Chemotherapy,?2001,45(4):999-1007.
[8] COSTERTON J W,?STEWART P S,?GREENBERG E P. Bacterial biofilms:?a common cause of persistent infections [J].Science,?1999,284(5418):1318-1322.
[9] WI Y M,?PATEL R. Understanding biofilms and novel approaches to the diagnosis,?prevention,?and treatment of medical device-associated infections [J]. Infectious Disease Clinics of North America,?2018,32(4):915-929.
[10] CONVERY N,?GADEGAARD N. 30 years of microfluidics [J]. Micro and Nano Engineering,?2019,2(7):76-91.
[11] DITTRICH P S,?MANZ A. Lab-on-a-chip:?microfluidics in drug discovery [J]. Nature Reviews Drug Discovery,?2006,5(3):210-218.
[12] VERTES A,?HITCHINS V,?PHILLIPS K S. Analytical challenges of microbial biofilms on medical devices [J]. Analytical Chemistry,?2012,84(9):3858-3866.
[13] BOWEN W H,?BURNE R A,?WU H,?et al. Oral biofilms:?pathogens,?matrix,?and polymicrobial interactions in microenvironments [J]. Trends in Microbiology,?2018,26(3):229-242.
[14] DRESCHER K,?SHEN Y,?BASSLER B L,?et al. Biofilm streamers cause catastrophic disruption of flow with consequences for environmental and medical systems [J]. Proceedings of the National Academy of Sciences of the United States of America,?2013,110(11):4345-4350.
[15] WANG P,?ROBERT L,?PELLETIER J,?et al. Robust growth of escherichia coli [J]. Current Biology,?2010,20(12):1099-1103.
[16] CAI L,?FRIEDMAN N,?XIE X S. Stochastic protein expression in individual cells at the single molecule level [J].Nature,?2006,440(7082):358-362.
[17] ZHANG R,?XIA A,?NI L,?et al. Strong shear flow persister bacteria resist mechanical washings on the surfaces of various polymer materials [J]. Advanced Biosystems,?2017,1(12):1700161.
[18] XIA A,?YANG S,?ZHANG R,?et al. Imaging the separation distance between the attached bacterial cells and the surface with a total internal reflection dark-field microscope [J]. Langmuir,?2019,35(26):8860-8866.
[19] KIM J,?KIM H S,?HAN S,?et al. Hydrodynamic effects on bacterial biofilm development in a microfluidic environment [J].Lab on a Chip,?2013,13:1846-1849.
[20] KIM M K,?INGREMEAU F,?ZHAO A,?et al. Local and global consequences of flow on bacterial quorum sensing [J].Nature Microbiology,?2016,1(1):15005.
[21] KIM K P,?KIM Y G,?CHOI C H,?et al. In situ?monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device [J]. Lab on a Chip,?2010,10(23):3296-3299.
[22] SKOLIMOWSKI M,?NIELSEN M W,?EMN?US J,?et al. Microfluidic dissolved oxygen gradient generator biochip as a useful tool in bacterial biofilm studies [J]. Lab on a Chip,?2010,10(16):2162-2169.
[23] HONG S H,?HEGDE M,?KIM J,?et al. Synthetic quorum-sensing circuit to control consortial biofilm formation and dispersal in a microfluidic device [J]. Nature Communications,?2012,3(1):613.
[24] OLIVEIRA N M,?FOSTER K R,?DURHAM W M. Single-cell twitching chemotaxis in developing biofilms [J]. Proceedings of the National Academy of Sciences,?2016,113(23):6532-6537.
[25] BENOIT M R,?CONANT C G,?IONESCU-ZANETTI C,?et al. New device for high-throughput viability screening of flow biofilms [J]. Applied and Environmental Microbiology,?2010,76(13):4136-4142.
[26] CONNELL J L,?RITSCHDORFF E T,?WHITELEY M,?et al. 3D printing of microscopic bacterial communities [J]. Proceedings of the National Academy of Sciences of the United States of America,?2013,110(46):18380-18385.
[27] SONG J,?ALI A,?MA Y,?et al. A graphene microelectrode array based microfluidic device for in situ?continuous monitoring of biofilms [J]. Nanoscale Advances,?2023,5(18):4681-4686.
[28] PAULA A J,?HWANG G,?KOO H. Dynamics of bacterial population growth in biofilms resemble spatial and structural aspects of urbanization [J]. Nature Communications,?2020,11(1):1354.
[29] STRAUB H,?EBERL L,?ZINN M,?et al. A microfluidic platform for in situ?investigation of biofilm formation and its treatment under controlled conditions [J]. Journal of Nanobiotechnology,?2020,18(1):166.
(責(zé)任編輯:郁慧,顧浩然)

