擠壓對小麥面筋蛋白構象變化和功能特性影響的研究進展
郭遠,翟曉娜,裴海生,江利華,李媛媛
(1.農業農村部規劃設計研究院,北京 100125;2.農業農村部農產品產地初加工重點實驗室,北京 100121;3.河北工程大學 生命科學與食品工程學院,河北 邯鄲 056038)
蛋白質提供必需氨基酸以供人體合成激素、酶和抗體等,是人體所需營養素之一[1]。蛋白質除了具有營養價值外,還具有重要的食品工業應用價值,可開發利用其不同的功能特性如乳化性和凝膠性等以滿足食品生產的實際需求。小麥面筋蛋白作為淀粉生產中的副產物,來源廣泛,價格便宜,主要應用在面粉、肉制品和一些非食品如飼料加工中,是人類獲得能量、蛋白質的主要來源[2]。國家統計局數據顯示,2021 年我國小麥總產量為13 694.45 萬t,小麥面筋蛋白原料充足。2010 年我國小麥面筋蛋白的年產量已達30 萬t,年消費量10 萬t 以上,傳統領域對小麥面筋蛋白的需求已趨于飽和[2]。根據小麥面筋蛋白結構和功能特性,利用改性方法,深度加工利用小麥面筋蛋白,將其開發應用在新領域中是小麥面筋蛋白加工業的重要方向和研究熱點。
目前,關于小麥面筋蛋白的改性加工方法有諸多報道,擠壓加工技術是集混合、攪拌、破碎、加熱、蒸煮、殺菌、膨化以及成型等過程為一體的新型蛋白改性技術,具有設備成本低、能源消耗低、工藝操作簡化等特點,以及產品口感好、可鈍化不良因子等優勢,廣泛應用于蛋白改性領域[3]。近幾年來,國內外對于小麥面筋蛋白擠壓過程中的微觀結構和性質變化均有一定研究,小麥面筋蛋白在擠壓過程中的變性機理為擠壓機內蛋白質受到高溫、高壓和剪切力的影響,維持蛋白質高級結構的結合力會變弱,失去其本身球形結構和三維空間結構,從折疊狀態伸展開來,蛋白質分子鏈重組,分子間的相互作用力如氫鍵、二硫鍵等會發生斷裂,使蛋白質變性[4-7]。通過擠壓加工小麥面筋蛋白,使小麥面筋蛋白的微觀結構改變,進而改變蛋白質的物理、化學和營養性質,改性后的小麥面筋蛋白在某些方面相較之前有更大的優勢,從而有更好的利用價值[8]。
基于此,本文從小麥面筋蛋白的組成和功能出發,綜述了擠壓處理中擠壓剪切力、擠壓溫度和調制劑的添加對面筋蛋白構象變化和功能特性影響的研究進展,以期為小麥面筋蛋白的加工利用提供參考,指導小麥面筋蛋白類食品的開發。
1 小麥面筋蛋白的組成和功能
小麥籽粒中蛋白質含量為9%~15%,根據溶解特性可分為溶于水的清蛋白、溶于稀鹽溶液的球蛋白、溶于醇溶液的麥醇溶蛋白、溶于稀酸或稀堿的麥谷蛋白,未被溶解的殘存蛋白也可歸為麥谷蛋白。其中,清蛋白和球蛋白是小麥籽粒的酶蛋白,主要參與各種代謝;麥醇溶蛋白和麥谷蛋白是小麥籽粒的儲藏蛋白,合稱為小麥面筋蛋白(gluten),約占小麥籽粒中總蛋白的80%[9-10]。
麥醇溶蛋白具有單體結構,根據其氨基酸序列不同,分為ω5(相對分子質量為49 000~55 000 Da,分別占麥醇溶蛋白含量的3%~6%)、ω1,2(相對分子質量為39 000~44 000 Da,分別占麥醇溶蛋白含量的4%~7%)、α/β(相對分子質量為28 000~35 000 Da,分別占麥醇溶蛋白含量的28%~33%)和γ-醇溶蛋白(相對分子質量為31 000~35 000 Da,分別占麥醇溶蛋白含量的23%~31%)。由于缺乏半胱氨酸,大多數ω-醇溶蛋白不可能形成二硫鍵,而γ-醇溶蛋白和α/β-醇溶蛋白分別含有8 個和6 個半胱氨酸殘基,可分別形成4 個和3 個鏈內交聯物[11-14]。
麥谷蛋白為一種由亞基通過分子間二硫鍵相連形成的聚集體蛋白,相對分子質量在500 000 Da 到10 000 000 Da 之間。亞基根據氨基酸序列和分子量不同,分為低分子量麥谷蛋白亞基(low molecular weight gluten subunit,LMW-GS)和高分子量麥谷蛋白亞基(high molecular weight gluten subunit,HMW-GS)。LMW-GS 含量約占整個面筋蛋白的19%~25%,相對分子質量在32 000~39 000 Da。HMW-GS 含量約占整個面筋蛋白的10%[15]。根據氨基酸序列和分子量的不同,HMW-GS 可以進一步分為x 類型和y 類型,相對分子量分別為83 000~88 000 Da 和67 000~74 000 Da,LMW-GS 和HMW-GS 分別由8 個和11 個(x-HMW)-12(y-HMW)-半胱氨酸殘基組成[16-17]。
面筋蛋白及其亞基是植物蛋白的重要組成部分,它們可以在凝膠和可食性薄膜生產中形成起主導作用的網絡,產生穩定乳液和泡沫的界面薄膜[13]。然而,麥醇溶蛋白能夠溶解于70%乙醇水溶液中,而不能溶解在水中,這限制了麥醇溶蛋白在實際食品生產中的應用[18]。另外,關于既不溶于乙醇溶液也不溶于水的麥谷蛋白應用的研究仍然較少,如要綜合利用小麥面筋蛋白,就需要針對其蛋白特性,利用改性方法,擴展面筋蛋白及其組分在食品加工中的應用。
2 擠壓對面筋蛋白構象變化和功能特性影響的研究進展
擠壓過程依賴于高溫、壓力、螺桿轉速、剪切力、模具形狀和水分含量,使小麥面筋、淀粉等動植物資源生成大量具有膨脹特性和低密度特征的產品。小麥面筋蛋白中隱藏氨基酸的暴露以及蛋白質分子之間疏水相互作用和二硫鍵的生成提供了與其他食物成分相互作用的可能性。通過擠壓處理,食品的質構特性、消化性和持水性、美拉德反應和其他功能顯著增強。因此,從擠壓過程中小麥面筋蛋白構象變化出發,探究擠壓剪切力、溫度和調制劑在擠壓過程中對小麥面筋蛋白的影響。
2.1 擠壓處理(剪切和溫度組合)對面筋蛋白構象變化和功能特性影響的研究進展
小麥面筋蛋白在擠壓處理過程中,由于異肽聚集、美拉德反應和自由基引發的交聯,對結構變化和聚合反應產生了重大影響;擠壓加工過程中的聚集和降解導致蛋白質的二級、三級或四級結構發生改變。蛋白質聚集的發生主要伴隨著α-螺旋的消失和反平行β-折疊的增加。由于擠壓導致小麥面筋蛋白結構發生變化,進而對小麥面筋蛋白功能性產生影響。
2.1.1 擠壓處理(剪切和溫度組合)對面筋蛋白構象變化的影響
擠壓過程中面筋蛋白發生變性、解離和碎裂過程,使變性的蛋白質分子沿剪切方向排列[19]。擠壓過程中,面筋蛋白質分子的變化見圖1。
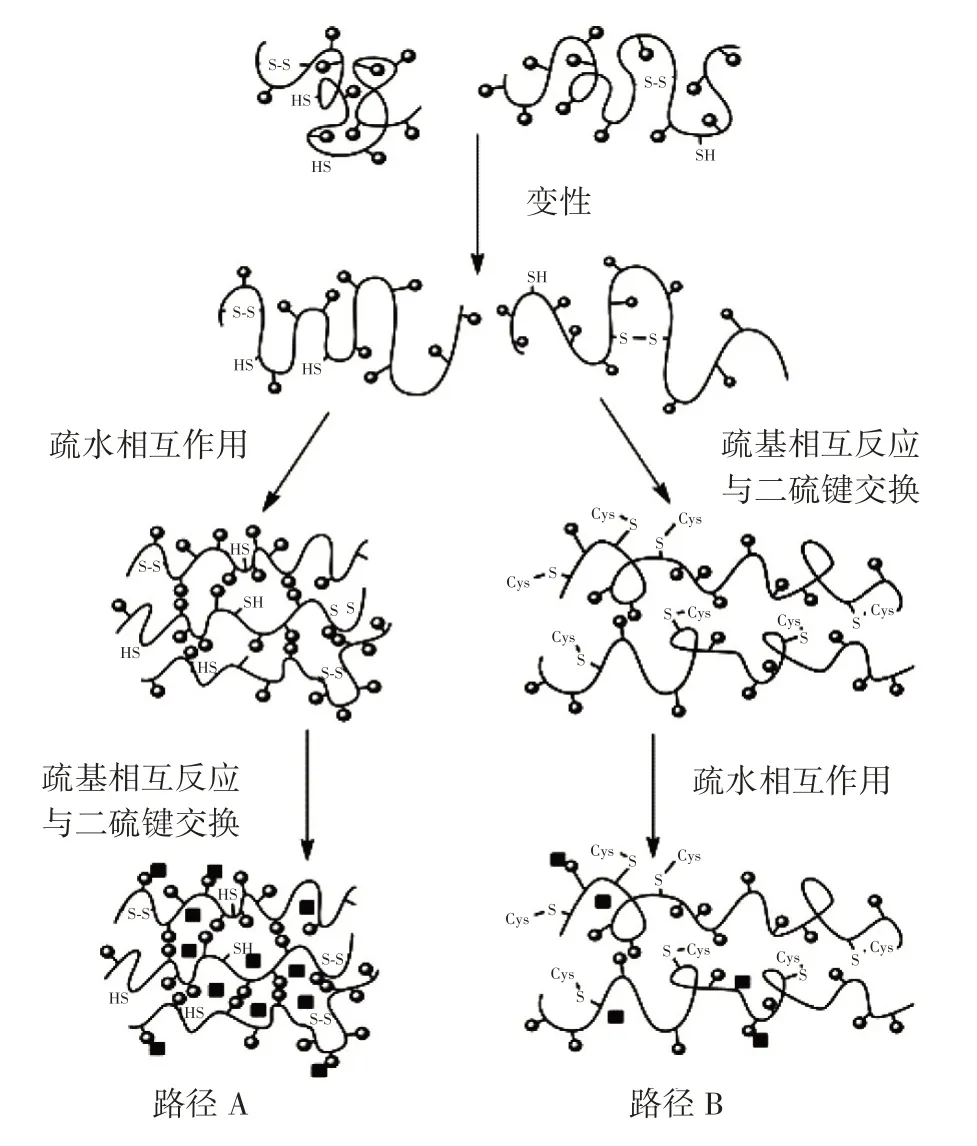
圖1 蛋白質分子在擠壓加工過程中通過疏水相互作用和二硫鍵與另一種蛋白質或半胱氨酸分子變性、排列和交聯的示意圖Fig.1 Schematic diagrams of denaturation,arrangement and cross-linking of protein molecules with another protein or cysteine molecules through hydrophobic interactions and disulfide bonds during extrusion
由圖1 中路徑A 可知,變性蛋白通過疏水作用相互聚集后,相關蛋白質中的巰基相互反應和/或與二硫鍵交換,產生鏈間二硫鍵。然而,當添加的半胱氨酸的含量(>1.5%)高于蛋白質二硫鍵和巰基時,半胱氨酸中的巰基能夠打破面筋蛋白間二硫鍵網絡結構,產生蛋白質—S—SH 或蛋白質—SS—半胱氨酸,極大地降低面筋蛋白的相對分子質量(圖1 路徑B)[20]。此外,在擠壓過程中,半胱氨酸與蛋白質之間的相互作用阻止了蛋白質與蛋白質之間的二硫鍵交聯。由于蛋白質分子間的交聯度降低,面筋蛋白網絡結構弱化[21]。
Rahaman 等[22]報道,剪切(500、1 000、1 500 s-1)不能單獨影響小麥面筋蛋白的構象變化;然而,與低剪切速率(500 s-1)相比,當剪切速率增加到1 000 s-1和1 500 s-1時,疏水性增強。這可能歸因于剪切力誘導的面筋分子的構象變化、機械解離和解體,導致疏水相互作用的破壞和某些疏水殘基的暴露[23]。Grabowska等[24]對小麥面筋蛋白和大豆分離蛋白的濃縮混合物同時施加簡單剪切變形和加熱(95 ℃),以產生具有新型半固體纖維或層狀織構的剪切誘導結構。當兩相在剪切單元中水平和垂直排列時,分別形成纖維狀和層狀結構[25]。Redl 等[26]研究表明外加機械剪切應力對共價鍵聚合和斷裂的影響取決于剪切應力的范圍。當剪切不能對聚合物作出足夠的解纏時,較高的剪切應力有助于將面筋聚合物分解為較小的分子量。Jansens等[27]研究發現,隨著擠壓剪切時間的延長,胱氨酸含量降低,同時伴隨著DHA、半胱氨酸衍生物(lanthionine,LAN)和游離巰基含量的增加。DHA 可以與一些氨基酸反應,生成共價鍵、LAL 和/或蛋白質鏈之間的鍵,從而促進面筋蛋白聚合。
2.1.2 擠壓處理(剪切和溫度組合)對面筋蛋白功能特性的影響
在擠壓過程中,由于水分含量、剪切速率、螺桿速度和進料速度等機械應力的作用,會發生小麥面筋共價鍵斷裂和/或小麥面筋聚合等現象,影響面筋蛋白的功能特性。
Wang 等[28]在剪切速率為500 s-1的情況下,研究水分含量對小麥面筋蛋白聚集行為的影響。研究發現水分含量在10%~55%適合于小麥面筋蛋白食品的擠壓加工。擠出物表現出較高的水溶指數、較低的吸水指數、較低的膨脹率、較高的密度和較高的硬度。對于高水分(>55%)擠壓工藝,較大的水分含量促進了面筋蛋白網絡的形成[22]。在145 ℃的擠出機溫度下,樣品的內部結構表現為各向異性,質地不均勻,面筋蛋白網絡強度不一致,出現流動取向的斷裂行為;而在110 ℃的擠出機溫度下,擠出物的斷裂行為表現為各向同性,缺乏特征的流動模式[29]。因此,擠壓下流變特性與小麥面筋分子結構的變化直接相關。
Redl 等[26]發現螺桿轉速從180 r/min 增加到800 r/min,擠出物的密度和硬度略有下降,可溶性蛋白含量顯著降低。隨著螺桿轉速增加,麥醇溶蛋白-麥谷蛋白交聯度逐漸降低,面筋蛋白網絡致密性減弱,觀察到擠出物斷裂的現象。Pietsch 等[29]通過改變螺桿配置和模具長度,研究了機械能輸入從32~206 kJ/kg,剪切率高達50 s-1的機械應力,以及1.5~3.5 MPa 的擠出機壓力對小麥面筋蛋白的影響。在研究范圍內,未觀察到上述條件對面筋蛋白共價鍵的產生以及聚合和/或裂解反應有顯著影響,然而,擠出機溫度在90~160 ℃時,聚集行為會發生顯著變化。研究發現,擠壓過程中的剪切應變水平也會影響蛋白質的聚集和降解。在7%的剪切應變下,兩種反應的活化能相同;而在70%的剪切應變下,降解反應的活化能較低。事實上,在高溫和巨大的剪切應變下,面筋蛋白的降解需要重點關注。此外,大量研究發現擠壓協同溫度會顯著改善面筋蛋白的結構和功能,因此,本文重點關注擠壓溫度對面筋蛋白品質特性的影響。
2.2 擠壓溫度對面筋蛋白構象變化和功能特性的調節作用
在擠壓過程中,受擠壓溫度的影響,蛋白逐漸展開原有的天然結構進而發生重排,這是小麥面筋蛋白結構改變的契機,包括離子、氫鍵和二硫鍵以及靜電和疏水作用。擠壓溫度決定蛋白變性的劇烈程度,較低溫度下擠壓使蛋白變性后會發生局部的聚集,而溫度過高則會造成聚集體重新展開,甚至影響如β-折疊等肽鏈間的作用從而改變二級結構相對含量。擠壓會改變小麥面筋蛋白在水中的溶解程度,改變蛋白中的分子質量分布,不同亞基形成的聚集體其溶解狀態也不盡相同。通常高溫高壓條件可促使小麥面筋蛋白變性和聚集,從而降低蛋白溶解度,然而,過高螺桿轉速和過高溫度又會破壞形成的蛋白聚集體。因此,本文重點綜述擠壓溫度對面筋蛋白構象變化和功能特性的調節作用。
2.2.1 擠壓溫度對面筋蛋白構象的調節作用
擠壓過程中的進料溫度通過各種化學作用導致谷物蛋白構象的變化,包括離子、氫鍵和二硫鍵以及靜電和疏水作用,因此,在熱誘導擠壓過程中,小麥面筋蛋白既有聚集又有碎裂[30]。Wang 等[28]研究發現,熱誘導擠壓過程導致面筋的二級、三級或四級結構發生改變,伴隨著α-螺旋的消失和β-折疊的增加。小麥面筋蛋白的熱誘導聚合反應包括谷蛋白亞基之間分子內二硫鍵的形成,麥醇溶蛋白和麥谷蛋白亞基之間通過分子間二硫鍵或氧化的分子間交聯鏈,在擠壓溫度大于90~120 ℃下由胱氨酸衍生的交聯鏈[31-33]。
Pietsch 等[29]研究發現,當擠壓溫度升高到120 ℃和160 ℃時,擠出物中可溶性二硫鍵水平分別從127.1、61.7 nmol/mg 大幅下降;不溶性二硫鍵的含量從44.6 nmol/mg 增加到145.5 nmol/mg。然而,當擠壓臨界溫度升高至160 ℃時,超聲(5 W,20 kHz,60 s)可使擠出物中可溶性二硫鍵的含量分別從對照的126.6 nmol/mg降至47.5 nmol/mg;不溶性二硫鍵的含量從對照組的不可檢測水平增加到擠出物中的138.3 nmol/mg。Chen等[34]研究表明隨著擠壓溫度的升高,小麥面筋蛋白的游離基減少,二硫鍵增加,小麥面筋蛋白通過二硫鍵交聯促進了聚集。此外,在擠壓過程中,溫度的升高通過增加巰基—二硫鍵交換促進了面筋的聚集。
Rombouts 等[35]研究表明,在擠壓過程中應用極端條件(160 ℃、180 s)存在二硫鍵(從75 ℃到170 ℃)和美拉德反應的共價鍵(>110 ℃)。由于半胱氨酸中的游離巰基氧化成二硫鍵,擠壓處理后半胱氨酸的含量與對照相比顯著降低,半胱氨酸、酪氨酸、蛋氨酸、精氨酸、丙氨酸、甘氨酸和異亮氨酸的損失大于5.0%是美拉德反應發生的依據[29,36]。此外,在還原的聚丙烯酰胺凝膠電泳的頂部出現了新的條帶,這意味著形成了新的大分子,擠出物的相對分子質量太大而無法進入凝膠[28]。由于整個二硫鍵在還原的條件下被分解,上述大分子可能不是來自二硫鍵的形成,而是潛在地歸因于美拉德產物或異肽鍵的發生。麥醇溶蛋白和麥谷蛋白亞基已被證明在大于120 ℃的溫度下通過硫醇—二硫鍵交換反應產生分子間交聯鏈[37]。然而,異肽聚集、美拉德反應和自由基引發的交聯也可能在聚合理論中發揮重要作用。熱加工過程中的非剪切面筋聚合由反應圖2(a)表示,其中二硫鍵是由作為蛋白質骨架中的兩個官能團的兩個—SH 相互作用而形成的[35]。總體而言,在非還原條件下,由于形成二硫鍵和異肽鍵等共價鍵,處理時間和溫度的增加導致十二烷基硫酸鈉可提取的蛋白質減少。
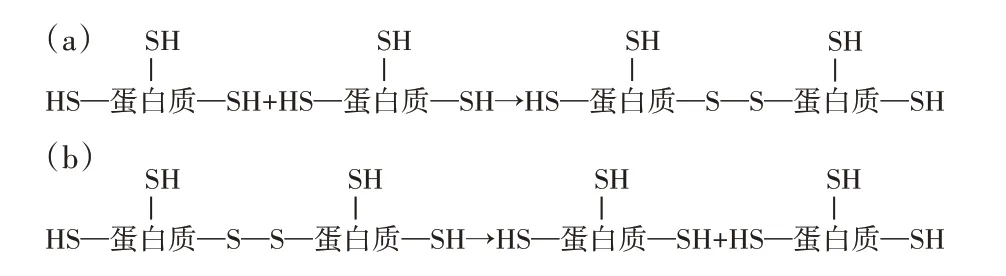
圖2 擠壓過程中有剪切和無剪切面筋聚合-解聚模型Fig.2 Polymerization-depolymerization model of gluten with and without extrusion shear
2.2.2 擠壓溫度對面筋蛋白功能特性的調節作用
Fischer 等[38]研究表明擠壓溫度升高經歷兩步過程:1)面筋蛋白變性、結構展開、疏水基團和分子反應位點暴露;2)由分子間二硫鍵和非特異性疏水相互作用誘導的蛋白質-蛋白質相互作用。Pietsch 等[29]研究發現,當擠壓臨界溫度在60~160 ℃內,擠壓物中蛋白質幾乎不溶于提取液,因此表現出較低的溶解性。當擠壓溫度升高到160 ℃時,擠出物中可溶性二硫鍵水平顯著降低;不溶性二硫鍵的含量顯著增加。當擠壓臨界溫度升高至160 ℃時,超聲(5 W,20 kHz,60 s)可使擠出物中可溶性二硫鍵的含量分別進一步降低;不溶性二硫鍵的含量明顯增加。由于蛋白質的分子量可以決定其在加熱蛋白質中的溶解度,在擠壓加工過程中蛋白質的聚集引起的蛋白質分子量的增加反過來導致蛋白質的溶解性降低。在擠壓過程中,當擠壓溫度達到120 ℃時,非共價鍵的作用力有助于小麥蛋白質的聚集,然而,超聲可使膨化產物中的大部分不溶性蛋白質(相對分子質量>42 000)溶解;而膨化產物中的大部分不溶性蛋白質在160 ℃的模壓下不能被超聲溶解,而是溶于十二烷基硫酸鈉-巰基乙醇水體系,這表明小麥蛋白質可能形成了共價交聯,這種共價交聯不能被超聲影響。
Abedi 等[20]研究表明極端溫度(185 ℃)對膨化產物的溶解度有正向影響,在水、0.5 mol/L 氯化鈉、0.05 mol/L磷酸二氫鈉緩沖溶液、0.01 mol/L 氫氧化鈉、0.1 mol/L鹽酸和70%乙醇等溶劑中的溶解度略大于160 ℃和170 ℃擠壓溫度時的溶解度,這是由于面筋蛋白聚集力的破壞和蛋白質相對分子質量的降低所致。較高的擠壓溫度加速了共價鍵(S—S 鍵、肽鍵)和非共價鍵(靜電力、疏水力、氫鍵)的斷裂,降低了蛋白質的相對分子質量。同樣,Jansens 等[27]研究發現麥谷蛋白和醇溶蛋白的結構區域隨著擠壓溫度從160 ℃增加到185 ℃而明顯斷裂,表現出增加的表觀黏度。分子量在45 000~67 000 Da 之間的麥醇溶蛋白受到高溫擠壓過程的影響較小,可能是因為它們含有很少的半胱氨酸殘基和/或很少的疏水氨基酸。
2.3 調制劑在擠壓過程中對面筋蛋白構象變化和功能特性的調節作用
擠壓機作為小麥蛋白反應容器,蛋白質分子在套筒內經歷聚合和解聚過程。蛋白質分子在擠壓過程中相互作用力主要包括有共價鍵和非共價鍵交聯,其中共價鍵包括有二硫鍵和非二硫鍵的共價鍵交聯,非共價鍵包括由疏水相互作用和氫鍵等。小麥蛋白在擠壓過程中,增加分子間的相互作用力,誘導蛋白質聚合成更大分子量的聚合體,從而使蛋白質的拉絲強度增強,擠壓產品的品質提高。為改變蛋白質之間的相互作用,提高產品品質,通常在擠壓過程中添加調制劑,主要分為氧化還原類、酸堿類和其他等。
2.3.1 調制劑在擠壓過程中對面筋蛋白構象變化的調節作用
在小麥蛋白擠壓過程中加入的氧化還原類型的調制劑一般為溴酸鉀、亞硫酸鈉、半胱氨酸等。加入氧化還原劑的原因是為了改變小麥蛋白在擠壓過程中聚合狀,從而探究小麥蛋白的聚合對組織化蛋白的影響[39]。擠壓過程中加入亞硫酸鈉,蛋白質分子間二硫鍵被打斷,蛋白質以小聚體或者單體狀態存在,氧化還原劑的加入可調控組織化蛋白中二硫鍵的含量[40]。Wang等[28]研究表明,當擠壓過程中小麥粉中L-半胱氨酸的添加量為1.5%時,二硫鍵的數量增加了一倍。
通過改變擠壓過程中的酸堿度,能改變蛋白質表面的電荷分布,使維持蛋白質分子構象的次級化學鍵發生改變,從而影響了蛋白質在擠壓套筒內的變性程度[39]。Li 等[41]在擠壓條件相同的情況下,添加堿性調制劑,在擠壓過程中小麥蛋白處于堿熱的環境中,可誘導小麥蛋白發生β-消除反應,蛋白質聚集成分子量更大的聚合體,然而,Ding 等[42]發現,低堿含量更有利于基于面筋蛋白的產品生產。
擠壓過程中添加的其他類調制劑主要有氯化鈉、磷酸鹽、多糖、乳化劑等。Zhao 等[43]通過研究溫度調控羧甲基纖維素與小麥面筋蛋白相互作用對面筋蛋白流變特性和結構的影響,結果表明添加羧甲基纖維素后小麥面筋蛋白的β結構發生明顯轉變;溫度促進了羧甲基纖維素與面筋蛋白相互作用,蛋白質-多糖結合物是通過共價作用發生的,且蛋白質-多糖結合物的含量隨溫度升高而增加。
Wang 等[28]研究了在擠壓過程中加入三聚磷酸鈉、焦磷酸鈉和六偏磷酸(0%~2%),研究其對小麥組織化蛋白品質的改性機制。三聚磷酸鈉的添加顯著提高了小麥組織化蛋白的品質,焦磷酸鈉和六偏磷酸鈉起著相反的作用。蛋白質聚合行為結果分析表明:三聚磷酸鈉降低了游離巰基含量,提高了蛋白質中二硫鍵和β-折疊相對含量以及蛋白質的熱穩定性;相反,焦磷酸鈉和六偏磷酸鈉降低了蛋白質的聚合程度,降低了大分子蛋白質的含量。Zhang 等[44]研究表明低水平(1%以下)果膠的添加降低了面筋蛋白的α-螺旋含量,但增加了面筋的β-折疊和β-轉角結構,影響面筋蛋白的水合水平。Chen 等[45]研究發現KHCO3降低了醇溶蛋白與谷蛋白的比例,改變了面團的二級結構,增強了面筋的聚集性。在擠壓處理過程中,添加各類調制劑通過對蛋白質中的二硫鍵、β-折疊相對含量和次級化學鍵產生影響,進而改變蛋白質之間的相互作用力[28]。
2.3.2 調制劑在擠壓過程中對面筋蛋白功能特性的調節作用
在雙螺桿擠壓過程中,小麥面筋蛋白的保水性能明顯提高,氮溶指數降低,這可能歸因于新的二硫鍵生成和非共價相互作用[28]。Koh 等[46]在擠壓過程中添加對苯二酚抑制面筋蛋白的交聯,結果表明對苯二酚添加后顯著抑制了蛋白質交聯,但對面筋蛋白的氨基酸組成沒有顯著的影響。此外,面筋蛋白擠出物形狀較不規則,稍有膨化,面筋纖維狀結構粗糙。Jia 等[47]研究了維生素C 對小麥面筋蛋白結構和功能特性的影響,結果表明維生素C 可以通過改變面筋中二硫鍵的含量,降低面筋的乳化特性和乳化穩定性,增加面筋的溶解度,改善面團的動態黏度。
Wang 等[28]研究表明,當擠壓過程中小麥粉中L-半胱氨酸的添加量為1.5% 時,小麥面筋蛋白黏度的降低。這歸因于面筋蛋白質的不穩定性以及半胱氨酸和半胱氨酸、蛋白質和半胱氨酸以及蛋白質和蛋白質之間的巰基基團的氧化。然而,擠壓協同熱處理影響了面筋蛋白的聚合反應和分子間相互作用,面筋蛋白網絡致密性減弱,顯著降低麥醇溶蛋白-麥谷蛋白交聯度,表現出膨化產物的含水率顯著降低,黏度增加,擠出物的斷裂性能和彈性顯著降低。熱處理和機械處理影響面筋蛋白的聚合反應和分子相互作用,增加黏度,除了共價鍵,非共價分子相互作用也有助于在熱機械處理過程中復雜黏度的演變[25]。在堿性擠壓條件下,由于蛋白質的交聯性增強,擠出物的硬度、回復性和咀嚼性能高于對照樣品;然而,低堿含量有利于以面筋蛋白為基礎的質構產品的生產。Li 等[41]通過加入碳酸氫鈉、碳酸鈉以及氫氧化鈉來改變谷朊粉在擠壓套筒中的擠壓環境,小麥組織化蛋白的咀嚼性、黏彈性顯著增加,內部的拉絲效果提高。在擠壓條件相同的情況下,添加堿性調質劑,在擠壓過程中小麥蛋白處于堿熱的環境中,可誘導小麥蛋白發生β-折疊反應,蛋白質聚集成分子量更大的聚合體,從而提高小麥組織化蛋白的品質。
擠壓過程中添加的其他類調質劑主要有氯化鈉、磷酸鹽、多糖、乳化劑等。多糖的加入會加劇蛋白質在擠壓套筒內的美拉德反應,從而使擠出物的顏色加深。Zhao 等[43]通過溫度誘導與羧甲基纖維素間的相互作用對小麥面筋蛋白流變特性和結構的影響表明添加0.5% 羧甲基纖維素,增強了面筋網絡,改善了面筋的黏彈性行為。相反,加入1.0%的羧甲基纖維素鈉,導致網絡被破壞和穩定。低濃度的氯化鈉添加量對于高水分擠壓成型的小麥組織化蛋白品質提升有著促進作用,而高濃度添加下蛋白質溶解度降低,阻礙蛋白質結構的展開,不利于蛋白質分子之間的交聯。三聚磷酸鹽的添加,增加了小麥面筋蛋白的溶解度和黏度,從而改善了其乳化性、起泡性、熱穩定性和流變性[48],增加產品的硬度、咀嚼性以及回復力,對小麥蛋白組織化產品品質的提升具有促進作用[49]。Wang 等[28]發現海藻酸鈉、單甘酯和三聚磷酸鈉均可提高小麥面筋蛋白的持水性,其中三聚磷酸鈉的作用最顯著。
3 總結與展望
小麥面筋蛋白是豐富的蛋白質資源之一,擠壓處理是小麥面筋蛋白常見的改性方式之一。在擠壓過程中涉及面筋蛋白的聚集和降解,顯著影響面筋蛋白二級和三級結構,進而影響其加工成為面團獨特的流變性和功能性以及烘焙品質,因此,明確擠壓過程、擠壓溫度、調制劑加入對面筋蛋白品質特性的影響,利用擠壓技術改善谷物蛋白的功能特性,從而拓寬谷物蛋白的開發利用,在未來食品領域前景非常廣闊。
隨著研究的不斷深入,擠壓技術和其他生產技術結合的新產品的開發逐漸成為研究熱點,未來研究中,可考慮擠壓協同超高壓、超聲波等技術聯合使用改善小麥面筋蛋白構象和功能特性,這對促進小麥面筋蛋白類產品加工的創新開發、實現環境友好和資源保護、提高小麥產品價值鏈、促進小麥產業升級具有重要的意義。

